2. 中国医学科学院 北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
兰科白及属Bletilla Reichb. f.植物在世界范围内有6种,主要分布在亚洲的缅甸、中国和日本,中国有4种,分别为白及Bletilla striata (Thunb.) Reichb. f.、黄花白及Bletilla ochracea Schltr.、华白及Bletilla sinensis (Rolfe) Schltr.、小白及Bletilla formosana (Hayata) Schltr.[1]。该属植物多作为药用,其中白及是《中国药典》收载白及药材的植物来源[2],同属近缘种黄花白及、小白及和华白及作为地方习用品或代用品使用[3-5]。作为传统中药,白及药用历史悠久,中医认为白及具收敛止血、消肿生肌之功效[6];现代研究表明,白及具有止血、抗肿瘤、抗菌、抗炎、促进创伤愈合、促进细胞生长等多种药理活性[7-9]。此外,其提取物还是一种优良的生物高分子材料和性能优良的药用辅料[7, 10-11]。近年来白及市场需求量逐年上升,商品药材价格迅速攀升,野生资源遭到掠夺式采挖。白及种子细小无胚乳,在自然状态下萌发后生长十分缓慢[7],野生种群一旦遭破坏自然恢复能力较弱,过度采挖导致野生资源的分布急剧萎缩和遗传多样性丢失[4, 12-14]。随着白及野生资源日趋枯竭,采挖同属植物作为替代品,导致包括黄花白及、小白及在内的整个白及属药用资源遭到严重破坏[3]。2002年,白及、华白及被列入《国家重点保护野生植物名录》[12, 14-15]。目前,白及的野生资源已极度濒危,许多以之为主要原材料的中成药产品被迫停产,严重制约相关产业的发展。为了解决白及药用资源面临的严峻危机,近年来围绕白及的资源和人工繁育开展了大量研究,本文对此进行了梳理和总结,以期为白及属药用植物资源的保护和人工繁育提供参考。
1 来源与鉴定白及属隶属于被子植物门、单子叶植物纲、百合目、兰科[1],是由德国植物学家Heinrich Gustav Reichenbach 1853年以Bletilla gebina (Lindl.) Reichb. f. [Bletilla striata (Thunb. ex A. Murray) Reichb. f.]为模式种建立。本属名为Bletilla,因与Bletia一词仅有2个字母的差异,有学者认为早田文藏(Hayata)可能误将产于亚洲地区的本属植物放于Bletia属中。Bletia属有50余种,均产于美洲大陆,其花葶侧生于假鳞茎的环节上,不从叶丛中抽出。Bletilla属仅有6种,分布在缅甸北部经我国至日本一带,其花葶生于假鳞茎顶部,从叶丛中抽出。2属的区别特征显著,应是2个独立的属[10]。我国分布的白及属4个种在花部特征、植株大小及假鳞茎形态上有一定差异,其最主要的差异在花色、唇瓣褶片形态及数目上,《中国植物志》第18卷1册进行了详细描述。黄花白及因花色为黄色显著区别于其他3个种的粉红至紫红色;华白及唇瓣褶片数为3片区别于白及和小白及的5片;而小白及5条脊状褶片从基部至中裂片上面均为波状,与白及仅在中裂片以上为波状相区别。白及属药用植物及其混伪品的功效与应用见表 1。
|
|
表 1 白及属药用植物及其混伪品的功效与应用 Table 1 Efficacy and application of medicinal plants in genus Bletilla Reichb. f. and their adulterants |
本属植物除白及是《中国药典》收载正品白及药材的植物来源,属内其他3个种在四川、云南、广西等地区作为不同的药用功效使用(表 1)[3, 5, 12],药材名通称“小白及”。此外,主要分布于华东、中南、西南及陕西、甘肃等地区[5, 16]的兰科植物杜鹃兰Cremastra appendiculata (D. Don) Makino、独蒜兰Pleione bulbocodioides (Frach.) Rofe的假鳞茎,也作为白及使用。目前,以小白及、黄花白及等近缘种为代表的习用品,以及独蒜兰、杜鹃兰为代表的混伪品充斥市场,作为白及药材广泛销售和使用,对用药的安全性和有效性造成巨大隐患。有多位学者开展白及的生药鉴定研究[5, 16-19],并编制白及及其混伪品药用部位鉴定检索表[5, 19],本文进行了整理(表 2),以便在实际应用中快速鉴别真伪白及药材。由于华白及分布狭窄较为罕见[1],近年来亦未见文献资料记载,因此本文讨论的白及属药用植物主要指在我国境内分布的白及、黄花白及、小白及3个种。
|
|
表 2 白及属药材及其混伪品药用部位快速鉴别检索表 Table 2 Rapid identification and retrieval of medicinal parts of plants in Bletilla Reichb. f. and their adulterants |
2 生境与分布 2.1 生境特征
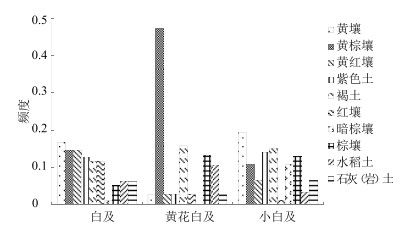
对白及属植物自然生境的了解有助于制定相适应的保护策略,并为人工栽培奠定基础。苏钛等[3]对云南产白及类习用药材的生境及植被调查显示,白及生长于400~3 200 m较湿润的石壁、苔藓层中,常与灌木相结合,或者生长于林缘。小白及生于海拔400~2 350 m的石灰岩山林下。黄花白及生于海拔400~2 350 m的石灰岩、山林下、松林、灌丛下、草坡、路边草丛中或沟边。周涛等[12, 14]对贵州六盘水地区和荔波茂兰自然保护区的野生白及资源调查显示,贵州野生白及从海拔950~1 600 m的亚热带常绿阔叶林带、落叶阔叶混交林带到中山针阔叶混交林带及亚高山针叶林带均有分布。常生于疏生灌木和杂草的山坡多石之地,如栎树林或针叶林下、路边草丛或岩石缝中。伴生植物以菊科、萝科、觅科、毛莫科、黎科、马齿苋科、马鞭草科以及多种蔗类的植物为主。笔者对重庆白及、黄花白及、小白及的野生生境调查发现,白及、小白及多生长在500~1 200 m的溪流边石壁缝、乱石堆和草丛中,生长环境较湿润。黄花白及多生于林缘、坡坎带土层的石壁上、岩石缝隙中,干燥和湿润的环境皆适宜。陈黎[20]基于“中药材产地适宜性分析地理信息系统”(TCMGIS),通过对我国各大标本馆收集的近600份白及、小白及、黄花白及标本采集地点信息进行整理,从TCMGIS数据库中提取标本点处的气候数据和土壤数据,分析得出适宜白及生长的环境条件。结果表明,黄花白及、小白及生态因子与白及有近似的区域,但仍有不同(表 3),主要差异在野生分布的土壤类型(图 1,根据陈黎[20]的数据绘制),说明导致白及及其近缘种资源分布差异的主要因素是土壤类型。因此,在进行人工培植过程中,选择适宜的土壤类型显得尤为关键。该研究获得的环境条件信息较为全面、系统,对白及属药用植物人工种植的开展具有很好的指导意义。
|
|
表 3 白及属药用植物资源分布的气候因子值 Table 3 Climate factors of resources distribution of medicinal plants in genus Bletillae Reichb. f. |
|
图 1 白及属药用植物主要分布土类的频度 Fig.1 Distribution frequency of main soil type of genus Bletilla Reichb. f. medicinal plants |
以上研究从海拔高度、植被及群落结构、土壤气候条件等方面对白及属药用植物的生长环境进行了描述。在不同地区间白及属药用植物的生境存在一定差异,如白及在云南分布的海拔高度普遍较高,生境多为灌、草丛[3];而在重庆分布的海拔较低,生境多为林缘、溪流和坡坎的岩石缝隙。总体而言,白及和小白及的生长环境更为接近并对土壤条件要求较为严苛,喜温暖、阴湿的环境,稍耐寒,耐阴性强,忌强光直射,较适宜于排水良好含腐殖质多的砂壤土。黄花白及生态习性类似,但也能适应相对干燥的环境,分布的土壤类型更为多样。在人工栽培过程中应根据不同品种的生长习性,选择适宜的土壤类型和栽培措施。
2.2 地理分布在白及属植物中,白及分布范围最广,主要分布在湖北、四川、重庆、云南、陕西、甘肃、贵州、江西、江苏等省市[12, 15, 17, 20-21]。黄花白及主要分布在湖北、四川、重庆、贵州、云南、陕西、甘肃等省市[12, 15, 17, 20]。小白及主要分布在四川、云南、陕西、贵州、甘肃、重庆,西藏也有分布[12, 15, 17, 20]。白及、黄花白及、小白及在四川、陕西、云南、贵州、重庆均有分布,说明以上区域的气候条件比较适宜白及属植物的生长。白及药材多产的地区往往也是近缘种分布较广的地区,因此,应加强对白及药材质量的监管,防止混伪品的掺入。此外,陈黎[20]通过TCMGIS计算出白及95%~100%生态相似度的区域,主要包括重庆、贵州、湖北、湖南、四川、云南、陕西、江西、福建、安徽、浙江等省。根据白及野生分布及基于TCMGIS系统的生态适宜性区域信息,结合白及的生物学特性、土地条件、栽培历史及习惯等,建议规范化种植基地选址在重庆、四川、贵州、湖北、湖南、云南、安徽等地为宜。
3 繁育系统研究 3.1 花部特征兰科植物被认为是被子植物中为高度适应虫媒传粉而具有非常特殊花部结构的类群,比如雌蕊和雄蕊融合成蕊柱、花粉聚成花粉块,以及花瓣特化为各种形状的唇瓣等[22]。白及属植物花序顶生,总状,常具数朵花,通常不分枝或极罕见分枝,花具有紫红色、粉红色、黄色或白色,萼片与花瓣相似,近等长,离生;唇瓣中部以上明显3裂,侧裂片直立[1]。王彩霞等[23]对白及的花部特征进行了详细观察和描述,主要特征为总状花序顶生,具3~11朵花,无分枝,呈“之”字形;花大,紫红色,花瓣长约31.8 mm;唇瓣贴生于蕊柱基部,唇瓣中部以上常明显3裂;唇盘上从基部至中裂片近顶部具5条纵脊状褶片,褶片在中裂片以上呈现波状。蕊柱与唇瓣对生,顶端为药床,上着花药1枚。柱头位于花药之下,笑口状,略透明,与花药存在隔离,成熟时表面具晶莹的黏性物质。石晶[15]和陈黎[20]对白及属植物花部特征进行了比较,认为白及属3种药用植物的花部形态结构近似,最显著的差异为白及花大,花瓣长多在25 mm以上;小白及花小,多在20 mm以下;黄花白及花色为黄色,白及和小白及为紫红色。白及属植物花部特征一方面为物种鉴定提供依据;另一方面,基于花部的特殊结构,在花朵开放的整个进程中,花药与柱头间始终存在隔离,花粉成熟时由黏性物质聚结成团,无法散落至柱头,提示白及属植物需要借助外力才能完成授粉。
3.2 传粉生物学研究对有性生殖传粉过程的了解,对于阐释白及属植物在自然环境下濒危的原因,以及进一步开展人工繁育至关重要。兰科植物在野生状态下多依靠昆虫进行传粉。因其花大、色美、有特殊的香气能引诱昆虫为之传粉,却不提供任何报酬(如蜜腺或花粉)。如有些兰花的花朵上有色彩艳丽的假蜜腺,蜜蜂经不住假蜜腺的诱惑,便钻进花瓣中却一无所获。当蜜蜂离开时,恰巧碰到兰花的雄蕊,把花粉块带走,至另一朵花采蜜时,花粉块恰好又触到有黏液的柱头上从而完成授粉[22]。目前有关白及属植物传粉生物学的报道较少。Sugiura[24]对日本神户地区白及的传粉进行了观察,发现经常造访白及花朵的26种昆虫中7种具刺昆虫为有效造访者,雄性蜜蜂Tetralonia nipponensis Perez是最有效的造访者。Chung等[25]对韩国全罗南道海南郡内陆白及种群和海滨种群的自然结实率进行比较发现,前者(13.3%)高于后者(1.6%),推测其原因是内陆有传粉昆虫意大利蜜蜂,而海滨没有传粉昆虫。王彩霞等[23]通过野外观察、授粉特性分析、杂交指数估算及人工控制授粉实验等对白及野生居群的繁育系统进行了系统研究,发现无论去雄与否,套袋后的花均不结实,说明其不能进行自然的自花授粉和无融合生殖。白及人工自花授粉、同株异花授粉和异株授粉的结实率分别为93.33%、90.00%和93.33%,自然条件下的结实率仅为5.26%。开花后3 d内花粉活力和柱头可授性均较高。他们认为花粉成熟时由黏性物质聚结成块,以及缺乏有效的传粉媒介可能是白及自然条件下结实率低的主要原因。因此,人工种植过程中如果目标是收获种子,需要通过人工授粉提高结实率。笔者在实际生产中,通过人工授粉的方式获得了大量白及种子。
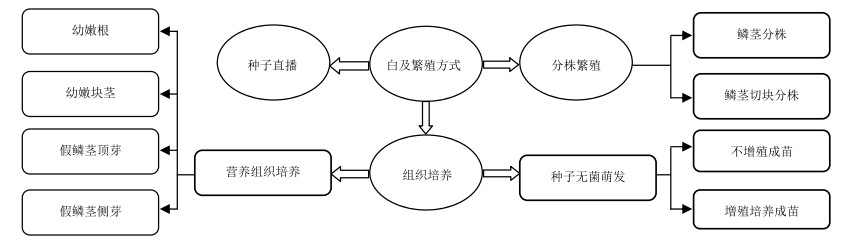
4 栽培研究 4.1 繁殖技术对濒危植物通过人工繁育的方式保存种质并扩大繁殖,为实际生产提供充分的种源供应。白及属植物的繁殖方式有种子直播、假鳞茎分株繁殖和组织培养。传统种植主要以分株繁殖为主,该方法简单、便捷,易于操作。缺点是繁殖系数低,用种量大。组织培养技术因外植体的选择不同可分为2种类型:一种是以种子为材料,采用非共生萌发法,将种子接种到培养基上进行无菌萌发;另一种是以白及的茎尖、侧芽、幼根或块茎等为外植体的营养组织培养。因白及种子材料易得(一个种果里有上万粒细小种子)[26],无菌萌发操作简便、成苗周期短、实生苗后期长势好。目前大多研究者关注于白及的种子无菌萌发途径,生产中也多采用该方法生产种苗。白及繁殖方式见图 2。
|
图 2 白及繁殖方式示意图 Fig.2 Schematic diagram of reproduction mood of Bletilla Reichb. f. |
4.1.1 种子直播
郭顺星等[27]研究表明,白及种胚的薄壁细胞贮存大量的蛋白质、油脂和碳水化合物,这些物质像胚乳一样可作为种子萌发的营养成分,是兰科植物中在常规条件下容易萌发的种子类型,因此可以通过种子直播的方式进行繁育。胡开治等[28]对白及种子的储藏方法进行研究。比较了沙藏、自然贮藏、低温干藏等不同储藏方式下不同储藏时间的萌发率。结果显示3种储藏方式的萌发率相互间呈显著或极显著差异,沙藏是白及种子较为理想的储藏方法,储藏时间越短萌发率越高,种子储藏180 d仍具有较强活力。黄永亮[29]以野生白及作为原始种源,进行种子直播实验,结果表明乙烯处理可使白及的发芽率达35.2%,分别比50 ℃温水和常温处理发芽率高13.6%和19.8%。此外,胡凤莲[30]介绍了一种简易的种子直播萌发方法。由于白及种子直播萌发后,幼苗生长十分缓慢,育苗周期较长,以及种子无菌萌发等新技术的介入,白及种子直播法的应用受到极大限制。
4.1.2 分株繁殖分株繁殖是白及传统的的繁殖方式。胡凤莲[30]和杨兴文[31]报道了白及的分株繁殖方式。一般在9~11月白及采挖时,选取当年生带有嫩芽的假鳞茎作种,以无虫蛀无采挖伤者为佳,可随挖随栽。周至明等[32]报道了一种白及块茎繁殖的新方法,该方法为10月左右将白及挖出,选择具有老秆和芽眼的假鳞茎作种,栽种于行株距约26×8 cm,深约10 cm的穴内。笠年3月再选择中等大小、芽眼多、无病害的假鳞茎,用刀横切成小块后栽种。在目前白及种源十分匮乏的情况下,切块儿分株大大提高了白及种茎的繁殖效率,且兼具假鳞茎繁殖生长周期短的优点,具有很强的实用性。
4.1.3 种子无菌萌发种子无菌萌发属于组织培养的一种,已成为白及最主要的育苗方式。选用白及蒴果种子为繁殖材料,采用Bemard创立的非共生萌发法,将种子播撒在萌发培养基上进行无菌萌发。种子萌发成原球茎后,再通过不同的培养程序及培养基获得无菌苗。
(1)培养程序:不同研究者采用的培养程序差别较大,主要差异在种子萌发后所采用的培养程序上,有研究者采用原球茎→生长分化→诱导生根和原球茎→诱导芽的分化→诱导生根的步骤较少的培养程序,期间不需要增殖和继代培养;有的则采用原球茎→诱导原球茎增殖→诱导芽的分化→诱导生根的组织培养程序,增殖主要利用诱导原球茎完成,继代培养也采用原球茎;有的采用原球茎→诱导丛生芽增殖→诱导芽的分化及生根的程序,继代培养使用丛生芽[33]。白及种子数目多,处于减少培养工序及成本控制的需要,生产中更倾向于选择原球茎直接诱导分化成苗的培养程序。
(2)材料准备:张建霞等[34]对白及胚发育与种子无菌萌发的关系进行研究。结果表明,随着胚龄增大,胚成熟度不断增加,有胚率和萌发率逐渐升高,种子萌发时间逐渐变短。胚龄为20周后胚的成熟度达到最佳,有胚率最高,萌发率接近100%,萌发时间只需1周。付志惠等[35]开展了类似的研究,结果表明,白及种子萌发率与其胚龄及有胚率呈正相关,萌发时间则与胚龄及有胚率呈负相关。胚龄较小的种子(≤16周)萌发率易受培养基成分的影响,胚龄20周的种子基本不受培养基无机盐比例的影响,均能正常萌发。两者的研究均表明,胚龄为20周后的种子最适宜作为无菌萌发的材料。
(3)培养基:有关白及种子萌发大部分研究者采用MS、1/2MS或KC为基本培养基,添加6-BA、NAA诱导萌发,添加马铃薯泥、香蕉泥、椰子汁、番茄汁、活性炭等以促进萌发。总体来讲,1/2 MS培养基的萌发率高。大量研究表明NAA能有效促进白及种子萌发,6-BA的作用存在一定争议,激素添加量可能是影响萌发效果的关键[33]。马铃薯泥、香蕉泥、椰子汁对种子萌发有较好的促进作用,活性炭、番茄汁对种子的萌发则有一定的抑制作用。曾宋君等[36]采用PT培养基进行萌发,有利于在规模化生产中降低成本。白及种子萌发后首先形成原球茎,部分研究者对原球茎进行诱导增殖以达到扩繁的目的。培养基一般选取MS和ZW。采用MS培养基,当激素中6-BA的质量浓度为1.0 mg/L,NAA的质量浓度为0.1 mg/L时有利于白及原球茎的增殖[37]。利用丛生芽途径进行繁殖的增殖系数大,且获得的试管苗在遗传上较稳定[38]。MS、PT、Kyoto培养基诱导丛生芽增殖效果较好,6-BA和NAA对丛生芽的诱导具有促进作用,2, 4-D则在很大程度上抑制丛生芽增殖[39]。袁宁等[38]通过正交试验优化了6-BA和NAA组合对丛生芽诱导增殖的最优浓度,通过方差分析,确定最优组合为MS+6-BA 1.0 mg/L+NAA 0.15 mg/L。生根培养基多选取1/2 MS作为基本培养基,NAA有助于根的生长,香蕉泥、活性炭等添加剂有增加根长的作用,但蛋白胨则有可能抑制白及的生根[33],1/2 MS+NAA 0.5 mg/L+香蕉泥75 g/L是比较理想的生根培养基[41]。
有学者开展了黄花白及和小白及的种子无菌萌发研究,其方法与白及类似。李晶等[40]采用L9(34)正交试验筛选黄花白及种子非共生萌发及幼苗发育条件。结果表明,马铃薯、蔗糖、NAA、6-BA 4个因素对种子萌发率的影响不显著,说明成熟种子对培养基的要求较低,但蔗糖和马铃薯对幼苗发育的影响显著。朱玉球等[37]系统地开展了黄花白及的种子无菌萌发技术研究。筛选出原球茎萌发培养基:1/2 Ms+1.0 mg/L BA+0.1 mg/L NAA;原球茎增殖、分化培养基:Kyoto+1.0 mg/L BA+0.1 mg/L NAA;茎切块儿诱导芽培养基:Kyoto+2.0 mg/L BA+0.1 mg/L NAA。在原球茎继代培养中应采用纵切法切割原球茎。陶刚等[41]采用ITS序列对黄花白及组培苗进行了鉴定。陈晓芳等[42]为了筛选促进和提高白及种子萌发率的菌根真菌,将分离得到的黄花白及菌根真菌与其种子共生培养,筛选出具有促进和提高黄花白及种子萌发率的菌根真菌Epulorhiza sp.和Sebacina sp.株菌,提高萌发率8.61%和18.43%。近年来,关于白及种子无菌萌发的研究报道较多,该技术已日趋成熟并在实际生产中得到广泛应用。而关于黄花白及和小白及的报道很少,这可能与两者为非药典收载品种有关。在白及愈加濒危的情况下,寻找替代品扩大药源,黄花白及和小白及作为同属近缘种应首先考虑,有必要开展相关的基础研究。
4.1.4 营养组织培养对于大多数植物而言,组织培养是快速繁育的有效方式。利用营养器官进行组织培养获得的试管苗在遗传上较稳定,不易发生变异,尤其在优良种质的扩繁上具有重要意义。白及新鲜的茎尖、侧芽、块茎以及幼根都可以作为组培的外植体。付志惠等[35]用侧芽和茎尖,石云平等[43]用侧芽和块茎,黄春球等[44]用侧芽,田英翠等[45]用幼根,韦卡娅等[46]用幼嫩块茎作为外植体进行组织培养。以侧芽为外植体的培养效果普遍较块茎好,可能是因为侧芽的灭菌效果好,恢复生长较快,但利用块茎为外植体样品采集不受到季节的限制,即使在休眠期也可取材培养。
利用营养器官为外植体时的组培程序与种子无菌萌发有一定的差别,其中最大的差别是大多不采用诱导成原球茎后进行增殖或分化的步骤,直接通过愈伤组织诱导丛生芽进行增殖。白及的营养器官组织培养主要采用MS培养基,在诱导生根时用1/2 MS培养基[33]。石云平等[43]采用MS为基本培养基,生根采用1/2 MS培养基,附加不同浓度的BA和NAA。田英翠等[45]筛选出原球茎诱导和幼苗分化培养基:ZW+1.0 mg/L BA+2.0 mg/L NAA+10%椰子汁+2 g/L CH+30 g/L蔗糖;生根壮苗培养基:l/2 MS+1.0 mg/LNAA+1.0 mg/L GA+200 g/L番茄汁。他们还发现在生根培养基中,GA和番茄汁的组合对白及无菌苗的生根壮苗有明显的促进作用。组培幼苗长到3~5 cm时即可进行炼苗和移栽。付志惠等[35]采用碎砖、蕨根、碎炭、粗椰糠混合基质或黄土-炭渣-椰壳(2:2:1)、珍珠岩-泥炭土(1:3),袁宁[47]采用60%腐植土+30%珍珠岩+10%素红土,能使移栽的成活率达到90%以上。而移栽的季节尽量选在春季,气温逐渐回升有利于试管苗适应自然环境和迅速恢复生长[33]。营养器官的组织培养技术经过多年的发展已趋于成熟,对于各物种间的差异需要对培养基、添加剂和组培程序进行优化筛选。白及通过各种外植体培养成试管苗阶段已有较多研究,而组培苗的驯化成苗仍是生产中面临的一个重要问题,目前的研究报道较少,还需进一步加强。
4.2 栽培技术近年来,国内研究者开展了许多与白及驯化及栽培相关的基础性工作,为人工栽培技术积累了基础资料。张亦诚[48]和曹琦等[49]对白及的生物学特性进行了观察。吴明开等[50]开展了白及的光合与蒸腾生理生态及抗旱特性研究。研究表明,白及为耐荫植物,抗旱能力不强,建议白及人工栽培应适当遮阴保持土壤与空气湿度。李姣红[51]通过不同氮、磷、钾配比施肥实验,考察了白及地上部分养分分布与吸收积累规律,以及对白及产量及药效成分的影响,并提出了对白及产量和品质影响较大的营养元素和合理的氮、磷、钾配比。
随着市场对白及药材的需求日趋紧迫,更多的研究者关注于白及的野生驯化及高产栽培技术。黄永亮[29]以野生白及作为原始种源,开展了云南元江野生白及的人工驯化研究。进行了块茎繁殖的种植密度实验,实验结果表明30 cm×30 cm是最佳的种植密度。郑维强等[52]采用L9(34)正交实验设计,考察了不同种植密度,不同基肥种类,不同追肥次数、种类及其追肥量对白及产量及品质的影响,结果表明,施用锌肥l5 kg/hm2、硼肥l5 kg/ hm2、KNO3 150 kg/hm2,种植密度为27 cm×17 cm时,白及吸收养分较好,品质优,产量最高。该研究获得的最佳种植密度更大,能更充分地利用土地资源。连细春[53]开展了杉木林下种植白及的新种植模式,研究表明不同隐蔽度下白及生物量积累具有显著差异,以0.5~0.6的隐蔽度产量为最高。黄永亮[29]报道了白及常见虫害地老虎、蝼蛄以及常见病害烂根病的防治。胡凤莲[30]分别报道了不同地区白及的人工栽培模式及技术。从上述研究可见,白及属药用植物栽培技术研究还十分薄弱,主要体现在研究报道的数量少,栽培相关的基础研究欠缺,现有关于白及人工栽培技术的文献多为描述性、总结性研究,缺少系统的实验研究作为依据。为了解决白及药用资源的紧缺问题,对于白及人工种植技术方面的研究显得尤为迫切,需要进一步加强。由于白及人工驯化栽培的历史较短,相关的基础研究较薄弱,对白及人工栽培的支撑明显不足。
5 问题与展望 5.1 制定针对性的保护措施,挽救白及濒危资源对濒危植物生长环境、历史分布及变化动态的掌握有助于濒危机制的揭示和相应保护策略的制定。苏钛等[3]、周涛等[14]和石晶[15]的调查显示,目前野生白及种群密度已极小,多为1~2年生的幼小植株,多年生的很少见。全国第4次资源普查(试点)显示,在贵州、重庆、云南等白及药材传统产区,已很少有野生白及的分布,几乎所有产区都面临资源严重枯竭的境地。究其原因,一方面与白及属植物自身的繁殖特性有关,但大多数研究者认为,人为的过度采挖是最主要的原因[3, 7, 14-15]。调查中了解到,随着近年来白及市场价格的迅速攀升,人们大量采挖野生资源。在经济利益的驱动下,药农没有资源可持续性利用的意识,发现一株采挖一株,且大多采用的采挖方式是在发现有白及生长的地方直接铲挖一大片土壤层,从中剥离出白及假鳞茎[14],极少会遗留下种株继续繁衍种群[25]。这种灭绝式的采挖方式导致白及野生种群自然繁衍能力的丧失,加之生态环境的改变,其分布区逐渐萎缩等原因,造成白及濒临灭绝的现状。对白及属药用资源的保护已迫在眉睫,我国政府已将白及列入《国家重点保护野生植物名录》,并进入濒危植物保护国际公约。但由于市场对白及的强烈需求和强大经济利益的驱动,以及监管的难度,这些政策和法规并未得到有效实施。为此,笔者建议相关部门应制定更具针对性的保护措施。一方面,在白及资源富集区域,对野生资源进行详细的调查,选择具有代表性的种群和生境,建立动态监测机制,加以重点保护,以挽救重要遗传资源和典型性生境;另一方面,加大执法力度,实施更精准的监管,比如针对上述不合理的采挖方式,在采集环节很难控制药农不采挖幼小植株,则从易于监控的药材贸易端出发,严格限制市售白及的商品规格,严禁低于一定标准的幼小鳞茎上市销售,使得药农不再采挖幼小植株,以保持野生种群的延续性。同时,相关部门应加大宣传力度,以提高自觉保护的意识,减少对野生资源的破坏。
5.2 加快人工繁育关键技术研究,转变资源供给方式白及属植物作为用途广泛的植物资源,各种保护措施只是挽救白及属植物的一种被动策略。要从根本上解决白及属植物的濒危问题,应从可持续利用的角度出发,平衡好保护与利用的关系,人工繁育是必由之路。兰科珍稀药材石斛通过人工繁育,不仅满足了药用的需求,在一定程度上也达到了保护野生资源的目的。种苗繁育是白及人工繁育的核心环节。白及种子在自然状况下萌发后成苗率低,生长十分缓慢,传统栽培方法主要以分株繁殖为主。但分株繁殖用种量大,繁殖率低,难以满足规模化生产的需求。组织培养技术可以利用有限的繁殖材料快速繁殖大量种苗,易于规模化,对野生资源的破坏小,是适宜白及繁育的重要手段。兰科植物的组织培养多采用种子为外植体进行无菌萌发。白及种子数量多,1个种果里有几万至十多万粒种子[21],在人工培养基上容易萌发[23],操作程序比常规营养组织培养途径更为简单。因此,种子无菌萌发模式已成为白及属植物较为理想的繁育手段,应加快技术研发,解决白及人工栽培的种源问题。近年来已有较多关于白及种子无菌萌发的报道,但主要针对培养程序及配方的筛选,下一步应主要从缩短培养周期和规模化应用的角度进行深度开发。然而,无菌萌发也并非最为理想的育苗方式,在生产中,种植白及的药农和企业普遍认为,组培或无菌萌发都对设施、设备要求较高,导致白及种苗的成本较高,前期投入大,一定程度上限制了大面积人工种植的发展。白及种子是兰科植物中易萌发的种子类型,只是在萌发后生长极为缓慢、成苗率低,提示如果提供较为优越的营养及环境条件,仍可以通过种子直播的方式获得大量种苗。笔者课题组开展了种子直播萌发的相关研究,通过对土壤基质和培养条件的优化,初步证明该方法的可行性。新一代种子直播萌发育苗技术若能取得实质性突破,将大大提高白及种苗繁育的经济性和效率。
栽培技术是白及人工繁育的另一个重要环节。白及生长缓慢,生产周期长,整个种植过程面临许多技术难题,目前的栽培技术十分粗放和落后。如何在保证药材质量的前提下,通过有效的农艺措施保障白及产量,对于白及紧缺的市场现状显得尤为关键。在自然条件下,兰科植物需要与特定真菌形成共生关系,靠后者提供营养才能正常生长发育[54]。研究表明,通过无菌萌发可以获得大量白及无菌种苗,初步解决了白及人工栽培的种源问题。但无菌苗下地移栽后的生长势较弱,导致人工种植的产量极不稳定,这也是白及无菌萌发育苗技术已出现近10年,仍没有通过组培苗获得大量商品药材的原因之一。郭顺星等[54]研究表明,白及种子同真菌伴播后,原球茎营养器官(叶片、假根等)的分化率及生长速度显著高于对照,并且成苗整齐、植株健壮,说明白及与真菌形成共生关系后,共生菌对于白及生长发育有明显促进作用。同为兰科植物的天麻通过引入共生菌蜜环菌而获得人工栽培的成功和高产,因此,在种植过程中引入共生真菌可能成为白及人工栽培缩短生产周期,提高产量的有效途径,相关研究有待进一步开展。参照天麻、石斛等兰科珍稀、濒危药材资源问题的解决路径,可以预见,白及新一代种子直播萌发技术的出现,以及栽培关键技术的突破,将大大提高白及人工繁育的效率,实现白及药材的规模化种植,从而转变资源供给的方式,减少对野生资源的过度依赖,达到保护和可持续利用的目的。
5.3 加强白及的资源和繁育基础研究,提高保护和利用效率国内外学者在白及属药用植物的资源和人工繁育方面做了大量工作,已取得了初步成效,为了更高效地保护和利用白及药用资源,笔者建议在以下方面开展更深入研究:1)广泛收集白及种质资源,通过多种形式建立种质资源库保存基因资源,采用现代分子生物学的技术和方法,对种质资源的遗传背景进行分析和评价,在此基础上开展良种选育和杂交育种研究,培育适宜于不同区域推广应用的优良品种,为白及人工栽培提供支持;2)深入开展白及生物学特性和生理、生态研究,充分了解白及生长发育、有效成分积累与环境因子之间的相关性,在此基础上优化栽培技术,以提高人工栽培效率,保障药材质量;3)结合基因工程的技术和方法,深入开展白及有效成分合成途径及调控机制研究,克隆合成及调控相关的关键酶基因,构建高效表达的载体及生物反应器,为白及的品种改良和有效成分的生物合成奠定基础。
| [1] | 中国科学院中国植物志编委会. 中国植物志(第十八卷)[M]. 北京: 科学出版社, 1999. |
| [2] | 中国药典[S].一部. 2015. |
| [3] | 苏钛, 邱斌, 李云. 滇产白及类习用药材资源调查及市场利用评价[J]. 中国野生植物资源, 2014, 33(5):49–52. |
| [4] | 吴劲松, 张宇思, 刘薇, 等. 白及属药用植物DNA条形码的确立及其应用[J]. 药学学报, 2014, 49(10):1466–1474. |
| [5] | 鞠康, 刘耀武, 王甫成, 等. 安徽亳州中药材市场白及品种调查[J]. 中国民族民间医药, 2011, 20(17):22–23. |
| [6] | 孙乐乐, 杨永红, 刘军凯, 等. 白及的本草考证[J]. 中药材, 2010, 33(12):1965–1968. |
| [7] | 李伟平, 何良艳, 丁志山. 白及的应用及资源现状[J]. 中华中医药学刊, 2012, 30(1):158–160. |
| [8] | 汤逸飞, 阮川芬, 应晨, 等. 白及属植物化学成分与药理作用研究进展[J]. 中草药, 2014, 45(19):2864–2872. |
| [9] | 赵艳霞, 邓雁如, 张晓静, 等. 白及属药用植物化学成分及药理作用研究进展[J]. 天然产物研究与开发, 2013, 25(8):1137–1145. |
| [10] | 陆峻波, 刘亚辉, 杨永红, 等. 从文献分析看我国白芨研究进展[J]. 云南农业大学学报:自然科学版, 2011, 26(2):288–292. |
| [11] | 孙达锋, 史劲松, 张卫明, 等. 白芨多糖胶研究进展[J]. 食品科学, 2009, 30(3):296–298. |
| [12] | 周涛, 江维克, 魏升华, 等.野生白芨的资源调查和利用现状分析[A]//中华中医药学会第九届中药鉴定学术会议论文集[C].建德:中华中医药学会, 2008. |
| [13] | 和志娇, 吕丽芬, 杨丽云, 等. 白芨种质资源遗传多样性的ISSR分析[J]. 西南农业学报, 2008, 21(4):1081–1085. |
| [14] | 周涛, 江维克, 李玲, 等. 贵州野生白及资源调查和市场利用评价[J]. 贵阳中医学院学报, 2010, 32(6):28–30. |
| [15] | 石晶.白芨属植物资源与利用[D].海口:海南大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10589-2010183768.htm |
| [16] | 彭翠仙, 向建英. 云南野生药用白及及其混伪品现状调查[J]. 安徽农业科学, 2014, 42(32):11279–11281. |
| [17] | 翟萌.白及与其混淆品、伪品的生药学对比研究[D].成都:成都中医药大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10633-1013111922.htm |
| [18] | 夏伟, 蒋万浪. 白及及其混淆品的鉴别研究[J]. 中国药业, 2009, 18(16):78. |
| [19] | 张晓莉, 武正强. 白及与小白及的比较鉴别[J]. 中国药师, 2001, 4(6):476. |
| [20] | 陈黎.鄂西北白及产地适宜性与品质评价研究[D].武汉:湖北中医药大学, 2014. |
| [21] | 李嵘, 王喆之. 白及的研究概述及其资源利用对策[J]. 中草药, 2006, 37(11):1751–1755. |
| [22] | Schiestl F P, Schlüter P M. Floral isolation specialized pollination, and pollinator behavior in orchids[J]. Annu Rev Entomol, 2009, 54: 425–426. DOI:10.1146/annurev.ento.54.110807.090603 |
| [23] | 王彩霞, 田敏, 李全健, 等. 白及的花部特征与繁育系统[J]. 园艺学报, 2012, 39(6):1159–1166. |
| [24] | Sugiura N. The pollination ecology of Bletilla striata (Orchidaceae)[J]. Ecol Res, 1995, 10(2): 171–177. DOI:10.1007/BF02347939 |
| [25] | Chung M Y, Chung M G. Pollination biology and breeding systems in the terrestrial orchid Bletilla striata[J]. Plant Syst Evol, 2005, 25(2): 1–9. |
| [26] | 李伟平, 田莎莎, 鲁光耀, 等. 利用人工种子技术快速繁殖白及[J]. 中国中药杂志, 2012, 37(22):3386–3390. |
| [27] | 郭顺星, 徐锦堂. 白芨种子染菌萌发过程中细胞超微结构变化的研究[J]. 植物学报, 1990, 32(8):594–598. |
| [28] | 胡开治, 刘杰, 肖波, 等. 不同贮藏方法及贮藏时间对白及种子萌发的影响[J]. 中药材, 2010, 33(1):7–10. |
| [29] | 黄永亮. 元江县野生白芨人工驯化栽培技术初探[J]. 林业调查规划, 2013, 38(3):124–126. |
| [30] | 胡凤莲. 白芨的栽培管理及应用[J]. 陕西农业科学, 2011, 57(3):268–269. |
| [31] | 杨兴文. 白芨栽培技术[J]. 农村实用技术, 2014(12):34. |
| [32] | 周至明, 黄程生, 彭丽丽, 等. 白及人工种植初步研究[J]. 中药材, 2006, 29(1):7–8. |
| [33] | 管常东, 叶静, 郑晓君, 等. 白芨组织快繁育苗技术研究进展[J]. 云南大学学报:自然科学版, 2010, 32(S1):416–421. |
| [34] | 张建霞, 付志惠, 李洪林, 等. 白芨胚发育与种子萌发的关系[J]. 亚热带植物科学, 2005, 34(4):32–35. |
| [35] | 付志惠, 张建霞, 李洪林, 等. 白及种子萌发与快速繁殖技术的研究[J]. 武汉植物学研究, 2006, 24(1):80–82. |
| [36] | 曾宋君, 黄向力, 陈之林, 等. 白及的无菌播种和组织培养研究[J]. 中药材, 2004, 27(9):625–627. |
| [37] | 朱玉球, 王雪根. 黄花白芨组培快繁技术[J]. 浙江林学院学报, 1999, 16(2):58–63. |
| [38] | 袁宁, 何俊蓉, 何锐, 等. 白芨组培快繁育苗技术研究[J]. 西南农业学报, 2009, 22(3):781–785. |
| [39] | 林伊利, 李伟平, 马丹丹, 等. 白及组培快繁的实验研究[J]. 中华中医药学刊, 2012, 30(2):336–339. |
| [40] | 李晶, 吴明开, 刘作易, 等. 黄花白及种子非共生萌发及幼苗发育研究[J]. 湖北农业科学, 2012, 51(1):111–113. |
| [41] | 陶刚, 朱英, 刘作易, 等. 野生黄花白芨的组织快繁及分子鉴定[J]. 种子, 2008, 27(8):22–24. |
| [42] | 陈晓芳, 刘准, 陶刚, 等. 兰科菌根真菌对黄花白及Bletillao chracea Schltr种子萌发率的影响[J]. 西南农业学报, 2012, 25(4):1393–1397. |
| [43] | 石云平, 李锋, 凌征柱. 白芨组织培养与快速繁殖技术研究[J]. 广西农业科学, 2009, 40(11):1408–1410. |
| [44] | 黄春球, 宋天顺, 李明静, 等. 外界条件对白及组织培养的影响[J]. 安徽农学通报, 2010, 16(21):42–43. |
| [45] | 田英翠, 袁雄强. 白芨组织培养快繁技术研究[J]. 江苏农业科学, 2006(4):75–77. |
| [46] | 韦卡娅, 刘燕琴, 秦静, 等. 白及组培外植体的筛选研究[J]. 中国现代中药, 2008, 10(5):13–14. |
| [47] | 袁宁.白芨组织培养技术体系研究[D].成都:西南交通大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10613-2009056784.htm |
| [48] | 张亦诚. 白芨的生物特性及栽培技术[J]. 农业科技与信息, 2007(10):45. |
| [49] | 曹琦, 王学平. 药用白芨的生物学特性及其保护[J]. 安徽农业科学, 2015, 43(18):175–176. |
| [50] | 吴明开, 刘海, 沈志君, 等. 珍稀药用植物白及光合与蒸腾生理生态及抗旱特性[J]. 生态学报, 2013, 33(18):5531–5537. |
| [51] | 李姣红.白芨营养特性与施肥效应研究[D].贵阳:贵州大学, 2007. |
| [52] | 郑维强, 张秀玥, 罗光琼, 等. 不同处理对白及产量及品质的影响[J]. 医学信息, 2010, 23(4):138–139. |
| [53] | 连细春. 杉木林冠下白芨人工栽培技术研究[J]. 中国农业信息, 2014(11):9. |
| [54] | 郭顺星, 徐锦堂. 白芨种子萌发和幼苗生长与紫萁小菇等4种真菌的关系[J]. 中国医学科学院学报, 1992, 14(1):51–54. |
 2016, Vol. 47
2016, Vol. 47


