红花Carthamus tinctorius L.为菊科草本植物。由于其种子含油率高且油中富含不饱和脂肪酸使得红花成为一类重要的油料作物[1]。在传统的本草研究中红花还是一类非常有价值的药用植物,其干燥管状花具有活血通经、散瘀止痛之功效,是预防和治疗心脑血管疾病的重要中药[2-5]。花中的黄酮类成分如羟基红花黄色素A(hydroxy safflor yellow A)、红花胺(tinctormine)、红花红色素(carthamin)等是发挥药理作用的主要活性成分[5-7],但这些活性成分的生物合成机制不明确,量也很低。因此,建立红花的细胞悬浮体系、探索其生源合成途径进而利用细胞工程技术生产红花的有效成分,日益受到人们的关注。
作为植物学研究中的一种精化的模式系统,植物悬浮细胞因具有材料均一、细胞数量大、增殖速度快、易于控制且不会发生恶性变异[8]等优点,成为广泛使用的实验材料[9],在研究细胞以及分子生物学过程中有着巨大的优势。植物悬浮细胞常用于研究次生代谢产物、遗传转化、原生质体的分离与融合等研究[10-11],而且在体外去分化的植物细胞悬浮体系非常有利于利用生物反应容器大规模地生产需要的产物。不同的植物种类,其愈伤组织和悬浮细胞生长条件都不同[12]。
茉莉酸甲酯(meythyl jasmonate,MeJA)作为一种诱导子常用于刺激悬浮细胞产生相应的化合物,目前已经用于多种植物的悬浮细胞体系研究中,如石蒜、紫茉莉、苍术、白桦、白木香等[13-17],用于研究相应代谢成分变化或者基因表达变化[18-21]。研究结果表明,MeJA刺激可以提高悬浮细胞的次生代谢产物量,高浓度的MeJA会抑制细胞的生长,甚至引起褐化死亡,低浓度的MeJA对悬浮细胞的生物量影响有差异,在贯叶连翘、怀槐、甘草、肉苁蓉、黄芩等中已有报道[22-31]。虽然植物悬浮细胞的研究报道已经很多,但有关红花的悬浮细胞研究至今少有报道。本研究以红花无菌子叶为外植体,从细胞形态、培养基pH值、细胞接种量等方面研究红花悬浮细胞培养条件以及MeJA刺激对红花悬浮细胞生长的影响,为红花悬浮细胞体系的应用提供技术支撑。
1 材料和仪器试剂红花Carthamus tinctorius L.来自第二军医大学药用植物园,由第二军医大学郭美丽教授鉴定。基础培养基、蔗糖、植物琼脂购自北京索莱宝公司,MeJA、植物激素N-苯基-N′-1, 2, 3-噻二唑-5-基脲(TDZ)、萘乙酸(NAA)购自Sigma公司,BD-PGX-250C智能光照培养箱购自南京贝帝实验仪器有限公司,光照摇床购自安竞公司,Leica DFC500荧光显微镜,安捷伦G6538四极杆-飞行时间串联质谱仪(QTOF),安捷伦1290超高效液相色谱仪。
2 方法 2.1 红花无菌愈伤组织的获得按照薛英茹等[32]的方法诱导培养红花愈伤组织。从−80 ℃取饱满无皱缩的种子,用自来水冲洗后放入灭菌培养瓶中,75%乙醇处理30 s,无菌水冲洗2次,5 min/次,加入0.1% HgCl2,均匀摇晃25 min,无菌水冲洗4~5次,5 min/次,镊子取出置于无菌滤纸上,吸干水分,接种到高压灭菌MS固体培养基上,每瓶5~6粒。4 ℃放置48 h春化后,于组培箱中培养[(25±2)℃,16 h光照,8 h黑暗,光照强度8 800 lx],培养约10 d即可获得无菌子叶。将无菌子叶切成约0.5 cm×0.5 cm的小块,无菌刀片在叶表面划线,接种于MS+1 mg/L TDZ+0.1 mg/L NAA,蔗糖30 g/L,琼脂8 g/L培养基上,光照条件同上。继代培养4~6次后,选取淡黄色、疏松的愈伤组织用于红花悬浮细胞的培养[33]。
2.2 红花悬浮细胞系的建立选取质地疏松、分散性好、胚性好的愈伤组织接种到液体培养基中(MS+愈伤组织继代培养的激素最佳浓度配方)。25 ℃培养,光照摇床转速为100 r/min。起初3 d继代1次,继代5次后每隔7 d继代1次,愈伤组织成团块并大量繁殖后,悬浮液用50目金属细胞筛过滤,收集滤液补充新鲜培养液进行培养。培养过程中采用Leica DFC500荧光显微镜观察悬浮细胞生长情况,并显微摄影。不同处理组重复3次。
2.2.1 植物激素配比以MS为基本培养基,本课题组对红花愈伤组织的激素配比做过系统的优化分析,最终得出MS+TDZ+NAA的浓度配比是最适宜红花胚性细胞生长的条件。
2.2.2 培养基pH值50 mL体系培养基,用NaOH/HCl调节培养基的pH值,2、3、4、5、5.5、6、7、8、9、10,愈伤组织接种量为1.0 g,置于光照摇床中培养。观察胚性组织成长状况。
2.2.3 愈伤组织接种量取愈伤组织0.5、1.0、2.0、3.0 g接种在50 mL体系液体培养基上。待细胞达到指数增长期时,采用TTC法检测各处理组的细胞活力及生长状况。
2.3 悬浮细胞生长的测定将稳定的红花悬浮细胞培养物真空抽滤,每隔6 d取样1次,滤过出愈伤组织,再用去离子水洗涤2~3次,滤纸吸干表面水分。将细胞培养物置于60 ℃烘箱中烘3 h,40 ℃干燥至恒定质量,冷却称质量为干质量,重复3次。
增长率=(不同生长时间干质量-初始干质量)/初始干质量
2.4 TTC测定细胞活力 2.4.1 TTC标准曲线的制作[34]取0.4% TTC溶液0.2 mL放入10 mL量瓶中,加少许Na2S2O4粉,摇匀后溶液立即产生红色的MTT formazan,用95%乙醇定容至刻度,摇匀。然后分别取0.25、0.50、1.00、1.50、2.00 mL置于10 mL量瓶中,用95%乙醇定容,即可得到含MTT formazan 25、50、100、150、200 μg的标准比色系列。以95%乙醇为参比,在485 nm波长下测定吸光度,绘制标准曲线。
2.4.2 悬浮细胞活力的测定取1 g真空抽滤的悬浮细胞,去离子水洗涤2~3次,滤纸吸干表面水分,放入50 mL锥形瓶中,加入5 mL 0.4% TTC和5 mL磷酸缓冲液,空白组加入2 mL H2SO4后加入TTC和磷酸缓冲液,摇匀后,37 ℃暗孵育2 h,实验组样品加入2 mL H2SO4终止反应,真空抽滤,去离子水清洗3次,取出细胞加入5 mL 95%乙醇,置于60 ℃避光摇床振荡,转速为50 r/min取上清,在485 nm波长下测定吸光度。
2.5 MeJA对红花悬浮细胞生长增殖率的影响 2.5.1 MeJA的配制自Sigma购置100 mmol/L MeJA溶液置于4 ℃,用乙醇稀释成50、500、5 000 μmol/L浓度现配现用。
2.5.2 MeJA对悬浮体系生长率的影响将稳定的悬浮细胞体系以合适的接种量转移到新的液体培养瓶中进行继代时,加入稀释好的MeJA,使终浓度分别为50、500、5 000 μmol/L,封上封口膜,置于光照培养箱中培养。生长增殖率计算同“2.3”项。
2.6 悬浮细胞培养体系化学成分初步鉴定 2.6.1 悬浮细胞样品制备取真空抽滤的新鲜悬浮细胞,称质量,加入1/5体积的70%甲醇,150 W超声提取6 min,再以1:1体积加入上述新鲜细胞的滤液,6 000 r/min离心10 min,取上清,微孔滤膜过滤即为待测样品。
2.6.2 UPLC-QTOF/MS检测悬浮细胞体系化学成分(1)色谱条件:Agilent 1290高效液相色谱仪,色谱柱为Agilent Eclipse Plus C18柱(100 mm×2.1 mm,1.8 μm),柱温40 ℃,二极管阵列检测器,进样量为4 μL,梯度洗脱,流动相为0.1%甲酸水(A)-0.1%乙腈(B),0~2 min,95% A;13~15 min,5% A;体积流量0.4 mL/min。
(2)质谱条件:质谱离子化方式:电喷雾离子化(ESI);在正负离子模式下分别采集数据。质谱全长扫描范围m/z 100~2 000。离子源参数:毛细管电压4 000 V,雾化气压力310.2 kPa(45 psi),干燥器体积流量11 L/min(温度350 ℃),碎片电压120 V。每天实验前TOF/MS通过参比溶液的实时注入实现自动校正质量坐标轴,参比液体积流量为100 μL/min,正离子模式下的参比离子包括121.050 9、922.009 8。数据采集和处理使用Agilent Mass Hunter Workstation软件。
2.7 数据处理实验数据用x±s表示,统计分析采用SPSS 21软件处理。
3 结果与分析 3.1 不同激素质量浓度对红花悬浮细胞的影响以MS作为基础培养基,比较了NAA、2, 4-D、TDZ 3种激素及其不同的浓度组合,结果表明MS+1 mg/L TDZ+0.1 mg/L NAA优于其他的激素组合,能促进红花悬浮细胞的快速增殖。TDZ浓度过高,会使愈伤组织快速成团,培养基营养物质消耗过快,影响细胞的增殖。
3.2 不同pH值对红花悬浮细胞的影响pH值对植物细胞体内的稳态环境起着重要的调节作用,并且影响着细胞的增殖和形态特征。pH值在2.0~10.0有明显的变化,pH值过低或过高都会抑制细胞的生长分裂。在pH值6.0左右时,红花悬浮细胞形状及增殖状态最为适宜。结果见表 1。
|
|
表 1 不同pH对红花悬浮细胞的影响 Table 1 Influence of different pH of safflower suspension cells |
3.3 不同接种量对红花悬浮细胞的影响
植物悬浮细胞生长需要适宜的起始密度,接种量过小时,细胞分裂缓慢,容易发生细胞自溶现象,而接种量过大时,胚性细胞容易成团成长,难以形成均匀分散的细胞系。只有当接种量大于起始密度时,细胞才会呈现明显的增殖生长。当红花悬浮细胞接种量为0.02 g/mL时(表 2),细胞在指数增长期(第12天)增长率最大,且细胞活力最强。随着接种量的增加,细胞活力和增长率都有所下降。
|
|
表 2 不同接种量对红花悬浮细胞的影响 Table 2 Influence of different inoculation quantity of safflower suspension cells |
3.4 红花悬浮细胞生长曲线
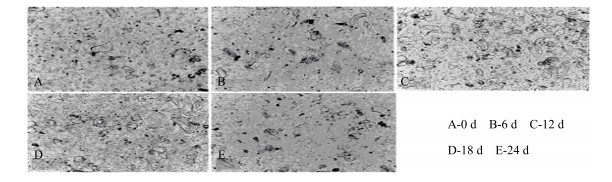
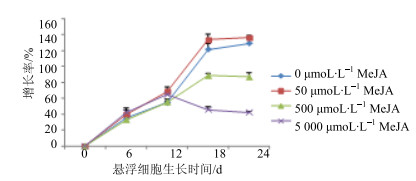
选取继代5次且生长旺盛、组织疏松的胚性愈伤组织,夹碎后接入MS+1.0 mg/mL TDZ+0.1 mg/mL NAA的液体培养基中,进行悬浮培养及细胞生长曲线的绘制。细胞刚开始密度很低(图 1-A),第6天(图 1-B)各种形状的胚性细胞开始增殖,到第12~18天(图 1-C、D),悬浮细胞大量存在,形成稳定的悬浮细胞系。红花悬浮细胞生长曲线如图 2所示。由图 2所示,红花悬浮细胞的生长量类似“S”型,细胞在生长的第12天进入指数增长期,细胞增殖迅速,18 d前后处于平台期。
|
图 1 显微镜下观察到的红花悬浮细胞图 Fig.1 Micrograph of suspension cells for growth cycle |
|
图 2 MeJA诱导的红花悬浮细胞生长曲线 Fig.2 Effect of MeJA at different concentration on growth curves of suspension cells |
3.5 MeJA对红花悬浮细胞生长曲线的影响
50 μmol/L MeJA诱导的红花悬浮细胞呈现出和未诱导条件下近似的生长趋势,而且增加了红花悬浮细胞的增殖率,增加趋势不明显。500 μmol/L的MeJA抑制了悬浮细胞的增殖,如图 2所示。
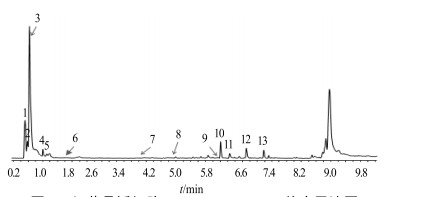
3.6 红花悬浮细胞体系化合物成分的积累在UPLC-QTOF/MS分析工作站中,本实验建立了红花的化合物数据库,基于红花悬浮细胞体系中化合物的一级质谱数据特征,经分子式匹配,对体系中的特征组分进行分子峰提取,进而对化合物进行推测,从总离子流图中可见,13个可能存在的特征化合物被标记,结果见图 3和表 3。
|
图 3 红花悬浮细胞UPLC-QTOF/MS总离子流图 Fig.3 UPLC-QTOF/MS-positive-ion for suspension cells of C. tinctorius |
|
|
表 3 红花悬浮细胞体系中推测的化学成分 Table 3 Predicted compounds for suspension cell system of C. tinctorius |
4 讨论
本研究用红花无菌子叶作为外植体进行悬浮培养,通过考察激素浓度、愈伤组织起始接种量、pH值对红花悬浮细胞体系的影响,建立了较好的红花悬浮细胞培养体系。
本研究中红花悬浮细胞的增长曲线早期生长缓慢,在第12天进入指数增长期,在第18天前后处于平台期。50 μmol/L MeJA诱导后,细胞增殖率有所上升,高浓度刺激后则抑制细胞增长,这与文献报道研究结果一致[22, 24, 26, 28]。经UPLC-QTOF/MS分析,发现红花悬浮细胞体系中可能存在红花花冠中的部分化合物,但尚有一些化合物没有检测到。红花悬浮细胞的培养条件有待进一步探索,其悬浮细胞体系的建立将为红花的基因工程和次生代谢产物的生源合成途径研究提供重要平台。
| [1] | Gecgel U, Demirci M, Esendal E, et al. Fatty acid composition of the oil from developing seeds of different varieties of safflower (Carthamus tinctorius L.)[J]. J Amer Oil Chem Soc, 2007, 84(1): 47–54. DOI:10.1007/s11746-006-1007-3 |
| [2] | Koyama N, Kuribayashi K, Seki T, et al. Serotonin derivatives, major safflower (Carthamus tinctorius L.) seed antioxidants, inhibit low-density lipoprotein (LDL) oxidation and atherosclerosis in apolipoprotein E-deficient Mmice[J]. J Agric Food Chem, 2006, 54(14): 4970–4976. DOI:10.1021/jf060254p |
| [3] | Tian Y, Yang Z F, Li Y, et al. Pharmacokinetic comparisons of hydroxysafflower yellow A in normal and blood stasis syndrome rats[J]. J Ethnopharmacol, 2010, 129(1): 1–4. DOI:10.1016/j.jep.2010.02.023 |
| [4] | Asgarpanah J, Kazemivash N. Phytochemistry, pharmacology and medicinal properties of Carthamus tinctorius L[J]. Chin J Integr Med, 2013, 19(2): 153–159. DOI:10.1007/s11655-013-1354-5 |
| [5] | Sun L, Yang L, Fu Y, et al. Capacity of HSYA to inhibit nitrotyrosine formation induced by focal ischemic brain injury[J]. Nitric Oxide, 2013, 35(6): 144–151. |
| [6] | Feng Z M, He J, Jiang J S, et al. NMR solution structure study of the representative component hydroxysafflor yellow A and other quinochalcone C-glycosides from Carthamus tinctorius[J]. J Nat Prod, 2013, 76(2): 270–274. DOI:10.1021/np300814k |
| [7] | Wang C, Huang Q, Zhu X, et al. Hydroxysafflor yellow A suppresses oleic acid-induced acute lung injury via protein kinase A[J]. Toxicol Appl Pharmacol, 2013, 272(3): 895–904. DOI:10.1016/j.taap.2013.07.021 |
| [8] | 罗建平, 郑光植. 人参培养细胞单细胞克隆的条件培养[J]. 生物工程学报, 1995, 11(1):58–62. |
| [9] | Ogawa Y, Dansako T, Yano K, et al. Eficient and high-throughput vector construction and agrobacterium-mediated transformation of Arabidopsis thaliana suspension-cultured cells for functional genomics[J]. Plant Cell Physiol, 2008, 49(2): 242–250. |
| [10] | Fukuda H, lto M, Sugiyama M, et al. Mechanisms of the proliferation and diferentiation of plant cells in cell suspension systems[J]. Int J Dev Biol, 1994, 38(2): 287–299. |
| [11] | Meyer A J, Fricker M D. Control of demand-driven biosynthesis of glutathione in green Arabidopsis suspension culture cells[J]. Plant Physiol, 2002, 130(4): 1927–1937. DOI:10.1104/pp.008243 |
| [12] | Moscatiello R, Baldan B, Nanazio L. Plant cell suspension cultures[J]. Methods Mol Biol, 2013, 953: 77–93. |
| [13] | 张玉琼, 陈娜, 周建辉, 等. 石蒜悬浮细胞系的建立及其生物碱累积的研究[J]. 中草药, 2013, 44(24):3540–3545. |
| [14] | 赵倩, 林景卫, 冯雅萍, 等. 紫茉莉悬浮细胞培养体系的建立[J]. 热带亚热带植物学报, 2013, 21(5):453–458. |
| [15] | Kathryn K, Janet C, Roger L. The establishment of cell suspension culture of gladiolus that regenerate plants[J]. In Vitro Cell Dev Biol, 1990, 26: 425–430. DOI:10.1007/BF02623835 |
| [16] | 常志凯, 朱珠, 董恒, 等. 茉莉酸甲酯结合高温胁迫对白桦悬浮细胞三萜合成的影响[J]. 中草药, 2016, 47(13):2333–2340. |
| [17] | Liu J, Han X M, Liang L, et al. Establishment of a cell suspension culture system of endangered Aquilaria sinensis (Lour. Gilg)[J]. Acta Pharm Sin, 2014, 49(8): 1194–1199. |
| [18] | 王和勇, 罗恒, 孙敏. 诱导子在药用植物细胞培养中的应用[J]. 中草药, 2004, 35(8):959–963. |
| [19] | Suzuki H, Reddy M S, Naoumkina M, et al. Methyl jasmonate and yeast elicitor induce differential transcriptional and metabolic re-programming in cell suspension cultures of the model legume Medicago truncatula[J]. Planta, 2005, 220(5): 696–707. DOI:10.1007/s00425-004-1387-2 |
| [20] | Naoumkina M, Farag M A, Sumner L W, et al. Different mechanisms for phytoalexin induction by pathogen and wound signals in Medicago truncatula[J]. Proc Natl Acad Sci USA, 2007, 104(46): 17909–17915. DOI:10.1073/pnas.0708697104 |
| [21] | 韩娟, 杨艳, 祝传书, 等. 茉莉酸甲酯处理雷公藤悬浮细胞的基因差异表达分析[J]. 西北植物学报, 2012, 32(12):2398–2404. |
| [22] | 王保军, 张秀清, 孙立伟, 等. 茉莉酸甲酯(MeJA)对贯叶连翘悬浮细胞生长和贯叶金丝桃素产量的影响[J]. 植物生理学通讯, 2008, 44(4):669–672. |
| [23] | 罗建平, 夏宁, 沈国栋. 茉莉酸甲酯、水杨酸和一氧化氮诱导怀槐悬浮细胞合成异黄酮及细胞结构变化[J]. 分子细胞生物学报, 2006, 39(5):438–442. |
| [24] | 杨英, 郑辉, 李赞, 等. 茉莉酸甲酯与二氢茉莉酮酸甲酯对悬浮培养的甘草细胞生长和黄酮积累的影响[J]. 植物生理学通讯, 2008, 44(5):903–906. |
| [25] | 徐亮胜, 薛晓锋, 付春祥, 等. 茉莉酸甲酯与水杨酸对肉苁蓉悬浮细胞中苯乙醇甙合成的影响[J]. 生物工程学, 2005, 21(3):402–406. |
| [26] | 龙小凤, 郑丽屏, 赵培飞, 等. 葡萄细胞悬浮培养生产白藜芦醇[J]. 生物加工过程, 2013, 11(5):16–20. |
| [27] | 曹英杰, 贾景明. 一氧化氮、茉莉酸甲酯与水杨酸对肉苁蓉悬浮细胞生长及苯乙醇苷生物合成的影响[J]. 中国药学杂志, 2011, 46(14):1069–1073. |
| [28] | 张进杰, 徐茂军. NO和茉莉酸甲酯对黄芩悬浮细胞生长及黄芩苷合成的影响[J]. 植物学通报, 2006, 23(4):374–379. |
| [29] | Jacinda T J, Fidele T, Paul A, et al. Metabolomic analysis of methyl jasmonate-induced triterpenoid production in the medicinal herb Centella asiatica (L.) Urban[J]. Molecules, 2013, 18(4): 4267–4281. DOI:10.3390/molecules18044267 |
| [30] | Rohan A P, Sangram K L, Jennifer N, et al. Methyl jasmonate represses growth and affects cell cycle progression in cultured Taxus cells[J]. Plant Cell Rep, 2014, 33(9): 1479–1492. DOI:10.1007/s00299-014-1632-5 |
| [31] | Fan X, Hu G S, Li N, et al. Effects of lovastatin, clomazone and methyl jasmonate treatment on the accumulation of purpurin and mollugin incell suspension cultures of Rubia cordifolia[J]. Chin J Nat Med, 2013, 11(4): 396–400. |
| [32] | 薛英茹, 李东巧, 高越, 等. 基于植物调节剂萘乙酸和6-苄氨基嘌呤组合的红花组织培养体系的优化[J]. 药学服务与研究, 2015, 15(2):91–94. |
| [33] | Shilpa K S, Kumar V D, Sujatha M. Agrobacterium-mediated genetic transformation of safflower (Carthamus tinctorius L.)[J]. Plant Cell Tiss Organ Cult, 2010, 103: 387–401. DOI:10.1007/s11240-010-9792-7 |
| [34] | 李建安, 胡芳名, 谭晓风. 拟南芥悬浮细胞及其愈伤组织对潮霉素的反应[J]. 中南林学院学报, 2006, 26(3):42–46. |
 2016, Vol. 47
2016, Vol. 47


