呼吸道合胞病毒(respiratory syncytial virus,RSV)是导致婴幼儿急性下呼吸道感染重要的病原体之一,严重危害患儿的健康。著名中医儿科专家汪受传教授认为RSV肺炎当治以开肺解毒化痰[1],在麻杏石甘汤的基础上灵活加减,自拟金欣口服液,疗效显著[2-3]。
RSV作为特异性抗原,侵袭机体后,导致体液免疫和细胞免疫紊乱。脾脏是机体内重要的免疫器官,直接参与调节免疫功能,与病毒感染密切相关。王克林等[4]发现流感病毒感染小鼠急性期脾脏质量减轻,脾淋巴细胞增殖反应受到抑制;李旭芳等[5]研究巨细胞病毒感染对小鼠脾脏Th1/Th2/Th17细胞亚群分化的影响发现,上调Th1细胞分化比例,并诱导Th2细胞分化。杜丽娜等[6]发现RSV感染可能导致小鼠的脾脏萎缩,金欣口服液可以一定程度上减轻脾脏的萎缩,从而提高机体免疫功能。此外,清肺口服液可以有效上调RSV肺炎小鼠的脾脏中TH1表达,下调TH2表达,使TH1/TH2水平下降,从而抑制相关炎症因子产生,减轻炎症反应[7-8]。
气相色谱-质谱联用技术(GC-MS)是一种高效的分析技术,利用气相色谱的高分离能力和质谱的高鉴别特性,具有灵敏度高、分析速度快、鉴别能力强等特点,并具备较成熟的质谱数据库,采用适当的衍生化处理方法后,对复杂的生物样本可以进行有效的定性定量分析,且操作简便,已成为联用技术中应用最广泛、发展最完善的仪器之一。本实验运用GC-MS技术检测分析BALB/c小鼠脾脏内代谢物,通过治疗前后其相对量的变化,探讨金欣口服液的作用机制,以期进一步为临床治疗提供理论依据。
1 材料 1.1 细胞、病毒与动物人喉癌上皮细胞(Hep-2),由中国科学院上海生命科学研究院细胞资源中心提供。RSV A亚型(Long株),由武汉国家典型培养物保藏中心提供。SPF级BALB/c小鼠32只,雌性,体质量16~18 g,周龄为4~6周,购自北京维通利华实验动物技术有限公司,使用许可证号SCXK(京)2012-0001。
1.2 主要仪器Airstream® A2型二级生物安全柜(新加坡Esco公司);DMIL型倒置显微镜(德国Leica公司);MCO-20型CO2培养箱(日本Sanyo公司);MiniSpin面包式离心机(德国Eppendorf公司);Allegra64R高速冷冻离心机(美国Beckman公司);Savant SPD1010真空离心浓缩仪;Trace1310/TSQ8000气相色谱-质谱联用仪;TG-5MS毛细管色谱柱(美国Thermo公司)。
1.3 试剂与药品高糖改良杜氏伊格尔培养基(DMEM)、0.25%胰酶(含乙二胺四乙酸)、优级胎牛血清(加拿大Wisent公司);甲醇(批号1774807513,质量分数≥99.9%,德国Merck公司);正己烷(批号SZBE1070V,质量分数≥99%),吡啶(批号PE202178,美国Thermo公司);甲氧铵盐(批号BCBN2932V)、含1%三甲基一氯硅烷(TMCS)的N, O-双三甲基硅基三氟乙酰胺(BSTFA,批号BCBN4326V)、C8~C40烷烃混标(批号1408653V)、1, 2-13C肉蔻酸(批号SH2326V,德国Sigma-Alorch公司,内标);L-天冬氨酸(批号LCA0M32,质量分数98%)、L-谷氨酸(批号LT90M31,质量分数99%)、甘氨酸(批号L410N21,质量分数98%)等对照品(中国J & K百灵威公司)。
金欣口服液(浸膏):由炙麻黄3 g、苦杏仁10 g、生石膏20 g、葶苈子10 g、黄芩6 g、前胡10 g、桑白皮10 g、虎杖12 g组成。本实验所用金欣口服液由南京中医药大学植物药与新药开发研究中心(江苏省植物药深加工工程中心)制备与质控,将上方按比例取药,用10倍量水浸泡药材30 min,大火煮沸后再用小火煎煮30 min,倒出药汁,药材中再加入8倍量水依上法煎煮,合并2次药汁,用旋转蒸发仪低压浓缩至质量浓度为1.351 g/mL的金欣口服液,然后用无菌的滤器滤过除渣,备用。质量控制则以麻黄中的麻黄碱及虎杖中的白藜芦醇的定性鉴别为标准。
2 方法 2.1 RSV扩增及半数细胞感染量(TCID50)测定体外培养Hep-2细胞以扩增RSV,参照本实验室建立的方法[9]。病毒滴度的测定采用Reed-Muench公式计算,本实验所用病毒TCID50为10-4.038/100 μL。
2.2 动物实验及样本收集将32只BALB/c小鼠常规饲养于南京中医药大学实验动物中心,12 h光照、12 h黑暗环境下自由饮食。实验期间饲养室温度设定为18~22℃,相对湿度为50%~60%。将小鼠随机分为3组,分别为对照组(8只)、模型组(16只)和金欣口服液组(8只)。除对照组外,余皆在乙醚浅麻醉后50 μL/只鼻腔滴注100×TCID50的RSV悬液(对照组给予同剂量的DMEM高糖培养基,每日滴鼻1次),待全部吸入鼻腔后放回饲养笼中并记录时间[2]。滴鼻2 h后,金欣口服液组ig给予27. 6 g/(kg∙d)(相当于2岁儿童临床等效剂量),其余各组皆给予同剂量的生理盐水。连续滴鼻并给药3 d后,于第4天随机处死8只模型组小鼠,取脾脏,除去表面附着脂肪等组织,用生理盐水稍加清洗后吸干脏器表面水分,称质量,转移至2 mL冻存管中于-80℃保存。剩余小鼠继续给药至第6天,禁食24 h,第7天末次给药2 h后,处死后以上述方法取脾脏。同时取部分右肺下叶用10%甲醛溶液固定,石蜡包埋、切片,采用常规的HE染色,置于光学显微镜观察。
2.3 GC-MS分析条件 2.3.1 色谱条件石英毛细管色谱柱(30 m×0.25 mm,0.25 μm),程序升温:初始柱温设为60℃,保留1 min,以20℃/min升温至320 ℃后,再保留4 min。进样口温度为250℃,载气为高纯氦气,体积流量为1.2 L/min,柱前压为100 kPa,采用分流模式进样(分流比为20:1),进样量为1 μL。
2.3.2 质谱条件电离方式选用EI,碰撞能量为70 eV,离子源温度280℃,离子传输线温度250℃,溶剂延迟时间设为3.5 min,扫描方式:60~600 m/z全扫描。
2.4 样品预处理及衍生化将小鼠脾脏置于冰上,每个样本准确称量30 mg,置于相应编号的离心管内,加入1 mL甲醇,然后用球磨仪磨碎15 min,吸取600 μL脾脏匀浆,加入含10 μg内标1, 2-13C肉蔻酸的甲醇20 μL,涡旋2 min,4℃、10 000 r/min离心10 min,取300 μL上清液,置于离心浓缩仪中挥干2 h。加入15 mg/mL甲氧胺吡啶溶液50 μL,混匀5 min,室温下静置16 h后加入50 μL的BSTFA(含1% TMCS),混匀后静置1 h。3 000 r/min离心5 min后,吸取上清液60 μL于玻璃内插管中,供GC-MS进样分析。
2.5 数据分析与软件根据GC-MS总离子流图(TIC)中各峰的保留时间以分离共有峰,获取相对峰面积比值(各峰面积/内标峰面积)表示代谢物的量。使用SPSS 19.0进行单因素方差分析检查组间差异。共有峰的挑选、分离、峰对齐、计算相对峰面积使用Thermo Fisher公司的Xcalibur2.0.7数据处理系统,正交偏最小二乘法-判别分析(OPLS-DA)使用SMCA-P12.0软件(Umetrics公司,瑞典)。
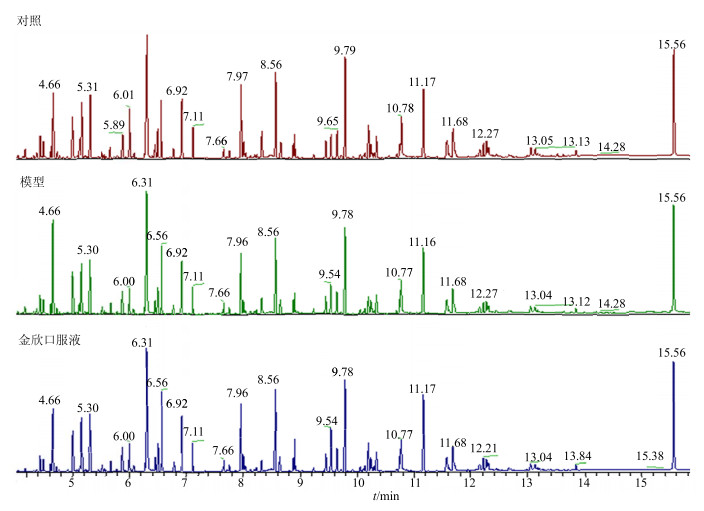
3 结果与分析 3.1 代谢组学方法的建立及脾内代谢物的鉴定脾脏组织GC-MS分析TIC如图 1所示。根据TIC中的共有峰,利用美国国家标准与技术研究院(NIST)质谱数据库以鉴定共有的内源性代谢物,通常认为匹配度高于800且可能性高于80%的鉴定结果可信度比较高[10]。鉴定结果中某些离子峰的匹配度很高而可能性较低,主要与裂解规律相似及同分异构现象有关。此外,本实验还通过对照品比对以鉴定某些代谢物。共鉴定35种内源性代谢物,见表 1。混合对照组、模型组和金欣口服液组的脾脏组织匀浆液,制备质控(QC)样本,随批次进样,进样结果发现,各QC样本相对峰面积的相对标准差(RSD)在1.38%~4.56%,提示所建立的代谢组学分析测定方法稳定性较好。
|
|
表 1 脾脏内源性代谢物 Table 1 Endogenous metabolites in spleen |
|
图 1 各组小鼠脾脏组织的TIC图 Fig.1 TIC of spleen tissue of mice in each group |
3.2 RSV感染BALB/c小鼠的肺组织病理变化
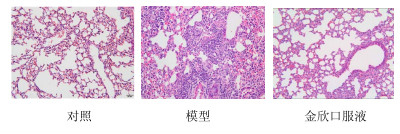
如图 2所示,对照组小鼠肺脏肺泡上皮完整,结构清晰,肺泡壁毛细血管无扩张充血,腔内无渗出物,间质少量慢性炎细胞浸润,肺间隔及支气管完好无损。模型组小鼠肺脏可见间质多灶性炎细胞浸润,以单核细胞、淋巴细胞为主;肺泡壁轻度充血,肺泡壁明显增厚。金欣口服液组小鼠肺泡结构清晰,肺泡上皮完整,肺泡腔内无明显渗出物,肺泡壁毛细血管无扩张及增厚,间质少量炎细胞浸润。因此,本研究成功建立RSV肺炎模型,并证实金欣口服液具有治疗RSV感染的疗效。
|
图 2 各组小鼠肺组织病理学检查 Fig.2 Histopathological analysis of mice spleen in each group |
3.3 代谢组学研究
代谢组学数据处理中,OPLS-DA是最常用的方法之一。作为一种新型的多元统计分析方法,其可以去除自变量X中与分类变量Y无关的数据变异,使分类信息主要集中在一个主成分中。
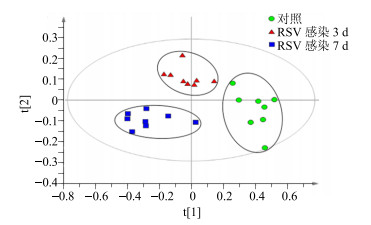
3.3.1 RSV肺炎小鼠感染3、7 d的代谢物谱分析将对照组、RSV感染3 d与7 d小鼠的脾脏中的代谢物的数据矩阵(经内标准品归一化处理)导入SIMCA-P12.0软件进行分析构建OPLS-DA模型。如图 3示,模型参数R2X=0.925,R2Y=0.793,Q2=0.74。RSV感染3 d时,即在感染初期小鼠体内的代谢物谱较对照组发生变化,与对照组可显著分离;RSV感染7 d时,其代谢物谱进一步偏离对照组,提示在感染后期其体内代谢物进一步发生改变。因此,在RSV感染期间,小鼠体内的代谢物可能呈动态变化趋势。
|
图 3 RSV感染后脾脏内源性代谢物谱模式分析OPLS-DA图 Fig.3 OPLS-DA score plots of endogenous metabolites in spleen of mice infected RSV |
3.3.2 金欣口服液对RSV肺炎的干预
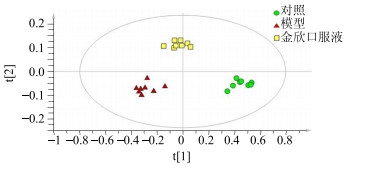
RSV肺炎引起小鼠机体代谢紊乱,金欣口服液作为治疗病毒性肺炎的有效方剂,可使紊乱的代谢恢复至正常[3]。将对照组、模型组和金欣口服液组小鼠脾脏中的内源性代谢物的数据矩阵用内标准品归一化处理后导入SIMCA-P12.0软件以构建OPLS-DA模型,模型参数R2X=0.952,R2Y=0.959,Q2=0.895,提示本模型的建模能力和预测能力均较好。由图 4可以看出,予金欣口服液干预后,在治疗7 d时,小鼠脾脏内因RSV感染而紊乱的代谢物谱具有逐渐恢复至正常状态的趋势。
|
图 4 各组小鼠脾脏内源性代谢物谱模式分析OPLS-DA图 Fig.4 OPLS-DA score plots of endogenous metabolites in spleen of mice in eachgroup |
3.4 差异代谢物的表达
运用单因素方差分析检验对照组、模型组、金欣口服液组的内源性代谢物的量的差异,设P值为0.05,共发现6种差异性代谢物,分别为脯氨酸、谷氨酸、缬氨酸、尿素、次黄嘌呤、葡萄糖。差异代谢物相对量结果见图 5。
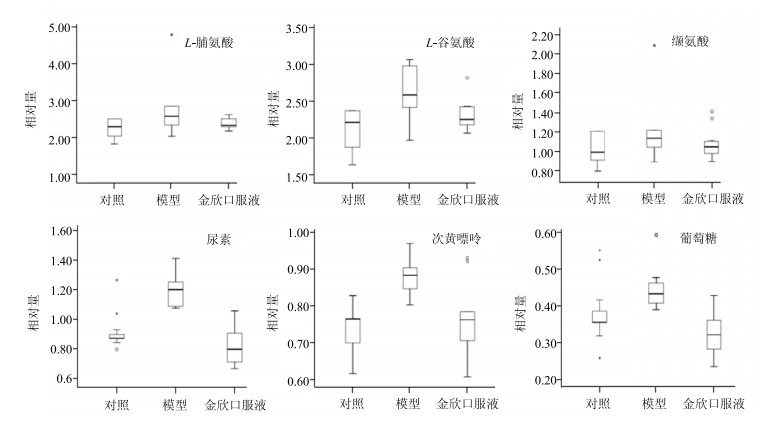
|
图 5 各组小鼠脾脏差异性代谢物相对量比较 Fig.5 Comparison on relative concentration of different endogenous metabolites in spleen of mice in each group |
3.5 相关代谢通路分析
将上述脾脏组织匀浆中的差异代谢物导入代谢通路数据库平台(http://www.metaboanalyst.ca/MetPA)进一步分析,代谢通路的重要值(pathway impact,PI)设定为0.1,结果见图 6。由此可知,在脾脏组织中,与金欣口服液干预RSV肺炎最为相关的是D-谷氨酰胺和谷氨酸代谢通路(PI=1),缬氨酸、亮氨酸和异亮氨酸代谢通路(PI=0.33),丙氨酸、天冬氨酸和谷氨酸代谢通路(PI=0.26),精氨酸和脯氨酸代谢(PI=0.16)。
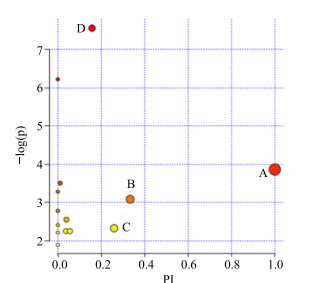
|
A-D-谷氨酰胺和谷氨酸代谢通路B-缬氨酸、亮氨酸和异亮氨酸代谢通路C-丙氨酸、天冬氨酸和谷氨酸代谢通路D-精氨酸和脯氨酸代谢 A-the metabolism pathway of D-glutamine and glutamic acid B-the metabolism pathway of valine, leucine, and isoleucine C-the metabolism pathway of alanine, aspartic acid, and glutamic acid D-the metabolism pathway of arginine and proline 图 6 相关代谢通路分析 Fig.6 Analysis of metabolism pathway |
4 讨论
病毒作为一类特异性抗原,侵袭机体后引起机体内内源性代谢物及代谢通路发生变化,运用代谢组学技术及多维统计分析方法,可以分析其中变化规律,进而阐明其中机制。Semmo等[11]研究发现丙型肝炎病人血浆代谢物谱和正常人存在显著差别,其内葡萄糖、甘露糖、油酸酰胺和乳酸等代谢物的量发生显著变化;Munger等[12]报道人巨细胞病毒感染细胞后,细胞内糖酵解、三羧酸循环、嘧啶合成的相关通路的代谢物呈动态变化。小鼠在患RSV肺炎时,体内的环境改变,代谢通路及相关代谢物也可能受到扰动。此猜想在本研究中得到证实,在小鼠RSV肺炎的病程中,其脾脏组织在3 d与7 d的代谢模式显著不同,提示RSV侵袭机体后,其内源性代谢物的量可能呈动态变化。
脾脏是机体重要的免疫器官,在发挥作用的过程中其内的代谢物也可能相应发生变化,运用代谢组学及多维统计分析方法分析其中变化有助于探究中药的作用机制。陈磊等[13]运用1H-NMR代谢组学技术研究发现补中益气汤能明显降低脾虚证模型大鼠脾脏中的乳酸、牛磺酸、次黄嘌呤的量,升高谷氨酸、鲨肌醇的量(P<0.01),使之趋向正常;Li等[14]运用GC-MS代谢组学技术研究发现当归可以调节脾脏内L-缬氨酸、L-脯氨酸、花生四烯酸、L-苏氨酸、L-丙氨酸、甘氨酸、苹果酸等代谢物的代谢,从而发挥补血作用。本研究发现,RSV肺炎时,脾脏内的次黄嘌呤、尿素、谷氨酸、脯氨酸的量均较对照组上调,显示其内源性物质的代谢可能发生紊乱。经金欣口服液治疗后,上述差异代谢物均较前有所回调,提示金欣口服液可能干预脾脏内源性代谢物的调节,从而调节脾脏发挥免疫作用。
脯氨酸是一种非必需氨基酸,主要由谷氨酸转化生成。在机体脾脏内,脯氨酸参与促吞噬素的合成。促吞噬素是一种有生物活性的肽片段,能增强吞噬细胞的吞噬能力,促进吞噬细胞的趋化作用,启动吞噬细胞的免疫功能。本研究发现,RSV肺炎小鼠脾脏内的脯氨酸的量较对照组高,推测其促吞噬素的量亦较高,可能和RSV感染后机体的免疫紊乱相关。予金欣口服液治疗后,其脯氨酸的量下降,随之促吞噬素的量亦降低,提示金欣口服液治疗RSV肺炎可能与调节脾脏免疫功能有关。
谷氨酸也是一种非必需氨基酸,既可以转化为上述脯氨酸,尚具有其他生物活性。毕爱华等[15]发现谷氨酸可能是潜在的免疫抑制剂,对细胞免疫和体液免疫均有明显的抑制作用。RSV肺炎时,机体的细胞免疫和体液免疫均增强。本研究发现,RSV感染后脾脏内的谷氨酸量较对照组增高,推测可能与机体增强的免疫反应相关,增多的谷氨酸可以反应性抑制体内增高的免疫反应。金欣口服液治疗后,谷氨酸的量较前下降,提示可能与调节机体免疫反应相关。尿素是氨基酸代谢的终产物。RSV肺炎小鼠脾脏内尿素的相对量增高,提示氨基酸的分解代谢增强,可能和RSV感染后机体的缺氧状态有关。RSV肺炎时,机体通气和换气功能障碍,能量供应不足,体内的氨基酸氧化分解以提供能量。
次黄嘌呤为嘌呤代谢物,在机体内可以通过腺嘌呤脱氨酶或亚硝酸作用由腺嘌呤脱氨生成。机体组织在缺氧状态下,ATP加速分解为二磷酸腺苷、一磷酸腺苷、次黄嘌呤,且此时次黄嘌呤转化为次黄嘌呤核苷酸的速率降低,导致机体内次黄嘌呤累积。Del Castillo Velasco-Martínez等[16]研究发现海豚运动后红细胞内的次黄嘌呤鸟嘌呤磷酸核糖基转移酶活性增强,提示缺氧组织中次黄嘌呤的再利用可能增加。本研究发现,RSV肺炎小鼠脾脏内的次黄嘌呤量增高,提示可能是机体在缺氧状态下,ATP加速分解为次黄嘌呤,虽然再利用可能反应性增加,但总量仍高于正常小鼠。运用金欣口服液治疗后,次黄嘌呤的量较前下降,可能与缺氧状态改善有关。
本实验运用GC-MS的代谢组学分析方法[17]研究RSV肺炎小鼠脾脏内源性代谢物的变化规律,发现脾脏内L-脯氨酸、L-谷氨酸、尿素、次黄嘌呤的量较对照组增高,经金欣口服液治疗后上述物质均有所回调,表明金欣口服液可以调节RSV感染导致的免疫紊乱,其赖以发挥作用的物质基础可能与脾脏内氨基酸代谢有关。本研究进一步明确了金欣口服液治疗RSV肺炎的作用机制,也为临床应用提供了一定的理论基础。
| [1] | 汪受传, 朱先康, 李江全, 等. 开肺化痰解毒法治疗小儿病毒性肺炎的研究[J]. 辽宁中医杂志, 2001, 28(7):410–412. |
| [2] | Chen Z G, Luo H, Wang S C, et al. Antiviral effects of Jinxin oral liquid against respiratory syncytial virus infection in the BALB/c mice model[J]. J Ethnopharmacol, 2015, 162: 287–295. DOI:10.1016/j.jep.2015.01.002 |
| [3] | Du L N, Xie T, Xu J Y, et al. A metabolomics approach to studying the effects of Jinxin oral liquid on RSV-infected mice using UPLC/LTQ-Orbitrap mass spectrometry[J]. J Ethnopharmacol, 2015, 174: 25–36. DOI:10.1016/j.jep.2015.07.040 |
| [4] | 王克林, 朱娟, 翟志光, 等. 流感病毒对小鼠脾淋巴细胞增殖的影响及板蓝根的干预作用[J]. 中国中医基础医学杂志, 2009, 15(10):754–755. |
| [5] | 李旭芳, 刘玲玲, 张菊, 等. 急性MCMV感染对小鼠脾Th1/Th2/Th17细胞亚群分化的影响[J]. 中国免疫学杂志, 2013, 29(5):464–467. |
| [6] | 杜丽娜, 单进军, 徐建亚, 等. 金欣口服液不同化学部位对呼吸道合胞病毒感染的影响[J]. 南京中医药大学学报, 2013, 29(2):165–168. |
| [7] | 朱莹莹, 袁斌, 徐建亚, 等. 从TH1/TH2细胞平衡角度探讨清肺口服液对感染RSV小鼠内T-bet、GATA3水平的影响[J]. 辽宁中医杂志, 2014, 41(4):805–807. |
| [8] | 陈传喆, 袁斌, 徐建亚, 等. 清肺口服液早期抗呼吸道合胞病毒肺炎的作用机制[J]. 中医杂志, 2014, 55(16):1405–1408. |
| [9] | 李佳曦, 汪受传, 徐建亚, 等. 金欣口服液含药血清及其有效单体白藜芦醇对RSV的RNA聚合酶转录活性的影响[J]. 南京中医药大学学报, 2011, 27(1):36–39. |
| [10] | Major H J, Williams A J, Wilson A J, et al. A metabonomic analysis of plasma from Zucker rat strains using gas chromatography/mass spectrometry and pattern recognition[J]. Rapid Commun Mass Spectrom, 2006, 20(22): 3295–3302. DOI:10.1002/(ISSN)1097-0231 |
| [11] | Semmo N, Weber T, Idle J R, et al. Metabolomics reveals that aldose reductase activity due to AKR1B10 is upregulated in hepatitis C virus infection[J]. J Viral Hepatitis, 2015, 22(7): 617–624. DOI:10.1111/jvh.2015.22.issue-7 |
| [12] | Munger J, Bajad S U, Coller H A, et al. Dynamics of the cellular metabolome during human cytomegalovirus infection[J]. PLoS Pathogens, 2006, 2(12): 1165–1175. |
| [13] | 陈磊, 向欢, 邢婕, 等. 补中益气汤干预脾虚证模型大鼠脾脏1H-NMR代谢组学机制研究[J]. 药学学报, 2014, 49(9):1320–1325. |
| [14] | Li P L, Sun H G, Hua Y L, et al. Metabolomics study of hematopoietic function of Angelica sinensis on blood deficiency mice model[J]. J Ethnopharmacol, 2015, 166: 261–269. DOI:10.1016/j.jep.2015.03.010 |
| [15] | 毕爱华, 王立人, 叶嗣颖, 等. 谷氨酸免疫抑制作用的研究[J]. 华中科技大学学报:医学版, 1985(6):419–425. |
| [16] | Del Castillo Velasco-Martínez I, Hernández-Camacho C J, Méndez-Rodríguez L C, et al. Purine metabolism in response to hypoxic conditions associated with breath-hold diving and exercise in erythrocytes and plasma from bottlenose dolphins (Tursiops truncatus)[J]. Comp Biochem Physiol A Mol Integr Physiol, 2015, 191: 196–201. |
| [17] | 田俊生, 左亚妹, 孙海峰, 等. GC-MS代谢组学分析逍遥散干预抑郁模型大鼠盲肠代谢物组的变化规律[J]. 中草药, 2015, 46(13):1931–1936. |
 2016, Vol. 47
2016, Vol. 47


