2. 国家中药材产品质量监督检验中心(安徽), 安徽 亳州 236800;
3. 安徽中医药大学, 安徽 合肥 230038
2. National Chinese Medicinal Materials Products Quality Supervision and Inspection Center (Anhui), Bozhou 236800, China;
3. Anhui University of Chinese Medicine, Hefei 230038, China
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是一种革兰阴性条件致病菌,广泛分布在自然界和医院环境中,且是医院内感染的重要病原菌之一[1-2]。PA能够引起伤口、眼睛和肺部等一系列器官的感染,尤其是非特异性免疫力较低的人群(烧伤患者、接受化疗癌症患者、囊性纤维化患者等)容易感染[1, 3-5]。PA对抗生素具有高度的多重耐药性,往往引起难以治愈的严重感染,对患者生命造成巨大威胁[2, 6-7]。PA产生的多种致病物质(如绿脓菌素、LasA蛋白酶等)受到群感效应系统调控。群感效应是依赖信号分子密度识别的一种细胞之间相互交流的通讯机制,可以通过协调基因的表达决定细菌的多种行为[8-10]。因此,抑制群感效应系统就能够抑制微生物的致病性。
鱼腥草素钠(sodium houttuyfonate,SH)是传统中药鱼腥草的有效成分鱼腥草素与亚硫酸氢钠的加成产物,具有抗炎消肿、抗化脓感染的功效,在临床上有着广泛的应用[11-16]。以往的研究表明,SH对PA有显著的抑制作用[17-22],但其作用机制仍然没有阐明,有待进一步研究。本实验主要观察SH对PA群感效应系统的影响,以期阐明SH对PA抑制作用的机制,为其临床应用提供理论依据。
1 材料 1.1 菌株PA(ATCC27853)、金黄色葡萄球菌(ATCC25923)均购于中国食品药品检定研究院。
1.2 药品、试剂和仪器SH(批号100247-199601)、阿奇霉素(AZM,批号130352-201007),均购于中国食品药品检定研究院。LB培养基(北京奥博星生物技术有限责任公司);pH 7.4磷酸盐缓冲液(PBS,武汉博士德生物科技有限公司);Total RNA提取试剂、逆转录试剂盒(TIANGEN公司);PCR试剂盒(TaKaRa公司);实时荧光定量PCR(qRT-PCR)反应试剂(QIAGEN公司)。DPH-9162型恒温培养箱(上海一恒科技有限公司);NRY-200型台式恒温摇床(上海南荣实验室设备有限公司);SpectraMax M2e多功能酶标仪[美谷分子仪器(上海)有限公司];GL-20G-Ⅱ高速冷冻离心机(上海安亭科学仪器厂);Eppendorf 5417R高速冷冻离心机(德国Eppendorf公司);Tgradient PCR仪(德国Biometra公司);ABI 7000荧光定量PCR仪(美国生物应用系统公司);FluorChem M凝胶成像分析系统(美国Protein Simple公司)。
2 方法 2.1 菌液配制将PA接种至液体LB培养基中,37℃摇床培养箱过夜培养,离心收集菌体,再用无菌PBS重悬并稀释至600 nm波长处吸光度(A600)值为0.05,备用[17]。
2.2 最小抑菌浓度(MIC)的测定采用微量稀释法测定SH和AZM对PA的MIC。两药的质量浓度梯度均为2 048、1 024、512、256、128、64、32、16、8、4、2、1、0.5、0.25 μg/mL。在96孔板中每个药物浓度设8个复孔,每孔分别加入100 μL含药物的培养液和100 μL菌液。混合后置于37℃下静置培养24 h,测定A600,与对照组比较,抑制率达80%的最低药物质量浓度为MIC。实验重复3次。
2.3 绿脓菌素定量实验将PA接种至6 mL含有SH(1/8 MIC、1/4 MIC、1/2 MIC、1 MIC)和AZM(1 MIC)的液体LB培养基试管中(接种量为1%),37℃摇床培养。不加药的培养基为阴性对照。培养24、72 h后,将菌液12 000 r/min离心1 min,量取上清液5 mL并加入3 mL氯仿充分混合振荡,4 500 r/min离心10 min。氯仿层转移到另一试管中,加入1 mL 0.2 mol/L HCl,液体由粉红色变为深红色,4 500 r/min离心10 min。测定其在520 nm处A520。绿脓菌素的量以A520×17.072[23]计算。每个浓度均设3个重复。
2.4 LasA蛋白酶活性的测定PA接种及药物处理同“2.3”项,用不同药物浓度作用72 h的PA上清液和在沸水中煮沸10 min的金黄色葡萄球菌的菌体[用10 mmol/LNa2HPO4(pH 4.5)重悬菌液至A600为0.8]按照1:9(体积比)混匀,测定其在混合后0、5、10、20、30、45、60 min时的A600,从而计算出每毫克LasA蛋白酶活性变化[24-26]。每个浓度均设3个重复。
2.5 菌落形态学观察将PA接种到LB液体培养基中,37℃摇床振荡培养至指数生长后期,取10 μL菌液转接到含有40 μg/mL刚果红、15 μg/mL考马斯亮蓝和含不同浓度药物的胰蛋白胨固体培养基中。药物浓度及分组同“2.3”项,培养5 d后,观察菌落形态[27-28]。
2.6 SH对PA群感效应相关基因表达的影响 2.6.1 总RNA的提取0.2 mL(7.5×105 CFU/mL)PA菌液转接到5 mL含有不同浓度药物的LB培养基中,37℃作用72 h后,10 000 r/min离心2 min,收集菌体,用无菌PBS冲洗3次后进行总RNA提取,调节RNA浓度,使菌体模板量一致。操作方法按照RNA提取试剂说明书进行。药物浓度及分组同“2.3”项,每个浓度均设3个重复。
2.6.2 引物的设计与合成所需基因序列由NCBI基因库查得,Premier 5.0软件设计引物,委托上海生工生物工程有限公司合成,各引物序列见表 1。
|
|
表 1 PA群感效应相关基因引物序列 Table 1 Related gene primer sequences for quorum sensing system of P. aeruginosa |
2.6.3 逆转录为cDNA
根据逆转录试剂盒说明书进行。8 μL RNA变性(42℃,3 min;4℃,5 min),加入Mix试剂(10×Fast RT Buffer 2 μL,RT Enzyme Mix 1 μL,RQ-RT Primer Mix 2 μL,ddH2O 5 μL)混合后按如下条件进行逆转录:42℃,15 min;95 ℃,3 min;4℃,5 min。反应完成后将cDNA稀释10倍,置于-80℃备用。
2.6.4 半定量PCR和qRT-PCR反应半定量PCR反应采用Takara公司的LA Taq试剂盒。反应条件:预变性95℃,5 min;扩增定量程序35个循环:变性95 ℃,30 s;退火56℃,30 s;延伸72℃,30 s;每个样品均设置3个重复,实验重复3次。将合成得到的DNA在1%琼脂糖凝胶上进行电泳,然后成像。qRT-PCR反应采用QIAGEN公司的Realtime PCR Master Mix(SYBR® Green)试剂盒。反应条件:预变性95℃,60 s;扩增定量程序40个循环:变性95℃,40 s;退火56℃,15 s;延伸72℃,30 s;熔解曲线:60~95℃,加热速率为0.1℃/s。qRT-PCR分别测定目的基因lasI、rhlI、lasR、rhlR、phzM、pqsA、pslA、lasA、lasB、toxA及内参rpoD的Ct值,实验平行重复3次,实验结果取其平均值。基因表达水平用倍数变化来表示(2-ΔΔCt法)[29]。
2.7 统计学方法SPSS 17.0软件进行统计学分析,计量资料以x±s表示,组间差异比较采用单因素方差分析。
3 结果 3.1 药物的MIC采用微量稀释法测得SH和AZM对PA的MIC分别为512 μg/mL和64 μg/mL。
3.2 对绿脓菌素的影响绿脓菌素是PA产生的一种重要的毒力因子,其参与微生物的竞争、抑制植物病原体、对人体和宿主动物有着极大的伤害作用[30]。绿脓菌素最重要的特点是呈现绿色或蓝绿色,如图 1所示在培养相同时间下,对照组平板颜色最深为深绿色,说明产生的绿脓菌素最多;在培养24 h时1 MIC SH和AZM组颜色几乎差不多,只有少量的绿色;随着SH质量浓度的增加培养基颜色逐渐变浅,说明绿脓菌素的合成受到了SH的抑制并呈现剂量依赖性特点。随着培养时间的延长绿脓菌素的量也不断的增加,培养72 h的绿脓菌素合成量要显著高于24 h,但各用药组的绿脓菌素增加量要显著小于对照组,(P<0.05)。结果表明SH能够有效抑制绿脓菌素的合成,并呈现剂量依赖性。
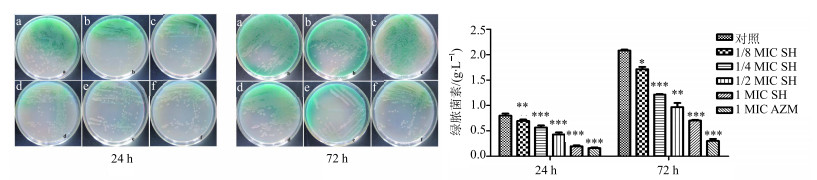
|
a-对照b-1/8 MIC SH c-1/4 MIC SH d-1/2 MIC SH e-1 MIC SH f-1 MIC AZM,与对照组比较:*P<0.05 **P<0.01 ***P<0.001 a-control b-1/8 MIC SH c-1/4 MIC SH d-1/2 MIC SH e-1 MIC SH f-1 MIC AZM, *P < 0.05 **P < 0.01 ***P < 0.001 vs control group 图 1 SH对PA合成绿脓菌素的抑制作用(x±s, n=3) Fig.1 Effect of SH on production of pyocyanin in P. aeruginosa (x±s, n=3) |
3.3 对LasA蛋白酶活性的影响
PA除了能够大量合成绿脓菌素之外,还能产生其他的毒力因子,如LasA蛋白酶在致病中起着重要的作用,尤其在急性感染过程中[31]。采用紫外分光光度法测定SH对LasA蛋白酶活性的影响。由表 2可见,与对照组比较,1/8 MIC SH、1/4 MIC SH、1/2 MIC SH和1 MIC SH组LasA蛋白酶活性分别被抑制了58.4%、80.5%、87.7%和90.3%,并呈现剂量依赖性的特点。此外,1 MIC AZM组的LasA蛋白酶活性也受到了显著的抑制(92.5%)。各药物组与对照组比较,差异均非常显著(P<0.001)。结果表明SH对LasA蛋白酶活性有显著的抑制作用。
|
|
表 2 SH对LasA蛋白酶活性的抑制作用(x±s, n=3) Table 2 Inhibition of SH against LasA activity (x±s, n=3) |
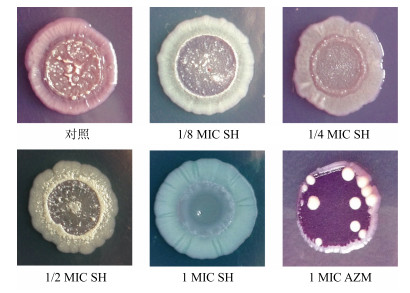
3.4 SH对菌落形态的影响
如图 2所示,对照组形成了粉红色且有褶皱的菌落,AZM组形成了紫色干燥的菌落,各SH组的菌落形态和颜色也显著不同。随着SH药物质量浓度的增加菌落中间的褶皱部分不断的减少,如1 MIC SH组菌落变得光滑无褶皱。
|
图 2 SH对PA菌落形态的影响 Fig.2 Effect of SH on colony morphology of P. aeruginosa |
3.5 对PA群感效应相关基因表达的影响
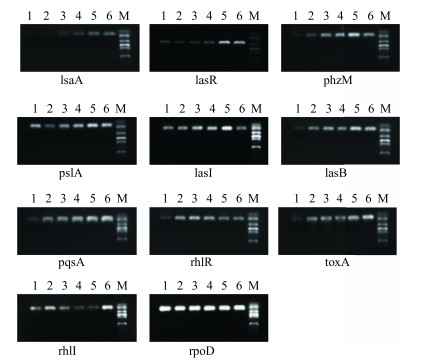
图 3为SH对PA群感效应相关基因表达影响的半定量PCR结果。进一步利用qRT-PCR技术检测了SH对群感效应相关基因表达的影响(表 3)。与对照组比较,1/8~1 MIC SH组和AZM组lasI基因表达下调倍数分别为2.500、7.407、8.130、9.090、4.910;lasR基因下调倍数分别为1.037、3.610、4.219、8.403、8.772;lasA基因下调倍数分别为1.611、3.635、6.177、8.938、9.092;pslA基因下调倍数分别为1.171、1.764、4.926、10.282、2.137;phzM基因下调倍数分别为1.541、2.609、5.366、6.612、8.474。然而,SH对rhlI基因表达却呈现了上调作用,对rhlR、pqsA、lasB、toxA基因无显著影响。
|
1-1 MIC AZM 2-1 MIC SH 3-1/2 MIC SH 4-1/4 MIC SH 5-1/8 MIC SH 6-对照M-Marker 1-1 MIC AZM 2-1 MIC SH 3-1/2 MIC SH 4-1/4 MIC SH 5-1/8 MIC SH 6-control M-Marker 图 3 群感效应相关基因半定量PCR结果 Fig.3 RT-PCR of quorum sensing and related genes |
|
|
表 3 SH对PA群感效应基因表达的影响 Table 3 Effect of SH on P. aeruginosa quorum sensing gene |
4 讨论
PA是ESKAPE病原体(Enterococcus faecium、Staphylococcus aureus、Klebsiella pneumoniae、Acinetobacter baumanii、Pseudomonas aeruginosa等)之一,因为它们能够逃避(escape)多种抗生素的治疗[32]。PA能够产生许多毒力因子形成多重耐药性,给治疗其感染带来很大的困难[33]。
群感效应是PA多重耐药性的重要调控系统[34]。因此,在抗假单胞菌领域中寻找群感效应抑制药物是热点项目之一[35]。AZM是一种临床上常用的大环内酯类抗生素,具有良好的抑制PA作用,其抗菌机制已被证明与抑制菌群传感调控系统,与抑制毒力因子、生物膜形成、运动能力有关[36]。因此,在本实验中,1 MIC浓度的AZM处理被设置为阳性对照。
PA中主要存在2种相互关联的群感效应调控系统,分别是Las和Rhl[37],并且两者存在先后顺序,Las在前并一定程度上调控Rhl。Las系统包括转录调节基因lasR和信号分子合成基因lasI,Rhl系统包括转录调节基因rhlR和信号分子合成基因rhlI[38-39]。Las和Rhl属于Lux型家族信号系统,负责信号分子的合成。lasR是PA Las系统的关键调控因子。
根据以往的研究表明SH能够通过下调藻酸盐合成相关基因和鞭毛基因的表达,抑制藻酸盐产生和运动能力,进而干扰PA生物被膜的形成抑制其生长繁殖[17-19]。本实验结果证明SH能够有效地抑制PA群感效应控制的毒力因子(如绿脓菌素、LasA蛋白酶等)的生成,并能够显著影响PA菌落的形态并呈剂量依赖性。结果还发现SH能够特异地并呈剂量依赖性地抑制Las群感效应系统的信号分子合成基因lasI和转录调节基因lasR。半定量PCR和qRT-PCR结果表明受到lasR正向调控的lasA和pslA基因的表达在SH作用下显著下调并呈剂量依赖性的特点[40-41],而lasA和pslA基因分别调控LasA蛋白酶的合成和生物被膜的形成。绿脓菌素的合成基因phzM的表达也受到了SH的强烈抑制作用,且phzM也受到lasR的正向调控。与此相反的是,SH对rhlI基因的表达却呈现了上调作用,对rhlR、pqsA、lasB和toxA基因没有影响,说明SH具有特异地抑制Las系统及其相关基因的表达,而AZM则是通过影响多种基因的转录从而影响Las和Rhl系统[36]。菌落的形态和生物被膜有很大的关系,生物被膜的形成又和多种毒力因子(如绿脓菌素等)、运动能力有着密切的联系,而这些又受到群感效应的调控[42]。
综上所述,本实验结果表明SH抗PA的机制可能是特异性地抑制PA群感效应LasA系统,从而影响了群感效应调控的相关基因和蛋白的表达,抑制了PA的生长繁殖和生物被膜的形成,从而发挥了抗菌作用,说明SH能够成为一个新的有潜力的抗群感效应药物应用于临床。然而,SH抗PA群感效应的具体机制仍然不清楚,需要进一步研究。本研究提示天然植物特别是中药可能成为抗群感效应药物的重要来源。
| [1] | Migula W. System der Bakterien[M]. Jena: Germany Gustav Fischer, 1900. |
| [2] | Palleroni N J. The Pseudomonas story[J]. Environ Microbiol, 2011, 12(6): 1377–1383. |
| [3] | Chatzinikolaou I, Abi-Said D, Bodey G P, et al. Recent experience with Pseudomonas aeruginosa bacteremia in patients with cancer:retrospective analysis of 245 episodes[J]. Arch Intern Med, 2000, 160(4): 501–509. DOI:10.1001/archinte.160.4.501 |
| [4] | Gang R K, Bang R L, Sanyal S C, et al. Pseudomonas aeruginosa septicaemia in burns[J]. Burns, 1999, 25(7): 611–616. DOI:10.1016/S0305-4179(99)00042-X |
| [5] | Jones A M, Dodd M E, Morris J, et al. Clinical outcome for cystic fibrosis patients infected with transmissible Pseudomonas aeruginosa:an 8-year prospective study[J]. Chest, 2010, 137(6): 1405–1409. DOI:10.1378/chest.09-2406 |
| [6] | Flemming H C, Wingender J. The biofilm matrix[J]. Nat Rev Microbiol, 2010, 8(9): 623–633. |
| [7] | Nathan E H, Hongwei Y. Cross-sectional analysis of clinical and environ-mental isolates of Pseudomonas aeruginosa:biofilm formation, virulence, and genome diversity[J]. Infect Immun, 2004, 72(1): 133–144. DOI:10.1128/IAI.72.1.133-144.2004 |
| [8] | Fuqua C, Greenberg E P. Self perception in bacteria:quorum sensing with acylated homoserine lactones[J]. Curr Opin Microbiol, 1998, 1(2): 183–189. DOI:10.1016/S1369-5274(98)80009-X |
| [9] | Whitehead N A, Barnard A M, Slater H, et al. Quorum-sensing in gram-negative bacteria[J]. FEMS Microbiol Rev, 2001, 25(4): 365–404. DOI:10.1111/j.1574-6976.2001.tb00583.x |
| [10] | Patzelt D, Wang H, Buchholz I, et al. You are what you talk:quorum sensing induces individual morphologies and cell division modes in Dinoroseobacter shibae[J]. ISME J, 2013, 7(12): 2274–2286. DOI:10.1038/ismej.2013.107 |
| [11] | Gao J P, Chen C X, Wu Q, et al. Effect of sodium houttuyfonate on inhibiting ventricular remodeling induced by abdominal aortic banding in rats[J]. Can J Physiol Pharmacol, 2010, 88(7): 693–701. DOI:10.1139/Y10-049 |
| [12] | Wang D, Yu Q, Eikstadt P, et al. Studies on adjuvanticity of sodium houttuyfonate and its mechanism[J]. Int Immunopharmacol, 2002, 2(10): 1411–1418. DOI:10.1016/S1567-5769(02)00060-7 |
| [13] | Shi J, Zhang H, Zhang Z, et al. Synergistic effects of tetrandrine on the antifungal activity of topical ketoconazole cream in the treatment of dermatophytoses:A clinical trial[J]. Chin J Integr Med, 2011, 17(7): 499–504. DOI:10.1007/s11655-010-0782-3 |
| [14] | Yoshino H, Imai N, Nabae K, et al. Thirteen-week oral toxicity study of dokudami extract (Houttuynia Cordata Thunb.) in F344/DuCrj rats[J]. J Toxicol Pathol, 2005, 18(4): 175–182. DOI:10.1293/tox.18.175 |
| [15] | Gao J P, Chen C X, Wang Y, et al. Effect of sodium houttuyfonate on myocardial hypertrophy in mice and rats[J]. J Pharm Pharmacol, 2009, 61(5): 677–683. DOI:10.1211/jpp.61.05.0018 |
| [16] | Ye X, Li X, Yuan L, et al. Interaction of houttuyfonate homologues with the cell membrane of gram-positive and gram-negative bacteria[J]. Coll Surf A:Physicochem Eng Aspects, 2007, 301(1/3): 412–418. |
| [17] | Shao J, Cheng H, Wang C, et al. Sodium houttuyfonate, a potential phytoanticipin derivative of antibacterial agent, inhibits bacterial attachment and pyocyanine secretion of Pseudomonas aeruginosa by attenuating flagella-mediated swimming motility[J]. World J Microbiol Biotechnol, 2013, 29(12): 2373–2378. DOI:10.1007/s11274-013-1405-2 |
| [18] | Shao J, Cheng H, Wang C, et al. A phytoanticipin derivative, sodium houttuyfonate, induces in vitro synergistic effects with levofloxacin against biofilm formation by Pseudomonas aeruginosa[J]. Molecules, 2012, 17(9): 11242–11254. |
| [19] | 程惠娟, 张昌峰, 汪长中, 等. 鱼腥草素钠对铜绿假单胞菌生物被膜藻酸盐合成的影响[J]. 中成药, 2013, 35(3):455–460. |
| [20] | 程惠娟, 汪长中, 卢文波, 等. 鱼腥草素钠对铜绿假单胞菌黏附的清除作用及对生物被膜形成的影响[J]. 中国中药杂志, 2012, 37(21):3297–3301. |
| [21] | 程惠娟, 汪长中, 胡跃龙. 鱼腥草素钠对铜绿假单胞菌生物被膜的清除作用[J]. 中成药, 2012, 34(12):2274–2277. |
| [22] | 李芳, 黄卫锋, 段强军, 等. 鱼腥草素钠联合EDTA-Na2对生物被膜菌的影响[J]. 中草药, 2014, 45(24):3585–3589. |
| [23] | Essar D W, Eberly L, Hadero A, et al. Identification and characterization of genes for a second anthranilate synthase in Pseudomonas aeruginosa:Interchangeability of the two anthranilate synthases and evolutionary implications[J]. J Bacteriol, 1990, 172(2): 884–900. DOI:10.1128/jb.172.2.884-900.1990 |
| [24] | Kessler E, Safrin M, Olson J C, et al. Secreted LasA of Pseudomonas aeruginosa is a staphylolytic protease[J]. J Biol Chem, 1993, 268(10): 7503–7508. |
| [25] | Diggle S P, Winzer K, Lazdunski A, et al. Advancing the quorum in Pseudomonas aeruginosa:MvaT and the regulation of N-acylhomoserine lactone production and virulence gene expression[J]. J Bacteriol, 2002, 184(10): 2576–2586. DOI:10.1128/JB.184.10.2576-2586.2002 |
| [26] | Kong K F, Jayawardena S R, Indulkar S D, et al. Pseudomonas aeruginosa AmpR is a global transcriptional factor that regulates expression of ampc and poxb β-lactamases, proteases, quorum sensing, and other virulence factors[J]. Antimicrob Agents Chemother, 2005, 49(11): 4567–4575. DOI:10.1128/AAC.49.11.4567-4575.2005 |
| [27] | Friedman L, Kolter R. Two genetic loci produce distinct carbohydrate-rich structural components of the Pseudomonas aeruginosa biofilm matrix[J]. J Bacteriol, 2004, 186(14): 4457–4465. DOI:10.1128/JB.186.14.4457-4465.2004 |
| [28] | Romling U, Bian Z, Hammar M, et al. Curli fibers are highly conserved between between Salmonella typhimurium and Escherichia coli with respect to operon structure and regulation[J]. J Bacteriol, 1998, 180(3): 722–731. |
| [29] | Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| [30] | Lau G W, Hassett D J, Ran H, et al. The role of pyocyanin in Pseudomonas aeruginosa infection[J]. Trends Mol Med, 2004, 10(12): 599–606. DOI:10.1016/j.molmed.2004.10.002 |
| [31] | Kharazmi A. Interactions of Pseudomonas aeruginosa proteases with the cells of the immune system[J]. Antibiot Chemother, 1989, 42: 42–49. DOI:10.1159/000417602 |
| [32] | Boucher H W, Talbot G H, Bradley J S, et al. Badbugs, nodrugs:no ESKAPE! An update from the infectious diseases society of America[J]. Clin Infect Dis, 2009, 48(1): 1–12. DOI:10.1086/596722 |
| [33] | Zelenitsky S A, Harding G K, Sun S, et al. Treatment and outcome of Pseudomonas aeruginosa bacteraemia:an antibiotic pharmacodynamic analysis[J]. J Antimicrob Chemother, 2003, 52(4): 668–674. DOI:10.1093/jac/dkg403 |
| [34] | Van Delden C, Iglewski B H. Cell-to-cell signaling and Pseudomonas aeruginosa infections[J]. Emerg Infect Dis, 1998, 4(4): 551–560. DOI:10.3201/eid0404.980405 |
| [35] | Fothergill J L, Winstanley C, James C E. Novel therapeutic strategies to counter Pseudomonas aeruginosa infections[J]. Expert Rev Anti Infect Ther, 2012, 10(2): 219–235. DOI:10.1586/eri.11.168 |
| [36] | Imperi F, Leoni L, Visca P. Antivirulence activity of azithromycin in Pseudomonas aeruginosa[J]. Front Microbiol, 2014, 5(2): 178. |
| [37] | Latifi A, Foglino M, Tanaka K, et al. A hierarchical quorum-sensing cascade in Pseudomonas aeruginosa links the transcriptional activators LasR and RhIR (VsmR) to expression of the stationary-phase sigma factor RpoS[J]. Mol Microbiol, 1996, 21(6): 1137–1146. DOI:10.1046/j.1365-2958.1996.00063.x |
| [38] | Passador L, Cook J M, Gambello M J, et al. Expression of Pseudomonas aeruginosa virulence genes requires cell-to-cell communication[J]. Science, 1993, 260(5111): 1127–1130. DOI:10.1126/science.8493556 |
| [39] | Bleves S, Soscia C, Nogueira-Orlandi P, et al. Quorum sensing negatively controls type Ⅲ secretion regulon expression in Pseudomonas aeruginosa PAO1[J]. J Bacteriol, 2005, 187(11): 3898–3902. DOI:10.1128/JB.187.11.3898-3902.2005 |
| [40] | Gilbert K B, Kim T H, Gupta R, et al. Global position analysis of the Pseudomonas aeruginosa quorum-sensing transcription factor LasR[J]. Mol Microbiol, 2009, 73(6): 1072–1085. DOI:10.1111/mmi.2009.73.issue-6 |
| [41] | Jimenez P N, Koch G, Thompson J A, et al. The multiple signaling systems regulating virulencein Pseudomonas aeruginosa[J]. Microbiol Mol Biol Rev, 2012, 76(1): 46–65. DOI:10.1128/MMBR.05007-11 |
| [42] | Daniels R, Vanderleyden J, Michiels J. Quorum sensing and swarming migration in bacteria[J]. FEMS Microbiol Rev, 2004, 28(3): 261–289. DOI:10.1016/j.femsre.2003.09.004 |
 2016, Vol. 47
2016, Vol. 47


