2. 山西大学化学化工学院, 山西 太原 030006;
3. 山西省中西医结合医院, 山西 太原 030000
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
3. Shanxi Hospital of Integrated Traditional and Western Medicine, Taiyuan 030000, China
款冬花为菊科植物款冬Tussilago farfara L.的干燥花蕾,主产于我国的山西、河南、陕西和甘肃等地,主治喘咳痰多、劳嗽咯血、急慢性气管炎等症,始载于《神农本草经》,列为中品,谓其“主咳逆上气,善喘,喉痹,诸惊痫、寒热邪气”[1]。款冬花是中医临床常用药材,也是止咳橘红口服液[2]、止嗽青果合剂[3]、感冒止咳膏[4]等多种常用中成药的重要原料。
款冬在欧洲同样是一种具有悠久历史的药用植物,与国内使用未开放的花蕾不同,在欧洲其用药部位为叶,其功效同样是止咳化痰[5]。从药用资源的角度来看,叶比花蕾具有明显的优势:首先,叶的采收容易,因为款冬花蕾的发育在地下进行,冬天地冻前花尚未出土时采挖,采收相对困难,而且采收期大多依靠经验确定,采收时常发现花蕾有腐烂现象,直接影响药材质量;其次,叶的产量高,可以有效避免不法商贩将花梗掺入花蕾中带来药材质量问题。
本课题组前期采用GC-MS[6]、核磁共振[7]等分析手段对款冬花、叶的化学成分以及止咳化痰药效进行了比较[8],结果发现,款冬叶和款冬花均可以发挥止咳化痰作用,且叶的止咳化痰作用略优于花。既然款冬花和叶都具有止咳祛痰作用,而且叶更容易采收,在中医临床中能否用款冬叶替代款冬花是值得探讨的问题。由于款冬植物中含有肝毒性的吡咯里西丁生物碱[9-11],这类生物碱表现出明显的肝毒性。因此,阐明款冬叶的安全性是其资源利用的前提。复方配伍是我国中医临床用药的主要形式,一般认为复方配伍后具有减毒增效的作用,这是中医药有别于西方植物药体系的主要特点。《本草经集注》指出款冬“得紫菀良”,即二者相须使用,其效更佳。款冬花和紫菀是中医常用药对,并构成止咳化痰常用方剂,如紫菀百花散,同时又是对立的小复方,如紫菀散。因此,考虑到款冬花在中医临床复方配伍使用的特点,应该将花和叶置于复方中进行毒性的比较。
代谢组学技术是近年来继蛋白组学、基因组学之后出现的一种新型的组学技术,以高通量检测和数据处理为手段,具有整体观的研究思路。代谢组学技术已广泛地应用于中药的毒性研究,如防己[12]、苍耳子[13-14]、朱砂[15]等。因此,本研究拟采用传统的生化指标、病理切片结合代谢组学技术对款冬花、叶配伍的紫菀散的毒性进行比较,以探讨款冬叶替代款冬花的可行性。
1 材料与方法 1.1 药材款冬花和款冬叶分别于2014年8月、12月采自山西省长治市沁县,紫菀购于山西维康堂中药饮片有限公司(批号20150101),药材经山西大学中医药现代研究中心秦雪梅教授鉴定,分别为款冬Tussilago farfaraL.的干燥花蕾及叶、紫菀Aster tataricus L. f.的干燥根和根茎,并保存在山西大学中医药现代研究中心。
1.2 动物SPE级雄性ICR小鼠,体质量18~22 g,北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2011-0012。动物自然昼夜节律光照,适应1周后进行实验。
1.3 仪器与试剂Bruker 600-MHz Avance III NMR Spectrometer(600.13 MHz质子频率,德国布鲁克公司600兆核磁仪);TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司);SPT-24氮空吹扫浓缩仪(北京斯珀特科技有限公司);电子超声组织匀浆器(宁波心之生物科技股份有限公司);漩涡混合器XW-80A(上海精科实业有限公司);旋转蒸发器RE-52A(上海亚荣生化仪器厂);LD500-1电子天平(沈阳龙腾电子有限公司);珊顿冷冻切片机;Konelab PRIME 30全自动生化分析仪。乙腈、蒸馏水、NMR试剂重水(Norell,Landisville,美国);K2HPO4·3H2O(天津市光复精细化工研究所);NaH2PO4·2H2O(天津市致远化学试剂有限公司);三甲基硅烷丙酸钠盐(TSP,Cambridge Isotope Laboratories Inc.,MA)。
1.4 款冬花、叶与紫菀配伍复方提取物的制备取款冬花蕾、叶各300 g,同时在花、叶中分别加入300 g的紫菀,10倍体积的水(质量与体积比)浸泡30~40 min后,分别用10、8、8倍量的水回流提取3次(2、1.5、1.5 h)。滤过,将滤液进行合并,冻干(款冬花复方出膏率为31.6%,款冬叶复方出膏率为40.0%)。冻干粉储存于−20 ℃冰箱中,备用。
1.5 动物实验动物适应1周后,48只小鼠称体质量,随机分为3组,包括对照组、款冬花配伍紫菀(花复方)组(生药40 g/kg)和款冬叶配伍紫菀(叶复方)组(生药40 g/kg)。从实验第1天起,连续ig给药14 d,对照组给予等量的蒸馏水,给药体积为0.8 mL/30 g,药物质量浓度1.5 g/mL。给药结束后禁食16~24 h,摘眼球取血,血液放入EP管中,在室温下静置30 min,然后3 000 r/min下离心10 min,得上清液,将上清液转移至EP管中,随机取8只动物的血清,采用全自动生化仪检测白蛋白(ALB)、碱性磷酸酶(ALP)、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、血清总胆红素(TBIL)。剩余的8只动物血清保存在−80 ℃冰箱用于代谢组学分析。每组随机取5只大鼠的脏器(心脏、肝脏、脾、肺、肾脏、胸腺),放入10%福尔马林溶液中固定,用于病理学检查。剩余的动物脏器保存在−80 ℃冰箱用于代谢组学分析。
1.6 血清、肝脏核磁检测样品的制备及测定条件冰水混合溶液中解冻血清样品,吸取血清255 μL置于1.5 mL EP管中,加入305 μL D2O,涡旋30 s,使其充分混匀,于4 ℃、13 000 r/min离心20 min,取上清液520 μL转移至内径5 mm的核磁管中。使用Bruker 600 MHz Avance III NMR谱仪采集数据,采用Carr-Purcell-Meiboom-Gill(CPMG)脉冲序列,扫描次数为64,谱宽12 345.7 Hz,脉冲时间14 s,采样时间2.654 s,弛豫时间1.0 s,采样数据点65 536,FID分辨率0.188 Hz,采样间隔40.5 s。
将储存于−80 ℃的动物肝脏取出后,迅速称取150 mg肝脏于5 mL离心管中,加入900 μL提取预冷的甲醇-水(2:1)溶液,超声匀浆,于4 ℃、13 000 r/min离心15 min,取上清液,将上清液转移至1 mL EP管中,至冰水浴中吹干,加入含TSP的磷酸盐缓冲液(D2O配制,0.1 mol/L,K2HPO4/NaH2PO4,pH 7.4)750 μL,充分震摇,使充分溶解,转移至1.5 mL EP管中,于4 ℃、13 000 r/min离心15 min,取上清液600 μL转移至内径5 mm的核磁管中用于核磁分析。于600 MHz NMR仪上采用noesygppr1d序列进行1H-NMR测定。
1.7 1H-NMR图谱处理核磁图谱采用MestReNova(version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain)进行手动相位、基线调整,血清以肌酐的化学位移δ 3.04为标准,肝脏以TSP的化学位移δ 0.00为标准进行定标。以δ 0.01分别对血清(δ 0.86~8.50)、肝脏(δ 0.65~8.90)化学位移区间进行分段积分,去除血清图谱的残余水峰(δ 4.67~5.21)、肝脏图谱的残余水峰(δ 4.68~5.18)。血清图谱以峰面积进行归一化,肝脏以脏器质量进行归一化。
1.8 统计学分析将上述处理的积分数据导入SIMCA-P 13.0(Umetrics,Sweden)软件中进行主成分分析(PCA)、正交偏最小二乘法判别(orthogonal PLS-DA,OPLS-DA)分析,用单变量分析寻找差异代谢物,并对比给药前后物质含量的变化程度。在SPSS软件中对差异成分进行ANOVA分析。
2 结果 2.1 动物脏器指数分别计算胸腺、心脏、肝脏、肾脏、肺和脾的脏器指数(脏器质量/体质量×100)。如表 1所示,给药14 d后花复方组和叶复方组的肝脏指数、脾脏指数显著高于对照组;此外,叶复方组的肾脏指数较对照组有轻度升高;其余的脏器指数无显著差异。从脏器指数的变化来看,款冬花和款冬叶组成的紫菀散对小鼠脏器指数的影响无明显差异。
|
|
表 1 各组小鼠脏器指数(x±s, n=8) Table 1 Organ indexes of mice in different groups (x±s, n=8) |
2.2 组织病理学检查结果
给药14 d后,组织病理学检查结果见图 1。花复方组和叶复方组肝脏均病变,出现汇管区炎细胞浸润、纤维组织增生、库氏细胞增生、部分肝细胞脂肪变等病理特征;花复方组[3/5(病变例数/总例数,下同)]和叶复方组(4/5)脾脏巨核细胞轻度增生;花复方组(3/5)和叶复方组(5/5)肾脏发生皮质少量肾小管嗜碱性变;其余脏器均正常。说明,款冬花、叶组成的紫菀散复方给药后均引起肝脏的明显病变,但2个复方组无显著性差异。
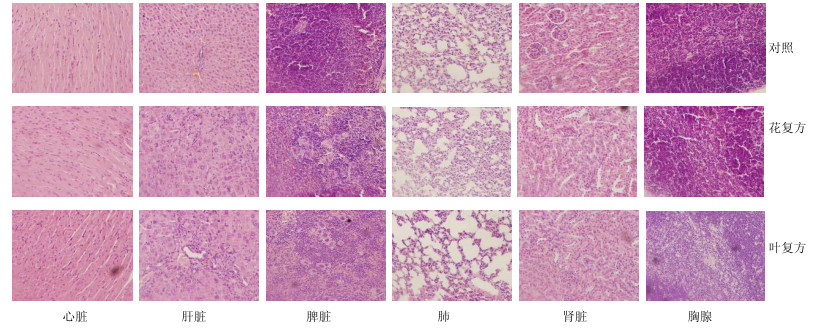
|
图 1 各组小鼠脏器病理观察 Fig.1 Histopathological analysis of mice organs in each group |
2.3 血清生化指标检测结果
由于脏器系数和病理切片的结果均显示肝脏发生明显病变,因此对给药14 d后血清中与肝脏功能相关的指标进行测定,结果见表 2。ALT、AST、ALP在2个给药组中均显著升高,说明给药引起小鼠肝功能异常。此外,花复方和叶复方对ALP、ALT的影响组间差异显著(P<0.05)。
|
|
表 2 各组小鼠血清生化指标(x±s, n=8) Table 2 Clinical chemistry parameters in serum of mice in each group (x±s, n=8) |
2.4 血清、肝脏的核磁共振数据分析
通过化学位移、耦合常数及峰形等核磁数据分析,结合对照品和文献数据[8-9]对照,从小鼠血清核磁图谱中(图 2)指认了32种化合物,肝核磁图谱(图 2)中指认出44种化合物,包括氨基酸、有机酸、糖类等(表 3)。
|
|
表 3 小鼠血清、肝脏中主要化合物的1H-NMR数据归属 Table 3 1H-NMR assignments of major metabolites from mice serum and liver |
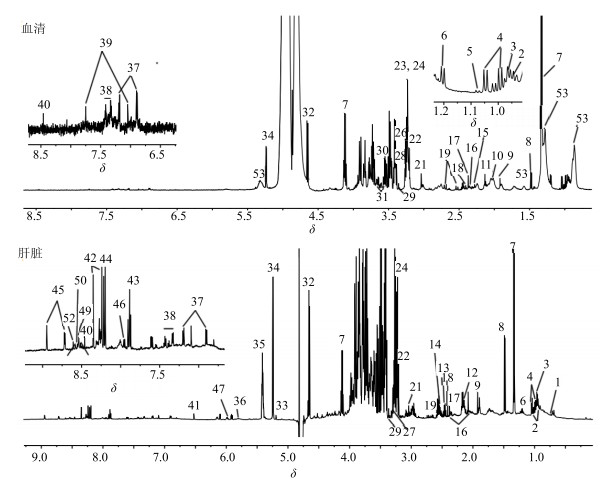
|
图 2 小鼠血清和肝脏的核磁图谱 Fig.2 Typical 1H-NMR spectra of mice serum and liver |
2.5 多元统计分析
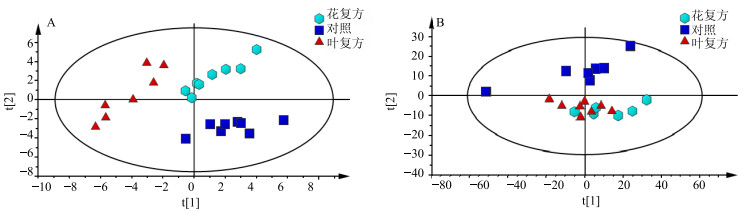
无监督的模式识别方法PCA分析是通过降维技术把具有一定相关性的指标约化为几个综合指标,可以反映数据的原始状态,从而直观地显示不同样品之间的整体差异。以前2个主成分为坐标轴构建的得分散点图见图 3,从血清的得分散点图 3-A(t1:43.1%,t2:30.6%)中可以看出,对照组与给药组可明显分开,说明给药对机体血液内源性代谢物组成有明显影响;从肝脏的得分散点图 3-B(t1:49.8%,t2:11.6%)中可以看到,2个给药组和对照组虽然均有明显分离趋势,但不明显。由于PCA分析不能忽略与研究目的无关的组内误差和随机误差,下面采用有监督的OPLS-DA(图 4)进一步分析给药后内源性代谢物的变化,并用距离法表征组间差异程度。具体方法:提取每个样品在OPLS-DA模型中的二维空间坐标参数,按照下列公式(1)计算每组样品X和Y坐标的平均值,再按照公式(2)、(3)计算花复方组和叶复方组与对照组的距离。结果见表 4,血清分析显示,花复方组距对照组近,肝脏分析结果则是叶复方组距对照组近,推测款冬花、叶组成的复方毒性相当。
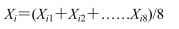
|
(1) |
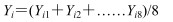
|
(2) |
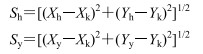
|
(3) |
|
|
表 4 各组的平均坐标和给药组与对照组的距离 Table 4 Mean value coordinates and distances between administration groups and control group |
Xi、Yi代表某一组的横坐标和纵坐标的平均值,i代表组别,Sh代表花复方组和对照组的相对距离,Sy代表叶复方组和对照组的相对距离
|
图 3 小鼠血清(A)和肝脏(B) 1H-NMR谱的PCA图谱 Fig.3 PCA score plots of the 1H-NMR spectra of mice serum (A) and liver (B) |
|
图 4 小鼠血清(A)和肝脏(B)1H-NMR谱的OPLS-DA图谱 Fig.4 OPLS-DA score plots of 1H-NMR spectra of mice serum (A) and liver (B) |
2.6 单变量分析
以肌酐为内标,选取血清中指认出的化合物中特征峰明显且与其他物质无重叠的成分进行积分,结果如表 5所示,采用相同的方法对肝脏组织进行单变量分析(表 6)。给药组小鼠血清中的异亮氨酸、亮氨酸、缬氨酸、3-羟基丁酸、乳酸、柠檬酸、肌酸、丙酮酸都显著降低,谷氨酸、丙三醇则显著升高。给药后引起小鼠肝脏中亮氨酸、缬氨酸、异亮氨酸、3-羟基丁酸、乙酸、谷氨酸、丙酸、肌酐、胆碱、甘氨酸、酪氨酸、烟酰胺显著降低,而乳酸、琥珀酸、谷胱甘肽、牛磺酸、鲨肌醇、甜菜碱、β-葡萄糖、α-葡萄糖、α-甘露糖、尿嘧啶显著升高。
|
|
表 5 花复方组和叶复方组与对照组小鼠血清代谢差异物积分面积单变量分析(x±s, n=8) Table 5 Comparison of integral levels of metabolites in control, H, and Y from mice serum (x±s, n=8) |
|
|
表 6 花复方组和叶复方组与对照组小鼠肝脏代谢差异物积分面积单变量分析(x±s, n=8) Table 6 Comparison of integral levels of metabolites in control, H, and Y from mice liver (x±s, n=8) |
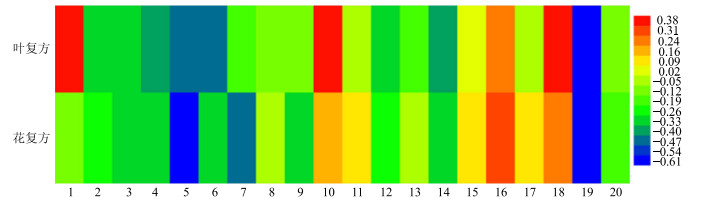
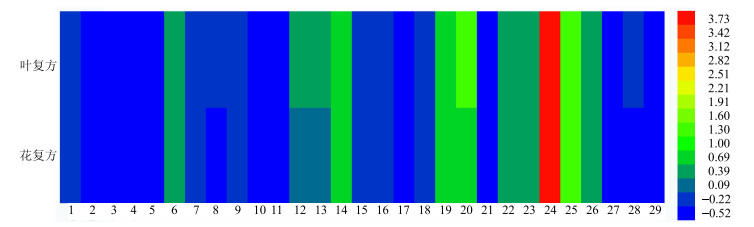
分别计算给药组中各代谢物相对于对照组的变化率,并以热图表示(图 5和图 6),可见血清中脂质、谷氨酸、缬氨酸、甘油等代谢物在叶复方组中的变化率较大,而3-羟基丁酸、丙氨酸、乙酰乙酸盐等代谢物在花复方组中的变化率较大。肝脏中琥珀酸、鲨肌醇等代谢物在叶复方组中的变化率较大,而乳酸、醋酸盐、黄嘌呤在花复方组中的变化率较大。
|
1~20代表表 5中物质的代号 1-20 means metabolites in table 5 图 5 花复方组、叶复方组较对照组血清中代谢差异物差异程度图 Fig.5 Difference degree of H and Y in serum of mice |
|
1~29代表表 6中物质的代号 1-29 means metabolites in table 6 图 6 花复方组、叶复方组较对照组肝脏中代谢差异物差异程度图 Fig.6 Difference degree of H and Y in liver of mice |
变化率=(给药组积分面积-对照组积分面积)/对照组积分面积
3 代谢通路分析为了研究款冬花和款冬叶配伍的紫菀散毒性相关标志物所涉及的代谢途径,本研究参考KEGG库,对单变量积分后具有差异的标志物进行分析。肝脏是重要的解毒器官[16],也是氨基酸代谢的主要场所。当肝脏受到外部刺激,必然导致氨基酸代谢的异常,进而影响肝脏正常的生理功能[17]。支链氨基酸是亮氨酸、异亮氨酸和缬氨酸的统称,研究发现支链氨基酸能促进蛋白质合成[18],在复方给药组中,支链氨基酸(亮氨酸和异亮氨酸)的量降低,这可能是由于肝脏受损时组织蛋白合成加速而消耗大量支链氨基酸所致。苯丙氨酸属于芳香族氨基酸,在肝脏中可以转化成酪氨酸,然后在神经系统和肾上腺髓质中合成某些激素,在给药后肝脏中酪氨酸含量降低表明肝损伤引起苯丙氨酸代谢被抑制[19]。在肝脏中氨基酸通过代谢转变生成黄嘌呤,机体内90%次黄嘌呤通过补救途径再利用形成次黄嘌呤核苷酸(MP),肝脏中氨基酸代谢异常可能导致嘌呤供应不足。给药组小鼠肝脏中黄嘌呤的量均降低,间接证明了给药组小鼠氨基酸代谢发生异常。
需氧细胞在代谢过程中产生一系列活性氧簇(ROS),ROS通过细胞氧化应激反应诱导细胞凋亡甚至导致其坏死,ROS生成也触发抗氧化机制[20]。谷胱甘肽是一种有效的非酶促抗氧化剂,能清除活性氧物质本身转化为氧化型谷胱甘肽(GSSG)[21],谷氨酸和谷氨酰胺是GSSG的前体,在本研究中,观察到给药后小鼠肝脏中谷氨酸、谷氨酰胺的量均降低,GSSG浓度显著升高,表明花、叶复方给药引起肝脏氧化应激,进而导致肝脏损伤。
葡萄糖或糖原分解为丙酮酸,在缺氧条件下丙酮酸则可在乳酸脱氢酶的催化下,接受磷酸丙糖脱下的氢,被还原为乳酸。给药后小鼠血清中乳酸、丙酮酸的量减少,表明肝脏损伤使血液中糖异生及糖酵解作用均减弱[22]。而给药后肝脏中乳酸的量升高,α-葡萄糖、β-葡萄糖的量也升高,这可能是肝脏损伤状态下有氧呼吸降低,而导致无氧呼吸增强所致。
酮体(包含丙酮、乙酰乙酸和β-羟基丁酸)是脂肪酸β-氧化的副产物,在肝细胞的线粒体基质中,它们由乙酰辅酶A而生成[23]。本研究中,给药后肝脏内3-羟基丁酸的量降低,表明脂肪酸在肝脏中的β-氧化减少,说明给药后的小鼠肝细胞线粒体功能发生障碍。磷脂酰胆碱(PC)是肝脏分泌脂蛋白的重要组成部分,花、叶复方引起小鼠血清中PC的量升高,说明给药还可能导致小鼠的脂质代谢紊乱[24]。
肝脏是合成牛磺酸的主要器官,牛磺酸从肝脏转运到机体各个位置以维持组织中的牛磺酸浓度。牛磺酸可以防止因缺氧而造成的肝细胞死亡[25],给药后牛磺酸的量显著升高,原因可能在于给药导致缺氧肝损伤,机体代偿性的生成大量的牛磺酸以保护受损的肝脏组织。
综上,复方对小鼠血清、肝脏内氨基酸、脂类、糖类等物质的代谢均有影响,参与肝脏代谢的黄嘌呤、3-羟基丁酸、乳酸在花复方组的变化程度大,谷氨酸、脂质在叶复方组中变化程度大。
4 讨论本实验对款冬花和叶分别配伍的紫菀散进行了毒性比较。病理切片和生化指标均显示给药组小鼠的肝脏发生了明显病变,血液和肝脏代谢组学分析共鉴定15个毒性相关的生物标志物,涉及氨基酸、脂质、嘌呤代谢异常、能量代谢失衡和氧化损伤等病理过程。从本研究所检测到的内源性代谢物的变化程度来看,款冬花复方给药后血液中3-羟基丁酸、丙氨酸、乙酰乙酸盐以及肝脏中乳酸、醋酸盐、黄嘌呤等代谢物的变化更大,而款冬叶复方给药后血液中缬氨酸、脂质、谷氨酸、甘油以及肝脏中琥珀酸、鲨肌醇等代谢物的变化更大。综合这些代谢物的变化来看,大剂量分别给予花、叶组成的紫菀散复方对肝脏的毒性影响虽然有所不同,但在毒性强度差异无显著区别。
款冬中含有肝毒性的吡咯里西丁生物碱,下一步我们将对款冬花和叶分别配伍的紫菀散复方中肝毒性生物碱进行定性定量测定。肝脏以及血液的代谢产物非常复杂,单一的核磁共振难以检测到所有的代谢产物,因此后续的研究中还要借助液质联用等其他检测手段进一步深入比较款冬花和款冬叶在复方中的毒性差异,为款冬叶的资源利用奠定基础。
| [1] | 李娟, 张松, 秦雪梅, 等. 基于NMR代谢组学技术的款冬花生品与蜜炙品化学成分比较[J]. 中草药, 2015, 46(20):3009–3016. |
| [2] | 赵红实, 王铭文. 止咳橘红口服液的工艺研究[J]. 中成药, 1991, 13(11):4–5. |
| [3] | 崔崇寅. 止嗽青果合剂已获批准[J]. 中成药, 1992, 14(8):43. |
| [4] | 袁建平, 徐怀志, 姚荣成, 等. 感冒止咳膏的制备及临床应用[J]. 中成药, 2005, 27(1):122–123. |
| [5] | Tys J, Szopa A, Lalak J, et al. A botanical and pharmacological description of petasites species[J]. Curr Issues Pharm Med Sci, 2015, 28(3): 151–154. |
| [6] | Xue S Y, Li Z Y, Zhi H J, et al. Metabolic fingerprinting investigation of Tussilago farfara L. by GC-MS and multivariate data analysis[J]. Biochem Syst Ecol, 2012, 41: 6–12. DOI:10.1016/j.bse.2011.11.003 |
| [7] | Zhi H J, Qin X M, Sun H F, et al. Metabolic fingerprinting of Tussilago farfara L. using 1H-NMR spectroscopy and multivariate data analysis[J]. Phytochem Anal, 2012, 23(5): 492–501. DOI:10.1002/pca.v23.5 |
| [8] | Li Z Y, Zhi H J, Zhang F S, et al. Metabolomic profiling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis[J]. J Pharm Biomed Anal, 2013, 75: 158–164. DOI:10.1016/j.jpba.2012.11.023 |
| [9] | 吴笛, 张朝凤, 张勉, 等. 中药款冬花的化学成分研究[J]. 中国药学杂志, 2008, 43(4):260–263. |
| [10] | 张燕, 黄芳, 吴笛, 等. 款冬花及其所含生物碱对小鼠肝脏毒性作用的研究[J]. 时珍国医国药, 2008, 19(8):1810–1811. |
| [11] | 祁乃喜, 刘玉梅, 何翠翠, 等. 中药毒性的代谢组学研究(Ⅱ):吡咯里西啶类生物碱的肝肾毒性[J]. 南京中医药大学学报, 2012, 28(5):448–451. |
| [12] | 梁琦, 倪诚, 颜贤忠, 等. 广防己、粉防己的肝肾毒性及代谢组学比较研究[J]. 中国中药杂志, 2010, 35(21):2882–2888. |
| [13] | Lu F, Cao M, Wu B, et al. Urinary metabonomics study on toxicity biomarker discovery in rats treated with Xanthii Fructus[J]. J Ethnopharmacol, 2013, 149(1): 311–320. DOI:10.1016/j.jep.2013.06.040 |
| [14] | Xue L M, Zhang Q Y, Han P, et al. Hepatotoxic constituents and toxicological mechanism of Xanthium strumarium L. fruits[J]. J Ethnopharmacol, 2014, 152(2): 272–282. DOI:10.1016/j.jep.2013.12.024 |
| [15] | 周昕睿, 王旗, 杨晓达. 朱砂的药理及毒理机制研究进展[J]. 中国中药杂志, 2009(22):2843–2847. |
| [16] | Huang C, Lei H, Zhao X, et al. Metabolic influence of acute cyadox exposure on kunming mice[J]. J Prot Res, 2012, 12(1): 537–545. |
| [17] | 牛倩芸, 刘月涛, 李震宇, 等. 基于核磁代谢组学技术的阿霉素肝毒性研究[J]. 药学学报, 2015, 50(6):708–713. |
| [18] | 王芃, 谢青. 支链氨基酸作为药理营养素在慢性肝病治疗中的应用[J]. 药学与临床研究, 2011, 19(6):481–484. |
| [19] | 王清平, 唐爱国. 苯丙氨酸代谢失调与疾病[J]. 国外医学:生理病理科学与临床分册, 2001, 21(6):451–453. |
| [20] | Powers S. K, Jackson M. J. Exercise-induced oxidative stress:cellular mechanisms and impact on muscle force production[J]. Physiol. Rev, 2008, 88(4): 1243–1276. DOI:10.1152/physrev.00031.2007 |
| [21] | Meister A. Glutathione metabolism and its selective modification[J]. Biol Chem, 1988, 263(33): 17205–17208. |
| [22] | Zhao X J, Huang C, Lei H, et al. Dynamic metabolic response of mice to acute mequindox exposure[J]. J Prot Res, 2011, 10(11): 5183–5190. DOI:10.1021/pr2006457 |
| [23] | Chao J, Huo T I, Cheng H Y, et al. Gallic acid ameliorated impaired glucose and lipid homeostasis in high fat diet-induced NAFLD mice[J]. PLoS One, 2014, 9(6): e96969. DOI:10.1371/journal.pone.0096969 |
| [24] | Klein J. Membrane breakdown in acute and chronic neurodegeneration:focus on choline-containing phospholipids[J]. J Neur Transm, 2000, 107(8/9): 1027–1063. |
| [25] | 秦秋兰, 鲁力. 牛磺酸抗肝毒性作用的分子生物学研究进展[J]. 国外医学:卫生学分册, 2007, 34(4):244–249. |
 2016, Vol. 47
2016, Vol. 47


