槲寄生Visci Herba为桑寄生科(Loranthaceae)槲寄生属Viscum L.植物槲寄生Viscum coloratum (Kom.) Nakai的干燥带叶茎枝,常寄生于山楂树、杨树、榆树、苹果树等植物,在我国主要分布于吉林、辽宁、黑龙江、河北、安徽、山东、江苏等省[1]。槲寄生味苦,性平,《中国药典》2015年版记载其具有祛风湿、补肝肾、强筋骨、安胎元等功效,用于治疗风湿痛、腰膝酸软、胎动不安等疾病[2]。本实验对槲寄生干燥带叶茎枝的水部位进行了系统的化学成分研究,通过各种色谱技术分离得到9个化合物,分别鉴定为鼠李秦素-3-O-β-D-芹菜糖(1→2)-O-β-D-葡萄糖苷[rhamnazin-3-O-β-D-api (1→2)-O-β-D-glucoside,1]、鼠李秦素(rhamnazine,2)、鼠李秦素-3-O-β-D-葡萄糖苷(rhamnazin-3-O-β-D-glucoside,3)、鼠李秦素-3-O-β-D-(6″-乙酰)-O-β-D-葡萄糖苷[rhamnazin-3-O-β-D-(6″-acetyl)-O-β-D-glucoside,4]、高圣草素-7-O-β-D-葡萄糖苷(homeriodictyol-7-O-β-D-glucoside,5)、高圣草素-7-O-β-D-芹菜糖基(1→2)-O-β-D-葡萄糖苷[homeriodictyol-7-O-β-D-api (1→2)-O-β-D-glucoside,6]、高圣草-7-O-β-D-葡萄糖基-4′-O-β-D-芹菜糖苷(homeriodictyol-7-O-β-D-glucoside-4′-O-β-D-apioside,7)、圣草酚-7-O-β-D-葡萄糖苷(homeriodictyol-7-O-β-D-glucosid,8)、枫香槲寄生苷(liquidamboside,9)。其中化合物1为新的黄酮苷类化合物,命名为槲寄生新苷IX,化合物9首次从槲寄生中分离得到。
1 仪器与材料UV759S紫外分光光度仪(上海精密科学仪器有限公司);Wzz-2s型旋光仪(上海精密科学仪器有限公司);X-5型显微熔点测定仪(北京泰克仪器公司);制备型液相色谱仪(LC-8A型泵,SPD-M10A型检测器,日本岛津制作所);INOVA-400型核磁共振波谱仪(美国Varian公司);Q-TOF microYA019型四极杆飞行时间质谱仪(美国Waters公司);YMC-Pack ODS-AQ制备色谱柱(250 mm×20 mm,5 μm,日本YMC公司);Sephadex LH-20(GE Healthcare公司);GF254薄层色谱板和柱色谱硅胶均系烟台芝罘黄务硅胶开发试验厂生产;所用色谱纯及分析纯有机试剂均为国药集团上海化学试剂公司生产。
槲寄生药材30 kg,购自安徽省安庆华氏中药饮片有限公司,产地为黑龙江尚志县,经中国医药工业研究总院吴彤研究员鉴定为槲寄生Viscum coloratum (Kom.) Nakai干燥带叶茎枝,药材批号14031901,标本(14031901)保存于上海医药工业研究院中药研究部。
2 提取与分离槲寄生干燥带叶茎枝27.0 kg,粉碎后用95%乙醇于60 ℃提取4次,每次2 h,合并提取液,60 ℃以下减压浓缩回收溶剂得浸膏。加入约4.0 L水分散,每次再加约1.8 L的CHCl3萃取3次,浓缩后得氯仿层流浸膏和水层流浸膏。水层流浸膏加水约3.8 L稀释,上D101大孔树脂用不同比例乙醇-水混合液洗脱得到水和10%、30%、50%、70%、95%乙醇6个部位。50%乙醇部位(70.1 g)经硅胶柱色谱,依次用醋酸乙酯-甲醇(100:0→0:100)梯度洗脱,TLC检测合并相同组分,共得到5个流分Fr. B1~B5。其中Fr. B3(23.0 g)经反复硅胶柱色谱,醋酸乙酯-甲醇(50:1→1:1)梯度洗脱,再经SephadexLH-20柱色谱及半制备HPLC分离纯化,得到化合物3(23.8 mg)、4(86.0 mg)、5(123.7 mg)、6(98.3 mg)、7(90.0 mg);Fr. B4(8.3 g)用甲醇溶解,滤过,分为2个部位,甲醇难溶部位为Fr. B4-1(4.5 g),易溶解的部位为Fr. B4-2(3.8 g);Fr. B4-2经反复硅胶柱色谱,石油醚-丙酮(6:1→1:2)梯度洗脱,Sephadex LH-20柱色谱、半制备型HPLC分离纯化,得到化合物1(21.2 mg)、2(35.6 mg)、8(22.1 mg)、9(30.0 mg)。
对化合物1中糖组分的酸水解和检测按照文献报道[3]中记载的方法进行。将化合物1(1.5 mg)在2 mL盐酸二氧六环(1:1)中回流2 h,蒸干,用100 μL无水吡啶溶解后加入200 μL(0.1 mol/L)的半胱氨酸甲酯盐酸盐。混合物在60 ℃下加热1 h,再加入2.6 mL的三甲基硅化试剂HMDS-TMCS(六甲基二硅氮烷-三甲基氯硅烷-吡啶,2:1:10),在60 ℃继续加热30 min,反应完全后,混合物用2 mL环己烷萃取,萃取物进行GC-MS分析以鉴定糖的构型。
对照品单糖(β-D-葡萄糖、β-D-芹菜糖均购自麦克林试剂,质量分数分别为99%和97%)也采用上述方法处理,并对其环己烷萃取物进行GC-MS分析,测试结果作为对照。
3 结构鉴定化合物1:黄色无定形粉末。ESI-MS m/z: 647.06 [M+Na]+, 663.06 [M+K]+, 1 271.12 [2M+Na]+, 1 287.15 [2M+K]+, 515.05 [M+H-132]+提示相对分子质量为624。分子式为C28H32O16。1H-NMR (500 MHz, CD3OD)δ: 3.86 (3H, s, 3′-OCH3), 3.97 (3H, s, 7-OCH3), 3.5~4.5 (糖上其他质子信号), 5.47 (1H, s, 芹菜糖C1-H), 5.69 (1H, d, J=7.0 Hz, β-D-葡萄糖C1-H), 6.27 (1H, d, J=2.0 Hz, H-6), 6.58 (1H, d, J=2.0 Hz, H-8), 7.96 (1H, d, J=2.0 Hz, H-2′), 6.91 (1H, d, J=8.0 Hz, H-5′), 7.63 (1H, dd, J=2.0, 8.0 Hz, H-6′), 9.12 (1H, s, 4′-OH);13C-NMR (125 MHz, CD3OD)显示有28个碳信号,其中56.6、57.0为2个甲氧基碳信号,结合DEPT谱分析:110.6 (CH, C-1′′′), 78.7 (CH, C-2′′′), 81.1 (C, C-3′′′), 75.8 (CH2 C-4′′′), 66.9 (CH2, C-5′′′)与文献报道[4]中数据基本一致,提示为芹菜糖上碳信号。δC 100.7 (CH, C-1″), 78.4 (CH, C-2″), 78.0 (CH, C-3″), 71.9 (CH, C-4″), 78.8 (CH, C-5″), 62.6 (CH2, C-6″)为葡萄糖上碳信号,由1H-NMR葡萄糖C1″-H位δH (5.69, J=7.0 Hz)可提示为β-葡萄糖。芹菜糖δ5.47 (1H, s, C-1′′′)提示为β-芹菜糖。
将化合物1糖水解后进行GC-MS分析,进一步确认为β-D-吡喃葡萄糖和β-D-呋喃芹菜糖。由ESI-MS m/z: 515.05 [M-132+H],提示芹菜糖连在末端,化合物1与化合物2、3苷元波谱数据基本一致,C-2位向低场位移δ9.0,C-3向高场位移约δ1.0,与化合物3一致,且葡萄糖C1-H与C-3相关,提示母核3位被苷化,由HMBC谱可知葡萄糖C1-H与芹菜糖C1相关,葡萄糖C2与芹菜糖C1-H相关,提示连接方式为芹菜糖(1→2)-O-β-D-葡萄糖,经Scifinder数据库检索,化合物1为新化合物,鉴定为鼠李秦素-3-O-β-D-呋喃芹菜糖(1→2)-O-β-D-吡喃葡萄糖苷,命名为槲寄生新苷IX(图 1)。具体1H-NMR,13C-NMR谱数据归属见表 1。
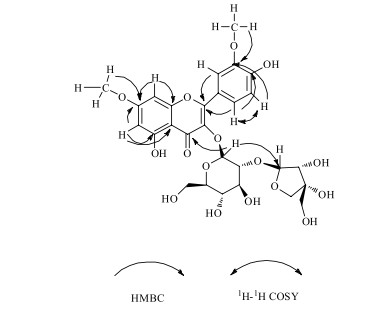
|
图 1 化合物1的结构和主要的HMBC相关 Fig.1 Structure and key HMBC correlations of compound 1 |
|
|
表 1 化合物1的1H-NMR和13C-NMR数据(500/125 MHz, CD3OD) Table 1 1H-NMR and 13C-NMR data of compound 1 (500/125 MHz, CD3OD) |
化合物2:ESI-MS m/z: 383.07 [M+Na]+, 683.13 [2M+Na]+, 329.06 [M-H]−;1H-NMR (500 MHz, CD3OD)δ: 3.82 (6H, s, 2×OCH3), 6.25 (1H, d, J=2.1 Hz, H-6), 6.51 (1H, d, J=2.0 Hz, H-8), 7.79 (1H, d, J=2.0 Hz, H-2′), 6.79 (1H, d, J=8.5 Hz, H-5′), 7.62 (1H, dd, J=2.0, 8.5 Hz, H-6′);13C-NMR (125 MHz, CD3OD)δ: 149.1 (C-2), 136.1 (C-3), 178.1 (C-4), 162.4 (C-5), 97.4 (C-6), 165.9 (C-7), 92.5 (C-8), 156.7(C-9), 105.4 (C-10), 123.0 (C-1′), 113.6 (C-2′), 147.4 (C-3′), 149.0 (C-4′), 115.6 (C-5′), 124.0 (C-6′), 56.0 (OCH3), 55.9 (OCH3)。以上数据与文献报道[4-5]基本一致,故鉴定化合物2为鼠李秦素,结构见图 2。
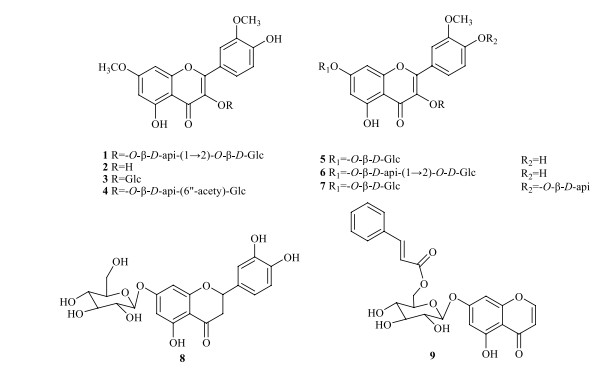
|
图 2 化合物1~9的结构 Fig.2 Structures of compounds 1-9 |
化合物3:荧光黄无定形粉末。ESI-MS m/z: 515.03 [M+Na]+, 1 007.15 [2M+Na]+, 491.06 [M-H]−;1H-NMR (500 MHz, DMSO-d6)δ: 3.82 (6H, s, 2×OCH3), 3.31~3.70为葡萄糖其他质子信号,5.34 (1H, d, J=7.5 Hz, β-D-葡萄糖C1-H), 6.20 (1H, d, J=2.0 Hz, H-6), 6.46 (1H, d, J=2.0 Hz, H-8), 7.82 (1H, d, J=2.0 Hz, H-2′), 6.82 (1H, d, J=8.0 Hz, H-5′), 7.5 (1H, dd, J=2.0, 8.5 Hz, H-6′);13C-NMR (125 MHz, DMSO-d6)δ: 158.4 (C-2), 135.2 (C-3), 179.6 (C-4), 162.9 (C-5), 99.2 (C-6), 167.4 (C-7), 93.6 (C-8), 159.0 (C-9), 106.7 (C-10), 122.4 (C-1′), 113.8 (C-2′), 148.5 (C-3′), 151.0 (C-4′), 116.1 (C-5′), 123.0 (C-6′), 56.6 (OCH3), 56.9 (OCH3), 103.5 (C-1″), 76.0 (C-2″), 78.7 (C-3″), 71.6 (C-4″), 78.1 (C-5″), 60.9 (C-6″)。化合物3与化合物1苷元波谱数据一致,其C-3位与葡萄糖相连,C-2位向低场位移δ9.0,以上数据与文献报道[4, 6]基本一致,故鉴定化合物3为鼠李秦素-3-O-β-D-吡喃葡萄糖苷。
化合物4:黄色无定形粉末。ESI-MS m/z: 557.17 [M+Na]+, 533.16 [M-H]−;1H-NMR (500 MHz, DMSO-d6)δ: 1.70 (1H, s, 6″-COCH3), 3.84 (6H, s, 2×OCH3), 5.38 (1H, d, J=8.0 Hz, β-葡萄糖C1-H), 6.27 (1H, d, J=2.0 Hz, H-6), 6.68 (1H, d, J=2.0 Hz, H-8), 6.85 (1H, d, J=8.0 Hz, H-5′), 7.47 (1H, dd, J=2.0, 8.0 Hz, H-6′), 7.80 (1H, d, J=1.5 Hz, H-2′), 9.65 (1H, s, 重水交换信号消失, OH-4′), 12.48 (1H, s, 重水交换信号消失, OH-5′);13C-NMR (125 MHz, DMSO-d6)δ: 158.6 (C-2), 135.4 (C-3), 178.5 (C-4), 163.1 (C-5), 98.6 (C-6), 165.7 (C-7), 93.3 (C-8), 156.9 (C-9), 106.4 (C-10), 122.8 (C-1′), 113.6 (C-2′), 147.6 (C-3′), 150.2 (C-4′), 115.7 (C-5′), 122.8 (C-6′), 56.2 (OCH3), 56.8 (OCH3), 102.9 (C-1″), 74.7 (C-2″), 77.2 (C-3″), 70.2 (C-4″), 74.3 (C-5″), 63.1 (C-6″), 170.1 (COCH3), 21.1 (COCH3)。以上数据与文献报道[4]基本一致,故鉴定化合物4为鼠李秦素-3-O-β-D-(6″-乙酰)-吡喃葡萄糖苷。
化合物5:黄色无定形粉末。ESI-MS m/z: 487.05 [M+Na]+, 463.06 [M-H]−;1H-NMR (500 MHz, DMSO-d6)δ: 3.86 (3H, s, OCH3), 2.73 (1H, dd, J=3.0, 17.2 Hz, H-3), 4.96 (1H, m, 葡萄糖Cl-H), 5.33 (1H, dd, J=2.8, 12.8 Hz, H-2), 6.16 (1H, d, J=2.0 Hz, H-6), 6.30 (1H, d, J=2.0 Hz, H-8), 6.90 (1H, dd, J=8.0, 1.8 Hz, H-6′), 6.81 (1H, d, J=8.0 Hz, H-5′), 7.06 (1H, d, J=1.8 Hz, H-2′), 9.35 (1H, s, 4-OH), 12.07 (1H, s, 5-OH);13C-NMR (125 MHz, DMSO-d6)δ: 81.1 (C-2), 44.3 (C-3), 198.6 (C-4), 164.9 (C-5), 97.0 (C-6), 167.0 (C-7), 98.1 (C-8), 164.6 (C-9), 105.0 (C-10), 131.5 (C-1′), 111.4 (C-2′), 149.2 (C-3′), 148.2 (C-4′), 116.2 (C-5′), 120.7 (C-6′), 56.6 (OCH3), 103.2 (C-1″), 74.7 (C-2″), 78.2 (C-3″), 71.2 (C-4), 77.8 (C-5″), 62.4 (C-6″)。以上数据与文献报道[7-8]基本一致,故鉴定化合物5为高圣草素-7-O-β-O-吡喃葡萄糖苷。
化合物6:黄色无定形粉末。ESI-MS m/z: 619.03 [M+Na]+, 1 215.01 [2M+Na]+, 487.03 [M+H-132]+, 303.01 [M+H-132-162]+;1H-NMR (500 MHz, DMSO-d6) δ: 2.73 (1H, dd, J=3.2, 17.0 Hz, H-3), 3.95 (3H, s, OCH3), 5.13 (1H, d, J=7.2 Hz, β-D-葡萄糖C1-H), 5.42 (1H, s, 芹菜糖C1-H), 5.49 (1H, dd, J=2.8, 12.0 Hz, H-2), 6.14 (1H, d, J=2.0 Hz, H-6), 6.28 (1H, d, J=2.0 Hz, H-8), 6.83 (1H, d, J=8.0 Hz, H-5′), 7.44 (1H, dd, J=8.5, 2.0 Hz, H-6′), 7.76 (1H, d, J=2.0 Hz, H-2′), 9.12, 12.04 (各1H, s, 重水交换信号消失, OH-4′, 5);13C-NMR (125 MHz, DMSO-d6)δ: 81.0 (C-2), 44.4 (C-3), 198.6 (C-4), 165.0 (C-5), 96.9 (C-6), 166.0 (C-7), 98.0 (C-8), 164.6 (C-9), 105.0 (C-10), 130.9 (C-1′), 111.9 (C-2′), 149.2 (C-3′), 148.2 (C-4′), 116.2 (C-5′), 120.8 (C-6′), 56.6 (OCH3), 99.8 (C-1″), 79.2 (C-2″), 78.3 (C-3″), 71.2 (C-4″), 78.41 (C-5″), 62.3 (C-6″), 108.4 (C-1′′′), 78.7 (C-2′′′), 78.4 (C-3′′′), 75.5 (C-4′′′), 66.0 (C-5′′′)。以上数据与文献报道[7, 9]一致,故鉴定为高圣草素-7-O-β-D-呋喃芹菜糖基(1→2)-O-β-D-吡喃葡萄糖苷。
化合物7:土黄色无定形粉末。EI-MS m/z: 597.01 [M+H]+, 465.03 [M+H-132]+, 435.04 [M+H-162]+;1H-NMR (500 MHz, DMSO-d6)δ: 2.75 (1H, dd, J=2.4, 18.0 Hz, H-3), 3.80 (3H, s, OCH3), 5.05 (1H, d, J=8.0 Hz, β-葡萄糖C1-H), 5.32 (1H, s, 芹菜糖C1-H), 5.48 (1H, dd, J=4.0, 12.0 Hz, H-2), 6.13, 6.15 (2H, s, H-6, 8), 6.80 (1H, d, J=8.0 Hz, H-5′), 7.02 (1H, dd, J=8.0, 2.0 Hz, H-6′), 7.10 (1H, d, J=2.0 Hz, H-2′), 12.03 (1H, s, 重水交换信号消失, OH-5);13C-NMR (125 MHz, DMSO-d6)δ: 79.8 (C-2), 43.5 (C-3), 197.5 (C-4), 163.2 (C-5), 96.9 (C-6), 165.3 (C-7), 95.8 (C-8), 163.1 (C-9), 103.8 (C-10), 129.6 (C-1′), 111.7 (C-2′), 148.0 (C-3′), 147.4 (C-4′), 115.7 (C-5′), 120.1 (C-6′), 56.2 (OCH3), 102.9 (C-1″), 77.9 (C-2″), 77.3 (C-3″), 70.2 (C-4″), 77.0 (C-5″), 61.0 (C-6″), 110.2 (C-1′′′), 76.6 (C-2′′′), 79.6 (C-3′′′), 74.2 (C-4′′′), 64.5 (C-5′′′)。以上数据与文献报道[8]一致,故鉴定化合物7为高圣草-7-O-β-D-吡喃葡萄糖基-4′-O-β-D-呋喃芹菜糖苷。
化合物8:黄色无定形粉末。EI-MS m/z: 483.04 [M+Na]+, 923.15 [2M+Na]+, 449.01 [M-H]−, 288.04 [苷元]+;1H-NMR (500 MHz, DMSO-d6)δ: 2.81 (2H, dd, J=4.5, 17.0 Hz, H-3), 5.39 (1H, dd, J=4.1, 12.5 Hz, H-2), 5.03 (1H, d, J=7.5 Hz, 葡萄糖C1-H), 3.31~3.70 (葡萄糖其他质子信号), 6.20 (2H, d, J=2.0 Hz, H-6), 6.34 (1H, d, J=2.0 Hz, H-8), 6.82 (1H, d, J=2.0 Hz, H-2′), 6.8 (1H, d, J=8.5 Hz, H-5′), 6.89 (1H, dd, J=2.0, 8.5 Hz, H-6′);13C-NMR (125 MHz, DMSO-d6)δ: 80.9 (C-2), 43.8 (C-3), 198.5 (C-4), 163.8 (C-5), 97.0 (C-6), 165.1 (C-7), 96.1 (C-8), 163.1 (C-9), 104.8 (C-10), 130.1 (C-1′), 111.5 (C-2′), 147.8 (C-3′), 147.4 (C-4′), 115.7 (C-5′), 120.1 (C-6′), 102.6 (C-1″), 76.6 (C-2″), 77.3 (C-3″), 71.2 (C-4″), 77.0 (C-5″), 62.0 (C-6″)。以上数据与文献报道[8]基本一致,故鉴定化合物8为圣草酚-7-O-β-O-吡喃葡萄糖苷。
化合物9:浅黄色无定形粉末。ESI-MS m/z: 493.06 [M+Na]+, 469.07 [M-H]−;1H-NMR (500 MHz, DMSO-d6)δ: 2.95, 3.71 (2H, m, H-6′), 3.59 (1H, m, H-4′), 3.85 (1H, m, H-3′), 3.82 (1H, m, H-5′), 4.91 (1H, t, J=8.4 Hz, H-2′), 5.49 (1H, d, J=8.0 Hz, 葡萄糖C1-H), 6.29 (1H, d, J=2.4 Hz, H-6), 6.49 (1H, d, J=6.0 Hz, H-3), 6.66 (1H, d, J=16.0 Hz, H-2″), 6.72 (1H, d, J=2.4 Hz, H-8), 7.69 (1H, d, J=16.0 Hz, H-3″), 8.16 (1H, d, J=6.0 Hz, H-2);13C-NMR (125 MHz, DMSO-d6)δ: 158.6 (C-2), 112.1 (C-3), 181.9 (C-4), 163.1 (C-5), 101.0 (C-6), 163.2 (C-7), 96.0 (C-8), 159.1 (C-9), 107.1 (C-10), 99.4 (C-1′), 73.9 (C-2′), 75.4 (C-3′), 70.9 (C-4′), 77.9 (C-5′), 61.9 (C-6′), 165.8 (C-1″), 119.1 (C-2″), 146.0 (C-3″), 134.9 (C-4″), 129.2 (C-5″, 9″), 130.0 (C-6″, 8″), 131.2 (C-7″)。以上数据与文献报道[10]基本一致,故鉴定化合物9为枫香槲寄生苷。
| [1] | 赵晶, 贺江萍. 槲寄生的化学成分及药理作用研究[J]. 天津中医学院学报, 2005, 24(3):185–186. |
| [2] | 中国药典[S].一部. 2015. |
| [3] | Zhang Y, Tan C H, Tan J J, et al. Glycosidic constituents of Celastrus orbiculatus[J]. Helv Chim Acta, 2010, 93(7): 1407–1412. DOI:10.1002/hlca.v93:7 |
| [4] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究Ⅰ[J]. 上海医药工业杂志, 1987, 18(3):123–127. |
| [5] | 孔德云, 李惠庭, 罗思齐. 槲寄生化学成分的研究-Ⅶ.槲寄生新甙Ⅶ的分离和结构[J]. 药学学报, 1990, 25(8):608–611. |
| [6] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究-Ⅳ.槲寄生新甙IV的结构[J]. 药学学报, 1988, 23(9):707–710. |
| [7] | 韩冬.槲寄生化学成分的研究[D].长春:长春中医药大学, 2008. |
| [8] | 王晓林, 李良琼, 李美蓉. 偏枝槲寄生化学成分研究[J]. 华西药学杂志, 1995, 10(1):1–3. |
| [9] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究-Ⅲ.槲寄生新甙Ⅲ的结构[J]. 药学学报, 1998, 23(8):593–600. |
| [10] | 杨燕军, 林洁红, 许雄伟. 枫香槲寄生化学成分的分离与结构鉴定[J]. 药学学报, 2005, 40(4):351–354. |
 2016, Vol. 47
2016, Vol. 47


