2. 中药质量研究国家重点实验室, 澳门科技大学, 澳门 000853
2. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 000853, China
中药材的品种真伪和质量优劣,直接关系到治疗效果。因此,保证中药品种的准确鉴定是中药质量控制的首要环节。相对于传统表型标记方法,中药DNA分子标记鉴定技术是指通过直接分析遗传物质的多态性来对外在性状表现规律进行鉴别,DNA分子作为遗传信息的载体,信息量大,在同种内具有高度的遗传稳定性,且不易受外界环境因素和生物发育阶段及器官组织差异的影响,因此具有高度特异性。DNA分子标记方法的兴起和逐步成熟,使得中药材以组织解剖学、化学等客观指针为依托的现代质量评价方法得到了有益的补充,并以此为突破口来解决品种鉴定中的一些难题。国内外已经利用不同DNA分子标记技术对几百种中药材进行了鉴别研究。《中国药典》也于2010年版正式将其纳入法定中药鉴定方法[1]。中药鉴定的发展趋势是寻找高效、便捷、准确的鉴定方法,但目前一般的DNA分子标记鉴别方法受PCR扩增技术限制,不仅存在需大量昂贵的实验仪器的缺点,而且操作检测步骤复杂,时间还是长于其他常规鉴别方法,大大限制了其作为快速鉴定方法的使用和推广。
以环介导等温扩增(loop-mediated isothermal amplification,LAMP)技术为代表的核酸等温扩增技术的问世,解决了核酸分子标记鉴别方法上的诸多难题,使其进行快速鉴定成为可能。LAMP是一种快速的核酸扩增技术,利用特异引物及链置换DNA聚合酶在恒温条件下自循环几十分钟,就可完成核酸扩增反应。LAMP法操作十分简单,对仪器设备要求低,结果的检测也很简便快捷,十分适合基层快速鉴别。与传统PCR技术相比,核酸等温扩增具有快速高效,且不需要专用的仪器等优点[2]。LAMP方法因其具有高特异性、高灵敏性、简便、快速、低成本等特点,已在病原体检测和疾病的快速基因诊断等诸多领域应用,取得了可喜的成就。有学者利用LAMP技术成功进行了人参Panax ginsengC. A. Mey.、何首乌Polygonum multijiorumThunb.、冬虫夏草Cordyceps sinensis(Berk.) Sacc.以及蒲公英Taraxacum formosanum Kitamura等中药材的快速分子鉴定。综合来看,LAMP法具有的简便、快速、灵敏等特点,可以实现对中药材的快速鉴定,在中药鉴定中有着广阔的应用前景。鉴于此,本文对常见的核酸等温扩增技术及其在中药材分子鉴定研究中的应用进展进行综述及分析,为中药材的快速分子鉴定体系研究提供参考。
1 常见的核酸等温扩增技术基因扩增技术是分子生物学领域的一项重要的研究手段,人们已经建成了多种方法,其中PCR技术得到了广泛的应用,但该方法需要特殊的仪器、模板的热变性及长时间的温度循环,不利于在基层实验室推广。20世纪90年代以来,以核酸等温扩增技术为基础的检测技术得到了迅猛的发展,与PCR技术相比,核酸等温扩增技术的特点是可在特定温度条件下实现核酸的扩增。由于扩增反应的全过程在同一温度下进行,可以通过加热模块、水浴锅等简单的,甚至非专业的设备完成反应,大大缩短了反应时间,因而能满足现代分子检测技术“快速简便”的需求,具有较大的实际应用价值[3]。目前,常见的核酸等温扩增技术有如下6种。
1.1 依赖核酸序列扩增(nucleic acid sequence based amplification,NASBA)技术NASBA是一项以RNA为模板的快速等温扩增技术,又称自主序列复制系统或再生长序列复制技术[4],特别适用于RNA分子的检测。利用T7RNA聚合酶仅在结合核酸上相应位点才能起作用的特点,将结合位点序列与靶序列相连,然后产生靶分子的RNA拷贝,形成反转录和RNA转录的连续循环,从而使靶序列扩增。NASBA技术已成功应用于病毒、细菌、寄生虫和细胞因子等的检测,并已被列为我国禽流感检测的国家标准[5]。然而针对以干燥药材和饮片为主要存在形式,RNA已经完全降解的中药样品,该技术显然并不适用。
1.2 滚环扩增(rolling circle amplification,RCA)技术RCA是借鉴自然界中环状病原微生物DNA分子的滚环式的复制方式而设计的一种等温核酸扩增方法,在恒温的条件下,当有环形DNA模板和聚合酶时,基于连接酶连接、引物延伸、与链置换扩增反应,可以产生大量的与环型探针互补的重复序列[6]。这种方法不仅可以直接扩增DNA和RNA,还可以实现对靶核酸的信号放大,灵敏度达到1个拷贝的核酸分子,因此在全基因组扩增、单核苷酸多态性、DNA芯片、蛋白质芯片等检测方面中具很大的应用价值。然而目前RCA的检测也还存在诸多不足:模板DNA需事先环化、锁式探针合成的费用较高、易产生背景信号干扰、RCA的结果目前没有理想的质控指标以及反应时间偏长(一般4 h以上)。因此,要想发展成为普通实验室的诊断技术,还应在探针设计和实验室质控等方面做进一步的探索研究[7]。
1.3 单引物等温扩增(single primer isothermal amplification,SPIA)技术SPIA主要是通过一条3’端是DNA片段、5’端是RNA片段的混合引物,RNase H及具有强链置换活性的DNA聚合酶实现DNA的体外线性等温扩增。SPIA扩增反应一般在55~65 ℃进行,全程需要30 min,反应过程中,RNase H不断降解引物与模板DNA所产生的DNA/RNA杂合链中的RNA部分,使未结合的引物能够不断获得结合位点并与模板进行链置换合成,并在模板链末端或链终止序列结合处终止,最终扩增出大量的具有高度忠实性的cDNA单链[8]。该技术在RNA扩增方面具有较大优点,然而其引物合成相对复杂,反应需要碱基修饰,且无法进行实时定量分析,因此目前仍难以应用在中药材分子鉴定研究方面。
1.4 依赖于解旋酶的等温扩增(helicase-dependent isothermal DNA amplification,HDA)技术HDA仿真自然界生物体内DNA复制的自然过程,在恒温条件下利用解旋酶解开DNA双链,同时DNA单链结合蛋白稳定解开的单链,为引物提供结合的模板,然后由DNA聚合酶催化合成互补链。新合成的双链在解旋酶的作用下又解成单链,并作为下一轮合成的模板进入上述的循环扩增反应,最终实现靶序列的指数式增长[9]。
1.5 链置换扩增(strand displacement amplification,SDA)技术SDA是一种基于酶促反应的DNA体外等温扩增技术[10]。在靶DNA两端带上被化学修饰的限制性核酸内切酶识别序列,核酸内切酶在其识别位点将链DNA打开缺口,DNA聚合酶继之延伸缺口3’端并替换下一条DNA链。被替换下来的DNA单链可与引物结合并被DNA聚合酶延伸成双链。该过程不断反复进行,使靶序列被高效扩增。目前该技术无法用于长片段扩增,一般不超过200 bp,产物不均一,电泳法检测时出现拖尾现象,引物设计复杂,限制条件较多,使用范围比较窄[11]。
除了以上列举的技术以外,近年来还发展了一些其他的核酸等温扩增技术,如快速等温检测放大(rapid isothermal detection and amplification,RIDA)技术、切刻内切酶核酸恒温扩增(nicking endonuclease mediated amplification,NEMA)技术、重组酶介导扩增(recombinase-aid amplification,RAA)技术[8]等。综合来看,这些方法或者基于DNA/RNA生物合成机制研究的新发现,或者利用具有特殊功能的核酸酶,均能将微量标本进行快速扩增,但都在特异性、简便程度、温度、试剂和仪器要求等方面各有缺点。
1.6 LAMP技术Notomi等[12]于2000年开发了一种新颖的核酸等温扩增方法LAMP,其特点是针对靶基因的6个区域设计4条特异引物,利用一种链置换DNA聚合酶(Bst DNA polymerase)在等温条件(65 ℃左右)保温几十分钟,即可完成核酸扩增反应,不需要模板的热变性、长时间温度循环、繁琐的电泳、紫外观察等过程。
引物设计是否合理是决定LAMP技术是否高效特异的关键。该技术针对靶基因6个特异区域(3’端的F3c、F2c、Flc区以及5’端的B1c、B2c、B3c区)设计4条特异引物,即上游外引物(F3)、下游外引物(B3)、上游内引物(FIP)、下游内引物(BIP)。FIP引物在3’末端含有与F2c互补的F2区段,在5’末端含有与F1c相同序列的区段。BIP引物在3’末端含有与B2c互补的B2区段,在5’末端含有与B1c相同序列的区段(图 1,引自Eiken Co. Ltd.网站)。为提高扩增效率,可以再添加2条环状引物,即上游环状引物(LF)和下游环状引物(LB)。
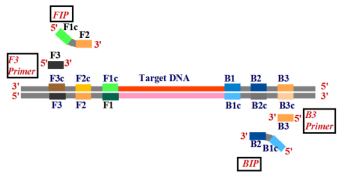
|
F3-上游外引物B3-下游外引物FIP-上游内引物(F2+F1c)BIP-下游内引物(B2+B1c) F3-forward outer primer B3-backward outer primer FIP-forward inner primer BIP-backward inner primer 图 1 LAMP引物在靶基因上的设计 Fig.1 Design of LAMP primers on target gene |
LAMP的扩增原理是利用Bst DNA聚合酶的链置换活性提供反应的动力,在恒温条件下短时间(30~60 min)内完成靶DNA的高效扩增,整个反应分为两大阶段,即初反应物哑铃状模板的合成,基因循环扩增、延伸和再循环阶段(图 2,引自Eiken Co. Ltd.网站)。
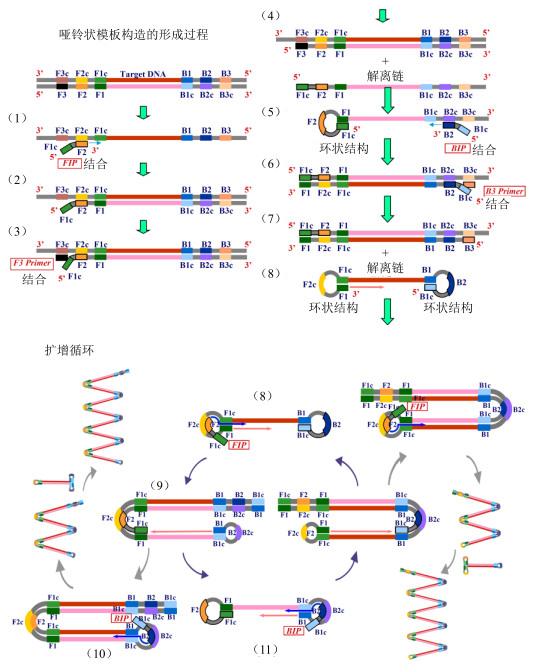
|
图 2 LAMP扩增原理 Fig.2 Amplification principle of LAMP |
第1阶段:哑铃状模板构造形成。在具有链置换活性DNA聚合酶的作用下,内引物FIP与模板DNA结合形成互补链;随后,新合成链在外引物F3的作用下被置换,而被置换的单链在5’末端形成环状结构。然后,内引物BIP与该单链结合,在延伸过程中同时打开环状结构,形成双链DNA。最后,
外引物B3与该双链DNA的B3c结合,随着引物B3的不断延伸,两侧分别为FIB和BIP的完整单链被置换。由于该单链两端存在互补序列,于是形成“哑铃状”循环扩增的起始结构。
第2阶段:扩增循环过程。在哑铃状结构中,以3’端F1区段为起点,以自身为模板,进行DNA合成延伸。与此同时,F2与F2c结合,启动新一轮链置换反应,使F1区段新合成的链解离,解离出的单链再形成环状结构。该环状结构一方面以B1为引物进行延伸,使F2合成链解离,解离链进而形成哑铃状结构,重复上述过程;另一方面,BIP引物上的B2与环上的B2c结合,启动新一轮扩增,再经过链解离、环状结构形成、环状结构自身扩增、单链置换等过程,最后形成大小不一的茎环结构、多环花椰菜样结构的DNA片段混合物,使得琼脂糖凝胶电泳条带呈现梯形[12]。
相对于PCR和其他核酸等温扩增方法,LAMP法具有许多所无法比拟的优势:(1)操作简单,在恒温的条件下实现核酸的扩增,不需要热循环仪;不论是DNA还是RNA,检测步骤都是需将反应液、酶和模板混合于PCR管中,置于水浴锅或恒温箱中63 ℃左右保温30~60 min,肉眼观察结果。(2)灵敏度高,可以达到1×109~1×1010倍的扩增,比传统的PCR法高100~1 000倍。(3)特异性高,采用4/6条特异引物识别目的基因上的6/8个特异性区域。(4)扩增速度快,效率高,可在30~60 min内获得结果,若在引物上再进一步改进,可大大提高其扩增效率,扩增时间在原来的基础上减少1/3~1/2。(5)结果判定简单,在核酸大量合成时,从dNTP析出的焦磷酸根离子与反应溶液中的Mg2+结合,产生副产物焦磷酸镁沉淀,无需电泳即可实现肉眼可见或浊度计观察的扩增效果;也可利用现有的荧光定量PCR仪作荧光定量检测,或加入荧光指示剂直接荧光目视检测(图 3,引自Eiken Co. Ltd.网站)。(6)只要加入反转录酶,对于RNA病毒或其他RNA目标物亦可利用本方法来做检测。(7)如果实验室有Real-time PCR的仪器,本方法亦可搭配该仪器进行目标物定量的检测[11]。

|
图 3 LAMP扩增结果的目视判定 Fig.3 Results of LAMP amplification of visual judgment |
2 LAMP技术在中药分子鉴定中的应用
目前LAMP技术已广泛应用于日本国内各种病毒、细菌、寄生虫等引起的疾病检测和食品、化妆品安全检查及进出口快速诊断中,许多检测方法已经列入《日本药典》,并得到了欧美国家的认同[13]。
最早将LAMP技术用于中药快速鉴别研究的是Sasaki等[14],他们选择18 S核糖体RNA片段为靶基因序列,比对序列差异位点,设计LAMP特异引物,进行了人参与竹节参Panax japonicusC. A. Mey.、甘草Glycyrrhiza uralensisFisch.的LAMP鉴别研究。通过观察实时浊度曲线的变化,可在30 min内快速灵敏地将人参鉴别。Sasaki等[15]还基于trnK序列设计LAMP引物,建立了姜黄Curcuma longaL.和郁金Curcuma aromatica Salisb.的快速鉴别方法。
Sasaki等[16]基于trnL内含子片段的序列差异位点,设计LAMP引物,通过观察实时浊度曲线的变化和荧光目视2种检测方式,进行了2种性状极其相似药用植物的仙人掌乌羽玉Lophophora. WilliamsiiJ. M. Coulter和翠冠玉L. diffusa Bravo的快速鉴别。呙军[17]利用LAMP对何首乌及其混伪品进行了快速鉴定研究,通过相关序列扩增多态性(SRAP)寻找何首乌特异性条带,再通过对特异性条带序列测序,设计一套LAMP引物对何首乌进行特异扩增,最后通过对扩增结果的荧光检测实现何首乌快速鉴定。Chaudhary等[18]使用RAPD扩增长春花Catharanthus roseus (L.) G. Don及其伪品,获得了1个610 bp的长春花特有片段,利用该标记设计LAMP引物,成功鉴别了长春花及其伪品。李奎等[19]针对冬虫夏草的CS2 serine protease(csp2)基因设计LAMP内外引物对,采用包括冬虫夏草在内的6种不同虫草进行LAMP扩增,并对阳性产物酶切鉴定以检测其特异性,通过对模板DNA的10倍梯度稀释,检测其灵敏度;紫外灯下观察凝胶电泳或加入荧光染料SYBR Green I的扩增产物。结果设计的LAMP引物可以特异地针对冬虫夏草的csp2基因进行扩增,产物可被限制性内切酶Taq I酶切,且有较高的灵敏度,检出限达6 pg/mL。江荧真[20]采用LAMP技术进行了台湾蒲公英及其混淆品的分子鉴定研究,针对ITS2序列设计台湾蒲公英正品药材的高特异LAMP引物,通过对引物的反应性测试、反应时间、特异性和灵敏度试验,建立了一套可快速且灵敏鉴定台湾蒲公英药材及其混淆品的基因鉴别方法。蒋超[21]根据trnL-trnF序列625C/A变异位点设计了LAMP引物组,对21份金银花类中药及50份其他种属物种进行LAMP鉴别。当设定孵育温度为63 ℃时,扩增完成加入SYBR Green I荧光染料时,金银花类中药均显示强烈的荧光,而其伪品显示极弱荧光。当温度为65 ℃时,能鉴别金银花Lonicera japonicaThunb.及其伪品。余淑琳等[22]通过测序比对钩吻Gelsemium elegans(Gardn. & Champ.) Benth.与金银花及山银花Lonicerae Flos的trnL-trnF序列,依据其差异位点进行引物设计,成功对金银花类药材及其易混淆品有毒药材钩吻进行鉴别。赵源等[23]以线粒体基因nad 1为靶基因设计特异性引物建立了人参的LAMP检测方法,能够在1 h内完成检测,灵敏度比常规PCR高10倍。
3 结语与展望LAMP方法因其具有高特异性、高灵敏性、简便、快速、低成本等特点,已在病原体检测和疾病的快速基因诊断,以及转基因植物、真菌、食品安全等诸多领域应用,取得了可喜的成就。然而,由于中药多是固体,样品的快速处理和DNA提取存在困难,难以实现快速分子鉴定,同时LAMP技术比较新颖,发展时间较短,近两年才成熟起来,还没有引起中药界广泛关注和接受,LAMP技术在中药材的快速鉴定应用中仍较鲜见报道。此外,LAMP技术对中药的分子鉴定研究还存在一些技术困难,主要表现在3个方面:1)样品基因组信息不全。LAMP反应通常被扩增序列较短且特异性较高,因此目的基因选择和LAMP引物设计要求对基因组的信息了解较全面,但目前中药的基因组序列基本都还不明确。2)LAMP的引物设计较为复杂。LAMP实验原理和常规PCR不同,其引物设计原则也有较大差异。3)LAMP太过于灵敏和产物量的巨大,使得LAMP产物及易污染。
针对以上问题,笔者认为,LAMP技术虽然存在一定困难和不足,但其拥有卓越的特性,且该技术近年来已取得了飞速的发展和完善,并找到相应的解决方案,在中药材的快速分子鉴定研究中前景广阔。首先,常规分子鉴定研究,因受到PCR技术的限制,且操作步骤较多,通常要求DNA模板质量较高,因此对中药固体样品多采用常规方法处理提取,而基于LAMP技术的高灵敏度,模板DNA即使拷贝数较低,仍可在30 min内检出,因此对模板质量要求较低,这就使得中药固体样品的快速处理和DNA快速提取成为可能。其次,在以往的分子鉴定研究中,需要大量基因测序、筛选比对,才能选择到合适的序列。近年来随着中药分子鉴定技术,尤其是DNA条形码技术的发展,相关研究表明,在中药的基因组序列还不明确的情况下,可以利用一段或几段标准DNA序列实现动物、植物和真菌物种的准确鉴定,现该技术已经被广泛认可并已应用于生物物种的鉴定。随着LAMP理论和技术的发展成熟,已经出现了自动化的LAMP引物设计软件,操作简单方便,并可委托专业公司代为设计,大量实践也证明,其成功率较高。最后,针对容易污染的情况,在任何进行LAMP实验前,一定要关注污染问题。通过实验室严格分区,尽量进行不开盖检测,或是采用业界最新研制的固态封闭剂,可有效防止核酸的污染。
LAMP法具有的简便、快速、灵敏等特点,可以实现对中药材的快速鉴定检测,在中药鉴定中有着广阔的应用前景。更为重要的是,LAMP技术对仪器设备的要求低、操作简单、成本低廉,非常适合在生产实践中推广使用。不仅实现对中药材进行快速并高通量的分子鉴定,而且更容易开发成检测现场的应用产品。随着LAMP技术的不断完善和改进,其将在中药材的快速分子鉴定中发挥更大的作用。
| [1] | 中国药典[S].一部. 2010. |
| [2] | 赵新, 侯晓红. 核酸恒温扩增检测技术发展态势分析[J]. 基因组学与应用生物学 , 2016, 35 (3) :656–663. |
| [3] | 马丽敏. 核酸等温扩增技术研究进展[J]. 浙江预防医学 , 2013, 25 (1) :24–27. |
| [4] | Tillmann R L, Simon A, Müller A, et al. Comparison of in-house PCR, rapid ELISA and NASBA technology for the detection of respiratory syncytial virus in clinical specimen[J]. J Clin Virol , 2008, 41 (2) :168–169. DOI:10.1016/j.jcv.2007.10.005 |
| [5] | Ge Y, Cui L, Qi X, et al. Detection of novel swine origin influenza a virus (H1N1) by real-time nucleic acid sequence-based amplification[J]. J Virol Methods , 2010, 163 (2) :495–497. DOI:10.1016/j.jviromet.2009.10.025 |
| [6] | Gusev Y, Sparkowski J, Raghunathan A, et al. Rolling circle amplification:A new approach to increase sensitivity for immunohistochemistry and flow cytometry[J]. Am J Pathol , 2001, 159 (1) :63–69. DOI:10.1016/S0002-9440(10)61674-4 |
| [7] | 张俊, 曾照芳. 滚环扩增技术的原理及其应用的研究[J]. 生物信息学 , 2012, 10 (1) :12–14. |
| [8] | Kurn N, Chen P, Heath J D, et al. Novel isothermal, linear nucleic acid amplication systems for highly multiplexed applications[J]. Clin Chem , 2005, 51 (10) :1973–1981. DOI:10.1373/clinchem.2005.053694 |
| [9] | Vincent M, Xu Y, Kong H. Helicase-dependent isothermal DNA amplification[J]. EMBO Rep , 2004, 5 (8) :795–800. DOI:10.1038/sj.embor.7400200 |
| [10] | Shi C, Liu Q, Ma C, et al. Exponential strand-displacement amplification for detection of microRNAs[J]. Anal Chem , 2014, 86 (1) :336–339. DOI:10.1021/ac4038043 |
| [11] | 彭涛. 核酸等温扩增技术及其应用[M]. 北京: 科学出版社, 2009 . |
| [12] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucl Acids Res , 2000 . DOI:10.1093/nar/28.12.e63 |
| [13] | 谌秋华, 杜朝阳. 环介导等温扩增技术的研究进展[J]. 南昌大学学报:医学版 , 2013, 53 (1) :93–95. |
| [14] | Sasaki Y, Komatsu K, Nagumo S. Rapid detection of Panax ginseng by loop-mediated isothermal amplification and its application to authentication of Ginseng[J]. Biol Pharm Bull , 2008, 31 (9) :1806–1808. DOI:10.1248/bpb.31.1806 |
| [15] | Sasaki Y, Nagumo S. Rapid Identification of Curcuma longa and C. aromatica by LAMP[J]. Biol Pharm Bull , 2007, 30 (11) :2229–2230. DOI:10.1248/bpb.30.2229 |
| [16] | Sasaki Y, Fujimoto T, Aragane M, et al. Rapid and sensitive detection of Lophophora williamsii by loop-mediated isothermal amplification[J]. Biol Pharm Bull , 2009, 32 (5) :887–891. DOI:10.1248/bpb.32.887 |
| [17] | 呙军.环介导等温扩增对何首乌及其混伪品的快速鉴定[D].广州:华南理工大学, 2009. |
| [18] | Chaudhary A A, Mohsin M, Ahmad A. Application of loop-mediated isothermal amplification (LAMP)-based technology for authentication of Catharanthus roseus (L.) G. Don[J]. Protoplasma , 2012, 249 (2) :417–422. DOI:10.1007/s00709-011-0293-2 |
| [19] | 李奎, 李琦, 袁媛, 等. 环介导等温扩增法鉴定检测冬虫夏草[J]. 中草药 , 2011, 42 (8) :1605–1608. |
| [20] | 江荧真.台湾蒲公英及其误用品之分子鉴定研究[D].台中:中国医药大学, 2011. |
| [21] | 蒋超.中药现场快速鉴别方法的建立--以金银花为例[D].北京:中国中医科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-84502-1013311100.htm |
| [22] | 余淑琳, 蒋超, 黄璐琦, 等. 基于环介导等温扩增技术快速鉴别钩吻[J]. 中药材 , 2014, 37 (4) :594–596. |
| [23] | 赵源, 宋云, 李明福, 等. 基于LAMP的人参物种鉴定技术的研究[J]. 植物检疫 , 2015, 29 (5) :30–34. |
 2016, Vol. 47
2016, Vol. 47

