2. 华侨大学生物医学学院, 福建 泉州 362000 ;
3. 中国人民解放军第二军医大学药学院, 上海 200433
2. School of Biomedical Sciences, Huaqiao University, Quanzhou 362000, China ;
3. School of Pharmacy, Second Military Medical University, Shanghai 200433, China
生物碱是植物在长期进化过程中与环境相互作用形成的次生代谢产物类型之一,其对于植物适应生态环境、抵御病虫害、耐盐抗损伤等方面发挥着重要作用。许多生物碱具有特殊的生物活性,是药用植物的重要活性部分。药用植物是传统中药的主要来源,其次生代谢产物是新药、先导化合物、新化学实体的重要来源[1-2]。然而,来源于药用植物的次生代谢产物的量往往很低,且天然药用资源有限,严重影响药用植物的开发利用。生物碱代谢工程存在的主要问题是缺乏对大多数生物碱代谢途径及其调控机制的深入研究,本文就药用植物生物碱在次生代谢工程领域内的代表性成果进行回顾,探讨生物碱代谢工程的研究方法与策略。
1 生物碱的合成途径生物碱是一大类含氮有机化合物,根据含氮结构特征的不同可分为吲哚生物碱如长春碱、喜树碱;苄基异喹啉生物碱如小檗碱、吗啡;莨菪烷类生物碱如莨菪碱、东莨菪碱;嘌呤生物碱如茶碱、咖啡因;其他如紫杉醇、乌头碱等[3]。不同类型的生物碱都有其特定的生物合成途径,如吲哚生物碱由莽草酸途径合成色氨酸转化而得,苄基异喹啉类生物碱由酪氨酸经多步酶促反应形成,烟碱和茛菪碱等的生物合成则是起始于鸟氨酸或精氨酸的脱羧反应(表 1)。从生物合成的起源来看,生物碱可分为异戊二烯类(萜类和甾体来源)与非异戊二烯类(氨基酸来源)[4]。至今,在阐明生物碱生物合成途径上还有许多环节有待进一步深入探索,但其中萜类吲哚生物碱因为几十年来备受广泛关注的长春花而得到较为深入地研究,本文将以萜类生物碱为主体,结合各常见来源的生物碱来对其合成途径进行阐述。
|
|
表 1 部分生物碱类型及其代表性药用植物 Table 1 Some types of alkaloids and representative medicinal plants |
植物萜类生物碱的合成途径主要分为萜类部分的合成和含氮部分的合成,萜类部分合成主要有发生于细胞质中的甲羟戊酸(MVA)途径和发生于质体中的2-C-甲基-D-赤藓糖醇-4-磷酸(MEP)途径[5],二者均通过生成异戊烯基焦磷酸(IPP)及其异构体二甲基烯丙基焦磷酸(DMAPP)进入后续反应。MVA和MEP途径上的大部分基因在植物上已经得到克隆并有不少相关基因功能研究成果,如长春花中萜类吲哚生物碱的合成途径已报道过脱氧木酮糖-5-磷酸合成酶(DXS)、脱氧木酮糖-5-磷酸还原酶(DXR)等基因的克隆及其功能研究[6]。存在于植物细胞质中的MVA途径迄今为止已有50多年历史,该途径由三羧酸循环产生的乙酰-CoA经由乙酰乙酰辅酶酰基转移酶(AACT)、3-羟基-3-甲基戊二酰辅酶A合成酶(HMGS)、3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)、甲羟戊酸激酶(MK)、甲羟戊酸磷酸激酶(MPK)、甲羟戊酸5-磷酸脱羧酶(MDC)等的催化生成IPP;MEP途径则由丙酮酸和3-磷酸甘油醛在DXS、DXR作用下合成MEP,再经由4-(5′-二磷酸胞苷)-2-甲基-D-赤藓醇激酶(CMK)、2-甲基-D-赤藓醇-2, 4-环二磷酸合成酶(MECS)、异戊烯基单磷酸激酶(IPK)等催化生成IPP。2条途径产生的IPP可在IPP异构酶催化下生成其同分异构体DMAPP。IPP与DMAPP通过头尾缩合的方式在二磷酸香叶醇酯(GPP)合成酶的作用下生成十碳化合物GPP,GPP可在单萜还原酶作用下形成单萜及其衍生物;GPP与IPP再缩合可生成十五碳化合物二磷酸金合欢酯(FPP),其可在倍半萜还原酶作用下生成倍半萜及其衍生物;同样FPP可再与IPP缩合生成二磷酸香叶酰香叶醇酯(GGPP),而后可在二萜环化酶的作用下生成二萜及其衍生物,以此类推,可形成三萜、四萜、多萜及其衍生物[7-10]。萜类生物碱含氮部分多数为吲哚结构,故吲哚生物碱大部分属于萜类吲哚生物碱,其由萜类合成途径和吲哚合成途径结合而成(图 1)。
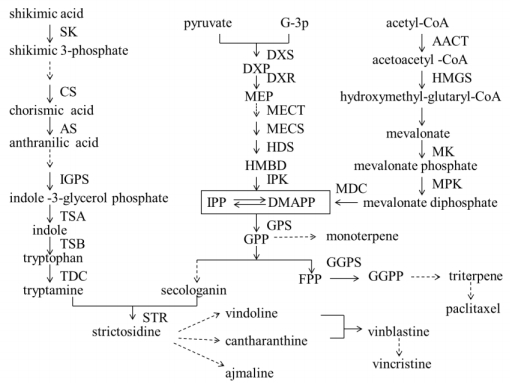
|
SK-莽草酸激酶CS-分支酸合酶AS-邻氨基苯甲酸合成酶IGPS-吲哚-3-磷酸糖苷合成酶TSA-色氨酸合成酶α TSB-色氨酸合成酶β TDC-色氨酸脱羧酶STR-异胡豆苷合酶DXS-脱氧木酮糖-5-磷酸合成酶DXR-脱氧木酮糖-5-磷酸还原酶MECT-2-甲基-D-赤藓醇-2, 4-环二磷酸转移酶MECS-2-甲基-D-赤藓醇-2, 4-环二磷酸合成酶HDS-羟化甲基丁烯基-4-二磷酸合成酶IPK-异戊烯基单磷酸激酶GPS-二磷酸香叶醇酯合成酶GGPS-甘油磷酸香叶醇酯合成酶AACT-乙酰乙酰辅酶酰基转移酶HMGS-3-羟基-3-甲基戊二酰辅酶A合成酶MK-甲羟戊酸激酶MPK-甲羟戊酸磷酸激酶MDC-甲羟戊酸5-磷酸脱羧酶 SK-shikimate kinase CS-chorismate synthase AS-anthranilate synthase IGPS-indole-3-glycerol phosphate synthase TSA-tryptophan synthase alpha TSB-tryptophan synthase beta TDC-tryptophan decarboxylase STR-strictosidine synthase DXS-deoxy-D-xylulose-5-phosphate synthase DXR-deoxy-D-xylulose 5-phosphate reductoisomerase MECT-2C-methyl-D-erythritol 2, 4-cyclodiphosphate transferase MECS-2C-methyl-D-erythritol 2, 4-cyclodiphosphate synthase HDS-hydroxymethylbutenyl-4-diphosphate synthase IPK-isopentenyl pyrophosphate kinase GPS-glycerol phosphate synthase GPPS-glycerol diphosphate synthase AACT-acetoacetyl coenzyme A thiolase HMGS-hydroxymethyl-glutaryl-CoA synthase MK-mevalonate kinase MPK-mevalonate phosphate kinase MDC-mevalonate diphosphate decarboxylase 图 1 萜类吲哚生物碱代谢途径(虚线表示多个反应步骤) Fig.1 Metabolic pathway of terpenoid indole alkaloids (dotted lines indicate a number of reaction steps) |
1.1 吲哚生物碱(indole alkaloids,IAs)
IAs是植物生物碱中数量最庞大的,有2 000多种该类化合物被广泛应用,其中包括用于抗肿瘤的长春碱、喜树碱及用于抗心脏功能失调的阿玛灵等,最有代表性的植物来源为长春花与萝芙木[3]。IAs以萜类吲哚生物碱居多,其含氮部分多数来源于莽草酸途径产生的色氨酸[11],图 1中显示莽草酸在莽草酸激酶(SK)、分支酸合酶(CS)、邻氨基苯甲酸合酶(AS)的作用下生成邻氨基苯甲酸,再由吲哚-3-磷酸糖苷合成酶(IGPS)、色氨酸合成酶(TSA/TSB)催化生成色氨酸,最后经色氨酸脱羧酶(TDC)作用生成色胺,色胺是吲哚生物碱的重要前体物质之一,可与开联番木鳖苷在异胡豆苷合酶(STR)的催化下生成异胡豆苷,此后再经各不同分支上的催化酶作用后生成多种生物碱如利血平、文多灵、喜树碱、长春碱等[7]。
1.2 苄基异喹啉生物碱(benzyl isoquinoline alkaloids, BIAs)BIAs起源于酪氨酸[3]。麻醉镇痛药吗啡、止咳药可待因、肌肉松弛药罂粟碱和抗微生物药小檗碱均属于苄基异喹啉生物碱[3]。BIAs的生物合成从2种酪氨酸衍生物的缩合开始[12],而后在酪氨酸脱羧酶(TYDC)作用下生成多巴胺,多巴胺是多数异喹啉生物碱的前体,其在去甲乌药碱合成酶(norcoclaurine synthase NCS)催化下生成(S)-去甲乌药碱[(S)-norcoclaurine],再经6-O-甲基转移酶(6OMT)作用生成反式乌药碱[(S)-coclaurine],而后经4′-O-甲基转移酶(4′OMT)等酶的催化生成反式心果碱,反式心果碱是大部分生物碱的中间及普遍的前体物质,随后在各种不同酶如桥小檗碱酶(BBE)、可待因酮还原酶(COR)等催化下沿着不同途径可生成血根碱、可卡因和吗啡等苄基异喹啉生物碱(图 2)。
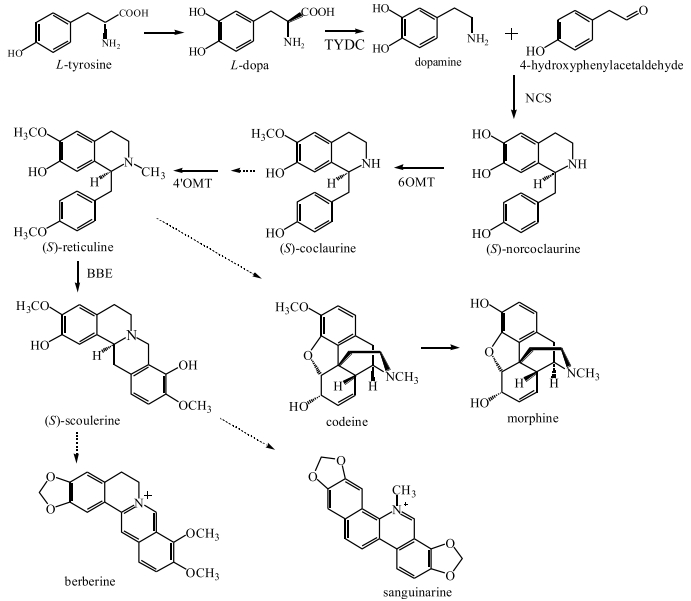
|
TYDC-酪氨酸脱羧酶NCS-去甲乌药碱合成酶6OMT-6-O-甲基转移酶4′OMT-4′-O-甲基转移酶BBE-桥小檗碱酶 TYDC-tyrosine decarboxylase NCS-norcoclaurine synthase 6OMT-6-O-methyltransferase 4′OMT-4′-O-methyltransferase BBE-bridge berberine enzyme 图 2 苄基异喹啉生物碱代谢途径(虚线表示多个反应步骤) Fig.2 Metabolic pathway of benzyl isoquinoline alkaloids (dotted lines indicate a number of reaction steps) |
1.3 莨菪烷类生物碱(tropane alkaloids,TAs)
TAs典型的代表成分有山莨菪碱、樟柳碱、莨菪碱和东莨菪碱等,都是重要的抗胆碱能神经药物。该类生物碱起源于鸟氨酸、精氨酸[3, 13],二者在脱羧酶(OrnDC、ArgDC)的作用下均生成1, 4-丁二胺(腐胺),再经腐胺甲基转移酶(PMT)的催化生成N-甲基-1, 4-丁二胺,而后被甲基腐胺氧化酶(MPO)氧化成4-甲基氨基正丁醛,后者可自发环化生成N-甲基-Δ1吡咯啉正离子,此后,代谢途径分为2支,其一是与烟酸结合后生成尼古丁,其二是经过一系列未知酶促反应生成TAs途径特有的前体托品酮[14],而后在托品酮还原酶Ⅰ(TR-Ⅰ)、托品酮还原酶Ⅱ(TR-Ⅱ)、细胞色素氧化酶P80F1(Cyp80F1)、莨菪碱6-β-羟化酶(H6H)等酶催化下生成山莨菪碱、东莨菪碱等TAs(图 3)。
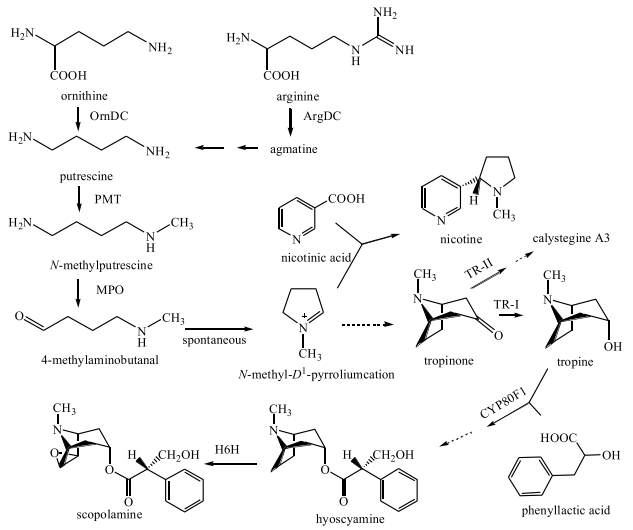
|
OrnDC-鸟氨酸脱羧酶ArgDC-精氨酸脱羧酶PMT-腐胺甲基转移酶MPO-甲基腐胺氧化酶TR-Ⅰ-托品酮还原酶Ⅰ TR-Ⅱ-托品酮还原酶Ⅱ H6H-莨菪碱6-β羟化酶CYP80F1-细胞色素氧化酶P80F1 OrnDC-ornithine decarboxylase ArgDC-arginine decarboxylase PMT-putrescine methyltransferase MPO-methylputrecine oxidase TR-Ⅰ-tropinone reductase Ⅰ TR-Ⅱ-tropinone reductase Ⅱ H6H-hyoscyamine 6-β-hydroxylase CYP80F1-cytochrome P80F1 图 3 莨菪烷类生物碱代谢途径(虚线表示多个反应步骤) Fig.3 Metabolic pathway of tropane alkaloids (dotted lines indicate a number of reaction steps) |
2 生物碱的代谢工程 2.1 IAs
IAs代谢工程的热点是抗肿瘤药物--长春碱的代谢工程。长春花中长春碱和长春新碱(vincristine)的生物合成途径见图 1。DXR是萜类吲哚生物碱(TIAs)生物合成重要的调节基因,长春花中DXR的表达量与单萜吲哚生物碱(MIAs)的积累呈现显著的正相关[6, 15]。在长春花中过量表达ORCA3和G10H可提高生物碱的合成[16]。外源激素和内源激素的诱导均能增加长春花中生物碱的产量[17-18]。转录因子与激素的共同协作有利于生物碱的合成,且呈现量相关性。茉莉酸甲酯敏感的转录因子表达量与激素诱导剂量相关,Goklany等[19]使用不同剂量激素诱导长春花发根,研究其ORCA、ZCT等转录因子和TIAs代谢途径基因(G10H、TDC、STR、SGD)与TIAs代谢产物[开联番木鳖苷(secologanin)、异胡豆苷(strictosidine)和水甘草碱(tabersonine)]之间的相关性,结果显示激素诱导量在250 mmol/L时,代谢产物增加150%~370%,同时,转录活化因子ORCA的表达增加29~40倍,关键基因表达增加8~15倍,而转录阻遏蛋白ZCT则处于低水平,结果表明长春花TIAs的产量与这两组转录因子家族有关系。此外,非生物诱导因素亦可增加药用植物内生物碱的产量,经紫外UV-B照射的长春花悬浮细胞中长春碱和文多灵分别增加了3倍和12倍[20]。喜树碱是药用植物喜树中重要的TIAs,萜类代谢途径的多个关键酶基因如DXS、DXR、STR、G10H等已从喜树中克隆获得[21],但由于喜树碱的多植物来源等原因而鲜见酶基因表达与喜树碱量的相关性报道(表 1)。近年来,有不少学者开始研究喜树中内生真菌与喜树碱量累积的关系,Pu等[22]从喜树中分离得到的多粘类芽孢杆菌Paenibacillus polymyxa LY214,在优化发酵条件下能使喜树碱产量显著增加,然而内生真菌对于提高喜树中生物碱生物合成的作用尚未见报道。
2.2 异喹啉生物碱(isoquinoline alkaloids)吗啡和小檗碱的代谢工程是异喹啉生物碱代谢工程的经典代表。吗啡生物碱的合成途径见图 2,用发根土壤杆菌诱导产生罂粟毛状根中可待因的量是非转化根的3倍[23]。在罂粟植株中过量表达可待因酮还原酶基因(COR)可使其蒴果中生物碱的量显著提高,其中吗啡生物碱的量比高产植株和非转基因植株高出15%~30%[24]。在罂粟发根培养中过量表达COR同样可使转基因发根比非转基因发根的基因表达水平高10倍,比野生型根高24倍,同时可待因产量达0.04%,吗啡产量达0.28%[25]。另外,在悬浮培养的加州罂粟细胞中过表达6OMT可使转基因型细胞的生物碱平均量比野生型多7.5倍[26]。在日本黄连中过表达4′OMT基因,转基因日本黄连叶和根中小檗碱量分别提高2.7倍和2.0倍,且量可维持稳定达20个月以上;持续表达4′OMT达20个月后,转基因日本黄连茎及根茎中小檗碱量增加1.6倍[27]。
2.3 TAsPMT被认为是TAs合成途径的第一个限速酶,TR-Ⅰ是该类生物碱合成途径上重要的分支酶,在三分三中同时表达PMT和TR-Ⅰ可使其中莨菪烷类生物碱包括莨菪碱、山莨菪碱、东莨菪碱和樟柳碱等的量明显高于对照组[28]。此外,通过诱导剂的诱导能影响植物中基因的表达水平及其重要有效成分的量,Kai等[29]以乙醇、茉莉酸甲酯和Ag+对三分三进行发根诱导,24 h后可提高其TAs的量,而经过水杨酸处理的发根中相关生物碱的量却降低,同时,经过乙醇诱导后AaH6H表达上调,而AaTR Ⅱ变化不明显,Ag+诱导可提高AaPMT1表达水平,茉莉酸甲酯诱导使AaTR Ⅰ表达上调。H6H是催化莨菪碱转化成更有药用价值TAs东莨菪碱的重要酶,在烟草Nicotiana tabacum L.和天仙子中喂饲外源莨菪碱可使含有CaMV 35S启动子的烟草更易于吸收外源莨菪碱,并使东莨菪碱及其他TAs和烟碱的量提高[30]。在天仙子发根中同时过量表达上游基因PMT和下游基因H6H可显著提高发根中东莨菪碱量,比野生型高9倍,比单基因过表达提高2倍[13]。类似报道见于颠茄[31]和曼陀罗[32]。
2.4 其他生物碱紫杉醇是具有重要药用价值的萜类生物碱,代谢工程策略是可能解决紫杉醇药源缺乏的理想途径[15]。李干雄等[33]研究在中国红豆杉悬浮培养细胞中添加诱导促进剂对细胞生长和紫杉醇(taxol)积累的影响,结果显示硝酸银、蔗糖、柠檬酸三铵的有效组合可使紫杉醇产量达到最高(39.2 mg/L),相对于最差组合提高了18.7倍。此外,在红豆杉悬浮培养细胞中过量表达10-脱乙酰巴卡丁-10-β-O-乙酰转移酶基因(DBAT)可使转基因细胞中紫杉醇产量比非转基因细胞高1.7倍[34]。
雷公藤是具有抗炎、抗免疫作用的另一重要药用植物,李琰等[35]以雷公藤不定根为材料,通过在培养基中添加不同种类的真菌诱导子和硝酸银等非生物诱导子,研究其对雷公藤不定根生长和次生代谢产物量的影响,结果显示,苹果炭疽和茉莉酸甲酯的协同作用能促进雷公藤生物碱的合成。
3 生物碱代谢工程的调控策略植物次生代谢工程主要是针对提高其重要次生代谢物或前体物质的量,通过基因工程的手段改变代谢流,或者扩展甚至构建新的代谢途径,以期在较广范围内改善细胞性能,满足人们对植物体的特定需求。在植物体内,各种影响目标产物合成与分解的因素包括遗传因素及环境因子都可能影响代谢流中化合物的积累。其中,遗传因素是控制代谢途径的先决条件,所以,通过基因工程技术改变植物体内的合成途径成为代谢工程最有效的手段。对次生代谢途径的调控主要有以下几种策略:(1)提高限速酶的表达水平或酶活性(含外源诱导子作用);(2)调节调控因子的表达;(3)促进代谢产物的跨膜转运;(4)通过抑制代谢竞争路径或削弱代谢产物的反馈抑制来促进目标产物的积累[36]。根据调控对象的不同从4个方面进行阐述。
3.1 代谢途径的酶基因针对酶基因常用的基因工程手段有基因过表达、基因共表达、RNAi(含VIGS)等。在生物碱的代谢调控中,过量表达一个或多个编码关键酶基因能够调控代谢途径,从而增加目的产物的积累[37],且有研究表明同时过表达转录因子和酶基因亦能显著提高目标产物的产生[16]。龙世平等[31]在颠茄发根中同时过表达PMT和H6H,4个转基因发根系(PH2、PH32、PH14和PH20)东莨菪碱的量都有提高,其中PH2东莨菪碱量比对照提高了8.2倍。Zhang等[38]用农杆菌介导转化的方法在红豆杉悬浮培养细胞中过量表达10-脱乙酰巴卡丁Ⅲ-10-β-O-乙酰转移酶(10-deacetylbaccatin Ⅲ-10-β-O-acetyltransferase),结果显示紫杉醇量比非转基因细胞多1.7倍。RNAi技术是植物基因功能研究中诱导基因沉默[39]的常用技术,是生物碱代谢途径调控的另一常用手段[40],近年来还用于抑制寄生植物生长保护宿主植物[41]。病毒介导的基因沉默(VIGS)是研究基因功能以及植物抗病性的重要工具,也是一种研究基因瞬时表达的新方法[42-43],曾成功运用于长春花[44]和萝芙木[45]等植物中基因功能的研究,然而在提高药用植物生物碱量方面却鲜有报道。
3.2 转录因子次生代谢产物合成代谢流通常有多个限速酶,且限速步骤较难确定,所以通过调节转录因子的表达量,从整体角度调控代谢途径以获得高产量目标产物具有可观前景[46-47]。许多研究证实WRKY在拟南芥中参与抗病调控,并与长春花中TIAs代谢途径的调控有关,过量表达CrWRKY1使serpentine的量提高2.5倍[48],在罂粟中过表达AtWRKY1同样可使二甲基吗啡(thebaine)量提高5倍;在长春花中瞬时过表达CrMPK3使serpentine量提高3.5倍,使文多灵(vindoline)量提高2.5倍[49];在烟草或长春花中过表达MYC2转录因子对于基因表达及产物量的提高有轻微效果[50];同时过表达ORCA3与非ORCA3控制的基因G10H对于提高长春碱和长春新碱也有轻微效果[51];在非产生物碱植物中异位表达AP2/ERF和MYB也能使其生物碱量增加[52]。近年来,腺毛发育成为研究热点,上调黄花蒿Artemisia annua Linn.中腺毛发育相关转录因子TAR1表达水平可提高青蒿素的量[53],调控烟草腺毛发育相关转录因子可影响腺毛中烟碱的量[54],因此,调控影响腺毛发育的相关因子对于有效成分主要储存于腺毛的药用植物具有重大意义。
3.3 转运蛋白次生代谢产物通常从源细胞运输到周边细胞,甚至运输到其他组织或器官中[55],几乎所有的生物碱最终都要储存在液泡中,在这个过程中,细胞膜或液泡膜上的转运蛋白起到了很大作用[56]。转运蛋白介导的次生代谢物的跨膜转运主要有2个蛋白家族:腺苷三磷酸结合盒(ATP-binding cassette,ABC)转运蛋白所介导的转运和依赖Na+/H+浓度梯度的逆向转运。Yazaki课题组在对日本黄连中黄连素的跨膜转运方面开展的较深入研究中阐明了黄连素在细胞中的跨膜转运除了有ABC转运蛋白参与外,液泡中黄连素的积累大部分取决于具有质子浓度梯度依赖的特殊黄连素/H+逆向转运体[56-58]。亦有研究表明长春花中TIAs的积累和转运有赖于能量依赖型转运蛋白[59-60]和质子逆向运转蛋白[61]。此外,常见的硝酸盐转运蛋白(NRT)、铵盐转运蛋白(AMT)、K+转运蛋白(HAK)、多药与有毒化合物排出蛋白(MATE)[62]等参与生物碱的转运尚未见相关研究,但其间仍可能存在一定联系,尤其是MATE对于有毒生物碱的次生代谢工程很可能是一个重要的限制因素[63-64]。
3.4 激素植物激素是植物自身合成的具有复杂生理效应的痕量生长调节分子的总称[65]。目前,除经典的生长素(auxin)、细胞分裂素(cytokinin)、赤霉素(GA)、脱落酸(ABA)和乙烯(ethylene)五大植物激素外[66],近年来被鉴定的油菜素内酯(BR)、茉莉酸(JA)、茉莉酸甲酯(MeJA)和水杨酸(SA)越来越多地被作为激素诱导子应用。Kochar等[67]以乙醇、MeJA、Ag+、SA作为诱导子对三分三发根进行诱导,对其产生的托品生物碱的定量测定结果显示,前三者均能提高托品生物碱的量,而SA却下调托品生物碱的产量。JA是迄今为止较为明确的能够提高生物碱量的激素诱导子[68-69],尤其是在长春花TIAs的生物合成途径上[70]。激素在调控有效成分量的研究方面发现其与激素的用量及诱导时间有关,Lee-Parsons等[71]用MeJA对长春花悬浮细胞进行诱导培养,发现MeJA使用量达100 mmol/L诱导6 d后,长春花中阿玛灵的量达最高,是未诱导组的3倍。作为包合材料的β-环糊精具有类似酶的催化活性,是一种诱导强化剂,有研究显示β-环糊精与植物激素可协同提高代谢产物的积累[72-73]。Zhou等[73]在长春花悬浮细胞培养的生物反应器中同时加入β-环糊精与MeJA,发现其可使文多灵、长春碱等生物碱量比对照组高,且当β-环糊精浓度为10 mmol/L和MeJA浓度为150 µmol/L时达最高值。
4 结语与展望药用植物生物碱化学成分类型虽多,但其代谢途径多有交叉,尤其是萜类生物碱的代谢途径对于其他类型生物碱均有一定参考意义;在代谢调控方面,各种调控手段可联合使用,诱导强化剂亦是值得研究的另一领域。此外,在药用植物次生代谢方面,Ming等[74]和Li等[75]利用内生真菌作为诱导子促进丹参Salvia miltiorrhiza Bge.毛状根生长并使其丹参酮和丹酚酸量显著提高的案例可借鉴用于含生物碱药用植物的次生代谢工程。
功能基因是植物基因组学研究中最活跃的一部分,也是进行药用植物次生代谢工程研究的基础。在药用植物功能基因研究中,与活性成分形成关系最密切的生物合成相关基因克隆研究是该领域研究热点。在这方面,笔者所在课题组熟练地将各种分子生物技术应用于模式植物水稻Oryza sativa L.[76],且先后在丹参[77]、菘蓝Isatis indigotica Fort.[78]、灯盏花Erigeron breviscapus (Vant.) Hand. -Mazz.)[79]等药用植物中开展并取得一定成绩,有效促进药用植物开发。
生物碱是药用植物中具有多种生物活性的一类化学成分,在人类抗病历史上发挥着重要作用,尤其是珍稀药用植物中的生物碱,应用基因工程手段提高药用植物中生物碱的量具有重要价值。然而,目前国内药用植物生物碱的研究还是集中于化学成分研究,生物碱类化合物代谢合成途径及其相关基因的研究虽已取得了一定的成果,但化学与分子生物学相结合用于药用植物研究尚处于起步阶段,二者的结合将有利于了解药用植物有效成分的累积并对其进行调控。在提高生物碱产量方面,虽然通过发酵或者半合成手段均具有巨大潜力,但限于成本及环境污染等问题,从药用植物中提取生物碱仍然是当前获取生物碱的主要来源。因此,利用代谢工程调控药效物质生物合成代谢流,即在解析生物碱类化合物代谢途径的基础上,运用各种代谢调控手段干扰代谢流,从而提高目标产物的产量具有重大意义。近年来,由于人们对天然药物的需求不断增加,从天然药物中获取有价值次生代谢产物日益受到重视。随着分子生物学的发展,深入开展次生代谢产物合成途径的研究将有利于推动次生代谢工程发展,从而为培育药用植物优良品系做好铺垫,为满足市场需求化种植和质量控制提供技术支撑,将有力推动中药材品质研究。
| [1] | 王勇波, 刘忠, 赵爱华, 等. 功能基因组学方法在药用植物次生代谢物研究中的应用[J]. 中国中药杂志 , 2009, 34 (1) :6–10. |
| [2] | Butler M S. The role of natural product chemistry in drug discovery[J]. J Nat Prod , 2004, 67 (12) :2141–2153. DOI:10.1021/np040106y |
| [3] | Ziegler J, Facchini P J. Alkaloid biosynthesis:metabolism and trafficking[J]. Annu Rev Plant Biol , 2008, 59 :735–769. DOI:10.1146/annurev.arplant.59.032607.092730 |
| [4] | Aniszewski T. Alkaloids-Secrets of Life[M]. Amsterdam: Elsevier, 2007 . |
| [5] | Miettinen K, Dong L, Navrot N, et al. The seco-iridoid pathway from Catharanthus roseus[J]. Nat Commun , 2014 . DOI:10.1038/ncomms4606 |
| [6] | Veau B, Courtois M, Oudin A, et al. Cloning and expression of cDNAs encoding two enzymes of the MEP pathway in Catharanthus roseus[J]. Biochim Biophys Acta , 2000, 1517 (1) :159–163. DOI:10.1016/S0167-4781(00)00240-2 |
| [7] | 邢世海, 王荃, 潘琪芳, 等. 长春花萜类吲哚生物碱的生物合成途径[J]. 西北植物学报 , 2012, 32 (9) :1917–1927. |
| [8] | Lange B M, Ghassemian M. Genome organization in Arabidopsis thaliana:a survey for genes involved in isoprenoid and chlorophyll metabolism[J]. Plant Mol Biol , 2003, 51 (6) :925–948. DOI:10.1023/A:1023005504702 |
| [9] | Salim V, Luca V D. Towards complete elucidation of monoterpene indole alkaloid biosynthesis pathway:Catharanthus roseus as a pioneer system[J]. Adv Bot Res , 2013, 68 :1–37. DOI:10.1016/B978-0-12-408061-4.00001-8 |
| [10] | Rohdich F, Kis K, Bacher A, et al. The non-mevalonate pathway of isoprenoids:genes, enzymes and intermediates[J]. Curr Opin Chem Biol , 2001, 5 (5) :535–540. DOI:10.1016/S1367-5931(00)00240-4 |
| [11] | Herrmann K M. The shikimate pathway:early steps in the biosynthesis of aromatic compounds[J]. Plant Cell , 1995, 7 (7) :907–919. DOI:10.1105/tpc.7.7.907 |
| [12] | 程巧, 曾建国, 乐捷. 异喹啉类生物碱生物合成、运输、储藏相关细胞生物学研究进展[J]. 植物学报 , 2014, 49 (6) :720–728. |
| [13] | Zhang L, Ding R, Chai Y, et al. Engineering tropane biosynthetic pathway in Hyoscyamus niger hairy root cultures[J]. Proc Natl Acad Sci USA , 2004, 101 (17) :6786–6791. DOI:10.1073/pnas.0401391101 |
| [14] | 卢衍, 王细荣, 陈敏, 等. 托品烷类生物碱生物合成分子生物学与代谢工程[J]. 中草药 , 2012, 43 (5) :1018–1023. |
| [15] | 刘万宏, 姚波, 祝顺琴, 等. 紫杉醇前体生物合成途径及生物技术研究进展[J]. 中草药 , 2009, 40 (8) :1327–1331. |
| [16] | Pan Q, Wang Q, Yuan F, et al. Overexpression of ORCA3 and G10H in Catharanthus roseus plants regulated alkaloid biosynthesis and metabolism revealed by NMR-metabolomics.[J]. PLoS One , 2012 . DOI:10.1371/journal.pone.0043038 |
| [17] | Papon N, Bremer J, Vansiri A, et al. Cytokinin and ethylene control indole alkaloid production at the level of the MEP/terpenoid pathway in Catharanthus roseus suspension cells[J]. Planta Med , 2005, 71 (6) :572–574. DOI:10.1055/s-2005-864163 |
| [18] | Pasquali G, Goddijn O J, de Waal A, et al. Coordinated regulation of two indole alkaloid biosynthetic genes from Catharanthus roseus by auxin and elicitors[J]. Plant Mol Biol , 1992, 18 (6) :1121–1131. DOI:10.1007/BF00047715 |
| [19] | Goklany S, Rizvi N F, Loring R H, et al. Jasmonate-dependent alkaloid biosynthesis in Catharanthus roseus hairy root cultures is correlated with the relative expression of Orca and Zct transcription factors[J]. Biotechnol Prog , 2013, 29 (6) :1367–1376. DOI:10.1002/btpr.v29.6 |
| [20] | Ramani S, Jayabaskaran C. Enhanced catharanthine and vindoline production in suspension cultures of Catharanthus roseus by ultraviolet-B light[J]. J Mol Signal , 2008 . DOI:10.1186/1750-2187-3-9 |
| [21] | 沈少华, 刘姬艳, 胡江琴, 等. 喜树碱生物合成途径及其相关酶的研究进展[J]. 中草药 , 2011, 42 (9) :1862–1868. |
| [22] | Pu X, Chen F, Yang Y, et al. Isolation and characterization of Paenibacillus polymyxa LY214, a camptothecin-producing endophytic bacterium from Camptotheca acuminata[J]. J Ind Microbiol Biotechnol , 2015, 42 (8) :1197–1202. DOI:10.1007/s10295-015-1643-4 |
| [23] | Le Flem-Bonhomme V, Laurain-Mattar D, Fliniaux M A. Hairy root induction of Papaver somniferum var. album, a difficult-to-transform plant, by A rhizogenes LBA 9402[J]. Planta , 2004, 218 (5) :890–893. DOI:10.1007/s00425-003-1196-z |
| [24] | Larkin P J, Miller J A, Allen R S, et al. Increasing morphinan alkaloid production by over-expressing codeinone reductase in transgenic Papaver somniferum[J]. Plant Biotechnol J , 2007, 5 (1) :26–37. DOI:10.1111/pbi.2007.5.issue-1 |
| [25] | Sharafi A, Sohi H H, Mousavi A, et al. Metabolic engineering of morphinan alkaloids by over-expression of codeinone reductase in transgenic hairy roots of Papaver bracteatum, the Iranian poppy[J]. Biotechnol Lett , 2013, 35 (3) :445–453. DOI:10.1007/s10529-012-1080-7 |
| [26] | Inui T, Tamura K, Fujii N, et al. Overexpression of Coptis japonica norcoclaurine 6-O-methyltransferase overcomes the rate-limiting step in benzylisoquinoline alkaloid biosynthesis in cultured Eschscholzia californica[J]. Plant Cell Physiol , 2007, 48 (2) :252–262. |
| [27] | Inui T, Kawano N, Shitan N, et al. Improvement of benzylisoquinoline alkaloid productivity by overexpression of 3'-hydroxy-N-methylcoclaurine 4'-O-methyltransferase in transgenic Coptis japonica plants[J]. Biol Pharm Bull , 2012, 35 (5) :650–659. DOI:10.1248/bpb.35.650 |
| [28] | Kai G, Yang S, Luo X, et al. Co-expression of AaPMT and AaTRI effectively enhances the yields of tropane alkaloids in Anisodus acutangulus hairy roots[J]. BMC Biotechnol , 2011 . DOI:10.1186/1472-6750-11-43 |
| [29] | Kai G, Yang S, Zhang Y, et al. Effects of different elicitors on yield of tropane alkaloids in hairy roots of Anisodus acutangulus[J]. Mol Biol Rep , 2012, 39 (2) :1721–1729. DOI:10.1007/s11033-011-0912-1 |
| [30] | Hakkinen S T, Moyano E, Cusido R M, et al. Enhanced secretion of tropane alkaloids in Nicotiana tabacum hairy roots expressing heterologous hyoscyamine-6beta-hydroxylase[J]. J Exp Bot , 2005, 56 (420) :2611–2618. DOI:10.1093/jxb/eri253 |
| [31] | 龙世平, 卢衍, 王亚雄, 等. 过表达内源PMT和H6H基因对颠茄发根托品烷类生物碱合成的影响[J]. 药学学报 , 2013, 48 (2) :243–249. |
| [32] | 孙际薇, 张鸿, 王凤英, 等. 茉莉酸甲酯对曼陀罗毛状根中主要莨菪烷类生物碱成分积累和释放的影响[J]. 中国中药杂志 , 2013, 38 (11) :1712–1718. |
| [33] | 李干雄, 张京维, 骆雪兰, 等. 促进剂组合对中国红豆杉细胞悬浮培养紫杉醇合成的影响[J]. 中草药 , 2010, 41 (9) :1552–1555. |
| [34] | Hong S B, Peebles C A M, Shanks J V, et al. Expression of the Arabidopsis feedback-insensitive anthranilate synthase holoenzyme and tryptophan decarboxylase genes in Catharanthus roseus hairy roots[J]. J Biotechnol , 2006, 122 (1) :28–38. DOI:10.1016/j.jbiotec.2005.08.008 |
| [35] | 李琰, 赵磊, 崔蕾, 等. 诱导子对雷公藤不定根生长和次生代谢产物含量的影响[J]. 生物工程学报 , 2015, 31 (5) :734–743. |
| [36] | Oksman-Caldentey K M, Inze D. Plant cell factories in the post-genomic era:new ways to produce designer secondary metabolites[J]. Trends Plant Sci , 2004, 9 (9) :433–440. DOI:10.1016/j.tplants.2004.07.006 |
| [37] | Hughes E H, Hong S B, Gibson S I, et al. Metabolic engineering of the indole pathway in Catharanthus roseus hairy roots and increased accumulation of tryptamine and serpentine[J]. Metab Eng , 2004, 6 (4) :268–276. DOI:10.1016/j.ymben.2004.03.002 |
| [38] | Zhang P, Li S, Liu T, et al. Overexpression of a 10-deacetylbaccatin Ⅲ-10β-O-acetyltransferase gene leads to increased taxol yield in cells of Taxus chinensis[J]. Plant Cell Tissue Org Cult , 2011, 106 (1) :63–70. DOI:10.1007/s11240-010-9894-2 |
| [39] | Courdavault V, Thiersault M, Courtois M, et al. CaaX-prenyltransferases are essential for expression of genes involved in the early stages of monoterpenoid biosynthetic pathway in Catharanthus roseus cells[J]. Plant Mol Biol , 2005, 57 (6) :855–870. DOI:10.1007/s11103-005-3095-0 |
| [40] | Sinharoy S, Pislariu C I, Udvardi M K. A high-throughput RNA interference (RNAi)-based approach using hairy roots for the study of plant-rhizobia interactions[J]. Methods Mol Biol , 2015, 1287 :159–178. DOI:10.1007/978-1-4939-2453-0 |
| [41] | Mach J. No more free lunch:using RNA interference in the host to reduce growth of a parasitic plant[J]. Plant Cell , 2012, 24 (7) :2709. DOI:10.1105/tpc.112.240712 |
| [42] | Li C, Zhang Z C, Ghebremariam K M, et al. A novel method for the evaluation of virus-induced gene silencing efficiency[J]. Genet Mol Res , 2014, 13 (4) :9443–9452. DOI:10.4238/2014.November.11.9 |
| [43] | George G M, Ruckle M E, Lloyd J R. Virus-induced gene silencing as a scalable tool to study drought tolerance in plants[J]. Methods Mol Biol , 2015, 1287 :243–253. DOI:10.1007/978-1-4939-2453-0 |
| [44] | Liscombe D K, O'Connorb S E. A virus-induced gene silencing approach to understanding alkaloid metabolism in Catharanthus roseus[J]. Phytochemistry , 2011, 72 (16) :1969–1977. DOI:10.1016/j.phytochem.2011.07.001 |
| [45] | Ruppert M, Woll J, Giritch A, et al. Functional expression of an ajmaline pathway-specific esterase from Rauvolfia in a novel plant-virus expression system[J]. Planta , 2005, 222 (5) :888–898. DOI:10.1007/s00425-005-0031-0 |
| [46] | Broun P. Transcription factors as tools for metabolic engineering in plants[J]. Curr Opin Plant Biol , 2004, 7 (2) :202–209. DOI:10.1016/j.pbi.2004.01.013 |
| [47] | Yamada Y, Sato F. Transcription factors in alkaloid biosynthesis[J]. Int Rev Cell Mol Biol , 2013, 305 :339–382. DOI:10.1016/B978-0-12-407695-2.00008-1 |
| [48] | Suttipanta N, Pattanaik S, Kulshrestha M, et al. The transcription factor CrWRKY1 positively regulates the terpenoid indole alkaloid biosynthesis in Catharanthus roseus[J]. Plant Physiol , 2011, 157 (4) :2081–2093. DOI:10.1104/pp.111.181834 |
| [49] | Raina S K, Wankhede D P, Jaggi M, et al. CrMPK3, a mitogen activated protein kinase from Catharanthus roseus and its possible role in stress induced biosynthesis of monoterpenoid indole alkaloids[J]. BMC Plant Biol , 2012, 12 :134–146. DOI:10.1186/1471-2229-12-134 |
| [50] | Zhang H, Hedhili S, Montiel G, et al. The basic helix-loop-helix transcription factor CrMYC2 controls the jasmonate-responsive expression of the ORCA genes that regulate alkaloid biosynthesis in Catharanthus roseus[J]. Plant J , 2011, 67 (1) :61–71. DOI:10.1111/tpj.2011.67.issue-1 |
| [51] | Wang C T, Liu H, Gao X S, et al. Overexpression of G10H and ORCA3 in the hairy roots of Catharanthus roseus improves catharanthine production[J]. Plant Cell Rep , 2010, 29 (8) :887–894. DOI:10.1007/s00299-010-0874-0 |
| [52] | Apuya N R, Park J H, Zhang L, et al. Enhancement of alkaloid production in opium and California poppy by transactivation using heterologous regulatory factors[J]. Plant Biotechnol J , 2008, 6 (2) :160–175. DOI:10.1111/pbi.2008.6.issue-2 |
| [53] | Tan H, Xiao L, Gao S, et al. Trichome and artemisinin regulator 1 is required for trichome development and artemisinin biosynthesis in Artemisia annua[J]. Mol Plant , 2015, 8 :1396–1411. DOI:10.1016/j.molp.2015.04.002 |
| [54] | Szymanski D B, Lloyd A M, Marks M D. Progress in the molecular genetic analysis of trichome initiation and morphogenesis in Arabidopsis[J]. Trends Plant Sci , 2000, 5 (5) :214–219. DOI:10.1016/S1360-1385(00)01597-1 |
| [55] | Yazaki K. Transporters of secondary metabolites[J]. Curr Opin Plant Biol , 2005, 8 (3) :301–307. DOI:10.1016/j.pbi.2005.03.011 |
| [56] | Otani M, Shitan N, Sakai K, et al. Characterization of vacuolar transport of the endogenous alkaloid berberine in Coptis japonica[J]. Plant Physiol , 2005, 138 (4) :1939–1946. DOI:10.1104/pp.105.064352 |
| [57] | Sakai K, Shitan N, Sato F, et al. Characterization of berberine transport into Coptis japonica cells and the involvement of ABC protein[J]. J Exp Bot , 2002, 53 (376) :1879–1886. DOI:10.1093/jxb/erf052 |
| [58] | Shitan N, Bazin I, Dan K, et al. Involvement of CjMDR1, a plant multidrug-resistance-type ATP-binding cassette protein, in alkaloid transport in Coptis japonica[J]. Proc Natl Acad Sci USA , 2003, 100 (2) :751–756. DOI:10.1073/pnas.0134257100 |
| [59] | Mccaskill D G, Martin D L, Scott A I. Characterization of alkaloid uptake by Catharanthus roseus (L.) G. Don protoplasts[J]. Plant Physiol , 1988, 87 (2) :402–408. DOI:10.1104/pp.87.2.402 |
| [60] | Jin H, Liu D, Zuo K, et al. Molecular cloning and characterization of Crmdr1, a novel MDR-type ABC transporter gene from Catharanthus roseus[J]. DNA Seq , 2007, 18 (4) :316–325. DOI:10.1080/10425170701207018 |
| [61] | Deus-Neumann B, Zenk M H. Accumulation of alkaloids in plant vacuoles does not involve an ion-trap mechanism[J]. Planta , 1986, 167 (1) :44–53. DOI:10.1007/BF00446367 |
| [62] | Lee J H, Lee J E, Kim Y, et al. Multidrug and toxic compound extrusion protein-1(MATE1/SLC47A1) is a novel flavonoid transporter[J]. J Agric Food Chem , 2014, 62 (40) :9690–9698. DOI:10.1021/jf500916d |
| [63] | Shoji T. ATP-binding cassette and multidrug and toxic compound extrusion transporters in plants:a common theme among diverse detoxification mechanisms[J]. Int Rev Cell Mol Biol , 2014, 309 :303–346. DOI:10.1016/B978-0-12-800255-1.00006-5 |
| [64] | Shitan N, Minami S, Morita M, et al. Involvement of the leaf-specific multidrug and toxic compound extrusion (MATE) transporter Nt-JAT2 in vacuolar sequestration of nicotine in Nicotiana tabacum[J]. PLoS One , 2014 . DOI:10.1371/journal.pone.0108789 |
| [65] | Santner A, Calderon-Villalobos L I, Estelle M. Plant hormones are versatile chemical regulators of plant growth[J]. Nat Chem Biol , 2009, 5 (5) :301–307. DOI:10.1038/nchembio.165 |
| [66] | Gantait S, Sinniah U R, Ali M N, et al. Gibberellins-a multifaceted hormone in plant growth regulatory network[J]. Curr Protein Pept Sci , 2015, 16 (5) :406–412. DOI:10.2174/1389203716666150330125439 |
| [67] | Kochar M, Upadhyay A, Srivastava S. Indole-3-acetic acid biosynthesis in the biocontrol strain Pseudomonas fluorescens Psd and plant growth regulation by hormone overexpression[J]. Res Microbiol , 2011, 162 (4) :426–435. DOI:10.1016/j.resmic.2011.03.006 |
| [68] | Gantet P, Memelink J. Transcription factors:tools to engineer the production of pharmacologically active plant metabolites[J]. Trends Pharmacol Sci , 2002, 23 (12) :563–569. DOI:10.1016/S0165-6147(02)02098-9 |
| [69] | Peebles C A, Hughes E H, Shanks J V, et al. Transcriptional response of the terpenoid indole alkaloid pathway to the overexpression of ORCA3 along with jasmonic acid elicitation of Catharanthus roseus hairy roots over time[J]. Metab Eng , 2009, 11 (2) :76–86. DOI:10.1016/j.ymben.2008.09.002 |
| [70] | Goldhaber-Pasillas G D, Mustafa N R, Verpoorte R. Jasmonic acid effect on the fatty acid and terpenoid indole alkaloid accumulation in cell suspension cultures of Catharanthus roseus[J]. Molecules , 2014, 19 (7) :10242–10260. DOI:10.3390/molecules190710242 |
| [71] | Lee-Parsons C W, Erturk S, Tengtrakool J. Enhancement of ajmalicine production in Catharanthus roseus cell cultures with methyl jasmonate is dependent on timing and dosage of elicitation[J]. Biotechnol Lett , 2004, 26 (20) :1595–1599. DOI:10.1023/B:BILE.0000045825.37395.94 |
| [72] | Yang T, Fang L, Nopo-Olazabal C, et al. Enhanced production of resveratrol, piceatannol, arachidin-1, and arachidin-3 in hairy root cultures of peanut co-treated with methyl jasmonate and cyclodextrin[J]. J Agric Food Chem , 2015, 63 (15) :3942–3950. DOI:10.1021/jf5050266 |
| [73] | Zhou P, Yang J, Zhu J, et al. Effects of beta-cyclodextrin and methyl jasmonate on the production of vindoline, catharanthine, and ajmalicine in Catharanthus roseus cambial meristematic cell cultures[J]. Appl Microbiol Biotechnol , 2015, 99 (17) :7035–7045. DOI:10.1007/s00253-015-6651-9 |
| [74] | Ming Q L, Su C Y, Zheng C J, et al. Elicitors from the endophytic fungus Trichoderma atroviride promote Salvia miltiorrhiza hairy root growth and tanshinone biosynthesis[J]. J Exp Bot , 2013, 64 (18) :5687–5694. DOI:10.1093/jxb/ert342 |
| [75] | Li X, Zhai X, Shu Z, et al. Phoma glomerata D14:An endophytic fungus from Salvia miltiorrhiza that produces Salvia nolic acid C[J]. Curr Microbiol , 2016, 37 (1) :31–37. |
| [76] | Tan H, Liang W, Hu J, et al. MTR1 encodes a secretory fasciclin glycoprotein required for male reproductive development in rice[J]. Dev Cell , 2012, 22 (6) :1127–1137. DOI:10.1016/j.devcel.2012.04.011 |
| [77] | Di P, Zhang L, Chen J, et al. 13C Tracer reveals phenolic acids biosynthesis in hairy root cultures of Salvia miltiorrhiza[J]. ACS Chem Biol , 2013, 8 (7) :1537–1548. DOI:10.1021/cb3006962 |
| [78] | Xiao Y, Wang K, Ding R, et al. Transgenic tetraploid Isatis indigotica expressing Bt Cry1Ac and Pinellia ternata agglutinin showed enhanced resistance to moths and aphids[J]. Mol Biol Rep , 2012, 39 (1) :485–491. DOI:10.1007/s11033-011-0762-x |
| [79] | Chen R B, Liu J H, Xiao Y, et al. Deep sequencing reveals the effect of MeJA on scutellarin biosynthesis in Erigeron breviscapus[J]. PLoS One , 2015 . DOI:10.1371/journal.pone.0143881 |
 2016, Vol. 47
2016, Vol. 47


