2. 湖南中医药大学药学院, 湖南 长沙 410208 ;
3. 广州中医药大学脾胃研究所, 广东 广州 510405 ;
4. 湖南中医药大学 中医方证研究转化医学湖南省高校重点实验室, 湖南 长沙 410208
2. School of Pharmaceutical Sciences, Hunan University of Chinese Medicine, Changsha 410208, China ;
3. Spleen and Stomach Institute, Guangzhou University of Chinese Medicine, Guangzhou 510405, China ;
4. Hunan Education Department Key Laboratory of Traditional Chinese Medicine, Hunan University of Chinese Medicine, Changsha 410208, China
胃肠黏膜损伤是临床常见的病理改变,是多种胃肠道疾病如萎缩性胃炎、胃十二指肠溃疡、炎症性肠病的发病基础和主要病理环节。近年来,通过对生理调控、信号通路、病理改变的深入和系统研究,胃肠黏膜损伤修复的机制获得了较大进展。胃肠黏膜损伤后的修复过程主要依赖于上皮细胞迁移、增殖和分化3个环节[1],其中细胞迁移是黏膜损伤修复的第1个步骤,在黏膜损伤重建过程中具有至关重要的作用。
多胺是存在于人类细胞和体液中的天然成分,包括精脒、精胺及腐胺,二氟甲基鸟氨酸(DFMO)可特异性地阻断机体多胺合成[2]。细胞质游离钙离子([Ca2+]cyto)是细胞迁移的主要刺激因素[2]。研究表明,多胺量的增加使小肠黏膜上皮(IEC-6)细胞超极化,从而促进Ca2+内流,提升[Ca2+]cyto水平;增加的[Ca2+]cyto进一步激活其下游细胞骨架蛋白RhoA表达,提高IEC-6细胞骨架中应力纤维的量,进而为细胞迁移提供动力,最终促进IEC-6细胞迁移[3]。
中医脾胃虚弱与胃肠黏膜损伤在病因学和发病机制方面存在相关性,脾胃虚弱是胃肠黏膜损害疾病的病理基础,健脾益气法是治疗胃肠黏膜损伤相关疾病的主要治法之一[4]。本研究考察临床常用益气健脾中药黄芪的多糖成分对IEC-6细胞迁移的影响,并检测黄芪多糖对迁移过程细胞内多胺的量、[Ca2+]cyto水平和RhoA蛋白表达的影响,旨在探讨黄芪修复胃肠黏膜损伤的作用机制。
1 材料 1.1 药物与试剂黄芪饮片购于湖南中医药大学第一附属医院,经湖南中医药大学中药鉴定教研室刘塔斯教授鉴定为膜荚黄芪Astragalus membranaceus (Fisch) Bge.的干燥根;完全培养基(cDMEM,批号8112580)、胎牛血清(FBS,批号1036087)、青霉素和链霉素组成的双抗(Pen Strep,批号1202398)、Trypsin-EDTA(TrypLE,批号526A986)均购于Invitrogen公司;α-二氟甲基鸟氨酸(DFMO,相对分子质量218.63,批号039K4963V)购于德国Merck公司;5 mL聚苯乙烯圆底管为Becton Dickinson公司产品;Fluo-3 AM ester(相对分子质量1 129.85,批号10F0402)、腐胺(相对分子质量88.15,批号BCBH3167V),均为Sigma公司产品;鼠抗β-actin单克隆抗体(批号GR111289-1)、兔抗RhoA多克隆抗体(批号GR503-6)、羊抗兔IgG多克隆二抗(批号GR1010882-1)、羊抗鼠IgG多克隆二抗(批号GR1010881-1)均购自Abcam公司。
1.2 细胞株大鼠小肠隐窝细胞(IEC-6),购于ATCC,Catalog No. CRL-1592,Lot No. 58541019。经形态学和免疫学鉴定,该细胞株保持了非致瘤及未分化的特性,培养21~28代细胞用于实验。
1.3 主要仪器IX-71型倒置荧光显微镜,日本Olympus公司;Forma 310型CO2培养箱,德国Thermo scientific公司;Agilent 1200高效液相色谱系统,美国安捷伦公司;FACSAria Ⅱ型流式细胞仪,美国Becton Dickinson公司;AUM-120D分析天平,日本SHIMADZU公司;SDS-PAGE电泳系统、ChemiDoc XRS成像系统,美国Bio-Rad公司。
2 方法 2.1 黄芪多糖的制备称取黄芪药材饮片400 g,以95%乙醇60 ℃超声(350 kHz)提取(料液质量比为1:5)3次,每次1 h,弃上清。残渣以蒸馏水于60 ℃超声提取(料液质量比为1:5)3次,每次1 h,合并水提液,减压浓缩至1 mg/mL。调整浓缩液使其含醇量为80%,4 ℃静置过夜,滤取沉淀,浓缩得黄芪多糖干浸膏45.32 g。蒸馏水溶解黄芪多糖干浸膏,Sevage法去蛋白,浓缩干燥得黄芪粗多糖27.19 g。取黄芪粗多糖1.0 g,DEAE-纤维素柱(3.0 cm×35.0 cm)色谱初步分离,依次用蒸馏水及0.01、0.1、1 mol/L氯化钠溶液洗脱(体积流量5 mL/min),分步收集各部分洗脱液,冷冻干燥得到4个黄芪多糖样品,黄芪多糖Ⅰ 612.31 mg,黄芪多糖Ⅱ 40.82 mg,黄芪多糖Ⅲ 19.35 mg,黄芪多糖Ⅳ 24.52 mg。由于黄芪多糖Ⅰ具有较好的调节细胞迁移的活性,且分离的量最多,所以对其进一步分离纯化。取黄芪多糖Ⅰ样品200 mg,适量蒸馏水溶解后以0.45 μm微孔滤膜滤过,采用Sephadex LH-20凝胶柱(3 cm×90 cm)色谱纯化,蒸馏水(体积流量0.5 mL/min)洗脱,收集洗脱液,冷冻干燥得到纯化的黄芪多糖Ⅴ 125.3 mg。本研究的受试药为黄芪粗多糖、黄芪多糖Ⅰ、黄芪多糖Ⅴ。
2.2 细胞培养及迁移测定方法参考本实验室前期建立的方法[5-6]。细胞于37 ℃,饱和湿度,95%空气-5% CO2环境培养箱中培养,隔天换液1次。待细胞生长至80%~90%时,消化细胞,制作单细胞混悬液,血球计数板计数,细胞以1×105 /mL密度接种于6孔板,每孔加入培养液2.5 mL。以红色标记笔在六孔板各孔底部水平方向划3条标记线。细胞接种于六孔板36 h后,吸弃培养液,采用1 mL移液枪头(tips)在6孔板各孔中央沿直径方向(移液枪头与水平面成45°)轻轻划一条痕,PBS清洗细胞表面以去除细胞残骸。立即加入含受试药的培养液,8 h后于划痕和标记线的交叉部位进行拍照记录。NIH Image软件测量划痕面积,计算细胞迁移率。
细胞迁移率=(S0-S8)/S0
S0为0 h划痕面积,S8为培养8 h后划痕面积
2.3 HPLC法检测细胞内多胺水平[2]给予受试药(黄芪多糖Ⅴ)培养24 h后,吸弃各孔培养液,消化细胞,转移细胞悬液至1.5 mL EP管,3 000 r/min离心5 min,重复2次。往细胞沉淀加入1.2 mL 5%冷高氯酸,吹打混匀,于4 ℃、14 000 r/min离心10 min,保留上清液用于衍生化处理。取上清液1.0 mL,加入1 mL 2 mol/L的NaOH溶液和5 μL苯甲酰氯,涡旋混匀,静置20 min;加入2 mL饱和氯化钠溶液和2 mL氯仿,涡旋混合1 min,3 000 r/min离心10 min,吸取下层有机相并氮气吹干。以0.5 mL色谱甲醇溶解白色固体,于50 ℃水浴中放置8 h,所得溶液加入0.2 mL 2 mol/L NaOH溶液和2 mL氯仿,涡旋混匀,3 000 r/min离心10 min,吸取下层有机相并氮气吹干,以0.5 mL色谱甲醇溶解白色固体,0.22 μm有机微孔滤膜滤过,待测。色谱条件:色谱柱为依利特Hypersil ODS2柱,检测波长234 nm;柱温25 ℃;流动相为55%甲醇-45%水;体积流量1.0 mL/min;进样量20 μL。
2.4 流式细胞仪检测[Ca2+]cyto水平取1×105个细胞于流式管,加PBS使细胞悬液的终体积为0.5 mL。每管加入10 μL 5 μmol/L的Fluo-3/AM溶液,37 ℃避光孵育30 min。3 000 r/min离心3 min,弃上清液,加入0.5 mL PBS重悬。用CellQuest软件获取和分析数据,激发波长为488 nm,FSC-SSC作散点图识别IEC-6细胞,FL1-Counts作直方图测定平均荧光强度(MFI)。上机时每个样本获取10 000个IEC-6细胞。
2.5 Western blotting法检测RhoA蛋白表达RIPA裂解液提取各组细胞总蛋白,BCA法对蛋白进行定量,运用溴酚蓝指示剂制备SDS-PAGE电泳样品;电泳结束后,参照Marker切取RhoA和β-actin分子量所在的凝胶制成“三明治”结构,200 mA恒流转膜90 min;将PVDF膜置于含5% BSA的TBST中封闭1 h,TBS洗膜后分别用小鼠来源β-actin一抗和兔来源RhoA一抗于4 ℃孵育过夜,以山羊抗小鼠、山羊抗兔HRP标记二抗室温孵育1.5 h,TBS洗膜3次,加入ECL发光液避光反应5 min,ChemiDocTM XRS+成像系统观察蛋白条带,采用Image Lab软件统计分析条带灰度值。
2.6 统计学处理数据采用x±s表示,采用SPSS 19.0统计软件对数据进行处理,组间比较采用单因素方差分析。
3 结果 3.1 黄芪粗多糖对IEC-6细胞迁移的影响表 1结果显示,50、100、200 mg/L的黄芪粗多糖可使细胞迁移率分别提升至47.29%、48.56%和48.92%,与对照组(33.26%)相比,差异均显著(P<0.01);加入多胺合成抑制剂DFMO后,细胞迁移被显著抑制,迁移率仅为18.25%,与对照组相比差异非常显著(P<0.01);给予DFMO的同时加入50、100、200 mg/L剂量的黄芪粗多糖,细胞迁移速度明显加快,迁移率与DFMO组相比差异均非常显著(P<0.01),以上结果提示黄芪粗多糖可促进IEC-6细胞的迁移。
|
|
表 1 黄芪粗多糖对IEC-6细胞迁移的影响 Table 1 Effect of crude polysaccharides of A. membranaceuson IEC-6 cell migration |
3.2 黄芪多糖Ⅰ对IEC-6细胞迁移的影响
表 2结果显示,对照组细胞迁移率为34.12%,黄芪多糖Ⅰ 50、100、200 mg/L剂量均可明显加速IEC-6细胞迁移,与对照组相比差异均非常显著(P<0.01)。多胺合成抑制剂DFMO使细胞迁移速度明显减慢,细胞迁移率仅为20.37%,与对照组相比差异非常显著(P<0.01)。50、100、200 mg/L的黄芪多糖Ⅰ均可逆转DFMO所致的细胞迁移抑制作用,使迁移率分别提升至34.77%、36.14%、37.25%,与DFMO组比较差异均非常显著(P<0.01)。以上结果提示,黄芪多糖Ⅰ具有促进IEC-6细胞迁移的作用,并且其效果略强于黄芪粗多糖。
|
|
表 2 黄芪多糖Ⅰ对IEC-6细胞迁移的影响 Table 2 Effect of AMP Ⅰ on IEC-6 cell migration |
3.3 黄芪多糖Ⅴ对IEC-6细胞迁移的影响
图 1和表 3结果显示,在正常情况(未加DFMO)或细胞内多胺耗竭(加DFMO)情况下,黄芪多糖Ⅴ均可明显促进IEC-6细胞迁移。对照组细胞迁移率为33.08%,50、100、200 mg/L的黄芪多糖Ⅴ可使细胞迁移率分别提高至53.16%、55.48%和56.02%,与对照组相比差异均非常显著(P<0.01);多胺合成抑制剂DFMO使细胞迁移率降至19.78%,50、100、200 mg/L黄芪多糖Ⅴ均可逆转DFMO诱导的细胞迁移抑制作用,细胞迁移率分别提高至37.07%、38.12%和39.07%,与DFMO组相比差异均非常显著(P<0.01)。以上结果提示,黄芪多糖Ⅴ可促进IEC-6细胞迁移,且其效果略强于黄芪粗多糖和黄芪多糖Ⅰ。
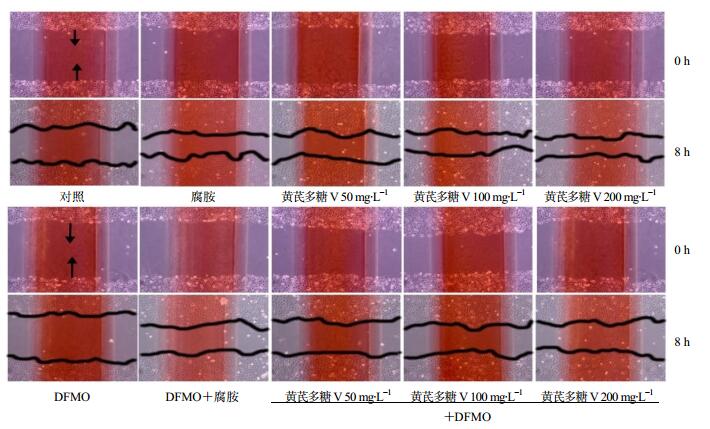
|
图 1 黄芪多糖Ⅴ对IEC-6细胞迁移的影响 Fig.1 Effect of AMP Ⅴ on IEC-6 cell migration |
|
|
表 3 黄芪多糖Ⅴ对IEC-6细胞迁移、多胺水平及[Ca2+]cyto的影响 Table 3 Effect of AMP Ⅴ on IEC-6 cell migration, intracellular polyamines content, and cytosolic free Ca2+ concentration |
3.4 黄芪多糖Ⅴ对IEC-6细胞迁移过程多胺水平的影响
表 3结果显示,100、200 mg/L的黄芪多糖Ⅴ明显提高了细胞内多胺的量,与对照组比较差异均非常显著(P<0.01);多胺合成抑制剂DFMO显著降低了细胞内多胺水平,与对照组比较差异非常显著(P<0.01);给予DFMO的同时加入100 mg/L或200 mg/L的黄芪多糖Ⅴ可逆转DFMO所致的细胞内多胺水平下降效果,使多胺的量显著增加,与DFMO组比较差异非常显著(P<0.01)。以上结果提示,黄芪多糖Ⅴ可增加IEC-6迁移过程细胞内多胺的量。
3.5 黄芪多糖Ⅴ对IEC-6细胞迁移过程[Ca2+]cyto的影响图 2和表 3结果显示,50、100、200 mg/L的黄芪多糖Ⅴ可使细胞内Fluo-3 MFI明显提高,与对照组比较差异非常显著(P<0.01);多胺合成抑制剂DFMO使MFI显著降低,与对照组比较差异非常显著(P<0.01);黄芪多糖Ⅴ 50、100、200 mg/L均可逆转DFMO所致的MFI降低作用,使MFI显著增加,与DFMO组比较差异均非常显著(P<0.01)。以上结果提示,黄芪多糖Ⅴ可提高IEC-6细胞迁移过程中[Ca2+]cyto水平。
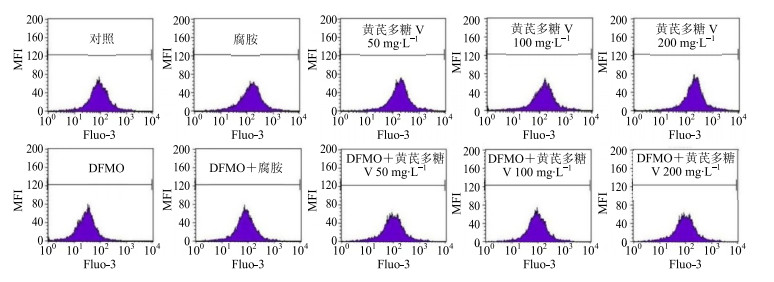
|
图 2 黄芪多糖Ⅴ对IEC-6细胞迁移过程[Ca2+]cyto的影响 Fig.2 Effect of AMP Ⅴ on [Ca2+]cyto concentration |
3.6 黄芪多糖Ⅴ对IEC-6细胞迁移过程RhoA蛋白表达的影响
图 3结果表明,与对照组比较,100、200 mg/L黄芪多糖Ⅴ可明显提高RhoA蛋白表达(P<0.01);DFMO使RhoA蛋白表达明显减少(P<0.01);100、200 mg/L黄芪多糖Ⅴ可逆转DFMO所致的RhoA蛋白表达抑制作用,使RhoA表达上调并接近正常水平,与DFMO组比较差异均非常显著(P<0.01)。
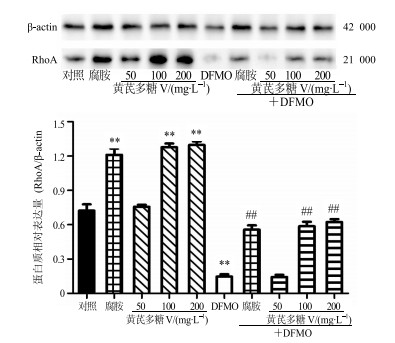
|
与对照组比较:**P<0.01;与DFMO组比较:##P<0.01 **P < 0.01 vs control group; ##P < 0.01 vs DFMO group 图 3 黄芪多糖Ⅴ对IEC-6细胞迁移过程RhoA蛋白表达的影响(x±s, n=6) Fig.3 Effect of AMP Ⅴ on RhoA protein expression (x±s, n=6) |
4 讨论
人体的胃肠黏膜是机体免疫系统的一道重要屏障,可阻止毒性物质和免疫原性成分侵袭,胃肠黏膜屏障功能的维系很大程度上依赖于胃肠黏膜结构的完整性。流行病学资料显示,由肿瘤治疗所导致的胃肠黏膜损伤发生率高达100%,服用NSAIDs的患者胃肠黏膜损伤发生率达60%[7]。胃肠黏膜损伤可引起消化不良症状如上腹部不适、恶心、呕吐、嗳气、食欲减退等,甚至出现溃疡、出血、穿孔、幽门梗阻等症状,严重影响到患者的日常生活,使临床多数患者不得不停止原有药物的治疗,从而加重原发疾病,因此制定系统性防治措施已经成了胃肠黏膜保护领域的一个重要课题。近年来,对胃肠黏膜保护作用的相关研究显示,中药可通过不同的有效成分和多种机制对胃肠黏膜损伤进行修复。有学者提出中医脾气虚证与胃肠黏膜损伤在病因和发病机制方面存在相关性,益气健脾是治疗胃肠黏膜损伤相关疾病的基本治法[4, 8]。
黄芪为临床常用的益气健脾中药,性味甘、微苦、微温,归心、肺、脾经,具有大补元气、补脾益肺、生津止渴、安神益智的功效。多糖是自然界含量丰富的天然大分子物质之一,多糖及其复合物(如糖蛋白、脂多糖)广泛存在于高等动、植物的细胞膜和微生物的细胞壁中,在人类生命活动中发挥着至关重要的作用。近年来,糖生物学、糖医药学和糖化学的研究逐渐成为生命医学领域的热点[9]。文献报道黄芪多糖具有免疫调节、抗动脉粥样硬化、抗肿瘤、抗病毒、抗衰老、降血糖等作用[10-11]。本研究发现,黄芪多糖还可促进胃肠黏膜上皮细胞迁移,提示其加速胃肠黏膜损伤修复、保护胃肠黏膜屏障的作用。
为了能从黄芪饮片中尽可能多地分离多糖,课题组采用95%乙醇对黄芪饮片进行超声提取,醇沉法去除苷类、挥发油等极性小的化合物,再用Sevage试剂除蛋白,得到黄芪粗多糖。随后的药效实验表明黄芪粗多糖具有明显的促进IEC-6细胞迁移的效果。因此,课题组采用DEAE纤维素阴离子柱进一步分离纯化黄芪粗多糖。DEAE纤维素法可吸附粗多糖中的离子型物质和小分子物质,如蛋白质、无机盐、色素、单糖和寡糖等,而大部分的多糖则可顺利流出。此外,DEAE较小的直径同时也起到了分子筛的作用,最终达到去粗取精、分离纯化的目的。通过DEAE纤维素法总共得到4个黄芪多糖,其中经水洗脱的黄芪多糖Ⅰ的量最高,并且具有较好的促进IEC-6细胞迁移的效果,而黄芪多糖Ⅱ、Ⅲ、Ⅳ的量均比较低,并且仅表现出微弱的促进IEC-6细胞迁移的作用。为了能从除杂后的混合多糖里获得均一的多糖,课题组采用Sephadex LH-20凝胶柱对黄芪多糖Ⅰ色谱分离纯化,得到黄芪多糖Ⅴ,并发现黄芪多糖Ⅴ可明显促进IEC-6细胞迁移,其活性略强于黄芪粗多糖和黄芪多糖Ⅰ。
多胺是一类带正电荷的烷基胺类小分子,普遍存在于哺乳动物细胞,机体多胺可通过离子键与DNA、蛋白质、磷脂等带负电荷的生物大分子结合,在细胞迁移、增殖、分化等生命活动中发挥着重要作用[2]。本研究结果表明,黄芪多糖Ⅴ可明显提高细胞内总的多胺的量。钙离子是细胞内多胺下游重要的第二信使,在细胞迁移、增殖等活动中具有关键的枢纽作用[12]。细胞内钙离子的量的增加主要来源于细胞外钙离子内流和细胞内钙库的释放。在IEC-6细胞,Ca2+内流途径包括Ca2+被动渗漏、储存操纵性钙通道(SOC)、受体操纵性钙通道(ROC),瞬时受体电位阳离子通道(TRPC)是构成IEC-6细胞膜SOC和ROC的分子基础,调控细胞外钙离子内流;磷酯酶Cγ-1(PLC-γ1)可催化二酰甘油(DAG)和三磷酸肌醇(IP3)的产生,IP3是细胞内Ca2+动员的使者,可促进细胞内质网和肌浆网释放Ca2+,同时还可通过细胞膜钙离子渗透通道激活Ca2+内流[2-3]。本研究结果显示,低、中、高剂量的黄芪多糖Ⅴ均能提高细胞迁移过程总的钙离子含量([Ca2+]cyto),但到底是上调TRPC蛋白表达促进Ca2+内流,抑或激活PLC-γ1促进细胞内钙库释放Ca2+有待进一步研究。
细胞迁移是依赖于细胞骨架动态组装及空间位置改变的复杂过程。细胞骨架为存在于胞浆中的纤维状网架结构体系,具有支撑和维持细胞形态及细胞运动的功能。Rho鸟苷三磷酸酶(Rho GTPases)通过改变细胞骨架结构,在调节细胞迁移过程中具有重要作用[13]。研究表明,RhoA是位于多胺及Ca2+下游的信号分子,细胞内多胺量的增加可提高[Ca2+]cyto量,从而提高RhoA蛋白表达,增加细胞骨架中应力纤维水平,进而刺激细胞迁移[14]。本研究结果表明,100、200 mg/L黄芪多糖Ⅴ可上调RhoA蛋白表达,并且可逆转DFMO所致的RhoA蛋白表达抑制效果。以上结果提示,黄芪多糖促进IEC-6迁移可能与增加细胞内多胺的量,从而提高[Ca2+]cyto,进而上调RhoA蛋白表达有关。本研究考察黄芪多糖对黏膜损伤修复早期细胞迁移的作用效果及机制,为阐述益气健脾中药黄芪治疗脾胃病的科学内涵提供实验依据,同时为从中医药角度寻求和开发胃肠黏膜保护剂提供一定的理论基础。
| [1] | Kemmerly T, Kaunitz J D. Gastroduodenal mucosal defense[J]. Curr Opin Gastroenterol , 2013, 29 (6) :642–649. DOI:10.1097/MOG.0b013e328365d42e |
| [2] | Song H P, Li R L, Chen X, et al. Atractylodes macrocephala Koidz promotes intestinal epithelial restitution via the polyamine-voltage-gated K+ channel pathway[J]. J Ethnopharmacol , 2014, 152 (1) :163–172. DOI:10.1016/j.jep.2013.12.049 |
| [3] | Rao J N, Rathor N, Zhuang R, et al. Polyamines regulate intestinal epithelial restitution through TRPC1-mediated Ca2+ signaling by differentially modulating STIM1 and STIM2[J]. Am J Physiol Cell Physiol , 2012, 303 (3) :308–317. DOI:10.1152/ajpcell.00120.2012 |
| [4] | 施甜, 朱方石, 徐婷婷. 脾虚与胃黏膜损伤相关性的理论探讨[J]. 医学与哲学 , 2011, 32 (12) :59–60. |
| [5] | 宋厚盼, 谢梦洲, 胡志希, 等. 白术、黄芪、党参促进IEC-6细胞损伤后的快速修复[J]. 中成药 , 2015, 37 (6) :1170–1175. |
| [6] | 宋厚盼, 李茹柳, 王一寓, 等. 白术提取物对IEC-6细胞迁移过程多胺信号通路钙离子调控的影响[J]. 中华中医药杂志 , 2014, 29 (5) :1361–1367. |
| [7] | Fong S Y, Efferth T H, Zuo Z. Modulation of the pharmacokinetics, therapeutic and adverse effects of NSAIDs by Chinese herbal medicines[J]. Exp Opin Drug Metab Toxicol , 2014, 10 (12) :1711–1739. DOI:10.1517/17425255.2014.970167 |
| [8] | Song H P, Li R L, Zhou C, et al. Atractylodes macrocephala Koidz. stimulates intestinal epithelial cell migration through a polyamine dependent mechanism[J]. J Ethnopharmacol , 2015, 159 (1) :23–35. |
| [9] | 谢明勇, 聂少平. 天然产物活性多糖结构与功能研究进展[J]. 中国食品学报 , 2010, 10 (2) :1–11. |
| [10] | 韩镕徽, 王洪新, 唐富天, 等. 黄芪多糖对异丙肾上腺素诱导的心肌肥厚大鼠内皮功能的影响[J]. 中草药 , 2015, 46 (24) :3722–3726. |
| [11] | 张莹, 贾英杰, 李小江, 等. 注射用黄芪多糖对耐顺铂人肺腺癌细胞A549/DDP耐药逆转作用研究[J]. 药物评价研究 , 2012, 35 (6) :417–419. |
| [12] | Rao J N, Rathor N, Zou T, et al. STIM1 translocation to the plasma membrane enhances intestinal epithelial restitution by inducing TRPC1-mediated Ca2+ signaling after wounding[J]. Am J Physiol Cell Physiol , 2010, 299 (3) :C579–588. DOI:10.1152/ajpcell.00066.2010 |
| [13] | 宋厚盼, 陈昫, 李茹柳. Rho鸟苷三磷酸酶调节细胞迁移中细胞骨架结构的研究进展[J]. 广州中医药大学学报 , 2013, 30 (2) :275–280. |
| [14] | Rao J N, Li L, Golovina V A, et al. Ca2+-RhoA signaling pathway required for polyamine-dependent intestinal epithelial cell migration[J]. Am J Physiol Cell Physiol , 2001, 280 (4) :C993–C1007. |
 2016, Vol. 47
2016, Vol. 47


