目前,周围神经缺损的修复(尤其是长段缺损的修复)以自体神经移植为“金标准”,但自体神经来源有限和造成新的神经缺损,制约了其临床应用。同种异体神经与自体神经保持了相同的形态结构,可以为周围神经缺损的修复提供不同长短、粗细的神经移植物,因此,同种异体神经将可能成为自体神经的最好替代物。实现周围神经体外保存,是保证神经缺损及时修复的关键。化学去细胞法和超低温保存法的周围神经虽可体外长期保存,并能降低周围神经免疫原性[1-2],但这些方法去除/灭活了周围神经包括雪旺细胞(Schwann cells,SCs)在内的所有细胞,而SCs是周围神经的主要结构与功能细胞,能分泌促进损伤神经再生必需的多种神经营养因子和黏附因子;失去SCs和髓鞘的促神经再生作用,不利于长段神经缺损的修复。
玻璃化冷冻保存是一种超速冷冻法,可减少低温冷冻对组织、细胞的损伤,延长组织细胞的保存时间,提高保存后细胞的生物活性[3-5]。参附注射液由参附汤衍化而成,由人参和附子组成,具有益气、温阳、固脱的功效,临床用以治疗“元气大亏、阳气暴脱”的危急重症[6]。本实验应用含参附注射液的玻璃化溶液深低温(-80 ℃)保存大鼠坐骨神经,观察保存后神经组织超微结构变化、凋亡相关蛋白表达以及SCs生物活性情况,并观察玻璃化保存后的大鼠坐骨神经同种异体移植后受体神经再生情况,以探讨参附注射液提高周围神经玻璃化冷冻保存效果的可行性。
1 材料 1.1 实验动物SPF级雄性SD大鼠50只和雄性Wistar大鼠50只分别为供体和受体,由重庆医科大学动物实验中心提供,体质量(200±20)g,许可证号SCXK(渝)2012-0001。
1.2 主要试剂和仪器参附注射液(批号150512010,雅安三九药业有限公司);Calcein-AM(东仁公司,日本);PI(上海前尘科技生物有限公司);Bcl-2、Bax单克隆抗体(SANTA公司,美国);二抗(兔抗山羊,中杉公司);I型胶原酶(Sigma公司,美国);FBS、DMSO、0.25%胰酶、高糖型DMEM培养基(Hyclone公司,美国)。H-7500型透射电镜(Hitachi公司,日本);TCS-SP2型激光扫描共聚焦显微镜(LEICA公司,德国);BL-420F生物机能实验系统(成都泰盟);电泳仪(Blo-RAO POWER/PAC 1000,上海汇分电子科技有限公司);凝胶成像系统(Blo-RAO Gel Doc 2000,美国伯乐公司)。
2 方法 2.1 玻璃化保存液的配制将参附注射液加入到含有10% FBS、20% DMSO的高糖DMEM溶液中,制成含0、5%、10%、30%(体积分数)参附注射液的玻璃化保存液,微孔滤膜(0.22 μm)滤过,4 ℃冰箱过夜。
2.2 Calcein-AM、PI荧光染色剂的配制100 μg Calcein-AM加入到100 μL无水DMSO中,漩涡振荡3 min,6 000 r/min离心2 min,涡旋再次振荡3 min,6 000 r/min离心2 min,使用前用PBS配成4 μmol/L溶液。将10 mg PI粉末加入到200 mL PBS中,反复吹打,配制成50 mg/L的工作液。
2.3 动物模型分组供体神经随机分为不同体积分数(0、5%、10%、30%)参附注射液保存组(A、B、C、D组,n=20)和新鲜神经组(F组,n=10),-80 ℃保存4周。受体大鼠A′、B′、C′、D′组(n=10)分别对应供体A、B、C、D组,并设立自体移植组(F′组,n=10)。
2.4 坐骨神经玻璃化保存常规消毒铺巾,10%水合氯醛(0.4 mL/100 g)大鼠腹腔麻醉,无菌条件下于梨状肌下缘5 mm处截取供体双侧坐骨神经15 mm,生理盐水冲洗,迅速置于含不同浓度参附注射液玻璃化液中,4 ℃预处理30 min,-20 ℃冰箱2 h,-80 ℃深低温冰箱保存4周。
2.5 坐骨神经同种异体移植受体大鼠消毒、麻醉同上,于右股后外侧纵行切口,钝性分离、游离坐骨神经,距梨状肌下缘5 mm处整齐切除大鼠坐骨神经造成10 mm缺损。将供体神经修剪成10 mm长,手术显微镜下,以9~0带线缝合针行神经外膜无张力间断缝合4~6针,逐层关闭切口。手术单人完成,术后动物不做特殊处理。
2.6 检测指标 2.6.1 玻璃化保存神经电镜观察取各组神经各2条,2.5%戊二醛4 ℃固定过夜,1%锇酸固定2 h,梯度丙酮脱水,环氧树脂包埋,超薄切片,醋酸铀-柠檬酸铅双重染色,透射电镜观察神经超微结构。
2.6.2 玻璃化保存神经SCs活性检测取各组神经各3条,剥离神经外膜,0.25%胰酶和2 mg/mL胶原酶1:1混合液室温下避光消化20 min,10% FBS的DMEM终止消化10 min,PBS冲洗3次(每次5 min),加4 μmol/L的Calcein-AM,室温避光孵育30 min;再加50 mg/L的PI,室温孵育30 min,PBS冲洗3次(每次5 min);加防荧光淬灭剂、封片,激光扫描共聚焦显微镜观察荧光强度,激发波长490 nm(绿色荧光)和545 nm(红色荧光)。
2.6.3 Western blotting检测玻璃化保存神经Bcl-2、Bax蛋白表达玻璃化保存各组和新鲜神经组严格按照全蛋白的提取试剂盒说明书提取全蛋白,以BCA蛋白定量法检测蛋白浓度,上样量50 μg,SDS-PAGE凝胶电泳(电泳液为甘氨酸缓冲液):5%浓缩胶恒压80 V,20 min;10%分离胶恒压120 V,90 min;凝胶与PVDF置于3层滤纸中间放入转移槽,恒定电流300 mA,90 min,转膜至PVDF膜上,自然晾干,以5%脱脂奶粉封闭30 min,加入一抗(以0.01 mol/L PBST稀释到1:1 000),4 ℃孵育过夜,37 ℃复温30 min;PBST漂洗3次,滴加HRP标记的二抗(以0.01 mol/L PBST稀释到1:1 000)室温下孵2 h,PBST漂洗3次,ECL法增强发光3 min,以GAPDH为内参,暗室中使X线片曝光,显影,定影,并扫入凝胶成像系统,以Quantity one 4.6图像分析软件分析。
2.6.4 移植后一般情况观察移植后大鼠伤口愈合、溃疡发生情况,取材时观察移植神经段粗细、与周围组织粘连情况等。
2.6.5 坐骨神经功能指数(sciatic functional index,SFI)检测术后4、8、12、16周,各组随机抽取5只大鼠检测。自备足印采集行走箱(长80 cm,宽10 cm),箱底平铺白纸。大鼠双后足蘸墨水,让其自行从行走箱一端走向另一端,留下足印,筛选完整足印测量:(1)足印长度(PL),从足跟到足尖的最大距离;(2)足趾宽度(TS),第1~5趾连线最大距离;(3)中间足趾距离(IT),第2~4趾连线最大距离。根据Bain公式:SFI=-38.3(EPL-NPL)/NPL+109.5(ETS-NTS)/NTS+13.3(EIT-NIT)/NIT-8.8(其中N代表新鲜足,E代表实验足),以SFI=0为正常值,SFI=-100为神经完全断离指标。
2.6.6 再生神经电生理检测术后16周,大鼠腹腔麻醉后,钝性分离、暴露移植侧坐骨神经,梨状肌下缘3 mm处神经干上放置刺激电极,外踝关节上10 mm腓肠肌上安置接收电极,地线远离两电极接地,刺激强度1 V,刺激间隙0.25 ms。BL-420F系统测定肌肉复合动作电位潜伏期和神经传导速度(never conduction velocity,NCV)。
2.6.7 再生神经图像分析电生理检测后,每组选取8只实验大鼠(另2只电镜观察),截取移植神经中段5 mm,固定、包埋同“2.6.1”项,半薄切片(0.5 μm),甲苯胺蓝染色,CCD光谱测量系统,每张切片随机取5个视野,以Image-Pro Plus 6.0图像分析软件,分析再生有髓神经纤维数目和髓鞘厚度。
2.6.8 再生神经电镜观察每组选取2只移植大鼠,整齐截取移植神经中段5 mm,固定、包埋、切片及染色同“2.6.1”项,透射电镜观察再生神经超微结构。
2.7 统计学分析采用SPSS 19.0统计软件分析,数据均以x±s表示,组间比较采用单因素方差分析,两两比较采用q检验。
3 结果 3.1 玻璃化保存神经电镜观察新鲜神经(F组)有髓神经纤维髓鞘板层排列紧凑,髓鞘少有分层及空泡化,轴浆无萎缩;A、B、C、D组均存在不同程度的脱髓鞘改变,髓鞘板层排列疏松、不同程度空泡化,轴浆不同程度萎缩,其中C、D组病理变化比A、B组轻,A组变化最显著(图 1)。
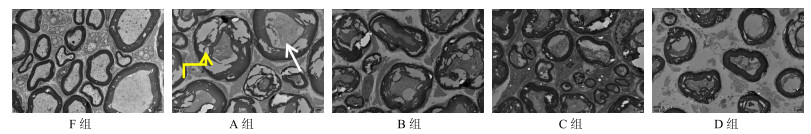
|
白色箭头示轴浆萎缩,黄色箭头示髓鞘空泡化 White arrow shows the axis of the plasma, yellow arrow shows the myelin sheath 图 1 保存4周后坐骨神经超微结构 Fig.1 Ultrastructures of sciatic nerves preserved for 4 weeks |
3.2 保存后神经SCs活性
F组神经纤维绿色荧光强、分布广泛,红色荧光少;A、B组绿色荧光较弱,分布局限,红色荧光较多;C、D组绿色荧光较强,分布较广,红色荧光较弱(图 2)。
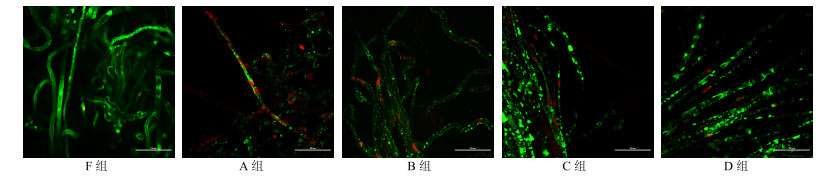
|
图 2 玻璃化保存4周坐骨神经Calcein-AM/PI荧光双染色 Fig.2 Calcein-AM and PI double staining of sciatic nerves after being preserved by vitrification preservation for 4 weeks |
3.3 Western blotting检测Bcl-2、Bax蛋白表达
各组神经均检测出Bcl-2、Bax蛋白表达,Bcl-2相对表达量分别为:F组0.861±0.009、A组0.253±0.007、B组0.458±0.008、C组0.659±0.009、D组0.671±0.009;Bax相对表达量:F组0.152±0.007、A组0.415±0.012、B组0.336±0.007、C组0.263±0.009、D组0.250±0.011。其中B、C、D组与A组间,以及C、D组与B组间差异均显著(P<0.05),但C、D组间差异不显著(P>0.05)(图 3)。
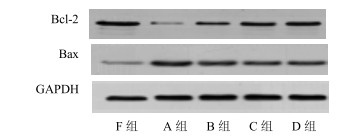
|
图 3 玻璃化保存4周坐骨神经Bcl-2、Bax蛋白表达 Fig.3 Expression of Bcl-2 and Bax of sciatic nerves after being preserved by vitrification preservation for 4 weeks |
3.4 移植后一般情况
实验期间无大鼠死亡,伤口无化脓感染,无足底溃疡、足趾脱落等损害,术后1周大鼠伤口愈合。16周取材时发现A′、B′、C′、D′组神经移植段与周围组织均出现轻度粘连,远近吻合口有轻微膨大;F′组(自体移植组)移植神经与周围组织无明显粘连,远近吻合口无明显膨大。
3.5 SFI比较移植后4、8、12、16周各组SFI比较,F′组均优于A′、B′、C′、D′组,C′、D′组优于A′、B′组,差异显著(P<0.05),但A′、B′组间及C′、D′组间差异不显著(P>0.05),见表 1。
|
|
表 1 移植术后各组SFI比较 Table 1 SFI detection after transplantation |
3.6 再生神经电生理指标
移植后16周,动作电位潜伏期、神经传导速度,F′组优于A′、B′、C′、D′组,C′、D′组优于A′、B′组,差异显著(P<0.05),但A′、B′组间及C′、D′组间差异不显著(P>0.05),见表 2。
|
|
表 2 移植后16周再生神经电生理指标 Table 2 Electrophysiological testing on nerve of rats in 16 weeks after transplantation |
3.7 再生神经图像分析
移植后16周,各组再生有髓神经纤维数及髓鞘厚度,F′组高于A′、B′、C′、D′组,C′、D′组高于A′、B′组,差异均显著(P<0.05),但A′、B′组间及C′、D′组间差异不显著(P>0.05),见表 3和图 4。
|
|
表 3 移植后16周再生神经图像分析 Table 3 Image analysis of regenerative nerve in 16 weeks after transplantation |
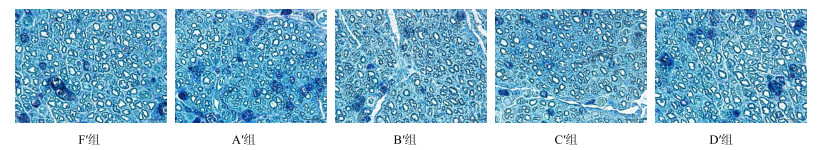
|
图 4 移植后16周再生神经甲苯胺蓝染色 Fig.4 Toluidine blue staining in 16 weeks after transplantation |
3.8 再生神经超微结构
F′组可见大量有髓神经纤维,纤维粗细均匀,髓鞘厚;A′、B′组再生有髓神经纤维数量较少,直径较细,分布稀疏,髓鞘较薄;C′、D′组再生有髓神经纤维数量较多,分布广泛、髓鞘较厚(图 5)。
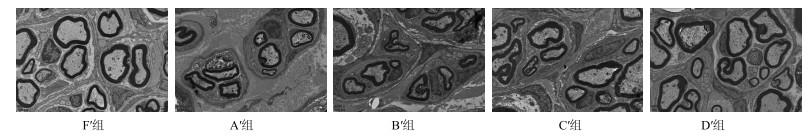
|
图 5 移植后16周再生神经超微结构 Fig.5 Ultramicro-structure of nerve graft of rats in each group in 16 weeks after transplantation |
4 讨论
目前,周围神经长段缺损的修复以自体神经移植效果最好,但自体神经移植会造成新的神经缺损,无法满足临床周围神经损伤修复需求,而同种异体神经具有与自体神经相同的组织结构和物质基础,有可能成为自体神经的最佳替代品。实现异体周围神经体外保存,是保证神经缺损及时修复的关键。
玻璃化冷冻保存是一种超速冷冻方法,它是以极快的速度降温冷冻细胞,使细胞中游离的水和胶体不形成冰晶,迅速玻璃化。该法能避免降温时盐浓度变化和冰晶形成对细胞造成的损伤,可使保存后的细胞获得较高存活率[7-8]。近年来,应用玻璃化法保存周围神经也有一些研究[9],但对于维持SCs较高生物活性的周围神经玻璃化保存条件,目前还存在争议[10-13]。
参附注射液是参附汤的注射剂,由人参、附子组成。人参甘温大补元气,附子大辛大热温阳而逐寒,参附汤临床用于治疗“元气大亏、阳气暴脱”的危急重症,具有益气、温阳、固脱功效。现代研究[14-18]发现参附注射液具有抑制钙内流、提高超氧化物歧化酶活性、降低丙二醛的量,对抗组织缺血时氧自由基引发的脂质过氧化,减少缺血-再灌注后氧自由基的产生,对移植肝脏、肺脏缺血-再灌注损伤有保护作用。本实验中,用参附注射液(B、C、D组)玻璃化保存大鼠坐骨神经4周,电镜结果显示神经纤维脱髓鞘变性病理变化程度均轻于对照组(不含有参附注射液的A组);Calcein-AM/PI双荧光染色、LSCM观察神经纤维荧光强度,B、C、D组绿色荧光强于A组,而红色荧光则比A组弱;凋亡相关蛋白表达,B、C、D组Bcl-2蛋白表达均高于A组,而Bax蛋白表达则低于A组。Calcein-AM是一种活细胞荧光染色剂,能穿透活细胞膜进入胞质,被水解并留下Calcein在细胞内,490 nm波长下发黄绿色荧光;而PI不能进入活细胞内,能穿透死亡细胞的细胞膜,545 nm波长激发出红色荧光。因此,Calcein-AM/PI双染色后的绿色荧光强度反映了活细胞情况,而红色荧光强度则反映了死亡细胞情况。本实验结果表明,参附注射液对深低温玻璃化保存的周围神经具有保护作用,能提高保存后神经SCs生物活性,其机制可能与调节凋亡相关蛋白表达有关。
SCs是周围神经的主要结构与功能细胞,在周围神经损伤后的再生微环境中具有极为重要的作用,可释放多种神经营养因子、黏附因子,表达基底膜素分子并促进基底膜管的支架作用,促进轴突再生和髓鞘形成。虽然化学去细胞法和超低温保存法降低了周围神经的抗原性,并能维持其三维空间结构,能为再生过程中神经轴突提供良好空间支架,是近年来研究较多的周围神经体外保存法[1-2]。但这些方法都清除/灭活了周围神经的主要结构与功能细胞(SCs),不利于异体移植后受体神经再生。而种植了SCs的化学去细胞异体神经修复坐骨神经缺损,术后受体神经再生明显优于单纯化学去细胞异体神经移植[19-21]。
本实验中,参附注射液玻璃化保存大鼠坐骨神经4周,移植术后(4、8、12、16周)SFI显示,参附注射液组(B′、C′、D′组)优于单纯玻璃化液组(A′组),且以中、高浓度(C′、D′组)效果明显;术后16周,动作电位潜伏期、神经传导速度及再生神经图像分析结果及再生神经超微结构,B′、C′、D′组均优于A′组,以中、高浓度(C′、D′组)效果为佳。实验结果表明,大鼠坐骨神经深低温玻璃化保存时加入一定浓度的参附注射液,能提高同种异体移植后受体神经移植后再生效果。这可能是参附注射液对深低温玻璃化保存周围神经具有保护作用,提高了玻璃化保存周围神经SCs生物活性,前期研究[22]发现玻璃化保存后具有生物活性的SCs仍具有分泌神经营养因子能力,本实验中参附注射液提高了玻璃化保存周围神经SCs的生物活性,这将有利于异体移植后SCs发挥促神经再生作用。
综上所述,参附注射液对深低温玻璃化冷冻保存坐骨神经具有保护作用,能提高保存后神经SCs生物活性,改善异体移植后的受体神经再生效果。至于参附注射液对周围神经玻璃化冷冻保存温度、时间、最佳浓度以及周围神经免疫原性等影响将进一步研究。
| [1] | 李航旭, 邹练, 刘德忠, 等. 化学去细胞同种异体神经移植修复大鼠骶1神经缺损[J]. 中国组织工程研究与临床康复 , 2011, 15 (31) :5735–5738. |
| [2] | 张勇, 陈德龙, 陈小龙, 等. 不同冷冻时间对异体神经移植后生理特性的影响[J]. 重庆医学 , 2013, 42 (29) :3521–3523. |
| [3] | Li L, Zhang X, Zhao L, et al. Comparison of DNA apoptosis in mouse and human blastocysts after vitrification and slow freezing[J]. Mol Reprod Dev , 2012, 79 (3) :229–236. DOI:10.1002/mrd.v79.3 |
| [4] | Motohashi H H, Sankai T, Kada H. Live offspring from cryopreserved embryos following in vitro growth, maturation and fertilization of oocytes derived from preantral follicles in mice[J]. J Reprod Dev , 2011, 57 (6) :715–722. DOI:10.1262/jrd.10-152H |
| [5] | Saragusty J, Arav A. Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification[J]. Reproduction , 2011, 141 (1) :1–19. DOI:10.1530/REP-10-0236 |
| [6] | 马建齐, 白静慧, 朱相宇. 参附注射液联合乌司他丁治疗脓毒血症的临床研究[J]. 现代药物与临床 , 2015, 30 (11) :1367–1369. |
| [7] | Hasegawa A, Mochida K, Matoba S, et al. Efficient production of off-spring from Japanese wild-derived strains of mice (Mus musculus molossinus) by improved assisted reproductive technologies[J]. Biol Reprod , 2012, 86 (5) :161–167. DOI:10.1095/biolreprod.111.097972 |
| [8] | Rahimi G, Isachenko V, Kreienberg R, et al. Re-vascularisation in human ovarian tissue after conventional freezing or vitrification and xeno-transplantation[J]. Eur J Obstet Gynecol Reprod Biol , 2010, 149 (1) :63–67. DOI:10.1016/j.ejogrb.2009.11.015 |
| [9] | Fahy G M, Wowk B, Pagotan R, et al. Physical and biological aspects of renal vitrificationn[J]. Organogenesis , 2009, 5 (3) :167–175. DOI:10.4161/org.5.3.9974 |
| [10] | 黄英如, 蒋电明, 冼华, 等. 人参皂甙Rb1对玻璃化保存坐骨神经异体移植后神经再生的影响[J]. 中国矫形外科杂志 , 2013, 21 (4) :390–396. |
| [11] | 袁新, 蒋电明, 陈增刚, 等. 含川芎嗪的玻璃化液对异体神经移植免疫反应的影响[J]. 重庆医科大学学报 , 2009, 34 (2) :70–73. |
| [12] | 陈增刚, 蒋电明, 欧云生, 等. 川芎嗪浓度对大鼠异体坐骨神经玻璃化保存后神经再生影响的实验研究[J]. 中国修复重建外科杂志 , 2009, 23 (7) :868–872. |
| [13] | 李沿江, 黄英如, 冼华, 等. 川芎嗪预处理促进大鼠坐骨神经异体移植后神经再生实验研究[J]. 中草药 , 2015, 46 (8) :1178–1183. |
| [14] | 谭萍, 张凌云, 张国欣, 等. 参附注射液对大鼠肢体缺血再灌注后肝脏损伤的保护作用[J]. 中国普外基础与临床杂志 , 2014, 21 (8) :960–964. |
| [15] | 江承平, 刘福, 李毅, 等. 参附注射液对脑缺血再灌注大鼠MDA、SOD、TXB2及6-keto-PGF1a的影响及意义[J]. 中国医科大学学报 , 2012, 41 (2) :124–127. |
| [16] | 于妍, 王硕仁. 参附注射液对肥大心肌细胞线粒体内外膜损伤的影响[J]. 中药药理与临床 , 2013, 29 (4) :19–21. |
| [17] | 蒲江涛, 刘伦旭, 余南彬, 等. 参附注射液对兔移植肺缺血-再灌注损伤的保护作用[J]. 中国胸心血管外科临床杂志 , 2010, 27 (3) :257–259. |
| [18] | 江承平, 王柏强, 刘福, 等. 参附注射液对大鼠脑缺血再灌注损伤脑组织磷酸果糖激酶表达的影响[J]. 药物评价研究 , 2013, 36 (2) :100–103. |
| [19] | 孙晓红, 张岩, 佟晓杰, 等. 种植施万细胞的脱细胞同种异体神经移植物对大鼠坐骨神经缺损的修复作用[J]. 解剖科学进展 , 2006, 12 (2) :146–149. |
| [20] | di Summa P G, Kingham P J, Raffoul W, et al. Adipose-derived stem cells enhance peripheral nerve regeneration[J]. Plast Reconstr Aesthet Surg , 2010, 63 (9) :1544–1552. DOI:10.1016/j.bjps.2009.09.012 |
| [21] | Aszmann O C, Korak K J, Luegmair M, et al. Bridging critical nerve defects through an acellular homograft seeded with autologous schwann cells obtained from aregeneration neuroma of the proximal stump[J]. J Reconstr Microsurg , 2008, 24 (3) :151–158. DOI:10.1055/s-2008-1076091 |
| [22] | 肖龙, 黄英如, 李沿江, 等. 二甲基亚砜和乙二醇对玻璃化保存大鼠坐骨神经的协同保护作用[J]. 上海交通大学学报:医学版 , 2015, 35 (7) :940–946. |
 2016, Vol. 47
2016, Vol. 47


