2. 山东中医药大学, 山东 济南 250355
2. Shandong University of Traditional Chinese Medicine, Jinan 250355, China
栝楼Trichosanthes kirilowii Maxim.为葫芦科(Cucurbitaceae)栝楼属Trichosanthes Linn.多年生草质藤本植物,具有重要的药用价值。其果实、果皮、种子、块根等均可药用,药材名称分别为瓜蒌、瓜蒌皮、瓜蒌子、天花粉[1]。近年来有关栝楼各药用部位的化学成分及药理作用研究较多[2-5],但少见对栝楼茎叶化学成分的研究报道。而栝楼雌雄异株,如果以果实为目标产品,实际生产中就要在栝楼花蕾出现、容易区分性别时将多余雄株拔除,而以栝楼种子繁育的后代,雄株的比例一般均超过90%[6],这样就会产生大量的雄株茎叶,造成了资源的极大浪费。从中药资源的综合开发利用以及开发新药源的角度分析,有必要对栝楼雄株茎叶化学成分进行系统研究,探究将其变废为宝的必要性。本研究从栝楼雄株茎叶中分离得到7种黄酮类化合物,分别鉴定为木犀草素(luteolin,1)、金圣草黄素(chrysoeriol,2)、木犀草素-7-O-β-D-葡萄糖苷(luteolin-7-O-β-D-glucoside,3)、柯伊利素-7-O-β-D-葡萄糖苷(chrysoeriol-7-O-β-D-glucoside,4)、芹菜素-7-O-β-D-葡萄糖苷(apigenin-7-O-β-D-glucoside,5)、香叶木素-7-O-β-D-葡萄糖苷(diosmetin-7-O-β-D-glucoside,6)、槲皮素-3-O-β-D-葡萄糖苷(quercetin-3-O-β-glucoside,7)。同时,测定其清除DPPH自由基的活性,为进一步开发利用栝楼雄株茎叶黄酮类成分药用价值及综合开发利用栝楼植物资源提供重要的理论依据。
1 仪器与材料Bruker-400核磁共振波谱仪(瑞士Bruker公司);Agilent 1100 series 6320 ion-trap质谱仪(美国Agilent公司);TBE300A高速逆流色谱仪(上海同田生物技术有限公司);EYEL4型旋转蒸发仪(东京理化器械株式会社);722E型紫外可见分光光度计(上海光谱仪器有限公司);普源L-3000高效液相色谱仪(北京普源精电科技有限公司);Waters e2695高效液相色谱仪(美国Waters公司)。
聚酰胺树脂(浙江省台州市路桥四甲生化塑料厂);柱色谱硅胶(100~200目、200~300目)及GF254硅胶板(青岛海洋化工厂);Sephadex LH-20填料(日本YMC公司);1, 1-二苯基-2-苦基肼(DPPH,和光纯药工业株式会社);高效液相色谱用甲醇、乙腈(色谱纯,美国Tedia公司);水为娃哈哈纯净水,其他试剂均为分析纯。
栝楼雄株茎叶于2014年7月份采于山东省济南市长清区马山镇双泉村,经山东中医药大学张永清教授鉴定为葫芦科栝楼属植物栝楼Trichosanthes kirilowii Maxim.的雄株茎叶。
2 提取与分离取干燥的栝楼雄株茎叶粗粉30 kg,以适量95%乙醇回流提取3次,合并滤液,旋转蒸发至无醇味。依次采用石油醚、醋酸乙酯和正丁醇萃取,分别回收溶剂,得栝楼雄株茎叶各极性部位。
醋酸乙酯部分(108 g)采用聚酰胺树脂柱分离,乙醇-水梯度洗脱,通过硅胶薄层色谱标识,合并具有相同斑点的流分,得11个组分A1~A11。A10采用高速逆流色谱分离,氯仿-甲醇-水(4:3.5:2)洗脱,检测波长254 nm,转速850 r/min,体积流量2 mL/min,分离得到化合物1(10.8 mg)和2(9.6 mg)。A6采用硅胶柱色谱分离,二氯甲烷-甲醇(100:1→1:1)梯度洗脱,其中二氯甲烷-甲醇(5:1)洗脱部位A6-17采用制备型HPLC分离得到化合物3(12.4 mg)和4(13.6 mg)。A9采用硅胶柱色谱分离,二氯甲烷-甲醇梯度洗脱,通过硅胶TLC标识,合并具有相同斑点的流分,得组分A9-1~A9-12。将A9-9及A9-10采用凝胶柱色谱分离,分别采用甲醇、甲醇-水(1:1)洗脱纯化,结合制备型HPLC从A9-9中分离得到化合物5(20.2 mg)和6(25.6 mg),从A9-10中分离得到化合物7(8.7 mg)。
3 结构鉴定化合物1:淡黄色粉末(丙酮),ESI-MS m/z: 285 [M-H]。1H-NMR (400 MHz, DMSO-d6) δ: 12.98 (1H, s)提示结构中存在5-OH,7.42 (2H, m, H-2′, 6′), 6.89 (1H, d, J=8.0 Hz, H-5′)显示B环存在ABX自旋耦合系统,3′和4′位有取代;6.68 (1H, s, H-3), 6.45 (1H, s, H-8), 6.19 (1H, s, H-6);13C-NMR (100 MHz, DMSO-d6) δ: 164.4 (C-2), 103.3 (C-3), 182.1 (C-4), 161.9 (C-5), 99.3 (C-6), 164.6 (C-7), 94.3 (C-8), 157.7 (C-9), 104.2 (C-10), 122.0 (C-1′), 113.9 (C-2′), 146.2 (C-3′), 150.2 (C-4′), 116.5 (C-5′), 119.4 (C-6′)。以上数据与文献报道[7]基本一致,故鉴定化合物1为木犀草素。
化合物2:黄色颗粒状结晶(丙酮),ESI-MS m/z: 299 [M-H]。1H-NMR (400 MHz, DMSO-d6) δ: 12.98 (1H, s)提示该化合物中存在5-OH结构,7.56 (2H, s, H-2′, 6′), 6.94 (1H, d, J=8.8 Hz, H-5′), 6.91 (1H, s, H-3), 6.52 (1H, s, H-8), 6.20 (1H, s, H-6), 3.90 (3H, s, 3′-OCH3);13C-NMR (100 MHz, DMSO-d6) δ: 164.1 (C-2), 104.2 (C-3), 182.3 (C-4), 157.8 (C-5), 99.3 (C-6), 164.6 (C-7), 94.5 (C-8), 161.9 (C-9), 103.7 (C-10), 122.0 (C-1′), 110.7 (C-2′), 151.2 (C-3′), 148.5 (C-4′), 116.2 (C-5′), 120.8 (C-6′), 56.4 (-OCH3)。以上数据与文献报道[8]基本一致,故鉴定化合物2为金圣草黄素。
化合物3:黄色粉末,ESI-MSm/z: 449 [M+H]+, 447 [M-H]−。推测分子式为C21H20O11。1H-NMR (400 MHz, DMSO-d6) δ: 13.00 (1H, brs, 5-OH), 7.45 (2H, t, J=8.8 Hz, H-2′, 6′), 6.90 (1H, d, J=8.0 Hz, H-5′), 6.79 (1H, s, H-8), 6.75 (1H, s, H-3), 6.45 (1H, s, H-6), 5.08 (1H, d, J=7.2 Hz, H-1″);13C-NMR (100 MHz, DMSO-d6) δ: 182.3 (C-4), 163.4 (C-2), 103.6 (C-3), 161.6 (C-5), 100.4 (C-6), 165.0 (C-7), 95.2 (C-8), 157.4 (C-9), 105.8 (C-10), 121.7 (C-1′), 114.0 (C-2′), 146.3 (C-3′), 150.6 (C-4′), 116.5 (C-5′), 119.7 (C-6′), 100.0 (C-1″), 73.6 (C-2″), 76.9 (C-3″), 70.0 (C-4″), 77.6 (C-5″), 61.1 (C-6″)。以上数据与文献报道[9]基本一致,故鉴定该化合物3为木犀草素-7-O-β-D-葡萄糖苷。
化合物4:淡黄色粉末。ESI-MSm/z: 463 [M+H]+, 461 [M-H]−。1H-NMR (400 MHz, DMSO-d6) δ: 13.04 (1H, brs, 5-OH), 7.94 (1H, s, H-6′), 7.57 (1H, s, H-2′), 6.96 (1H, s, H-3), 6.90 (1H, s, H-5′), 6.86 (1H, s, H-8), 6.45 (1H, s, H-6), 5.07 (1H, s, H-1″), 3.89 (3H, s, -OCH3);13C-NMR (100 MHz, DMSO-d6) δ: 182.4 (C-4), 164.8 (C-2), 103.4 (C-3), 161.6 (C-5), 99.9 (C-6), 163.4 (C-7), 95.3 (C-8), 157.4 (C-9), 105.8 (C-10), 121.3 (C-1′), 110.7 (C-2′), 148.8 (C-3′), 151.3 (C-4′), 116.5 (C-5′), 121.2 (C-6′), 100.4 (C-1″), 73.6 (C-2″), 77.6 (C-3″), 70.1 (C-4″), 76.9 (C-5″), 61.1 (C-6″), 56.4 (-OCH3)。以上数据与文献报道[10]基本一致,故鉴定化合物4为柯伊利素-7-O-β-D-葡萄糖苷。
化合物5:淡黄色粉末。1H-NMR (400 MHz, DMSO-d6) δ: 12.97 (1H, s, 5-OH), 7.96 (2H, d, J=8.0 Hz, H-2′, 6′), 6.94 (2H, d, J=7.6 Hz, H-3′, 5′), 6.87 (1H, s, H-3), 6.83 (1H, s, H-8), 6.45 (1H, s, H-6), 5.06 (1H, s, H-1″), 3.18~5.40 (5H, m, sugar protons)。13C-NMR (100 MHz, DMSO-d6) δ: 164.8 (C-2), 103.6 (C-3), 182.5 (C-4), 161.6 (C-5), 100.0 (C-6), 163.4 (C-7), 95.3 (C-8), 157.4 (C-9), 105.8 (C-10), 121.5 (C-1′), 129.1 (C-2′, 6′), 116.5 (C-3′, 5′), 151.6 (C-4′), 100.4 (C-1″), 73.6 (C-2″), 76.9 (C-3″), 70.0 (C-4″), 77.6 (C-5″), 61.1 (C-6″)。以上数据与文献报道[11]基本一致,故鉴定化合物5为芹菜素-7-O-β-D-葡萄糖苷。
化合物6:淡黄色粉末。1H-NMR (400 MHz, DMSO-d6) δ: 12.97 (1H, s)提示该化合物存在5-OH结构,10.02 (1H, brs, 3′-OH), 7.59 (2H, s, H-2′, 6′), 7.00 (1H, s, H-5′), 6.95 (1H, s, H-3), 6.87 (1H, s, H-8), 6.45 (1H, s, H-6), 5.07 (1H, s, H-1″), 3.89 (3H, s, 4′-OCH3);13C-NMR (100 MHz, DMSO-d6) δ: 163.5 (C-2), 103.9 (C-3), 182.5 (C-4), 157.4 (C-5), 100.0 (C-6), 164.6 (C-7), 95.5 (C-8), 161.6 (C-9), 105.8 (C-10), 121.0 (C-1′), 116.3 (C-2′), 148.5 (C-3′), 151.4 (C-4′), 110.8 (C-5′), 121.8 (C-6′), 56.5 (-OCH3), 100.5 (C-1″), 73.6 (C-2″), 76.9 (C-3″), 70.1 (C-4″), 77.7 (C-5″), 61.1 (C-6″)。以上数据与文献报道[12]基本一致,故鉴定化合物6为香叶木素-7-O-β-D-葡萄糖苷。
化合物7:黄色粉末。1H-NMR (400 MHz, DMSO-d6) δ: 7.57 (2H, s, H-2′, 6′), 6.84 (1H, d, J=8.4 Hz, H-5′), 6.38 (1H, s, H-8), 6.18 (1H, s, H-6), 5.45 (1H, s, H-1″), 3.09~3.60 (6H, m, sugar protons);13C-NMR (100 MHz, DMSO-d6) δ: 156.6 (C-2), 133.7 (C-3), 177.8 (C-4), 161.7 (C-5), 99.3 (C-6), 164.4 (C-7), 94.0 (C-8), 156.8 (C-9), 104.3 (C-10), 122.1 (C-1′), 115.7 (C-2′), 145.3 (C-3′), 149.0 (C-4′), 116.6 (C-5′), 121.6 (C-6′), 101.4 (C-1″), 74.6 (C-2″), 77.0 (C-3″), 70.4 (C-4″), 78.0 (C-5″), 61.5 (C-6″)。以上数据与文献报道[13]基本一致,故鉴定化合物7为槲皮素-3-O-β-D-葡萄糖苷。化合物1~7化学结构见图 1。
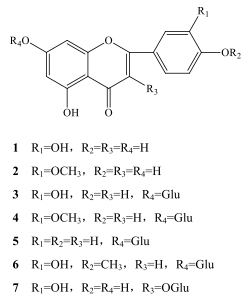
|
图 1 栝楼雄株茎叶中7种黄酮类化合物的结构 Fig.1 Structures of compounds 1-7 from stems and leaves of male T. kirilowii |
4 清除DPPH自由基实验
根据Akhavan等[14]报道的方法并稍作改动,准确称取2.0 mg DPPH溶解定容于50 mL量瓶中,于冰箱中避光保存。将化合物1~7配成系列浓度梯度(1~200 μg/L),精密量取2 mL样品溶液加入10 mL具塞试管中,再加入2 mL DPPH溶液,于30 ℃恒温条件下避光反应30 min。反应结束后于517 nm波长下测定吸光度(A),重复3次取平均值(Ai)。同等质量浓度的抗坏血酸(Vc)溶液作为阳性对照。计算自由基清除率[15]。

|
A0为2 mL DPPH+2 mL甲醇的A值,Aj为2 mL样品溶液+2 mL甲醇的A值
5 结果7种黄酮类化合物对DPPH自由基的清除作用见图 2。
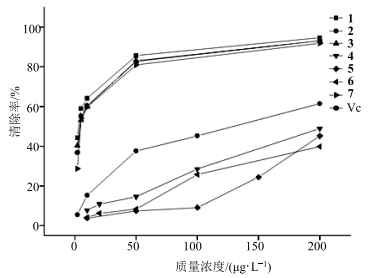
|
图 2 7种黄酮类化合物对DPPH自由基的清除效果比较 Fig.2 Effects of seven flavonoids on scavenging DPPH |
由图 2可以看出,7种黄酮类化合物在1~200 μg/L内对DPPH自由基均有清除作用,且随浓度升高,清除作用增强。以半数抑制浓度(IC50)比较,分析各化合物清除DPPH自由基能力,7种黄酮类化合物清除DPPH自由基能力依次为1(IC50=3.1 μg/L)>3(IC50=4.2 μg/L)>7(IC50=5.7 μg/L)>2(IC50=113.0 μg/L)>4(IC50=279.0 μg/L)>6(IC50=358.9 μg/L)>5(IC50=416.1 μg/L)。其中化合物1、3和7清除DPPH自由基能力明显强于另外4个黄酮单体,化合物1和3的清除能力甚至强于Vc(IC50=4.4 μg/L)。
6 讨论Patel等[16]认为植物中黄酮类化合物是一种广泛存在的、潜在的抗氧化剂。而DPPH法稳定性好,灵敏度高且操作简单,常用于评价化合物和植物提取物的抗氧化活性[17]。因此,本实验采用DPPH法对从栝楼雄株茎叶中分离得到的7种黄酮单体进行了体外抗氧化活性比较,初步探究其清除DPPH自由基能力与化学结构的关系。
在本实验条件下,7种黄酮类化合物均能清除DPPH自由基,但清除能力存在差异,这与化合物本身结构密切相关。从结构上看,木犀草素、木犀草素-7-O-β-葡萄糖苷及槲皮素-3-O-β-葡萄糖苷结构上均具有B环3′、4′邻二羟基,DPPH自由基清除能力明显强于其他4种黄酮结构,提示B环3′、4′邻二羟基结构存在时黄酮物质清除DPPH自由基能力较强,是黄酮类物质清除DPPH自由基的主要活性部位[18]。但对于3′, 4′-OH何者更为重要存在争议,Birt等[19]认为4′-OH为强抗氧化基团,是决定抗氧化性强弱的第1位因素;而Miyake等[20]则认为3′-OH尤为重要,若只有4′-OH则对抗氧活性无贡献,本实验中芹菜素-7-O-β-葡萄糖苷清除DPPH自由基能力明显弱于木犀草素-7-O-β-葡萄糖苷,而芹菜素-7-O-β-葡萄糖苷在结构上仅缺少3′-OH,这与Miyake的观点一致。同时,木犀草素-7-O-β-葡萄糖苷与香叶木素-7-O-β-D-葡萄糖苷清除能力比较发现,香叶木素-7-O-β-D-葡萄糖苷清除DPPH能力明显弱于前者,而在结构上仅区别在B环4′位,提示4′羟基甲氧基化会使其清除DPPH自由基能力减弱,这与文献报道[21]相一致;比较木犀草素-7-O-β-葡萄糖苷与柯伊利素-7-O-β-葡萄糖苷,可发现3′羟基甲氧基化同样会降低其清除自由基作用,但降低强度低于4′羟基甲氧基化的黄酮。另外,木犀草素和木犀草素-7-O-β-葡萄糖苷比较显示,A环7位羟基糖基化后其清除DPPH自由基能力有所下降,考虑为糖基化增加了化合物的空间位阻,导致其清除DPPH能力减弱。
| [1] | 中国药典[S].一部. 2015 |
| [2] | 李爱峰, 张永清. 栝楼的化学成分研究进展[J]. 安徽农业科学 , 2012, 40 (30) :14713–14716. |
| [3] | 徐礼英, 张小平, 蒋继宏. 栝楼子挥发油的成分分析及其生物活性的初步研究[J]. 中国实验方剂学杂志 , 2009, 15 (8) :38–43. |
| [4] | 滕勇荣, 张永清. 瓜蒌化学成分研究进展[J]. 山东中医药大学学报 , 2011, 35 (1) :85–86. |
| [5] | 赵启韬, 孟冰雪, 黄臻辉, 等. 不同品系栝楼果皮抗心肌梗死药效学比较研究[J]. 药物评价研究 , 2013, 36 (2) :95–99. |
| [6] | 宁志怨, 董玲, 李卫文, 等. 栝楼性别的分化与鉴定研究进展[J]. 江苏农业科学 , 2014, 42 (8) :4–6. |
| [7] | 杨泰然, 徐广涛, 徐晓雪, 等. 小蓟化学成分的分离与鉴定[J]. 沈阳药科大学学报 , 2015, 32 (6) :419–423. |
| [8] | 孙晓业, 吴红华, 付爱珍, 等. 瓜蒌的化学成分研究[J]. 药学学报 , 2012, 47 (7) :922–925. |
| [9] | 张金杰, 陈宇峰, 颜鸣, 等. 野菊花中的黄酮类化学成分[J]. 医药导报 , 2013, 32 (1) :15–18. |
| [10] | 郗峰.藏药短管兔耳草的化学成分研究[D].重庆:西南大学, 2009. |
| [11] | Ma Y M, Zhang Z W, Feng C L. Flavonoids of Broussonetia papyrifera[J]. Chem Nat Compd , 2009, 45 (6) :881–882. DOI:10.1007/s10600-010-9480-1 |
| [12] | 李爱峰, 孙爱玲, 柳仁民, 等. 栝楼果皮化学成分研究[J]. 中药材 , 2014, 37 (3) :428–431. |
| [13] | 才谦, 王灵芝, 刘玉强, 等. 齿叶白鹃梅叶化学成分研究[J]. 中草药 , 2012, 43 (4) :673–675. |
| [14] | Malihe A, Sajjad J, Ali S. Studies on the antioxidant and antimicrobial activity and flavonoid derivatives from the fruit of Trigonosciadium brachytaenium (Boiss.) Alava[J]. Ind Crop Prod , 2015, 63 (3) :114–118. |
| [15] | 董蒙蒙, 喻樊, 刘佳, 等. 中华补血草5种黄酮类化合物抗氧化和抗肿瘤活性的比较[J]. 江苏农业科学 , 2015, 43 (2) :297–299. |
| [16] | Patel R P, Boersma B J, Carwford J H, et al. Antioxidant mechanisms of isoflavones in liquid systems:paradoxical effects of peroxyl radical scavenging[J]. Free Radic Biol Med , 2001, 31 (12) :1570–1581. DOI:10.1016/S0891-5849(01)00737-7 |
| [17] | 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学 , 2014, 35 (9) :317–322. |
| [18] | 王婷, 张金超, 陈瑶, 等. 6种淫羊藿黄酮抗氧化和抗肿瘤活性的比较[J]. 中国中药杂志 , 2007, 32 (8) :715–718. |
| [19] | Birt D F, Hendrich S, Wang W. Dietary agents in cancerprevention:flavonoidsand isoflavonoids[J]. Pharmacol Ther , 2001, 90 (2/3) :157–177. |
| [20] | Miyake T, Shimoto T. Antioxidant activities of natural compounds found in plants[J]. Agric Food Chem , 1997, 45 (5) :1819–1822. DOI:10.1021/jf960620c |
| [21] | 邹淑君, 许树军, 付起风, 等. 三种黄酮清除自由基活性的研究[J]. 化学工程师 , 2015, 29 (5) :4–7. |
 2016, Vol. 47
2016, Vol. 47


