乌头属Aconitum L.植物属于毛茛科(Ranunculaceae),全世界约有350种,广泛分布于北半球温带地区。中国有200多种,主要分布于西南地区[1-2]。中药材川乌、草乌、甘青乌头、附子、关白附、雪上一枝蒿的原植物等都为该属植物,其中川乌、草乌、附子作为临床常用药物,被《中国药典》2015年版收录。乌头在蒙、藏医中均为常用药材。乌头类中药多功强效捷,尤其是在危重病症的抢救和慢性顽病痼疾、疑难病证治疗中显示出独特疗效,自古至今一直为临床广泛应用。但是,由于其含有毒性强烈的二萜类双酯型生物碱,乌头类中药毒性极大,未经炮制或炮制不当服用均可出现中毒,重者会导致死亡[3]。因此,乌头类中药是目前临床应用广泛,且具有代表性的一类有毒中药。乌头生品中主要的毒性成分和有效成分均为二萜类生物碱,由于其治疗窗狭窄,临床使用大大受限,因使用方式不当或错误的进补方式导致的安全性事件时有发生[4]。
乌头始载于《神农本草经》:“其汁煎之、名射周,杀禽兽”,被列为下品,其性刚烈迅捷,以后历代医家及本草著作称乌头“有毒”,用之不当,易出现严重的毒副作用。《本草纲目》中记载:“草乌头、射罔,乃至毒之药。非若川乌头、附子人所栽种,加以酿制,杀其毒性之比。自非风顽急疾,不可轻投。”可见早在几千年前,古人对乌头类中药的毒性就有明确的认识。唯有正确认识乌头毒性,用合适的方法去应用它,才能让乌头类中药安全可控的发挥其药用价值。因此对其毒性及相关机制的研究一直是乌头类中药研究的重要方向。本文通过对乌头类中药化学成分、急性毒性、毒性及其机制等研究现状进行总结,为其临床安全使用提供参考。
1 与毒性相关的化学成分研究乌头属植物的主要化学成分是二萜类生物碱,根据其骨架碳原子数目及其类型结构上的差异,可以分为4大类:C20、C19、C18-二萜生物碱和双二萜生物碱。其中C19-二萜生物碱中的乌头碱型生物碱是目前研究最多的一类生物碱,也是最具毒性的植物成分之一[5]。按照取代基的不同乌头碱型生物碱又可分为双酯型二萜生物碱、单酯型二萜生物碱和醇胺型二萜生物碱[6],三者的毒性大小顺序:双酯型>单酯型>醇胺型。药材中较重要、量较高且研究报道最多的3种C19-二萜生物碱为乌头碱(aconitine)、新乌头碱(mesaconitine)、次乌头碱(hypaconitine),都属于双酯型二萜生物碱。3种双酯型二萜生物碱均含有剧毒,是乌头类中药的主要毒效成分,其中乌头碱毒性最强。小鼠ig给药,三者半数致死量(LD50)值分别为1.0~1.8、1.9、5.8 mg/kg[7]。
双酯型二萜生物碱性质不稳定,遇水、加热易被水解或分解,其C-8位上的乙酰基水解或分解,失去一分子醋酸,得到相应的苯甲酰单酯型生物原碱,即苯甲酰乌头原碱(benzoylaconine)、苯甲酰新乌头原碱(benzoylmesaconine)、苯甲酰次乌头原碱(benzoylhypaconine),其毒性为双酯型二萜生物碱的1/200~1/500。再进一步水解,使C-14位上的苯甲酰基水解或分解,失去一分子苯甲酸,得到亲水性氨基醇类乌头原碱,即乌头原碱(aconine)、新乌头原碱(mesaconine)、次乌头原碱(hypaconine),其毒性仅为双酯型二萜生物碱的1/2 000~1/4 000。因此乌头类中药在炮制过程中加水、加热处理,都能促进双酯型二萜生物碱水解(图 1),使其结构发生变化,起到减毒的效果。
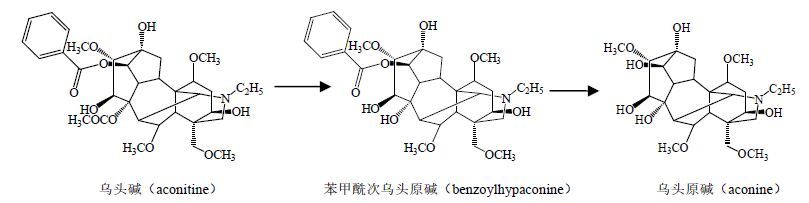
|
图 1 乌头碱的2步水解过程 Fig.1 Exampleof two-steps hydrolysis |
2 急性毒性研究
乌头类中药生品毒性较大,误服或过量服用极易导致中毒。所含有主要成分乌头碱、次乌头碱与新乌头碱毒性极大,但同时也是其有效成分。根据乌头碱、新乌头碱和次乌头碱不同给药途径的小鼠LD50值测定结果,三者急性毒性大小为乌头碱≈新乌头碱>次乌头碱。乌头经炮制加工或煎煮过程,水解后形成的苯甲酰乌头原碱、苯甲酰新乌头原碱、苯甲酰次乌头原碱急性毒性大大降低。部分二萜类生物碱对小鼠的急性毒性实验结果[4, 8-9]见表 1。
|
|
表 1 部分二萜类生物碱的急性毒性实验结果 Table 1 Acute toxicity tests for diterpenoid alkaloids in mice |
乌头类药材以雪上一枝蒿毒性最剧烈,是川乌、草乌毒性的几十倍。草乌的毒性大于川乌,附子为川乌的子根加工品,其毒性小于川乌。草乌、川乌和附子LD50值[11]分别为292.38、3 300、11 301 mg/kg。乌头类药材经炮制后急性毒性显著降低,可供内服。刘帅等[12]进行了草乌及其炮制品的急性毒性实验研究,结果表明,生草乌LD50值为700.9 mg/kg,按《中国药典》方法炮制后毒性减小,无法测出LD50值,其粉末和水煎液的最大给药量分别为20和64 g/kg。各组小鼠从ig后5 min均开始出现不同程度的出汗、腹泻、口吐白沫、运动不协调、呼吸急促或呼吸困难、痉挛、僵直、大小便失禁等中毒症状,抽搐,直至死亡。解剖死亡小鼠可见肺部有不同程度水肿,胃胀、部分肠管充盈,心肌肥大,肝脏发黑。附子药用有3种规格,分别为盐附子、黑附片和白附片。柴玉爽等[11]从毒效角度出发,比较附子3种饮片规格毒性大小,结果表明白附片和黑顺片毒性较小,其最大给药剂量均为20.52 g/kg,盐附子毒性较大,LD50为11.301 g/kg;临床安全指数由大到小依次为黑顺片>白附片>盐附子。
张少华等[13]以川乌与防己配伍(乌防)前后的水煎液分别ig小鼠,其中乌防1∶1组和乌防1∶2组LD50明显大于川乌单煎组(P<0.05、0.01),表明防己与川乌配伍能降低川乌的毒性。川乌与白芍配伍后,不同比例水煎液LD50值均大于川乌单煎液(P<0.01),表明川乌与白芍配伍能降低川乌的毒性[14]。通过平行比较附子和附子配伍不同比例甘草的LD50和半数中毒量(TD50),结果表明,当附子甘草配伍比例为1∶1和1∶3时,附子LD50和TD50增大[15]。附子配伍不同比例防风、黄芪后,附子的LD50和TD50也得到不同程度地提高,且减毒作用与药物的配伍比例有关[16]。以上结果说明相杀、相畏配伍是我国古代先贤在应用有毒中药过程中实践的总结,具有一定的科学性。3种乌头经炮制或配伍后对小鼠的急性毒性实验结果见表 2。
|
|
表 2 炮制或配伍对3种乌头急性毒性的影响 Table 2 Acute toxicity tests for processing or compatibility of three species of Aconitum L. in mice |
3 毒性与相关机制
乌头类中药的主要毒性来源于3种双酯型二萜生物碱,其毒性作用主要是影响中枢神经系统、心脏和肌肉组织。其中损害心脏是乌头碱中毒最重要、最多见的危险因素。现代研究表明,乌头类生物碱的毒理学机制主要包括影响电压依赖性钠离子通道、调节神经递质释放、促进脂质过氧化作用和诱导细胞凋亡等[18]。乌头碱可使中枢神经系统及周围神经先兴奋后麻痹,阻止冲动的发生和传导,出现一系列胆碱能神经毒蕈碱(M)样症状和烟碱(N)样症状,因而使心率变慢、心律不齐、血压下降[19]。此外乌头碱可直接作用于心肌细胞,使心室内异位起博点的兴奋性增高和产生折返激动,形成单源或多源多形室性早搏、室性心动过速、心室颤动等[20]。乌头类中药中毒表现为唇、舌、颜面、四肢麻木及流涎、呕吐、烦躁、心慌、心率减慢或心动过速、肤冷、血压下降、早期瞳孔缩小后放大、肌肉强直、呼吸痉挛、窒息而危及生命。
3.1 心脏毒性乌头类中药的心脏毒性主要是由于乌头碱中毒引起。目前,通过离子通道、细胞酶学、离子信号变化、DNA损伤以及蛋白表达等方面的研究,对乌头碱的心肌细胞毒性及其作用机制研究取得了一定的进展(表 3)。心律失常是乌头碱中毒的最典型、最主要的临床表现[20],但其作用机制较为复杂。现代研究表明,乌头碱诱导心律失常与乌头碱破坏细胞内Ca2+稳态[21],激活内质网钙释放通道兰尼碱受体(RyR2)[23],抗胆碱和阻断迷走神经特征[10],影响K+、Na+通道[34]、促进脂质体过氧化反应[29]等有关。此外,乌头碱可诱导Cx43蛋白在特定位点脱磷酸化可能是其心肌细胞毒性的重要环节[32]。乌头碱可抑制一系列呼吸酶的活性,造成心肌细胞能量代谢障碍[25-28],推测乌头的心脏毒性可能与心肌细胞能量代谢有关。
|
|
表 3 乌头类生物碱心肌细胞毒性及机制 Table 3 Cytotoxicity and mechanism of alkaloids in plants of Aconitum L. on cardiac muscle cells |
3.2 神经毒性
乌头类中药及其生物碱神经毒性及其机制研究近几年也取得了一定进展(表 4)。乌头碱、次乌头碱可使离体大鼠膈肌-膈神经肌肉阻滞,其机制主要是神经复合动作电位被阻断所致[39]。Peng等[40]用乌头碱作用于星形间质细胞(ICC),发现细胞膜完整性受到损伤,导致细胞内Na+、K+、Ca2+离子溢出和Na+,K+-ATP酶失活,其主要机制可能是离子紊乱导致细胞呼吸链中断,使无氧呼吸增加和糖原大量分解,最终造成细胞的能量代谢阻塞而受到损伤。韩屾等的研究表明,乌头类中药在大鼠整体动物试验中未见神经毒性作用,但在海马神经元体外培养模型中,表现出神经毒性,这可能与血脑屏障及体内代谢有关。生川乌明显影响小鼠黏着斑(Focal adhesion)通路中的黏附素(ECM)、局部黏附激酶(FAK)和GTP结合蛋白(Cdc42)等关键基因,推测生川乌可能是通过影响小鼠Focal adhesion信号通路的关键基因而引起毒性,最终导致毒性的产生。严光焰等[47]研究发现生川乌对小鼠的肌耐力无明显影响,但剂量为生药27.6 g/kg时,可影响小鼠记忆获得能力以及抑制小鼠的自发活动,所以生川乌对小鼠神经行为仍有不良影响。
|
|
表 4 乌头类中药及其生物碱神经毒性及机制研究 Table 4 Neurotoxicity and mechanism of plants in Aconitum L. and its main alkaloids |
3.3 生殖毒性
乌头碱各剂量组对大鼠睾丸间质细胞均无明显毒性作用[48],但高剂量乌头碱(5、50 µg/mL)对大鼠睾丸支持细胞具有一定的毒性作用,可抑制大鼠睾丸支持细胞的增殖,降低其对乳酸分泌的刺激作用[49]。张建军[50]研究了盐附子、生川乌、生草乌及其主要毒性成分乌头碱的生殖毒性,发现在体内它们对雄性大鼠性腺无明显毒性作用;体外实验,乌头碱各剂量组(50、500、5×103、5×104 ng/mL)对Leydig细胞无明显毒性作用;仅高剂量乌头碱(5、50 µg/mL)对Sertoli细胞具有一定毒性作用。
3.4 胚胎毒性Xiao等[51]将大鼠胚胎在发育关键时期分离出来暴露于不同浓度的乌头碱下,发现2.5 mg/L乌头碱即可影响胚胎的生长发育,主要表现为冠臂和头部长度的减少、体节数下降、身体形态改变;当乌头碱浓度上升到5 mg/L时会引起胚胎严重畸形,包括心脏缺损(如心血管的黏连和心包腔的膨大)、体节不规则、脑畸变等。刘强强等[52]研究乌头碱对体外培养的大鼠卵巢颗粒细胞的毒性,发现乌头碱浓度高于5 mg/L时,对雌性大鼠卵巢颗粒细胞有毒性作用,主要表现为抑制颗粒细胞的增殖及对细胞的氧化损伤作用。肖凯[53]研究了盐附子、生川乌、生草乌及乌头碱的胚胎发育毒性及其作用机制,结果发现生草乌8.39 g生药/kg出现胎鼠身长减小、胸骨骨化数减少,显示出一定的胚胎毒性。在体外胚胎培养实验中,生草乌>1.25 mg/mL和乌头碱>2.5 μg/mL对大鼠胚胎具有明显胚胎毒性和致畸性。并认为生草乌和乌头碱对脏层卵黄囊(VYS)结构破坏和功能的干扰可能是其胚胎发育毒性的重要机制之一。在尚未明确乌头类中药对人体胚胎发育的影响之前,建议孕妇在妊娠期间应慎用乌头类中药,避免对胚胎发育产生毒性作用。
4 展望乌头类中药川乌、草乌、附子等为临床常用药,但由于其毒性较大,一般需炮制后方可供内服使用。乌头经蒸、煮等方法加工处理过程,所含剧毒的双酯型生物碱水解,转化成毒性较小的苯甲酰单酯型生物碱;再进一步将苯甲酰基水解,失去一分子苯甲酸,得到几乎无毒性的乌头原碱,既降低了剧毒双酯型生物碱的量,新转化的单酯型生物碱又保留了部分功效,从而达到减毒存效的目的。在炮制过程中,大量的生物碱类成分流失。乌头类中药服用方式多要求先煎久煎,进一步降低汤液中双酯型生物碱的量,保证了临床用药的安全性。乌头类中药经炮制和煎煮后毒性降低,临床使用安全范围增大。然而,由于乌头生物碱类成分即是有毒成分也是有效成分,量降低导致毒性大大减少的同时,疗效也降低[54-55]。因此,如何保证乌头类药物临床使用的安全、有效、可控是亟待解决的问题。
对乌头类中药的毒性及其机制进行深入研究和总结,从不同的角度揭示乌头毒性机制,阐明乌头类中药毒性的现代科学内涵,可以更加有效地指导乌头的合理安全应用及进一步研究。对乌头类中药炮制配伍减毒的合理性及内在科学机制做深入探索,弄清其主要成分及水解产物的比例与毒-效之间的谱效关系[56],进一步阐释乌头炮制或配伍应用的“减毒存效”机制。最后,结合传统经验与HPLC、LC-MSn,MIR等现代分析技术,建立更加科学合理的质量控制及评价标准,大大促进乌头类中药的现代化研究,使其更加合理科学地应用于临床,使有毒中药发挥更大的价值。
| [1] | 傅立国, 陈谭清. 中国高等植物(第3卷)[M]. 青岛: 青岛出版社, 2000 . |
| [2] | Sun X J, Liu T T, Zhao Y L, et al. Toxicity of five herbs in Aconitum L. on Tetrahymena thermophila based on spectrum-effect relationship[J]. Chin Herb Med , 2014, 6 (1) :29–35. DOI:10.1016/S1674-6384(14)60003-4 |
| [3] | 姚琪. 乌头类药物的临床应用及毒性分析[J]. 中国医药卫生 , 2005, 6 (9) :10. |
| [4] | Chan T Y K. Aconitum alkaloid poisoning related to the culinary uses of aconite roots[J]. Toxins , 2014, 6 (9) :2605–2611. DOI:10.3390/toxins6092605 |
| [5] | 高黎明, 魏小梅. 二萜类生物碱的药理作用及构效关系研究概况[J]. 西北师范大学学报:自然科学版 , 1999 (1) :98–103. |
| [6] | 包懿, 宋凤瑞, 刘志强, 等. 乌头碱类双酯型二萜生物碱水解反应的电喷雾质谱分析[J]. 质谱学报 , 2009, 30 (1) :1–5. |
| [7] | Singhuber J, Zhu M, Prinz S, et al. Aconitum in traditional Chinese medicine-A valuable drug or an unpredictable risk?[J]. J Ethnopharmacol , 2009, 126 (1) :18–30. DOI:10.1016/j.jep.2009.07.031 |
| [8] | 宋东江, 陆满文, 李汉青. 乌头碱类化合物毒理学研究概况[J]. 中国药理学通报 , 1989 (5) :272–274. |
| [9] | Zhou G, Tang L, Zhou X, et al. A review on phytochemistry and pharmacological activities of the processed lateral root of Aconitum carmichaelii Debeaux[J]. J Ethnopharmacol , 2014, 12 (160) :173–193. |
| [10] | Pa I Y. Peculiarities of cardiotropic effect of aconitine[J]. Bull Exp Biol Med , 2000, 129 (4) :365–366. DOI:10.1007/BF02439272 |
| [11] | 柴玉爽, 王玉刚, 花雷, 等. 附子乌头草乌及其炮制品的毒效比较[J]. 世界科学技术-中医药现代化 , 2011, 13 (5) :847–851. |
| [12] | 刘帅, 刘晓艳, 李妍, 等. 草乌及其炮制品的急性毒性实验研究[J]. 中国药物警戒 , 2015 (9) :513–516. |
| [13] | 张少华, 秦林, 王平. 防己对川乌急性毒性实验的影响[J]. 中国基层医药 , 2004, 11 (11) :1281–1282. |
| [14] | 秦林, 孙蓉. 白芍与川乌配伍前后急性毒性实验研究[J]. 山东中医药大学学报 , 2000, 24 (6) :453–455. |
| [15] | 张广平, 解素花, 朱晓光, 等. 附子相杀、相畏配伍减毒实验研究[J]. 中国中药杂志 , 2012, 37 (15) :2215–2218. |
| [16] | 张广平, 解素花, 朱晓光, 等. 附子甘草配伍减毒增效/存效实验研究[J]. 中国中医药信息杂志 , 2012, 19 (6) :31–34. |
| [17] | 乌兰其其格, 那生桑. 草乌炮制品的药理毒理及药效学实验研究[J]. 内蒙古医学院学报 , 2009, 31 (5) :482–486. |
| [18] | Fu M, Wu M, Qiao Y, et al. Toxicological mechanisms of Aconitum alkaloids[J]. Pharmazie , 2006, 61 (9) :735–741. |
| [19] | 马天宇, 俞腾飞, 李树民, 等. 乌头类中药毒代动力学及代谢组学研究进展[J]. 中国中药杂志 , 2014, 39 (11) :430–431. |
| [20] | 刘艳, 章诗伟, 周兰, 等. 乌头类生物碱对心肌的毒性作用及分子毒理学研究进展[J]. 中国法医学杂志 , 2009, 24 (6) :398–401. |
| [21] | Fu M, Wu M, Wang J F, et al. Disruption of the intracellular Ca2+, homeostasis in the cardiac excitation-contraction coupling is a crucial mechanism of arrhythmic toxicity in aconitine-induced cardiomyocytes[J]. Biochem Biophysic Res Commun , 2007, 354 (4) :929–936. DOI:10.1016/j.bbrc.2007.01.082 |
| [22] | Zhang S W, Liu Y, Huanga G Z, et al. Aconitine alters connexin43 phosphorylation status and Ca2+ oscillation patterns in cultured ventricular myocytes of neonatal rats[J]. Toxicol In Vitro , 2007, 21 (8) :1476–1485. DOI:10.1016/j.tiv.2007.06.013 |
| [23] | Min F, Li R X, Li F, et al. Sarcoplasmic reticulum Ca2+, release channel ryanodine receptor (RyR 2) plays a crucial role in aconitine-induced arrhythmias[J]. Biochem Pharmacol , 2008, 75 (11) :2147–2156. DOI:10.1016/j.bcp.2008.02.027 |
| [24] | Yamanaka H, Doi A, Ishibashi H, et al. Aconitine facilitates spontaneous transmitter release at rat ventromedial hypothalamic neurons[J]. Br J Pharmacol , 2002, 135 (3) :816–822. DOI:10.1038/sj.bjp.0704517 |
| [25] | 李宏, 陈念祖, 刘明俊. 大鼠乌头碱中毒心肌酶的细胞化学研究(II)——线粒体细胞色素C氧化酶(CCO)的定位[J]. 中国法医学杂志 , 1988 (4) :202–205. |
| [26] | 梁强荣, 刘明俊, 胡炳蔚. 大鼠乌头碱中毒心肌酶的研究(IV)——乳酸脱氢酶的组织化学和细胞化学定位[J]. 中国法医学杂志 , 1991 (3) :140–141. |
| [27] | 李宏, 刘明俊, 陈念祖. 大鼠乌头碱中毒心肌酶的细胞化学研究(I)——线粒体琥珀酸脱氢酶(SDH)的定位[J]. 中国法医学杂志 , 1988 (4) :199–201. |
| [28] | 梁强荣, 刘明俊, 胡炳蔚. 大鼠乌头碱中毒心肌酶的研究(III)——线粒体NADHD的组织化学和细胞化学研究[J]. 中国法医学杂志 , 1991 (2) :84–86. |
| [29] | Skrupsk iĭV A, Plaksin S E. Changes in the fatty acid composition of the phospholipids in the internal organs of rats during the modelling of aconitine arrhythmia[J]. Eksp Klin Farmakol , 1994, 57 (4) :53–55. |
| [30] | 苏平, 刘明俊. 大鼠乌头碱中毒心肌超微结构的改变[J]. 西安交通大学学报:医学版 , 1991 (4) :321–324. |
| [31] | 韩旭. 附子及新乌头碱致心律失常机制研究[D]. 石家庄:河北医科大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-11919-1011157905.htm |
| [32] | 章诗伟, 任杰林, 张黎, 等. 乌头碱对培养新生大鼠心室肌细胞Connexin43蛋白磷酸化的影响[J]. 中国法医学杂志 , 2008, 23 (2) :92–95. |
| [33] | Sun G B, Sun H, Meng X B, et al. Aconitine-induced Ca2+ overload causes arrhythmia and triggers apoptosis through p38 MAPK signaling pathway in rats[J]. Toxicol Appl Pharmacol , 2014, 279 (1) :8–22. DOI:10.1016/j.taap.2014.05.005 |
| [34] | Suzuki K, Matsumoto A, Nishida H, et al. Termination of aconitine-induced atrial fibrillation by the KACh-channel blocker tertiapin:underlying electrophysiological mechanism[J]. J Pharmacol Sci , 2014, 125 (4) :406–414. DOI:10.1254/jphs.14023FP |
| [35] | Zhou Y H, Piao X M, Liu X, et al. Arrhythmogenesis toxicity of aconitine is related to intracellular Ca2+ signals[J]. Int J Med Sci , 2013, 10 (9) :1242–1249. DOI:10.7150/ijms.6541 |
| [36] | 李志勇. 附子成分次乌头碱心脏毒性及中毒机制研究[D]. 北京:北京中医药大学, 2008. http://www.oalib.com/references/16980798 |
| [37] | Onur R, Bozdagi O, Ayata C. Effects of aconitine on neurotransmitter release in the rat neuromuscular junction[J]. Neuropharmacology , 1995, 34 (9) :1139–1145. DOI:10.1016/0028-3908(95)00050-G |
| [38] | 雷怀成, 向文采, 石亮. 乌头碱中毒后脑神经细胞凋亡的实验研究[J]. 山东医药 , 2006, 46 (27) :21–22. |
| [39] | Muroi M, Kimura I, Kimura M. Blocking effects of hypaconitine and aconitine on nerve action potentials in phrenic nerve-diaphragm muscles of mice[J]. Neuropharmacology , 1990, 29 (6) :567–572. DOI:10.1016/0028-3908(90)90069-4 |
| [40] | Peng C, Wang L, Wang Y H, et al. The toxicity of aconitine, emodin on ICC cell and the anagonist effect of the compatibility[J]. Eur J Drug Metab Pharm , 2009, 34 (34) :213–220. |
| [41] | Peng C, Zheng T, Yang F, et al. Study of neurotoxic effects and underlying mechanisms of aconitine on cerebral cortex neuron cells[J]. Arch Pharm Res , 2009, 32 (11) :1533–1543. DOI:10.1007/s12272-009-2105-1 |
| [42] | 严妍, 杨茂, Wolf-dieterRausch, 等. 乌头碱对胎鼠中脑多巴胺能神经元细胞的神经毒性作用[J]. 江苏大学学报:医学版 , 2013, 23 (3) :212–215. |
| [43] | 韩屾. 三种乌头类中药神经毒性体内外实验研究[D]. 成都:四川大学, 2007. http://www.oalib.com/references/16986125 |
| [44] | 张仲林, 彭成, 刘宏伟. 生川乌对小鼠Focaladhesion信号通路毒性影响的实验研究[J]. 中草药 , 2009, 40 (1) :75–78. |
| [45] | 赵正航, 徐长福. 川乌对犬脊髓运动神经元损害的实验研究[J]. 西安交通大学学报:医学版 , 2000, 21 (1) :24–25. |
| [46] | 韩屾, 吕雷, 王汉蓉, 等. 3种乌头类中药在大鼠体内外的神经毒性[J]. 华西药学杂志 , 2007, 22 (3) :286–288. |
| [47] | 严光焰, 何晓娟, 王冲, 等. 生川乌对小鼠神经行为的影响[J]. 现代预防医学 , 2008, 35 (11) :2026–2027. |
| [48] | 潘黎, 张建军, 卢豪, 等. 乌头碱对大鼠睾丸间质细胞的毒性研究[J]. 癌变·畸变·突变 , 2008, 20 (3) :231–234. |
| [49] | 张建军, 王衍堂, 王金勇, 等. 乌头碱对大鼠睾丸支持细胞的毒性研究[J]. 现代预防医学 , 2007, 34 (7) :1221–1223. |
| [50] | 张建军. 乌头类中药雄性大鼠生殖毒性体内外试验研究[D]. 成都:四川大学, 2007. |
| [51] | Xiao K, Wang L, Liu Y, et al. Study of aconitine toxicity in rat embryos in vitro[J]. Birth Defects Res Part B Dev Reprod Toxicol , 2007, 80 (3) :208–212. DOI:10.1002/(ISSN)1542-9741 |
| [52] | 刘强强, 何晓娟, 严光焰, 等. 乌头碱对大鼠卵巢颗粒细胞毒性研究[J]. 现代预防医学 , 2010, 37 (2) :299–301. |
| [53] | 肖凯. 乌头类中药大鼠胚胎发育毒性体内外试验研究[D]. 成都:四川大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10610-2006188139.htm |
| [54] | 杨蕾, 陈裕明. 川乌饮片急毒及药效学的实验比较[J]. 北京中医药大学学报 , 1997 (2) :20–21. |
| [55] | 李志勇, 张硕峰, 畅洪昇, 等. 不同炮制时间附子饮片双酯型生物碱含量变化与饮片安全的相关性研究[J]. 中国中药杂志 , 2009, 34 (9) :1086–1089. |
| [56] | 吴环宇, 许妍妍, 卢志强, 等. 黑顺片血浆指纹图谱与抗心衰作用的谱效关系研究[J]. 中草药 , 2015, 46 (6) :861–865. |
 2016, Vol. 47
2016, Vol. 47


