2. 北京中医药大学 中药现代研究中心, 北京 100029
2. Modern Research Center for Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
植物在生长发育过程中会受到各种生物胁迫和非生物胁迫的影响,植物通过调节生理生化、表达胁迫响应基因等方式适应生存环境,而热激蛋白是其中最重要的胁迫响应蛋白家族之一[1-2]。植物中的热激蛋白根据相对分子质量可以分为5个家族:HSP110、HSP90、HSP70、HSP60,小分子HSPs(1.5×104~3.0×104),它们分布在细胞的各个部分,在植物胁迫如高温、低温、高盐中起到重要作用,其中量最丰富的是小分子热激蛋白(small heat shock proteins,sHSPs)[1, 3]。sHSPs是生物体内广泛存在的一类蛋白,在结构上高度保守,具有分子伴侣、保护mRNA、耐热性、耐冷性、降低细胞内的活性氧等功能,是植物响应生物胁迫和非生物胁迫的重要蛋白,因此对sHSPs的研究有利于培育抗逆、抗病品种和丰富植物防御反应机制,但是目前关于sHSPs的研究相对较少[4-6]。盐胁迫影响植物产量、蛋白质合成和光合作用及能量代谢[7];而脱落酸(abscisic acid,ABA)是调控植物生长发育(如种子休眠与萌发、幼苗生长、侧根发育、果实成熟与衰老等)和响应生物或非生物胁迫(如病原菌、干旱、高盐等)的重要激素之一[8],外源水杨酸(salicylic acid,SA)处理可诱导植物对多种病病毒、细菌、真菌的抗性,能对植物生长产生抑制作用;茉莉酸甲酯(methyl jasmonate,MJ)是高等植物体内的内源生长调节物质,具有广泛的生理功能。因此研究sHSPs在盐胁迫和经过外源ABA、SA、MJ处理的表达差异,有利于阐明sHSPs的功能和植物防御反应机制。
白木香Aquilaria sinensis (Lour.) Gilg是我国生产名贵芳香类药材沉香的唯一正品植物来源,现已被列为国家二级濒危保护植物[9]。沉香是白木香含树脂的木材,作为我国传统中药,沉香具有行气止痛、温中止呕、纳气平喘等功效,用于治疗胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急[10]。沉香临床应用广泛,具有消化系统和中枢神经系统保护等药理作用。沉香是独有龙涎香与檀香混合物香味的一种香料,融合动物界与植物界的精华,至今仍旧无法复制这种香味,因而极其珍贵,我国的药用沉香主要依赖进口,价格昂贵[11]。健康的白木香植物并不产生沉香,只有受到物理伤害和化学伤害时,沉香才会在白木香植物中逐渐形成,但是物理伤害和化学伤害诱导沉香形成的分子机制一直没有清晰揭示,严重制约了高效结香技术的建立[12]。当植物受到伤害时,植物自身产生防御反应,而sHSPs蛋白是植物防御反应中最重要的蛋白家族之一[4-6],因此通过研究sHSPs的结构、表达方式有助于阐明白木香中沉香形成机制。本研究通过高通量测序获得2个sHSP18.1基因的cDNA全长序列,并对其序列特征进行了生物信息学分析,通过荧光定量PCR技术分析其在不同组织中的表达差异,并研究其在受到高盐和外源ABA、SA、MJ处理不同时间的愈伤组织中的表达及积累情况,为进一步研究沉香结香机制及丰富植物的防御反应机制奠定基础。
1 材料样品由广州移植,现种植于北京中医药大学中药现代研究中心2年的白木香,经北京中医药大学中药现代研究中心屠鹏飞教授鉴定为瑞香科(Thymelaeaceae)植物白木香Aquilaria sinensis (Lour.) Gilg。采集冬季12月份白木香的根、茎、叶提取总RNA,检测sHSP18.1基因在不同组织中的特异性表达。将白木香叶诱导产生的愈伤组织进行200 mmol/L NaCl处理以及100 μmol/L ABA、SA、MJ处理,于处理后的0、12、24、36、48 h取样,提取总RNA,检测白木香在不同胁迫下的特异性表达量。
2 方法 2.1 白木香总RNA的提取和cDNA合成按照EASYspin Plus植物RNA快速提取试剂盒(Aidlab,中国)实验操作步骤进行植物总RNA提取,利用NanoDrop 2000C检测RNA浓度,同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。利用Sigma 公司的反转录酶M-MLV将白木香的总RNA反转录为第一链(cDNA),反转录的条件按照说明书进行。
2.2 白木香sHSP1和sHSP2基因序列全长克隆从白木香转录组高通量测序结果中获得2个由表达序列标签拼接而成的序列,经注释分析发现为具有完整开放阅读框的sHSP基因,2个基因的开放阅读框为474 bp,基因序列相似性为90.08%,定名为sHSP1和sHSP2。依据2端序列利用Primer软件设计两对引物,序列见表 1。以白木香总RNA的反转录产物为模板,按照下列体系对白木香中sHSP1和sHSP2基因进行扩增:cDNA 1 μL,10×LA-Taq buffer 5 μL,dNTP Mix(2.5 mmol/L)4 μL,LA-Taq(2.5 U/μL)0.5 μL,10 μmol引物各1 μL,终体积为50 μL。反应程序:94 ℃预变性5 min;然后进行30个循环,94 ℃、1 min,47 ℃、30 s,72 ℃、1 min,循环结束后72 ℃延伸反应10 mim,4 ℃保存。1%的琼脂糖凝胶电泳检测PCR产物,凝胶成像分析系统检测,目的片段回收和纯化按照胶回收试剂盒说明书进行。将回收后的PCR产物与pMD19-T连接,转化到DH5α菌株,在氨苄抗性的平板上进行筛选,并经过菌落PCR检测后送上海英潍捷基公司测序。
|
|
表 1 引物序列 Table 1 Primers sequences |
2.3 白木香sHSP1和sHSP2基因生物信息学分析
通过在线软件ProtParam预测蛋白结构,分析目的基因编码蛋白质的氨基酸组成、蛋白质相对分子质量、理论等电点及稳定性等参数;采用SignalP 4.1 Server进行细胞定位预测;通过ExPASY中的SOPMA工具分析蛋白质序列的二级结构;利用SWISS-MODEL Workspace 在线分析软件构建蛋白质三级结构模型;利用软件TMHMM 2.0进行蛋白质跨膜结构分析;将所获得的sHSP1和sHSP2基因编码的氨基酸序列在GenBank数据库中进行Blast P对比分析,利用DNAMAN对其他物种的sHSPs基因编码的氨基酸序列进行同源性分析;通过MEGA 6.05软件构建Neighbor-joining系统进化树,进化距离的计算采用泊松校正法,Bootstrap重复次数为1 000次。
2.4 白木香sHSP1和sHSP2基因在不同组织及盐胁迫和外源ABA、SA、MJ处理不同时间的表达分析利用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)的方法检测白木香不同组织中sHSP1和sHSP2的表达情况及盐胁迫和外源ABA、SA、MJ处理不同时间的表达情况。分析使用SYBR Green I荧光染料法,在qRT-PCR仪上进行。选取白木香Actin基因作为目标基因定量表达的内参基因,引物序列见表 1。每个样品设3个重复。反应体系中含有5 μL STBR Premix Ex Taq酶,上、下游引物(10 μmol/L)各0.5 μL,模板0.5 μL(50 mg/L),总体系为10 μL。反应程序:95 ℃预变性3 min,95 ℃变性30 s,60 ℃退火/延伸30 s(每次循环后采集荧光),40个循环后,95 ℃变性10 s,65~95 ℃做熔解曲线分析,每个温度以每步0.5 ℃上升,每个温度停留5 s。实验进行9次重复,结果采用2−ΔΔCt法来计算基因相对表达量。实验数据通过Excel进行分析,获得sHSP1和sHSP2基因的相对表达量。
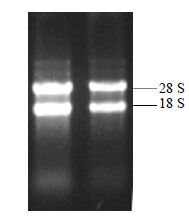
3 结果与分析 3.1 白木香总RNA的提取与检测从白木香诱导的愈伤组织中提取总RNA,经1.2%琼脂糖凝胶电泳检测,结果显示28 S rRNA和18 S rRNA条带清晰,结果见图 1,前者亮度约是后者的2倍,说明所提取的RNA完整性较好;经NanoDrop 2000C测得A260/A280=1.92,A260/A230=2.13,表明RNA纯度较高,可用于RT-PCR扩增。
|
图 1 白木香总RNA电泳图 Fig.1 Electrophoresis of total RNA from A. sinensis |
3.2 白木香sHSP1和sHSP2基因全长cDNA的克隆
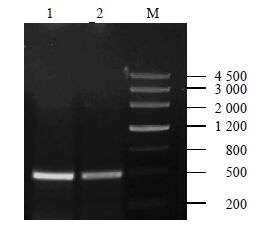
根据白木香愈伤组织转录组测序结果,以白木香愈伤组织的cDNA为模板进行扩增,利用PCR方法扩增后的2个474 bp的基因序列,编码157个氨基酸,白木香愈伤组织sHSP1和sHSP2基因的扩增结果见图 2,将其连接到pMD19-T载体转化大肠杆菌DH5α,测序结果经过NCBI的BLAST比对,确定2个扩增产物是白木香sHSPs基因cDNA的片段,同时BLAST结果显示,sHSP1和sHSP2基因与sHSPs家族具有很高的同源性,sHSP1与川桑Morus notabilis Schneid、桉树Eucalyptus grandis Hill、草莓Fragaria vesca subsp. Vesca中的sHSP18.1基因的相似性分别为为78%、76%、74%,sHSP2与番木瓜Carica papaya Linn.、桉树、川桑中的sHSP18.1基因的相似性分别为80%、77%、76%。
|
1-sHSP1基因的PCR扩增 2-sHSP1基因的PCR扩增 M-Marker 1-PCR amplification of sHSP1 gene 2-PCR amplification of sHSP2 gene M-Marker 图 2 白木香sHSP1、sHSP2基因的克隆 Fig.2 Cloning of sHSP1 and sHSP2 from A. sinensis |
3.3 sHSP1和sHSP2的生物学信息分析 3.3.1 sHSP1和sHSP2蛋白结构、亚细胞定位、跨膜区域分析
通过Protparam软件预测sHSP1和sHSP2基因编码的蛋白的理化性质。推测sHSP1编码的蛋白分子式为C803H1248N218O242S4,相对分子质量为17 975.3,理论等电点为6.34,不稳定系数II为48,属于不稳定蛋白,总平均亲水性GRAVY为−0.655,为亲水性蛋白;sHSP2编码的蛋白分子式为C798H1261N223O240S3,相对分子质量为17 896.2,理论等电点为5.48,不稳定系数II为54.99,属于不稳定蛋白,总平均亲水性GRAVY为−0.569,为亲水性蛋白。通过蛋白质亚细胞定位软件SignalP 4.1 Server预测结构表明,白木香sHSP1和sHSP2蛋白主要定位于细胞质。利用TMHMM 2.0预测白木香sHSP1和sHSP2的跨膜区域,预测结果表明sHSP1和sHSP2均没有跨膜区域。
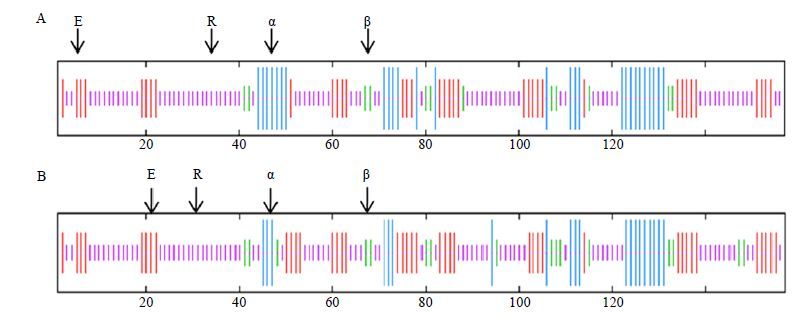
3.3.2 sHSP1和sHSP2蛋白的二级结构分析及三维结构预测运用ExPASY中的SOPMA工具预测sHSP1和sHSP2基因编码蛋白的二级结构,结果显示sHSP1蛋白的二级结构由50.96%的随机卷曲(random coil)、17.20%的α-螺旋(α-helices)、24.20%的延伸链(extended strand)和7.64%的β-折叠(β-turn)组成(图 3-A),推测随机卷曲是其最大量的二级结构元件,而α-螺旋、延伸链和β-折叠散布于整个蛋白中。而sHSP2蛋白的二级结构由50.32%的随机卷曲、12.74%的α-螺旋、26.75%的延伸链和10.19%的β-折叠(β-turn)组成(图 3-B),推测随机卷曲是其最大量的二级结构元件,而α-螺旋、延伸链和β-折叠散布于整个蛋白中。
|
图 3 sHSP1 (A) 和sHSP2 (B) 编码蛋白的二级结构 Fig.3 Predicted secondary structure of sHSP1 (A) and sHSP2 (B) protein |
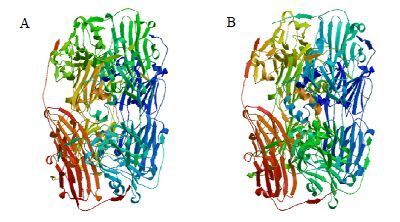
将白木香的sHSP1和sHSP2的氨基酸序列通过SWISS-MODEL Workspace在线分析软件建立了sHSP1(图 4-A)和sHSP2(图 4-B)的三维结构模型,选择小麦sHSP的结构模型为模板,进行白木香sHSP1、sHSP2的结构预测,预测结果表明,白木香sHSP1与模板小麦sHSP一致性为70.67%,白木香sHSP2与模板小麦sHSP一致性为69.33%,具有参考价值,预测的sHSP1与sHSP2的三维结构类似,具体三维结构如图 4所示。
|
图 4 sHSP1 (A) 和sHSP2 (B) 蛋白质的三维结构 Fig.4 3D structure of sHSP1 (A) and sHSP2 (B) protein |
3.3.3 白木香sHSP1和sHSP2氨基酸序列分子系统进化分析
将白木香sHSP1和sHSP2氨基酸序列与GenBank中其他植物中的不同sHSPs氨基酸序列进行比对,通过DNAMAN软件与多种植物进行比对分析(图 5),比对结果表明sHSP1氨基酸序列与可可Theobroma cocao Linn.、雷蒙德氏棉Gossypium raimondii Linn.、桉树的同源性分别为80%、78%、77%;而sHSP2氨基酸序列与可可、番木瓜、苜蓿Medicago truncatula Linn. 的同源性分别为81%、80%、80%,说明sHSPs 在进化过程中较为保守。与其他植物多序列比对后发现各相似蛋白序列在N端保守性较低,在中部和C端相对保守,在白木香sHSP1和sHSP2的53~156氨基酸区是sHSPs20亚家族sHSP2典型的(alphacrystallin domain,ACD)结构域。α-晶体域的氨基酸序列为该类蛋白的保守序列区。同时sHSP1、sHSP2与其他参与比对的植物一致,都含有丰富的脯氨酸残基活性位点。

|
图 5 白木香sHSP1、sHSP2与其他植物sHSPs氨基酸序列同源性比对 Fig.5 Homologous comparison on amino acid sequence of sHSPs in A. sinensis and other plants |
通过进化树构建软件MEGA 6.05,采用相邻连接法构建sHSPs进化树,进行sHSPs的聚类分析。通过软件构建的进化树如图 6所示,结果表明sHSP1和sHSP2蛋白氨基酸序列相似性较高,与柑橘sHSP18.5、本生烟sHSP17.4 的相似性比较高。
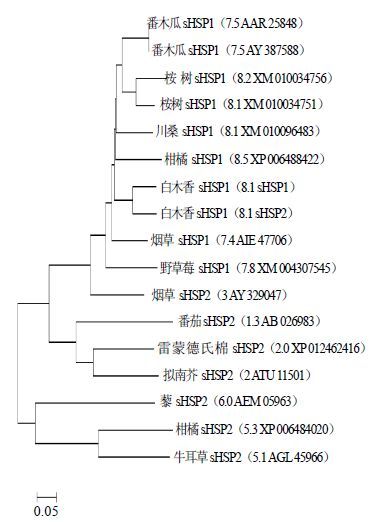
|
图 6 植物中sHSPs蛋白氨基酸序列的聚类分析 Fig.6 Phylogenetic analysis of sHSPs proteins from plants |
3.4 sHSP1、sHSP2基因的组织表达特异性分析
利用实时荧光定量PCR检测sHSP1、sHSP2基因的表达特异性,研究结果表明sHSP1、sHSP2基因在根中的表达量最多,其次是茎和叶(图 7),说明sHSP1、sHSP2基因可能主要在根中发挥生物学功能,推测sHSP1、sHSP2在白木香根受到胁迫响应时起到重要的作用。
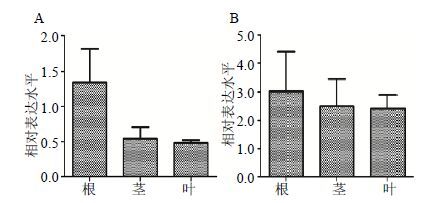
|
图 7 sHSP1 (A) 和sHSP2 (B) 在不同组织中的表达分析 Fig.7 Expression levels of sHSP1 (A) and sHSP2 (B) in different tissues |
3.5 sHSP1、sHSP2基因响应盐胁迫的表达分析
sHSPs是参与植物防御反应的重要蛋白家族,而研究表明小分子热激蛋白sHSPs除了能够响应高温、低温胁迫外,部分sHSPs还能够参与植物盐胁迫响应[13],为研究白木香愈伤组织中扩增的sHSP1和sHSP2基因是否参与盐胁迫响应,采用实时荧光定量PCR的方法对愈伤组织中在200 mmol/L NaCl处理下不同时间sHSP1和sHSP2的表达量进行分析。结果表明sHSP1基因在受到200 mmol/L NaCl处理后的36 h持续升高,36 h时达到最高水平,之后随时间的增加而表达量下降(图 8-A);sHSP2基因在愈伤组织受到200 mmol/L NaCl处理后24 h持续升高,24 h达到最高表达水平,然后随时间的增加而表达量下降(图 8-B)。这些结果表明白木香sHSP1和sHSP2基因参与盐胁迫响应,与植物的抗盐性密切相关。
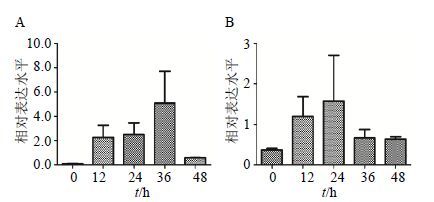
|
图 8 sHSP1 (A) 和sHSP2 (B) 在NaCl处理后不同时间的表达分析 Fig.8 Expression analysis of sHSP1 (A) and sHSP2 (B) in different NaCl treatment time |
3.6 sHSP1、sHSP2在外源ABA、SA、MJ处理后不同时间的表达分析
为研究白木香扩增sHSP1和sHSP2基因是否受到ABA信号通路调控以及SA和MJ的诱导,同样采用实时荧光定量PCR检测白木香愈伤组织sHSP1和sHSP2基因在外源100 μmol/L ABA[14]、100 μmol/L SA[15]和100 μmol/L MJ[16]处理下不同时间的表达量。实验结果表明,sHSP1基因和sHSP2基因在受到3种外源激素ABA、SA和MJ处理后的表达量趋势都是先增加后降低。sHSP1基因和sHSP2基因在受到外源100 μmol/L ABA和100 μmol/L MJ处理后的12 h表达量达到最高峰,然后随时间的增加而表达量逐渐降低。sHSP1基因在受到外源100 μmol/L SA处理后的12 h达到最高表达量,之后随时间的增加表达量下降(图 9-C);而sHSP2基因在外源SA处理后的24 h达到最高表达量,之后随时间表达量降低(图 9-D)。这些实验结果表明,白木香 sHSP1和sHSP2基因能够受到ABA信号通路调控以及SA和MJ的诱导,在植物防御反应中起到重要的作用。
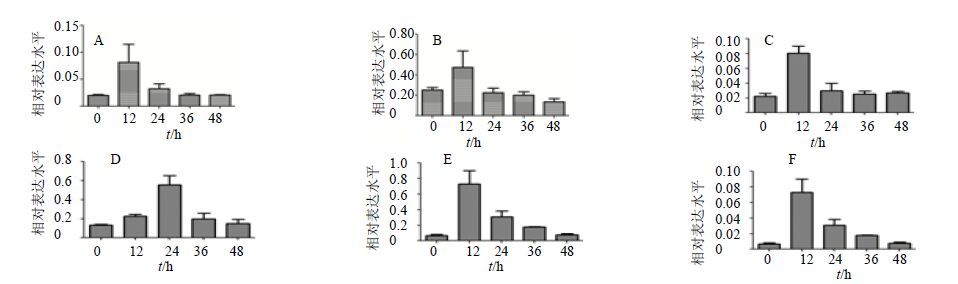
|
A、C、E-sHSP1基因在外源ABA、SA、MJ处理后不同时间的表达分析;B、D、F-sHSP2基因在外源ABA、SA、MJ处理后不同时间的表达分析 A,C,and E-expression analysis of sHSP1 in different ABA,SA,and MJ treatment time; B,D,and F-expression analysis of sHSP2 in different ABA,SA,and MJ treatment time 图 9 sHSP1、sHSP2在外源ABA、SA、MJ处理后不同时间的表达分析 Fig.9 Expression analysis of sHSP1 and sHSP2 in different ABA,SA,and MJ treatment time |
4 讨论
植物sHSPs是植物中最重要的一类热激蛋白,其广泛分布于细胞质、线粒体、叶绿体等组织中,研究表明sHSPs在植物响应逆境胁迫中起到重要作用[6]。白木香是名贵药材沉香的主要来源,但是健康的白木香中不产生沉香,只有在白木香受到物理或化学伤害时才能够产生沉香[11],因此沉香的产生机制与白木香的防御反应密切相关,而sHSPs又与植物防御反应密切相关,因此研究小分子热激蛋白生物信息学和表达分析有利于揭示白木香的结香机制。本研究根据首次从白木香的愈伤组织中扩增得到sHSP1和sHSP2基因全长,并对2个基因进行生物信息学分析,结果表明从白木香愈伤组织扩增的sHSP1与已经鉴定川桑、桉树、草莓中的细胞质sHSP18.1相似性较高,sHSP2与已经鉴定的番木瓜、桉树、川桑中的sHSP18.1基因的相似性较高;sHSP1和sHSP2基因编码蛋白质的氨基酸组成、蛋白质相对分子质量、理论等电点及稳定性等很接近,两者的理化性质相似;而细胞定位预测结果表明,白木香sHSP1和sHSP2定位于细胞质中;蛋白二级结构分析表明sHSP1和sHSP2基因编码的蛋白二级结构相似性很高;三维结构预测结果表明sHSP1和sHSP2三维结构相似性较高,两者与小麦中HSP18.1的三维结构相似;通过聚类分析结果表明白木香sHSP1和sHSP2相似性较高,两者与柑橘sHSP18.5、烟草sHSP17.4的相似性较高。
sHSPs已经被证明与高温、低温、高盐等环境胁迫相关,并且sHSPs的表达具有组织特异性[17]。白木香sHSP1和sHSP2基因组织特异性表达分析结果显示,两基因在茎和叶中表达比较少,但是在根中表达较多,说明两基因表达具有组织特异性。高盐是目前影响植物生长发育的最重要非生物胁迫,部分sHSPs与植物的盐胁迫响应有关[13],本研究表明通过高盐处理的愈伤组织中sHSP1基因36 h之前持续升高,36 h时达到最高表达水平;sHSP2基因在24 h之前持续升高,24 h达到最高表达水平;这些结果表明sHSP1和sHSP2基因参与了植物的抗盐胁迫。ABA和SA是非常重要的激素,是植物体内普遍存在的重要的内源信号分子,可以提高植物抗逆性,能够调控植物种子发芽、根系发育、种子枯萎等生理活动。在植物的抗病、抗低温、抗旱、抗盐等抗逆活动中具有重要的生理作用。而MJ是许多植物体产生的天然化合物,在植物代谢过程中发挥着与ABA、SA等激素相类似的作用。MJ除了是高等植物体内的内源生长调节物质,具有广泛的生理功能外,它本身也是病原物、诱导子及创伤植物防卫基因表达的信号分子,并且其本身也可作为诱导子[18]。有研究表明,植物受到胁迫启动ABA信号通路时会启动部分sHSPs表达[19],SA在植物诱导性防卫反应中起系统信号分子的作用[20],它同ABA一样在逆境胁迫下能做出应答,调控多种蛋白表达。而MJ能够作为诱导子会直接引发白木香细胞逆境条件下的次生代谢反应,诱导次生代谢产物色酮类化合物的产生[21]。ABA信号通路是植物的重要激素,与植物的生长发育和植物胁迫响应密切相关,因此能够在植物受到胁迫时,调控植物防御反应基因的表达[15],本研究表明外源ABA处理的白木香愈伤组织sHSP1和sHSP2基因在12 h达到最高表达水平,之后随时间增加而降低,这些结果表明ABA在胁迫条件下调控着sHSP1和sHSP2基因的表达;SA[16]和MJ[22]在植物诱导性防卫反应中起系统信号分子的作用,能诱导白木香次生代谢产物色酮化合物的产生,亦会调控多种蛋白的表达,本研究表明外源SA处理的白木香愈伤组织sHSP1和sHSP2基因分别在12、24 h达到最高表达水平,之后随时间增加而降低;MJ处理的白木香愈伤组织sHSP1和sHSP2基因都在12 h达到最高表达量,说明SA、MJ能够在逆境下调控sHSP1和sHSP2基因的表达。因此本研究为进一步研究白木香的结香机制和防御反应机制奠定了基础。
| [1] | Wang W, Vinocur B, Shoseyov O, et al. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response[J]. Trends Plant Sci , 2004, 9 (5) :244–252. DOI:10.1016/j.tplants.2004.03.006 |
| [2] | Montfort R L, Basha E, Friedrich K L, et al. Crystal structure and assembly of a eukaryotic small heat shock protein[J]. Nat Struct Biol , 2001, 8 (12) :1025–1030. DOI:10.1038/nsb722 |
| [3] | Kampinga H H, Hageman J, Vos M J, et al. Guidelines for the nomenclature of the human heat shock proteins[J]. Cell Stress Chaperones , 2009, 14 (1) :105–111. DOI:10.1007/s12192-008-0068-7 |
| [4] | Palakolanu S R, Polavarapu B K K, Christiane S, et al. Unraveling regulation of the small heat shock proteins by the heat shock factor HvHsfB2c in barley:Its implications in drought stress response and seed development[J]. PLoS One , 2014, 9 (3) :e89125. DOI:10.1371/journal.pone.0089125 |
| [5] | Cecilia R, Alexandra C, Valentina C, et al. Recovery from heat, salt and osmotic stress in Physcomitrella patens requires a functional small heat shock protein PpHsp16. 4[J]. BMC Plant Biol , 2013, 13 (5) :1471–2229. |
| [6] | 李春子, 成善汉. 植物小分子热激蛋白的进化及表达调控研究进展[J]. 热带生物学报 , 2010, 1 (2) :193–196. |
| [7] | Priyanka D, Kamlesh K M, Singla P, et al. Understanding salinity responses and adopting ‘omics-based’ approaches to generate salinity tolerant cultivars of rice[J]. Front Plant Sci , 2015, 6 (9) :712–727. |
| [8] | Klára K, Ilja T P, Pavel V. Protein contribution to plant salinity response and tolerance acquisition[J]. Int J Mol Sci , 2013, 14 (4) :6757–6789. DOI:10.3390/ijms14046757 |
| [9] | 中国珍稀濒危保护植物名录(第一册)[M]. 北京:科学出版社, 1987. |
| [10] | 中国药典[S]. 一部. 2015. |
| [11] | 李戈, 段立胜, 杨春勇, 等. 白木香结香技术研究进展[J]. 安徽农业科学 , 2009, 37 (25) :12012–12013. |
| [12] | 张争, 杨云, 魏建和, 等. 白木香结香机制研究进展及其防御反应诱导结香假说[J]. 中草药 , 2010, 41 (1) :156–159. |
| [13] | Silvia S M, Gracia G A, Pablo D S, et al. The Opuntia streptacantha OpsHSP18 gene confers salt and osmotic stress tolerance in Arabidopsis thaliana[J]. Int J Mol Sci , 2012, 13 (8) :10154–10175. |
| [14] | Hu X, Liu R, Li Y, et al. Heat shock protein 70 regulates the abscisic acid-induced antioxidant response of maize to combined drought and heat stress[J]. Plant Growth Regul , 2010, 60 (3) :225–235. DOI:10.1007/s10725-009-9436-2 |
| [15] | Kumar M, Busch W, Birke H, et al. Heat shock factors HsfB1 and HsfB2b are involved in the regulation of Pdf1. 2 expression and pathogen resistance in Arabidopsis[J]. Mol Plant , 2009, 2 (1) :152–165. DOI:10.1093/mp/ssn095 |
| [16] | Dat J F, Lopez-Delgado H, Foyer C H, et al. Parallel changes in H2O2 and catalase during thermotolerance induced by salicylic acid or heat acclimation in mustard seedlings[J]. Plant Physiol , 1998, 116 (4) :1351–1357. DOI:10.1104/pp.116.4.1351 |
| [17] | Mu C G, Zhang S J, Yu G Z, et al. Over expression of small heat shock protein LimHSP16. 45 in Arabidopsis enhances tolerance to abiotic stresses[J]. PLoS One , 2013, 8 (13) :e82264. |
| [18] | Creelman R A, Mullet J E. Jasmonic acid distribution and action in plants:Regulation during development and response to biotic and abiotic stress[J]. Proc Natl Acad Sci USA , 1995, 92 (10) :4114–4119. DOI:10.1073/pnas.92.10.4114 |
| [19] | Wu X L, Gong F P, Yang L, et al. Proteomic analysis reveals differential accumulation of small heat shock proteins and late embryogenesis abundant proteins between ABA-deficient mutant vp5 seeds and wild-type Vp5 seeds in maize[J]. Front Plant Sci , 2014, 5 (1) :801–819. |
| [20] | 刘林德, 姚敦义. 植物激素的概念及其新成员[J]. 生物学通报 , 2002, 37 (8) :18–20. |
| [21] | 何梦玲, 何芳, 孟京兰, 等. 3种诱导子对白木香根悬浮培养细胞中2-(2-苯乙基)色酮化合物形成的影响[J]. 中成药 , 2013, 35 (7) :1397–1371. |
| [22] | Thorpe M R, Ferrieri A P, Herth M M, et al. 11C-imaging:methyl jasmonate moves in both phloem and xylem, promotes transport of jasmonate, and of photoassimilate even after proton transport is decoupled[J]. Planta , 2007, 226 (2) :541–551. DOI:10.1007/s00425-007-0503-5 |
 2016, Vol. 47
2016, Vol. 47


