2. 吉林大学白求恩医科大学第二附属医院 骨科, 吉林 长春 130021
2. Department of Orthopedics, Second Affitialed Hospital of Bethume Medical University, Jilin University, Changchun 130021, China
糖皮质激素广泛应用于慢性阻塞性肺病、哮喘、风湿免疫性疾病、炎性肠病等多种疾患及器官移植后的治疗[1, 2]。除了直接减少成骨细胞的数量和活性以外,糖皮质激素还可减少钙在胃肠道的吸收,加速钙由肾脏排泄,通过减少性激素分泌,抑制胰岛素样生长因子和前列腺素,产生及影响甲状旁腺激素等环节导致骨量减少[3, 4]。随着糖皮质激素广泛用于临床,糖皮质激素性骨质疏松症(glucocorticoid- induced osteoporosis,GIOP)发病率剧增,仅次于绝经后及老年性骨质疏松症[5, 6]。因此,如何对GIOP进行有效防治已成为临床医生和科研工作者亟待解决的重要课题,其发病机制也越来越得到重视。
鹿骨是常用的中药之一,有着人们所不熟知的一些特殊的功效,鹿骨中含有大量蛋白质、骨胶原、磷脂质、软骨素和磷蛋白,有益于骨形成,促进体内胶原蛋白及弹性蛋白的更新,延缓骨吸收,促进软骨内骨化等过程[7, 8]。此外,鹿骨中亦含有大量矿物质,如钙、镁、铁、锌、钾、铜、磷、硒等,以维持血清中钙、磷、镁等离子的浓度和比例,为骨的再生提供一个适宜的微环境[8]。骨提取物中主要成分骨多肽具有水溶性强、活性高的特点而备受关注。本研究通过建立地塞米松诱导的大鼠骨质疏松模型,观察鹿骨多肽对大鼠骨质疏松模型预防及治疗作用,利用血清学和组织形态学指标来评价其治疗效果,预期鹿骨多肽能够延缓骨吸收、促进骨形成,起到预防及治疗GIOP的作用。
1 材料 1.1 实验动物Wistar大鼠,雄性,2个半月龄,体质量(350±20)g,清洁级,由吉林大学亿斯实验动物中心提供,实验动物许可证号SCXK-(吉)20140003。
1.2 药品与试剂梅花鹿Cervus nippon Temminck鹿骨(批号201505,经吉林市食品药品检验所王维礼主任药师鉴定)购于吉林市龙潭山鹿业有限责任公司;地塞米松(批号1501212111)为辰欣药业股份有限公司生产;复方鹿茸健骨胶囊(批号14110131)为白求恩医科大学制药厂生产;骨钙素(BGP)、甲状旁腺激素(PTH)、碱性磷酸酶(ALP)、降钙素(CT)、钙(Ca2+)ELISA检测试剂盒,均为基尔顿生物科技(上海)有限公司产品;其他化学试剂均为分析纯。
1.3 实验仪器microCTμ100扫描仪,瑞士Scanco公司;酶标仪,芬兰Labsystems Multiskan MS公司;URIT-8021A生化自动分析仪,优利特电子集团有限公司。
2 方法 2.1 鹿骨多肽的制备新鲜鹿骨股骨称质量后,清洗剃除毛和脂肪,60 ℃整骨烘干后,将骨打碎成3~5 cm小块,取500 g加1 000 mL蒸馏水浸泡2 h,置于压力蒸汽灭菌器中,于121 ℃提取1 h。后用滤布滤过,滤液冷却除脂,收取滤液。滤渣按上述条件再提取1次,合并2次滤液浓缩至500 mL。浓缩液于4 ℃下静置12 h,去除上层油脂,滤过,先用胃蛋白酶以酶与底物1∶50(质量体积比)在37 ℃ pH 2的条件下酶解5 h,然后再用胰蛋白酶以酶与底物1∶50(质量体积比)在37 ℃ pH 8的条件下再次酶解5 h后得鹿骨多肽,酶解液经喷雾干燥得鹿骨多肽干粉48.2 g,经测定鹿骨多肽干粉中含蛋白质为58.6%,水解度为13.9%。
2.2 动物分组及处理将48只Wistar 雄性大鼠随机分为6组:对照组,模型组,鹿骨多肽高、中、低剂量(250、125、62.5 mg/kg)组,阳性药复方鹿茸健骨胶囊组,每组各8只大鼠。除对照组外,其他5组大鼠im地塞米松2.5 mg/kg,每周2次,对照组im等体积的生理盐水。造模同时,鹿骨多肽各组分别ig给予鹿骨多肽250、125、62.5 mg/kg,阳性药组ig复方鹿茸健骨胶囊(胶囊内容物以双蒸水溶解)540 mg/kg,对照组和模型组ig等量生理盐水,各组均每天给药1次,连续75 d。
2.3 血清生化指标的检测末次给药后采用大鼠麻醉后腹主动脉取血法,所取全血静置后,经2 000 r/min离心10 min后取血清,−20 ℃冰冻保存备用。测定前置室温复融均匀,取上清测定。利用酶联免疫法,按照试剂盒说明书操作步骤检测大鼠血清中Ca2+、CT、BGP、PTH、ALP水平;利用生化自动分析仪检测血清磷(P3+)水平。
2.4 microCT检测各组大鼠处死后迅速取出右侧胫骨,去除附着的软组织,然后将骨组织置于4%多聚甲醛溶液中固定。将标本放入样品杯中并固定好,在相同条件(扫描电压70 kV,扫描电流200 μA,层距14.80 μm,平面分辨率300 ms,连续扫描约808层)下扫描。扫描完成后,选取胫骨膨大处及骨干区域作为感兴趣区,设定三维重建阈值后对各标本感兴趣区行三维重建,分析总体积(TV)、骨体积(BV)、骨体积/总体积(BV/TV)、骨小梁数量(Tb.N)、骨小梁厚度(Tb.Th)、骨小梁分离度(Tb.Sp)、骨表面积/骨体积(BS/BV)。
2.5 HE染色给药结束后,将各组大鼠处死,取左股骨远端1/3,除净周围附着的组织,然后将骨组织置于4%多聚甲醛溶液中固定,包埋,切片、染色,制作不脱钙骨切片。
2.6 统计学分析数据采用SPSS Statistics V21.0统计软件进行方差分析及检验,以x±s表示。
3 结果 3.1 对GIOP模型大鼠一般状态及体质量的影响在实验期间,模型组大鼠逐渐出现毛色无光泽、懒动、少食等现象,而对照组和鹿骨多肽高、中剂量组大鼠皮毛光泽较好,活动如常;与对照组相比,模型组大鼠体质量明显降低(P<0.05);与模型组大鼠相比,鹿骨多肽中、高剂量组大鼠体质量明显恢复(P<0.05),见表 1。
|
|
表 1 鹿骨多肽对GIOP模型大鼠体质量的影响 (x±s,n = 8) Table 1 Effects of deer bone polypeptides on body weight of rats with GIOP (x±s,n = 8) |
3.2 对GIOP模型大鼠血清Ca2+、P3+、ALP的影响
模型组大鼠血清Ca2+下降,而P3+、ALP明显增高,与对照组比较差异显著(P<0.05);鹿骨多肽高剂量组和阳性药物组血清Ca2+有不同程度的增加,P3+明显下降,与模型组比较差异显著(P<0.05),而鹿骨多肽高剂量组血清ALP明显下降(P<0.05),见表 2。
|
|
表 2 鹿骨多肽对GIOP模型大鼠血清Ca2+、P3+、ALP的影响 (x±s,n = 8) Table 2 Effects of deer bone polypeptides on serum Ca2+ and P3+ levels and ALP activities in rats with GIOP (x±s,n = 8) |
3.3 对GIOP模型大鼠血清PTH、BGP、CT的影响
与对照组比较,模型组大鼠血清PTH水平显著升高(P<0.05),BGP水平显著降低(P<0.05);与模型组比较,鹿骨多肽高、中剂量组大鼠血清PTH水平明显降低(P<0.05),血清BGP水平显著升高(P<0.05);鹿骨多肽组虽有降低血清CT的趋势,但与模型组比较未见统计学意义。见表 3。
|
|
表 3 鹿骨多肽对GIOP模型大鼠血清PTH、BGP、CT水平的影响 (x±s,n = 8) Table 3 Effects of deer bone polypeptides on serum PTH,BGP,and CT levels in rats with GIOP (x±s,n = 8) |
3.4 对GIOP模型大鼠骨微结构的影响
与对照组比较,模型组大鼠骨微结构指标Tb.N、BV/TV显著降低(P<0.05),而Tb.Sp、BS/BV显著升高(P<0.05);与模型组比较,鹿骨多肽高剂量组胫骨近端的Tb.N、BV/TV均明显升高(P<0.05),Tb.Sp、BS/BV均明显降低(P<0.05),各组Tb.Th无明显变化,见表 4。
|
|
表 4 鹿骨多肽对GIOP大鼠骨微结构的影响 (x±s,n = 8) Table 4 Effects of deer bone polypeptides on bone microstructure in rats with GIOP (x±s,n = 8) |
3.5 对GIOP模型大鼠骨组织形态学的影响
大鼠左股骨远端1/3病理切片光境检查显示,与对照组比较,模型组骨小梁数目明显减少,稀疏断裂,大部分不能连接成网状,骨髓腔明显增大,骨小梁结构出现较大的空白区域,且可见大量脂肪细胞。而鹿骨多肽组股骨骨小梁明显宽厚,数目也显著增加,骨小梁断裂与脂肪细胞少见,骨小梁光滑,接近对照组。见图 1。
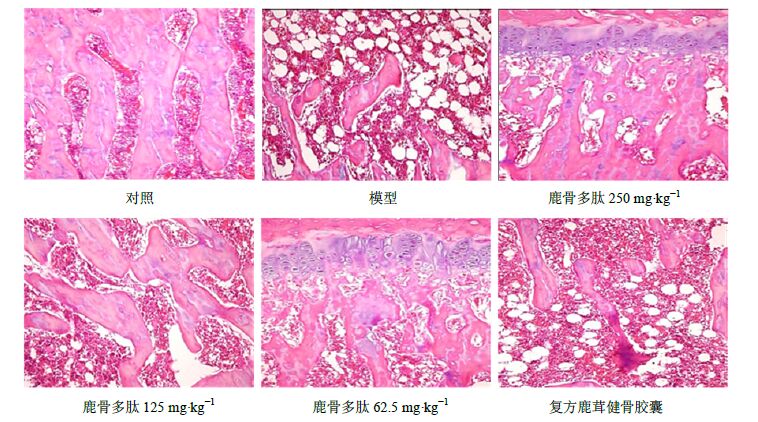
|
图 1 各组大鼠骨组织HE染色 Fig.1 HE staining of bone tissue of rats in each group |
4 讨论
长期大剂量使用糖皮质激素不仅可抑制成骨细胞增殖,促进其凋亡,减少骨骼中活性成骨细胞成分,导致骨生成能力下降,而且可使成骨细胞不能正常募集到骨侵蚀表面,使得被破骨细胞吸收的骨面未能及时被修复,造成骨质丢失,导致骨质疏松。由于激素所致骨量丢失主要是抑制骨形成为主,因此,遏制激素引起的骨质丢失,关键在于刺激骨形成、促进骨量增加[9, 10]。
本研究利用地塞米松im大鼠75 d后,模型组大鼠血清BGP明显降低,骨矿物质分解,钙从骨骼流失增加,骨代谢紊乱。病理结果显示骨小梁稀疏变薄、断裂,骨髓腔扩大,脂肪细胞增加,骨密度降低,说明GIOP大鼠模型已复制成功。血清学评价结果提示,模型组血清Ca2+明显下降,是由于短时间内应用较大剂量糖皮质激素,抑制不同胃肠道部位的钙离子吸收。尤其在十二指肠,糖皮质激素抑制钙离子的跨细胞转运,降低钙结合蛋白合成,进而使肠内钙离子的吸收减少。并且糖皮质激素抑制肾小管对钙离子的重吸收并产生高钙尿症,导致尿中钙排泄的增加。这种负钙平衡引起代偿性增加血清P3+和PTH水平[11]。若造模同时给予鹿骨多肽,血清生化检查各指标有所改善,即血清Ca2+有不同程度的提高,血清P3+和PTH则有明显下降。这些结果表明鹿骨多肽能够抑制地塞米松引起的钙磷代谢失衡。
ALP是一种磷酸单酯酶,骨骼中的ALP由成骨细胞分泌,主要集中在骨化部位,即在骨骺线和骨膜下[12]。BGP来源于骨组织,由成骨细胞合成并分泌到骨中,是骨组织中非胶原性蛋白的主要成分,约占骨质蛋白的3%,其作用是调节和维持骨钙。BGP 2/3与轻磷灰石结晶结合,沉积于骨基质,1/3进入血液循环。因此,血清中BGP浓度可特异性地反映它的“母体”成骨细胞的活性[13]。由于在骨吸收过程中,基质中的BGP又可释放到血液,所以综合来讲,BGP是评价骨形成和骨转换率的特异性指标。ALP、BGP均为骨形成生化指标,ALP、BGP水平反映了骨形成水平。CT主要由甲状腺C细胞合成和分泌的一种激素,对骨代谢有重要的调节作用,通过受体介导作用能抑制破骨细胞的活性[14]。本实验用ELISA法检测了各组大鼠血清中ALP、BGP和CT的量,鹿骨多肽组血清ALP降低,BGP升高,同时也有降低CT的趋势,提示鹿骨多肽具有抑制骨吸收,降低骨转化率,使骨形成加强,进而减少骨量丢失的作用。
骨组织显微结构退化是骨质疏松症的重要特征。骨小梁的数量、密度和空间构象等显微结构影响着骨的生物力学特性,因此骨显微结构的改变可以更直接地反映骨质疏松的情况。骨组织病理学检测是反映骨显微结构变化的最直接的依据,评价骨显微结构的金标准[15]。而MicroCT是一种体外无损伤测量技术,适用于药物治疗后骨小梁结构的三维分析。本研究同时采用组织病理学检测和MicroCT分析,发现模型组大鼠骨小梁变细、中断、游离端增多,数量减少,间隙增宽,空间结构破坏增加,而鹿骨多肽的干预能明显改善上述骨显微结构指标,提示鹿骨多肽对改善显微结构具有一定的疗效。
以上实验均证明了鹿骨多肽可抑制骨吸收和促进骨形成,具有防治GIOP的作用。鹿骨多肽能够抑制糖皮质激素诱导的钙磷代谢失衡,降低ALP,升高BGP,抑制骨吸收和促进骨形成。并且改善GIOP大鼠病理学改变和显微结构,发挥对骨的保护作用。
| [1] | Buttgereit F, Burmester G R, Lipworth B J. Optimised glucocorticoid therapy:the sharpening of an old spear[J]. Lancet , 2005, 365 (9461) :801–803. DOI:10.1016/S0140-6736(05)71005-9 |
| [2] | den Uyl D, Bultink I E, Lems W F. Advances in glucocorticoid-induced osteoporosis[J]. Curr Rheumatol Rep , 2011, 13 (3) :233–240. DOI:10.1007/s11926-011-0173-y |
| [3] | Hallberg I, Bachrach-Lindström M, Hammerby S, et al. Health-related quality of life after vertebral or hip fracture:a seven-year follow-up study[J]. BMC Musculoskelet Disord , 2009 . DOI:10.1186/1471-2474-10-135 |
| [4] | Kok C, Sambrook P N. Secondary osteoporosis in patients with an osteoporotic fracture[J]. Best Pract Res Clin Rheumatol , 2009, 23 (6) :769–779. DOI:10.1016/j.berh.2009.09.006 |
| [5] | Cauley J A, Thompson D E, Ensrud K C, et al. Risk of mortality following clinical fractures[J]. Osteoporos Int , 2000, 11 (7) :556–561. DOI:10.1007/s001980070075 |
| [6] | Briot K, Roux C. Glucocorticoid-induced osteoporosis[J]. RMD Open , 2015, 1 (1) . |
| [7] | 张鹤, 赵雨, 徐云凤, 等. 鹿骨胶原蛋白对去卵巢所致骨质疏松大鼠的治疗作用[J]. 中药药理与临床 , 2011, 27 (5) :76–79. |
| [8] | 王权, 毛颖, 马春晖, 等. 鹿骨粉治疗大鼠卵巢摘除后所致的骨质疏松[J]. 中国妇幼保健 , 2015, 30 (17) :2861–2864. |
| [9] | Chen Z, Xue J, Shen T, et al. Curcumin alleviates glucocorticoid-induced osteoporosis by protecting osteoblasts from apoptosis in vivo and in vitro[J]. Clin Exp Pharmacol Physiol , 2016, 43 (2) :268–276. DOI:10.1111/cep.2016.43.issue-2 |
| [10] | Chen Z G, Xue J Q, Shen T, et al. Curcumin alleviates glucocorticoid-induced osteoporosis through the regulation of the Wnt signaling pathway[J]. Int J Mol Med , 2016, 37 (2) :329–338. |
| [11] | Whittier X, Saag K G. Glucocorticoid-induced osteoporosis[J]. Rheum Dis Clin North Am , 2016, 42 (1) :177–189. DOI:10.1016/j.rdc.2015.08.005 |
| [12] | Lindgren J U, Johnell O, DeLuca H F. Studies of bone tissue in rats treated by prednisolone and 1,25-(OH) 2D3[J]. Clin Orthop Relat Res , 1983, 181 :264–268. |
| [13] | Krasselt M, Baerwald C. An update on glucocorticoid-induced osteoporosis[J]. Dtsch Med Wochenschr , 2016, 141 (5) :352–357. DOI:10.1055/s-00000011 |
| [14] | Modi A, Siris E S, Tang J, et al. Gastrointestinal events and association with initiation of treatment for osteoporosis[J]. Clinicoecon Outcomes Res , 2015, 7 :603–613. |
| [15] | Ritman E L. Micro-computed tomograph y-current. status and developments[J]. Annu Rev Biomed Eng , 2004, 6 :185–208. DOI:10.1146/annurev.bioeng.6.040803.140130 |
 2016, Vol. 47
2016, Vol. 47


