2. 天津国际生物医药联合研究院, 天津 300457 ;
3. 现代中药发现与制剂技术教育部工程研究中心, 天津 300193 ;
4. 方剂学教育部重点实验室, 天津 300073
2. Tianjin International Joint Academy of Biomedicine, Tianjin 300457, China ;
3. Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique, Ministry of Education, Tianjin 300193, China ;
4. Key Laboratory of Science of Prescription, Ministry of Education, Tianjin 300073, China
何首乌始载于《开宝本草》,为蓼科植物何首乌Polygonum multijiorum Thunb. 的干燥块根,具有补肝肾、益精血、乌须发、化浊降脂等功效[1]。现代研究表明何首乌具有延缓衰老、调节血脂、抗动脉粥样硬化、提高记忆等作用,因此何首乌在中药处方、已上市中成药及保健产品中应用广泛[2-3]。但近年来国内外陆续出现因服用何首乌或含何首乌制剂引起肝损伤的病例报道,且以急性肝细胞损伤型为主(约占92.4%)[4-9]。药物引起肝损伤时出现肝细胞凋亡甚至坏死(约占71.9%)、大量炎细胞浸润(93.8%)、点状样坏死(96.9%)等病理表现[8]。目前研究肝损伤多是通过动物模型或体外细胞模型检测病理组织、单个生化指标或细胞增殖,而中药由于成分不明确、含量不稳定、来源不统一,导致毒理机制研究存在较大困扰,运用传统方法难以在研发早期阶段发现药物潜在肝毒性[10]。因此,建立一种高效、快速、灵敏度高、特异性强的中药肝毒性体外检测方法对于中药早期筛选及上市后药物安全性再评价都具有重要意义。
基于细胞影像学的高内涵分析(high content analysis,HCA)技术因其高速、动态、自动地获取细胞成像并进行量化分析而在药物生物活性和潜在毒性筛选领域引起广泛关注[11-16]。但是由于中药是一个复杂的体系,HCA在中药安全性评价领域的应用仍十分罕见。前期研究利用HCA方法对中药注射剂进行肝毒性评价,结果发现该方法与动物体内研究基本一致,表明HCA可以用于中药注射剂的肝毒性检测[17]。本研究利用HCA检测何首乌的肝毒性,以进一步证实该方法用于评价中药成分安全性的可行性。
因人源肝癌细胞HepG2具有人正常肝细胞的很多特点和功能,保留了较完整的生物转化酶体系,敏感性高,与原代肝细胞等相比更为稳定、成熟,被认为是药物肝毒性体外筛选的理想模型之一[18-19]。已有研究报道在细胞凋亡早期会出现线粒体功能的失常,线粒体的损伤程度对细胞凋亡具有决定性作用[20]。因此本研究以HepG2细胞为模型,利用HCA技术检测何首乌不同极性提取物及8种毒性争议较大的单体成分二苯乙烯苷、芦荟大黄素、大黄素甲醚、儿茶素、大黄酚、大黄素、大黄酸、没食子酸对细胞数目、细胞核面积、线粒体质量和线粒体膜电位的影响。考察不同药物浓度及药物作用孵育时间对细胞核和线粒体各指标的影响,在建立的适用于中药复杂体系的体外肝毒性快速评价方法的基础上初步阐明何首乌肝毒性的物质基础。
1 材料与方法 1.1 细胞系及培养条件人肝癌细胞株HepG2购自中国科学院典型培养物保藏委员会上海细胞库,在含10%胎牛血清(FBS)、1%双抗的DMEM完全培养基、37 ℃、5% CO2及饱和湿度条件下进行常规培养[21],所有实验均在细胞对数生长期进行。
1.2 药品及试剂DMEM(批号12800-017)及胰酶(批号1676922)均为Gbico公司产品;青链霉素(批号1697550)、胎牛血清(批号1658396)均为Hyclone公司产品;Hoechst 33342(批号H3570)、MitoTracker Deep Red FM(批号M22426)、Rhodamine 123(批号R-22420)荧光分子探针均为Invitrogen公司产品;鼠尾I型胶原(批号200110)为杭州生友生物技术有限公司产品;何首乌饮片(批号皖20100112)购自安徽亳州市远光中药饮片厂,经天津中医药大学中药教研室刘洋副教授鉴定为廖科植物何首乌Polygonum multijiorum Thunb. 的干燥块根;对照品大黄素(批号W00-1-5)、大黄酸(批号W11-8-8)、二苯乙烯苷(批号W13-1-4)、大黄酚(批号W11-2-7)、儿茶素(批号W15-1-5)、大黄素甲醚(批号W05-1-6)、没食子酸(批号W00-5-4)、芦荟大黄素(批号W24-0-3),质量分数均>98%,购自天津中新药业股份有限公司;阳性药碳酰氰-4-三氟甲氧基苯腙(FCCP,批号122M4004V)、对乙酰氨基酚(APAP,批号061M0042V)均来源于Sigma-Aldrich公司。醋酸乙酯、二氯甲烷、正丁醇均购自天津市大茂化学试剂厂。75 cm2/25 cm2培养瓶、96孔黑色透底细胞培养板均为Corning公司产品。
1.3 何首乌提取物的制备及药物配制 1.3.1 何首乌提取物的制备取适量何首乌饮片,称质量,打碎,分别用95%乙醇和纯水回流提取,将提取液浓缩至黏稠膏状。提取物稠膏用纯水溶解,再分别用二氯甲烷、醋酸乙酯、正丁醇进行萃取。各萃取液真空干燥至干浸膏状态,分别称质量,得到何首乌二氯甲烷提取物、醋酸乙酯提取物、正丁醇提取物、水提取物,4种不同极性提取物的收率分别为0.3%、1.3%、1.5%、12.0%(二氯甲烷提取物含大黄素0.24%、二苯乙烯苷类成分4%;醋酸乙酯提取物含没食子酸0.13%、大黄酸0.5%,含大黄素0.37%),−20 ℃避光密封保存。分别取何首乌不同极性提取物的干浸膏5 mg,精密称质量,用5 mL含10% FBS的DMEM高糖培养基溶解,超声助溶,0.22 μm无菌滤膜滤过,得质量浓度为1 mg/mL不同极性提取物溶液。各提取物溶液分别用含10% FBS的DMEM高糖培养基逐级稀释,得200、40、1 000 μg/mL的不同极性提取物的样品溶液。
1.3.2 阳性药的配制分别以10 μmol/L FCCP和10 mmol/L APAP为阳性对照,两药粉末先分别用DMSO溶解,然后用含10% FBS的DMEM高糖培养基稀释至所需浓度。
1.3.3 何首乌8种单体成分的配制分别精确称取适量的二苯乙烯苷、芦荟大黄素、大黄素甲醚、大黄酚、儿茶素、大黄素、大黄酸、没食子酸,DMSO溶解,然后用含10% FBS的DMEM高糖培养基将上述成分稀释至100、1、0.01 μmol/L。所有样品置于离心管中,−20 ℃密封保存待用。
1.4 利用HCA技术检测药物的肝毒性在96孔黑色透底细胞培养板中每孔加入鼠尾I型胶原50 μL,包被过夜后吸出剩余胶原,无菌纯水漂洗3次。收集对数生长期HepG2细胞,以每孔6 000个细胞的密度种板,100 μL/孔。37 ℃、5% CO2培养箱中培养24 h。弃去培养基,分别加入用含10% FBS的DMEM高糖培养基稀释的待测药物100 μL/孔,对照组加入等量培养基,37 ℃避光,5% CO2培养24 h。每孔加入含10% FBS、适宜浓度的Hoechst 33342、Mitotracker Deep Red FM、Rhodamine123 的DMEM高糖培养基50 μL,37 ℃避光,5% CO2培养30 min。弃去培养基,DMEM高糖培养基100 μL/孔漂洗1次。采用Perkin Elmer公司的HCA系统进行活细胞成像,选择Hoechst 33342、Mitotracker Deep Red FM、Rhodamine123通道,计算细胞数量、细胞核面积、线粒体质量、线粒体膜电位4种指标,考察药物对细胞生存率、细胞形态及线粒体功能的影响。
1.5 统计方法利用Perkin Elmer公司的Harmony 3.0及Columbus软件对高内涵图像进行数据量化。采用GraphPad Prism 5.0及SPSS 17.0数据统计软件对数据进行正态性检验和多组间单因素方差分析,分析方法为LSD。
2 结果 2.1 何首乌提取物的肝毒性比较何首乌4种不同极性提取物HCA系统肝毒性多指标检测结果见图 1,除水提物外,何首乌3种不同极性的提取物在高质量浓度(1 000 μg/mL)下对HepG2细胞均有一定毒性影响。与对照组相比,醋酸乙酯提取物和二氯甲烷提取物在1 000 μg/mL下细胞数量明显降低、细胞核面积减小,并且引起线粒体质量的明显改变(P<0.01)。醋酸乙酯提取物在1 000 μg/mL下还可以引起线粒体膜电位的显著下降(P<0.01)。与对照组相比,正丁醇萃取物1 000 μg/mL下也对HepG2细胞增殖、细胞核形态和线粒体质量产生影响(P<0.01)。
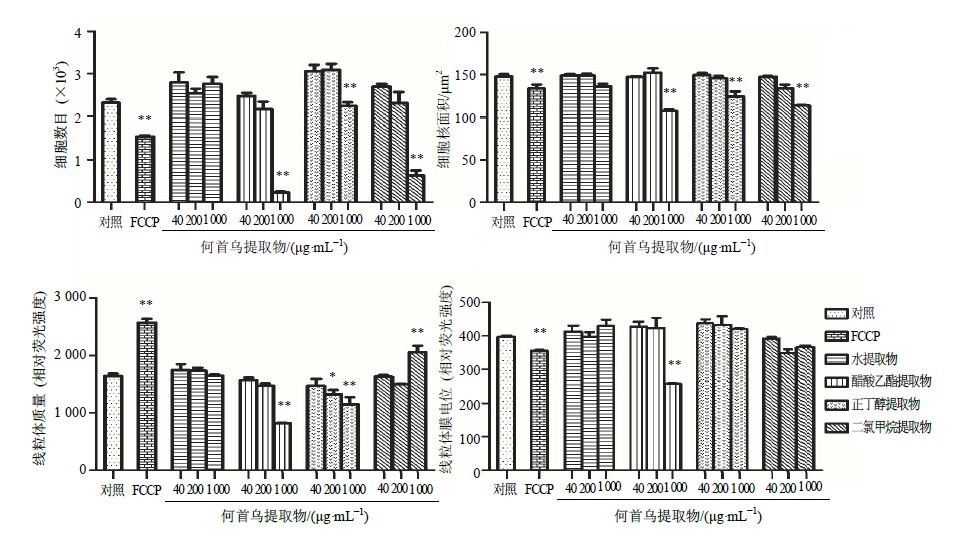
|
与对照组比较:P<0.05 **P<0.01,下同 P < 0.05 **P < 0.01 vs control group,same as below 图 1 何首乌不同提取物对HepG2细胞数目、细胞核面积、线粒体质量和线粒体膜电位的影响 (x±s,n = 3) Fig.1 Influence of different extracts from P. multijiorum on cell number,nucleus area,mitochondrial mass,and mitochondrial membrane potential of HepG2 cells (x±s,n = 3) |
利用高内涵分析仪观察细胞影像,可以直观发现何首乌3种不同极性的提取物(水提物除外)在高浓度(1 000 μg/mL)下使细胞数量明显减少、细胞核发生皱缩,荧光强度随之降低。醋酸乙酯提取物和正丁醇提取物线粒体荧光强度降低,质量显著降低;二氯甲烷提取物线粒体荧光强度升高,质量显著升高。何首乌醋酸乙酯提取物对HepG2细胞形态的影响结果见图 2。
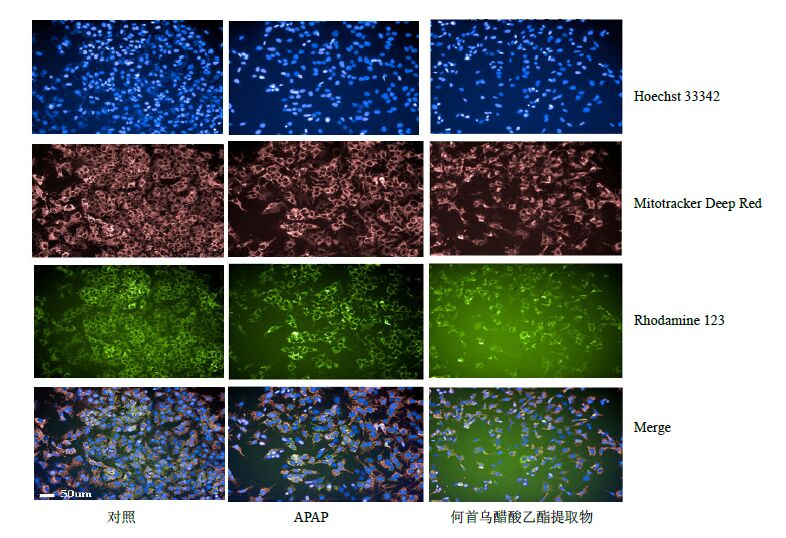
|
图 2 何首乌醋酸乙酯提取物对HepG2细胞形态的影响 Fig.2 Effect of ethyl acetate extract of P. multijiorum on HepG2 cells morphology |
2.2 不同浓度的8种何首乌单体成分对HepG2细胞的肝毒性
前期研究将何首乌的醋酸乙酯提取物和二氯甲烷提取物分别进行液相分析,发现其中量较多的成分主要有二苯乙烯苷、没食子酸及大黄素、大黄酸等蒽醌类成分。为了进一步考察何首乌主要成分中何种成分、在何种浓度下引起的肝损伤,本研究利用已建立的HCA肝毒性检测方法,以100、1、0.01 μmol/L浓度的二苯乙烯苷、芦荟大黄素、大黄素甲醚、大黄酚、儿茶素、大黄素、大黄酸和没食子酸孵育细胞,24 h后观察药物对HepG2细胞的影响,快速评价药物对细胞核的肝毒性效应。由图 3可知,何首乌8个单体成分在浓度为1、0.01 μmol/L时对HepG2的细胞数目和细胞核面积无明显影响。在浓度为100 μmol/L时,芦荟大黄素、大黄素、大黄酸、没食子酸可以引起细胞数目的明显下降,表明这4种成分会较大程度地抑制HepG2细胞增殖;此外,芦荟大黄素在100 μmol/L时细胞核面积明显增大,表明该药物能引起细胞核的肿胀。
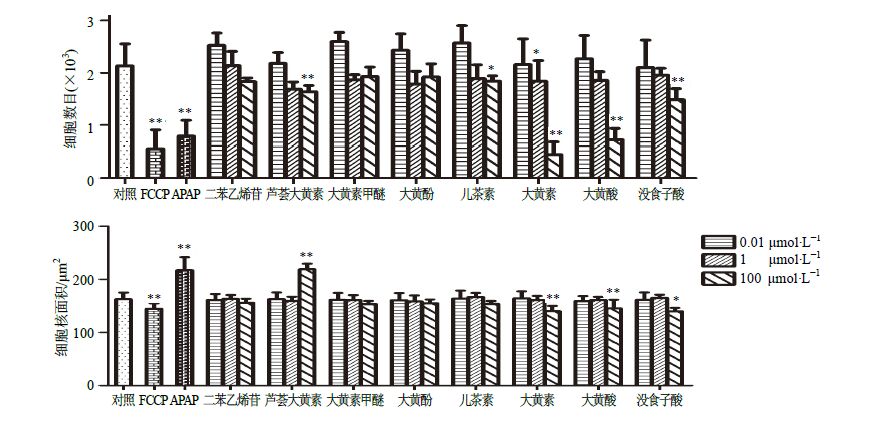
|
图 3 何首乌8种单体成分对HepG2细胞数目和细胞核面积的影响 (x±s,n = 3) Fig.3 Influence of eight components from P. multijiorum on cell number and nucleus area (x±s,n = 3) |
2.3 大黄素和大黄酸肝毒性的量效关系研究
何首乌可能通过细胞凋亡或线粒体异常引起肝脏不良反应。张瑞晨等[22]研究发现何首乌中的蒽醌类成分大黄素在高剂量(25、50 μg/mL)时可以明显抑制L02细胞生长,并且可以引起肝细胞S期阻滞,诱导细胞凋亡。为了考察何首乌中毒性较大的大黄素和大黄酸对HepG2细胞的肝毒性效应,本研究选取浓度分别为0.01、0.1、1、10、100、1 000 μmol/L的大黄素和大黄酸样品溶液孵育HepG2细胞,药物作用24 h后,利用HCA技术考察药物对HepG2细胞增殖、形态和线粒体的影响。由图 4和5可知,大黄素和大黄酸在10~1 000 μmol/L时细胞毒性显著增加,呈现一定的剂量依赖性。大黄素和大黄酸对HepG2细胞各指标的半数毒性浓度(TC50)分别为细胞数目140、53 μmol/L,细胞核面积148、933 μmol/L,线粒体质量1 153、1 001 μmol/L,线粒体膜电位946、13 μmol/L,与文献报道基本一致[23],进一步证实了该方法的可行性。
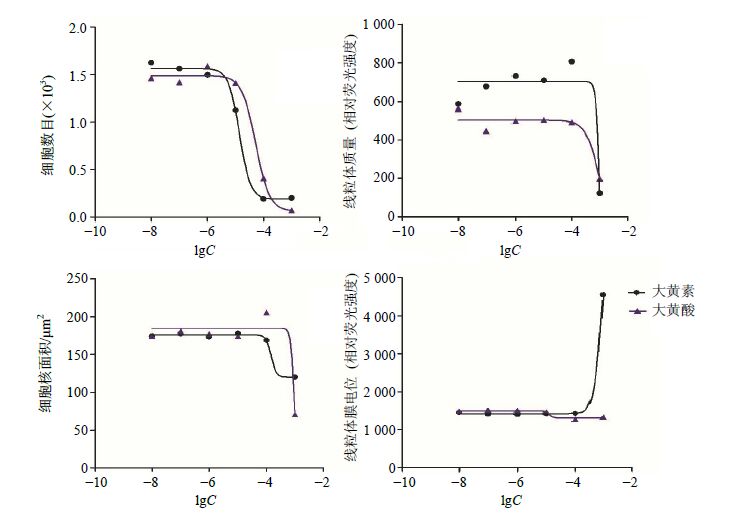
|
图 4 大黄素和大黄酸对HepG2细胞数目、细胞核面积、线粒体质量和线粒体膜电位的量效关系图 (x±s,n = 3) Fig.4 Dose-effect relationship of emodin and rhein on cell number,nucleus area,mitochondrial mass,and mitochondrial membrane potential of HepG2 cells (x±s,n = 3) |
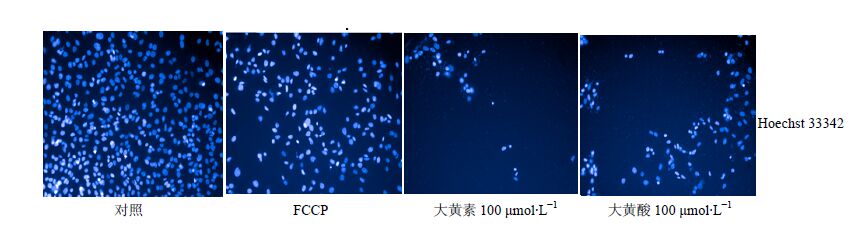
|
图 5 大黄素和大黄酸的HCA肝毒性代表图像 Fig.5 Representative HCA images of hepatotoxicityof emodin and rhein of P. multijiorum on HepG2 cells |
2.4 何首乌单体成分作用不同时间对HepG2细胞的肝毒性
据报道何首乌所致肝毒性可能与长期服用导致的体内蓄积有关,因此本研究利用HCA系统进一步考察了何首乌各单体药物二苯乙烯苷、芦荟大黄素、大黄素甲醚、大黄酚、儿茶素、大黄素、大黄酸、没食子酸在低浓度下(0.01 μmol/L)、不同的孵育时间(24、48、72 h)对细胞数目和细胞核面积的影响。如图 6所示,随着孵育时间的增加,细胞数目总体出现上升趋势,与对照组相比,何首乌的8种单体化合物均无显著性差异,说明药物在0.01 μmol/L时持续孵育72 h对细胞仍未见明显的毒性作用。
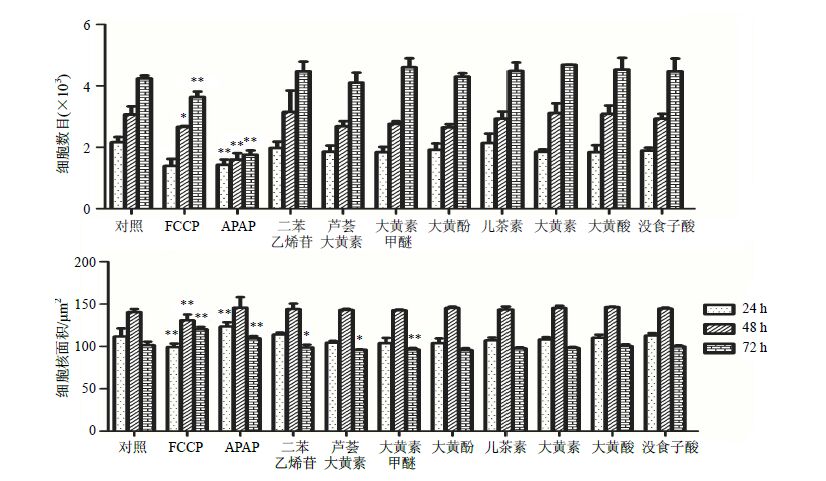
|
图 6 何首乌单体成分 (0.01 μmol/L) 时不同孵育时间对HepG2细胞细胞数目和细胞核面积的影响 (x±s,n = 3) Fig.6 Influence of different incubate time of eight components from P. multijiorum on cell number and nucleus area of HepG2 cells at concentration of 0.01 μmol/L (x±s,n = 3) |
3 讨论
FCCP是一种氧化磷酸化解偶联剂,通过改变线粒体膜通透性,降低线粒体膜电位,影响细胞生成ATP,对细胞进行损伤,即通过影响线粒体功能引起肝毒性[24]。对乙酰氨基酚(APAP)主要通过细胞色素P450代谢后产生的N-乙酰苯醌亚胺对细胞产生影响,即大剂量的APAP通过氧化应激等引起肝损伤[25]。本研究以这两种药物为阳性对照,力图从不同的影响机制对何首乌提取物及其主要成分对肝细胞多种形态学影响进行考察。
何首乌作为传统中草药的“四大仙草”之一,在临床上应用广泛,不仅可以用于高血脂、高血压、瘢痕性脱发(斑秃)、老年性疾病等的治疗,同时也广泛用于保健品和美容产品领域[23, 26]。但是近年来陆续出现服用何首乌及其制剂产生不良反应的报道,引起国内外药品监管部门的重视。肝脏是机体主要的代谢器官,也成为药物毒性的主要靶器官之一。通过检索CNKI中1950—2015年有关何首乌及其制剂不良反应的报道,发现何首乌不良反应以肝损伤最为常见[27-28]。药物性肝损伤是药物研发失败和上市药物撤市的常见原因之一[29-30]。
何首乌致肝损伤的确切机制和毒性物质尚不明了,综合分析现有临床肝毒性病例和文献报道,何首乌致肝毒性可能与脂质过氧化[27]、免疫损伤[27]、胆汁淤积性损伤[31]等引起的细胞凋亡有关,主要毒性成分可能为蒽醌类和鞣质类。目前何首乌肝毒性机制研究主要是利用动物在体实验观察给药后血清生化指标(如AST、ALT等)的变化或病理组织变化,或者利用体外细胞模型观察生化指标的变化。生化指标虽然在一定程度上可以反映肝功能,但是敏感性和特异性较低,无法及早预测其潜在毒性,且每次只能检测单个指标、通量低。而本研究所采用的HCA肝毒性评价方法,具有多指标、高通量的特点,可以同时评价何首乌中多种成分的多个指标。由于线粒体损伤是药物引起肝细胞凋亡的常见机制之一,而线粒体是细胞能量代谢中心,在ATP生成、钙离子储存和释放、氧自由基清除等过程中具有不可替代的作用[32]。在药物性肝损伤过程中,线粒体是机体初始损伤的重要靶点之一[33],所以本研究利用特异的荧光探针标记线粒体和细胞核,及早发现药物是否具有潜在的肝毒性,具有较高的灵敏度和特异性,可以为临床安全性用药提供参考。
从本研究的结果分析,何首乌醋酸乙酯提取物和二氯甲烷提取物在1 000 μg/mL时对HepG2细胞活力产生明显抑制作用;在此浓度时线粒体质量也产生明显改变,说明一定质量浓度的醋酸乙酯提取物和二氯甲烷提取物会对线粒体造成损伤。通过对2种提取物进行液相分析,发现醋酸乙酯提取物和二氯甲烷提取物中含有较多的蒽醌类、鞣质类和二苯乙烯苷类,因此选择其中的主要8种单体成分进一步检测。何首乌中的蒽醌类成分大黄素和大黄酸虽然量低于二苯乙烯苷,但是在同一浓度时蒽醌类成分却表现出明显的毒性效应,且大黄素和大黄酸在0.01~1 000 μmol/L 时对细胞增殖呈现一定的剂量依赖性抑制作用。何首乌8种单体成分在低浓度(0.01、1 μmol/L)时对HepG2细胞几乎无明显影响,而在100 μmol/L时大黄素、大黄酸、没食子酸和芦荟大黄素对细胞增殖和形态产生明显影响,这与文献所报道的体内动物实验蒽醌类成分可能引起肝毒性的研究相吻合[27]。由于动物实验具有较大的个体差异,且成本高,通量低,受到动物伦理学限制,而本研究的HCA多指标肝毒性体外检测方法可以克服以上动物实验的不足。综合分析本研究结果可知,何首乌的蒽醌类成分具有潜在的肝毒性,且何首乌引起的肝损伤与线粒体异常有关。
因临床上何首乌引起的肝损伤多是药物蓄积效应,即大剂量短时间和小剂量长时间服用何首乌或含何首乌的制剂引起的肝损伤症状[34]。本研究中药物孵育48、72 h对细胞并没有出现显著性差异,初步表明低浓度(0.01 μmol/L)的何首乌各单体成分在较短时间(72 h)内对细胞没有明显毒性。
但是有临床研究发现,有的患者服用很小剂量的何首乌或制剂时也可引起肝损伤,说明何首乌引起的肝损伤也可能是特异质肝损伤。特异质性肝损伤在临床上仅有小部分人群发生(通常发生率为1/1 000~1/10 000),在临床前药物评价实验中难以发现,只有大量人群应用后才会发现。但是要评价何首乌是否为特异质肝损伤,需要建立特殊的评价模型,如基于内毒素的特异质肝损伤模型[33]。
本研究中所选用的HepG2细胞来源于人类胚胎细胞瘤,具有人正常肝细胞的很多特点和功能,对外源化合物具有较强的代谢能力,且该细胞株成熟、稳定,易于培养,被广泛应用于药物的细胞毒性筛选。Schoonen 等发现与HeLa、ECC-1和CHO-k1等细胞株相比[36-37],HepG2细胞在肝毒性方面的预测性更高。
细胞数量与细胞存活率直接相关,是药物肝毒性检测中最重要、最灵敏的指标之一,对考察药物毒性有重要作用。细胞核的改变是细胞凋亡和细胞坏死的主要形态学标志[16]。在细胞凋亡及细胞坏死过程中,可见细胞核产生皱缩、碎裂等变化,因此本研究对8种何首乌单体进行初步筛选时选择细胞数目和细胞核面积2种最敏感、最准确的指标进行药物毒性的快速评价。
中药成分复杂、结构不明确,利用HCA系统研究中药活性或毒性的报道仍较少,因此HCA在中药领域的应用存在挑战性。由于中药物质基础成分的复杂性、作用的多靶点性和整体性,仅通过评价某些单体成分不能完全反映药物的综合情况,但是可以为其他含同类成分药物的安全性评价提供参考。本研究所建立的HCA肝毒性检测方法也需要进一步优化,选用不同的染料,考察药物对游离钙、溶酶体活性等更多指标的影响,也可以通过建立体外特异质肝损伤模型,利用HCA评价药物是否具有特异质效应,以期实现对潜在毒性药物快速筛选的基础上阐明其引起细胞毒性的具体机制,为中药单体成分肝毒性安全性评价及毒性发现提供科学依据。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 张瑞晨, 张超, 孙震晓, 等. 何首乌不同分离部位对人正常肝L02细胞和肝癌细胞HepG2细胞的杀伤作用[J]. 中国中药杂志 , 2012, 37 (12) :1830–1835. |
| [3] | 孙向红, 孙玉维, 李红, 等. 何首乌主要成分大黄素、大黄酸和二苯乙烯苷对肝细胞、肝癌细胞的影响[J]. 现代中西医结合杂志 , 2010, 19 (11) :1315–1319. |
| [4] | 俞捷, 谢洁, 赵荣华, 等. 何首乌肝脏不良反应研究进展[J]. 中草药 , 2010, 41 (7) :1206–1210. |
| [5] | 曹松松. 何首乌及其制剂致313例不良反应/事件综述[A]//中华中医药学会2014年医院药学分会学术年会、世界中联中药专业委员会2014年国际学术会议暨北京药师协会慢病防治药学专业委员会成立大会论文汇编[C]. 北京:中华中医药学会, 2014. |
| [6] | Dong H, Slain D, Cheng J, et al. Eighteen cases of liver injury following ingestion of Polygonum multiflorum[J]. Complement Therap Med , 2014, 22 (1) :70–74. DOI:10.1016/j.ctim.2013.12.008 |
| [7] | Yu J, Xie J, Mao X J, et al. Hepatoxicity of major constituents and extractions of Radix Polygoni Multiflori and Radix Polygoni Multiflori Praeparata[J]. J Ethnopharmacol , 2011, 137 (3) :1291–1299. DOI:10.1016/j.jep.2011.07.055 |
| [8] | 朱云, 刘树红, 王伽伯, 等. 何首乌及其制剂导致药物性肝损伤的临床分析[J]. 中国中西医结合杂志 , 2015, 35 (12) :1442–1447. |
| [9] | Lin L, Ni B, Lin H, et al. Traditional usages, botany, phytochemistry, pharmacology and toxicology of Polygonum multiflorum Thunb.:A review[J]. J Ethnopharmacol , 2015, 159 :158–183. DOI:10.1016/j.jep.2014.11.009 |
| [10] | 高绪聪, 柴振海, 张宗鹏. 药物性肝损伤的生物标志物及其评价的研究进展[J]. 中国药理学与毒理学杂志 , 2012, 26 (5) :692–696. |
| [11] | Zock J M. Applications of high content screening in life science research[J]. Comb Chem High Throughput Screen , 2009, 12 (9) :870–876. DOI:10.2174/138620709789383277 |
| [12] | Laia Tolosa, Gómez-Lechón M J, Donato M T. High-content screening technology for studying drug-induced hepatotoxicity in cell models[J]. Arch Toxicol , 2015, 89 (7) :1007–1022. DOI:10.1007/s00204-015-1503-z |
| [13] | 胡经阳, 严春琳, 朱彦, 等. 高内涵筛选应用于中药现代化的前景展望[J]. 天津中医药大学学报 , 2013, 32 (2) :120–124. |
| [14] | 王俨如, 陶晓倩, 胡玉梅, 等. 基于高内涵技术的20种中药提取物对β淀粉样蛋白致SH-SY5Y细胞损伤保护作用研究[J]. 中草药 , 2016, 47 (2) :267–274. |
| [15] | Martin H L, Adams M, Higgins J, et al. High-content, high-throughput screening for the identification of cytotoxic compounds based on cell morphology and cell proliferation markers[J]. PLoS One , 2014, 9 (2) :1–8. |
| [16] | O'Brien P J, Irwin W, Diaz D, et al. High concordance of drug-induced human hepatotoxicity with in vitro cytotoxicity measured in a novel cell-based model using high content screening[J]. Arch Toxicol , 2006, 80 (9) :580–604. DOI:10.1007/s00204-006-0091-3 |
| [17] | Wang M, Liu C X, Dong R R, et al. Safety evaluation of chinese medicine injections with a cell imaging-based multiparametric assay revealed a critical involvement of mitochondrial function in hepatotoxicity[J]. Evid-Based Complement Alternat Med , 2015 . DOI:10.1155/2015/379586 |
| [18] | Valerie Y S, Edward L L, Linda G G, et al. In vitro models for liver toxicity testing[J]. Toxicol Res (Camb) , 2013, 2 (1) :23–39. DOI:10.1039/C2TX20051A |
| [19] | 姚晓峰, 仲来福. 人肝癌细胞系HepG2在遗传毒物检测中的应用及其进展[J]. 世界华人消化杂志 , 2007, 15 (2) :145–150. |
| [20] | Russmann S, Kullak-Ublick G A, Grattagliano I. Current concepts of mechanisms in drug-induced hepatotoxicity[J]. Curr Med Chem , 2009, 16 (23) :3041–3053. DOI:10.2174/092986709788803097 |
| [21] | Chen Y N, Cheng C C, Chen J C, et al. Norcantharidin-induced apoptosis is via the extracellular signal-regulated kinase and c-Jun-NH2-terminal kinase signaling pathways in human hepatoma HepG2 cells[J]. Br J Pharmacol , 2003, 140 (3) :461–470. DOI:10.1038/sj.bjp.0705461 |
| [22] | 张瑞晨, 刘斌, 孙震晓, 等. 何首乌提取物对人正常肝细胞L02周期阻滞及凋亡的影响[J]. 中西医结合学报 , 2010, 8 (6) :554–561. |
| [23] | 冯婧怡, 王文刚, 王爱平, 等. 何首乌毒性的研究进展[J]. 中国药房 , 2014, 25 (43) :4116–4118. |
| [24] | Kuruvilla S, Qualls C J, Tyler R D, et al. Effects of minimally toxic levels of carbonyl cyanide P-(trifluoromethoxy) phenylhydrazone (FCCP), elucidated through differential gene expression with biochemical and morphological correlations[J]. Toxicol Sci , 2003, 73 (2) :348–361. DOI:10.1093/toxsci/kfg084 |
| [25] | Jaeschke H, McGill M R, Ramachandran A. Oxidant stress, mitochondria, and cell death mechanisms in drug-induced liver injury:Lessons learned from acetaminophen hepatotoxicity[J]. Drug Metabol Rev , 2012, 44 (1) :88–106. DOI:10.3109/03602532.2011.602688 |
| [26] | 梅雪, 余刘勤, 陈小云, 等. 何首乌化学成分和药理作用的研究进展[J]. 药物评价研究 , 2016, 39 (1) :122–131. |
| [27] | 潘雪梅, 房德敏. 制何首乌致肝损伤毒性的研究进展[J]. 天津药学 , 2015, 27 (6) :57–62. |
| [28] | 王敏江, 林佩, 李云飞, 等. 何首乌不同炮制品对肝细胞脂代谢的干预作用研究[J]. 现代药物与临床 , 2013, 28 (4) :494–499. |
| [29] | Bale S S, Vernetti L, Senutovitch N, et al. In vitro platforms for evaluating liver toxicity[J]. Exp Biol Med , 2014, 239 (9) :1180–1191. DOI:10.1177/1535370214531872 |
| [30] | Yano A, Oda S, Fukami T, et al. Development of a cell-based assay system considering drug metabolism and immune- and inflammatory-related factors for the risk assessment of drug-induced liver injury[J]. Toxicol Lett , 2014, 228 (1) :13–24. DOI:10.1016/j.toxlet.2014.04.005 |
| [31] | 王涛, 王佳颖, 江振洲, 等. 何首乌水提物大鼠连续灌胃给药28 d肝毒性研究——胆汁淤积相关性分析[J]. 中国中药杂志 , 2012, 37 (10) :1445–1450. |
| [32] | 金家金. 诃子肝毒性研究及高内涵肝毒性筛选方法的初探[D]. 北京:北京中医药大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10026-1015390096.htm |
| [33] | 郭家彬, 彭辉, 王以美, 等. 线粒体毒性评价及其在创新药物安全性评价中的意义[J]. 中国新药杂志 , 2012, 21 (16) :1867–1871. |
| [34] | 孙震晓, 张力. 何首乌相关肝损害文献回顾性分析[J]. 药物不良反应志 , 2010, 12 (1) :26–30. |
| [35] | 李春雨, 李晓菲, 涂灿, 等. 基于内毒素模型的何首乌特异质肝损伤评价[J]. 药学学报 , 2015, 50 (1) :28–33. |
| [36] | Schoonen W G, Westerink W M, de Roos J A, et al. Cytotoxic effects of 100 reference compounds on HepG2 and HeLa cells and of 60 compounds on ECC-1 and CHO cells. I. Mechanistic assays on ROS, glutathione depletion and calcein uptake[J]. Toxicol In Vitro , 2005, 19 (4) :505–516. DOI:10.1016/j.tiv.2005.01.003 |
| [37] | Schoonen W G, Westerink W M, de Roos J A, et al. Cytotoxic effects of 110 reference compounds on HepG2 and for 60 compounds on HeLa, ECC-1 and CHO cells. I. Mechanistic assays on NAD (P) H, ATP, and DNA contents[J]. Toxicol In Vitro , 2005, 19 (4) :491–503. DOI:10.1016/j.tiv.2005.01.002 |
 2016, Vol. 47
2016, Vol. 47


