2. 重庆医科大学 干细胞与组织工程研究室, 组织学与胚胎学教研室, 重庆 400016
2. Laboratory of Stem Cell and Tissue Engineering, Department of Histology and Embryology, Chongqing Medical University, Chongqing 400016, China
细胞衰老被认为是细胞和组织损伤的累积所导致,其中活性氧(ROS)是引起细胞损伤最主要的原因,去乙酰化酶SIRT1(沉默调节因子1)在线粒体调控及清除ROS过程中发挥重要功能,SIRT1通过抑制核转录因子-κB(NF-κB)通路,缓解细胞内ROS的负荷而延缓细胞的衰老[1-2]。
人参皂苷Rg1是人参重要的活性成分,具有补气生血、延缓衰老等功效[3],本课题组前期研究发现人参皂苷Rg1在体内、外均具有延缓造血干/祖细胞(HSC/HPC)衰老的作用,但其靶向调控分子仍不清楚。本研究将人参皂苷Rg1作用于D-半乳糖(D-gal)致大鼠衰老模型,检测人参皂苷Rg1对衰老模型大鼠Sca-1+ HSC/HPC衰老的作用,探讨SIRT1/NF-κB信号轴在人参皂苷Rg1延缓HSC/HPC衰老中的调控作用,为探寻延缓HSC衰老及机体衰老的途径提供理论及实验依据。
1 材料 1.1 实验动物雄性SD大鼠,3月龄,体质量210~250 g,由重庆医科大学实验动物中心提供,动物合格证号:SCXK(渝)2007-0001。
1.2 药品与试剂人参皂苷Rg1(吉林宏久生物科技有限公司,质量分数>95%,批号060427),D-gal(Amresco公司);IMDM、胎牛血清、马血清(Gibco公司);Anti-Sca-1+ Micro Bead Kit(Miltenyi公司);衰老相关β-半乳糖苷酶(SA-β-Gal)染色试剂盒(Cell Signaling 公司);Trizol、荧光定量PCR试剂、sybr green I(TaKaRa公司),PCR引物(Invitrogen公司);t-BHP、Ficoll分离液、L-谷氨酰胺、甲基纤维素(Sigma公司);重组人粒细胞巨噬细胞集落刺激因子(rhGM-CSF)、重组人促红细胞生成素(rhEPO),麒麟鲲鹏生物药业有限公司,SIRT1、NF-κB一抗、HRP二抗(SantaCruz公司);蛋白裂解液(Applygen公司);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);ECL发光试剂盒(Pierce公司)。
1.3 仪器7900HT荧光定量PCR仪(ABI,美国);MiniPROTEAN 3垂直凝胶电泳槽(Bio Rad,美国);165-8001印迹电泳转移系统(Bio Rad,美国);GelDoc It TS2凝胶成像和分析系统(Bio Rad,美国)。
2 方法 2.1 实验分组、造模及给药雄性SD大鼠随机分为对照组、模型组、人参皂苷Rg1对照组、人参皂苷Rg1治疗组和人参皂苷Rg1预防组,每组10只。对照组:大鼠颈背部sc生理盐水0.2 mL/只,每天1次,连续42 d;模型组:大鼠颈背部sc D-gal 120 mg/kg,每天1次,连续42 d;人参皂苷Rg1对照组:大鼠颈背部sc生理盐水0.2 mL/只,每天1次,连续7 d,然后ip人参皂苷Rg1(20 mg/kg[4]),连续35 d;人参皂苷Rg1治疗组:大鼠颈背部sc D-gal 120 mg/kg,每天1次,连续42 d,第8天起ip人参皂苷Rg1(20 mg/kg),连续35 d;人参皂苷Rg1预防组:大鼠先ip给予人参皂苷Rg1(20 mg/kg)预处理,连续7 d,接着颈背部sc D-gal 120 mg/kg,每天1次,连续42 d,于D-gal注射后第8天起ip人参皂苷Rg1(20 mg/kg),连续35 d。模型构建及药物注射完成2 d后,免疫磁性分选法[5]提取各组大鼠Sca-1+ HSC/HPC进行相关检测。
2.2 SA-β-Gal染色收集各组Sca-1+ HSC/HPC,按照SA-β-Gal 染色试剂盒方法操作,染色后离心甩片,70%甘油封片镜检。每张甩片随机计数400个细胞,观察和计数阳性细胞的百分比。
2.3 流式细胞术分析细胞周期收集各组Sca-1+ HSC/HPC细胞,PBS洗1次,70%冰乙醇固定过夜,PBS洗涤2次,加入100 μL牛胰核糖核酸酶(1 mg/mL),37 ℃水浴孵育30 min;加入碘化丙啶染色液(50 μg/mL)避光反应30 min,流式细胞仪检测,Multicycle软件(日本PHENIX公司)分析各组细胞的细胞周期时相。
2.4 造血祖细胞混合集落(CFU-Mix)培养参照文献方法[6]改进,依次加入2-巯基乙醇(0.1 mmol/L)、3% L-谷氨酰胺、马血清、rhEPO、白细胞介素-3(IL-3)、rhGM-CSF、1×104个各组细胞、2.7%甲基纤维素,总体积2 mL,充分混匀后接种于96孔板(0.2 mL/孔),在37 ℃、含5% CO2饱和湿度的培养箱中培养7 d,根据种植Sca-1+ HSC/HPC数与形成CFU-Mix数评价各组细胞形成CFU-Mix能力与多向分化潜能。
2.5 荧光定量PCR检测SIRT1、NF-κB mRNA的表达收集各组Sca-1+ HSC/HPC,Trizol裂解,分别提取各组细胞总RNA。逆转录为相应的cDNA,逆转录反应条件:42 ℃、30 min,99 ℃、5 min,5 ℃、5 min。以RNA反转录得到的cDNA为模板,扩增SIRT1、NF-κB,以β-actin为内参照。引物序列见表 1。PCR扩增条件:94 ℃、4 min;94 ℃、20 s,60 ℃、30 s,72 ℃、30 s,35个循环;72 ℃检测信号。应用Quantity One(Bio Rad)软件进行数据处理,分析结果。
|
|
表 1 荧光定量PCR引物序列 Table 1 Primers sequence of FQ-PCR |
2.6 Western blotting检测SIRT1、NF-κB蛋白的表达
收集各组Sca-1+ HSC/HPC,分别提取总蛋白,按BCA蛋白浓度测定试剂盒方法测定总蛋白浓度。取等量总蛋白经SDS-PAGE电泳分离后转移至PVDF膜;5%脱脂奶粉封闭2 h,加入兔抗鼠SIRT1、NF-κB一抗(1∶200),4 ℃过夜;TBST缓冲液充分漂洗后加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000),室温反应2 h;TBST充分洗膜3次,ECL增强发光试剂显色后,于凝胶成像系统曝光,显影定影后观察结果。
2.7 统计学处理运用SPSS 11.0软件进行实验数据统计学处理,采用析因设计、单因素方差分析方法,数据均以x±s表示。
3 结果 3.1 对Sca-1+ HSC/HPC SA-β-Gal染色阳性率的影响与对照组比较,模型组SA-β-Gal染色阳性细胞百分比显著增高(P<0.05),人参皂苷Rg1对照组与对照组之间无统计学差异;人参皂苷Rg1治疗组及预防组SA-β-Gal染色阳性细胞百分比低于模型组(P<0.05),且人参皂苷Rg1预防组SA-β-Gal阳性细胞百分比较人参皂苷Rg1治疗组低(P<0.05)。见表 2。
3.2 对Sca-1+ HSC/HPC形成CFU-Mix能力的影响与对照组比较,模型组形成CFU-Mix数量减少(P<0.05),人参皂苷Rg1对照组形成CFU-Mix数量增加(P<0.05);与模型组比较,人参皂苷Rg1治疗及预防组形成CFU-Mix数量增加(P<0.05),人参皂苷Rg1预防组变化较人参皂苷Rg1治疗组显著(P<0.05)。见表 2。
|
|
表 2 人参皂苷Rg1对Sca-1+ HSC/HPC SA-β-Gal染色阳性率和CFU-Mix形成的影响 (x±s,n = 6) Table 2 Effect of Rg1 on percentage of SA-β-Gal staining positive cells and number of CFU-Mix forming of Sca-1+ HSC/HPC (x±s,n = 6) |
3.3 对Sca-1+ HSC/HPC细胞周期分布的影响
与对照组比较,模型组G0/G1期比例明显增高(P<0.05),S期比例减少(P<0.05),S+G2/M比例明显降低;人参皂苷Rg1对照组G0/G1期比例低于对照组(P<0.05),S+G2/M比例高于对照组;与模型组组相比,人参皂苷Rg1治疗组及预防组G0/G1期比例明显降低(P<0.05),S+G2/M比例显著增高,其中人参皂苷Rg1治疗组变化最为明显(P<0.05)。见表 3。
|
|
表 3 人参皂苷Rg1对Sca-1+ HSC/HPC细胞周期分布的影响 (x±s,n = 6) Table 3 Effect of Rg1 on distribution of cell cycle to Sca-1+ HSC/HPC (x±s,n = 6) |
3.4 对Sca-1+ HSC/HPC SIRT1和NF-κB mRNA表达的影响
与对照组比较,人参皂苷Rg1对照组SIRT1 mRNA表达升高(P<0.05),NF-κB mRNA表达下降(P<0.05);模型组SIRT1 mRNA表达低于对照组(P<0.05)、NF-κB mRNA表达高于对照组(P<0.05);与模型组比较,人参皂苷Rg1 治疗组及预防组SIRT1 mRNA表达上调(P<0.05),NF-κB mRNA表达下调(P<0.05),人参皂苷Rg1预防组各指标变化较治疗组显著(P<0.05)。见图 1。
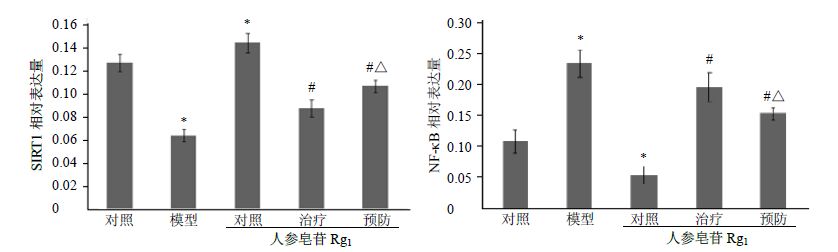
|
与对照组比较:P<0.05;与模型组比较:#P<0.05;与人参皂苷Rg1治疗组比较:△P<0.05,图 2同 P < 0.05 vs control group; #P < 0.05 vs model group; △P < 0.05 vs ginsenoside Rg1 treatment group,Figure 2 is same 图 1 人参皂苷Rg1对Sca-1+ HSC/HPC SIRT1和NF-κB mRNA表达的影响 (x±s,n = 6) Fig.1 Effect of Rg1 on expression of Sca-1+ HSC/HPC SIRT1 and NF-κB mRNA of aging model rat (x±s,n = 6) |
3.5 对Sca-1+ HSC/HPC SIRT1、NF-κB蛋白表达的影响
与对照组比较,模型组SIRT1蛋白表达下降(P<0.05),NF-κB蛋白表达增高(P<0.05),人参皂苷Rg1对照组较对照组SIRT1蛋白表达增高(P<0.05),NF-κB蛋白表达下降(P<0.05);与模型组比较,人参皂苷Rg 1治疗及预防组SIRT1蛋白表达上调(P<0.05),NF-κB蛋白表达下调(P<0.05);其中Rg1预防组变化较治疗组更为显著(P<0.05)。见图 2。
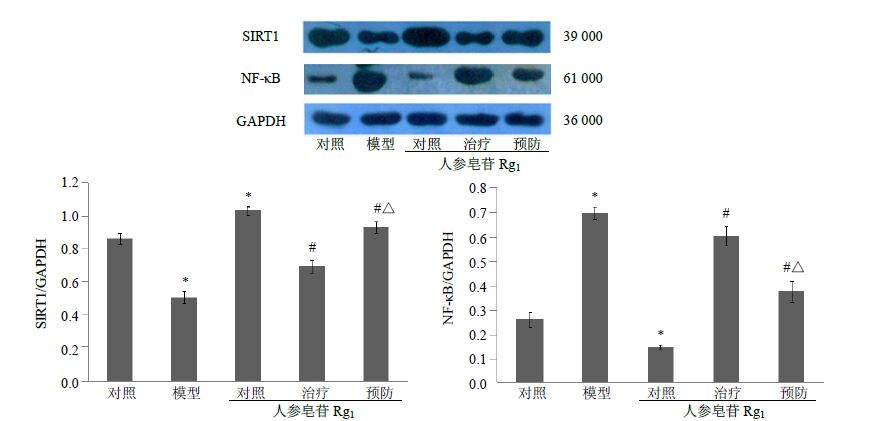
|
图 2 人参皂苷Rg1对Sca-1+ HSC/HPC SIRT1和NF-κB蛋白表达的影响 (x±s,n = 6) Fig.2 Effect of Rg1 on expression of Sca-1+ HSC/HPC SIRT1 and NF-κB protein of aging model rat (x±s,n = 6) |
4 讨论
现代药理学研究发现[7-8],人参皂苷Rg1是人参延缓衰老的主要活性成分,人参皂苷Rg1具有延缓成纤维细胞衰老的作用,能延长老年大鼠的存活时间,并可显著改善老年大鼠衰退的行为活动功能。本课题组既往研究[9]发现人参皂苷Rg1在体外可通过调控细胞周期调控分子(p16INK4a、p19Arf、p53、p21Cip1/Waf1)发挥其延缓小鼠Sca-1+ HSC/HPC衰老的作用。但人参皂苷Rg1延缓Sca-1+ HSC/HPC衰老的机制仍不清楚,人参皂苷Rg1延缓Sca-1+ HSC/HPC衰老的靶向调控分子是目前关注的热点问题。
本实验将人参皂苷Rg1作用于D-Gal诱导的大鼠衰老模型,结果提示人参皂苷Rg1治疗及预防处理后,Sca-1+ HSC/HPC G0/G1期细胞比例及形成CFU-Mix数量高于模型组,SA-β-Gal染色阳性率低于模型组,提示人参皂苷Rg1增强了Sca-1+ HSC/HPC自我更新及多向分化潜能增强,人参皂苷Rg1具有延缓D-Gal诱导的大鼠衰老模型中Sca-1+ HSC/HPC衰老的作用。
NF-κB是与衰老密切相关的调节因子,NF-κB过表达引起培养细胞出现衰老表型,抑制NF-κB表达,将诱发小鼠胚胎成纤维细胞产生逃避衰老的能力,从而延缓细胞衰老发生[10-11]。活性氧(ROS)是引起细胞累积性损伤,致细胞衰老最主要的原因。去乙酰化酶家族是营养代谢循环过程中重要调控因子,其中SIRT1在线粒体调控及清除ROS过程中发挥重要功能,SIRT1可通过抑制NF-κB通路缓解细胞内ROS的负荷从而发挥延缓细胞衰老的功能[12];研究发现[13]SIRT1可增强正常HSCs线粒体的稳定性及清除ROS的能力,SIRT1可上调衰老的HSCs自我更新潜能,发挥延缓HSCs衰老的作用。本研究发现模型组Sca-1+ HSC/HPC SIRT1表达下降,NF-κB表达增高,这与细胞衰老过程中SIRT1与NF-κB表达改变一致。人参皂苷Rg1作用于衰老模型后,SIRT1表达上调,NF-κB表达下调,说明人参皂苷Rg1增强了Sca-1+ HSC/HPC内SIRT1的表达,增高的SIRT1抑制了下游调控分子NF-κB的表达。该结果提示人参皂苷Rg1可通过调控SIRT1-NF-κB信号通路发挥延缓D-Gal诱导的大鼠衰老模型中Sca-1+ HSC/HPC衰老的作用。
| [1] | Ulkan K, Ozlem G, Ufuk E, et al. A remarkable age-related increase in SIRT1 protein expression against oxidative stress in elderly:SIRT1 gene variants and longevity in human[J]. PLoS One , 2015, 10 (3) :1–19. |
| [2] | Hubbard B P, Sinclair D A. Small molecule SIRT1 activators for the treatment of aging and age-related diseases[J]. Trends Pharmacol Sci , 2014, 35 (3) :146–154. DOI:10.1016/j.tips.2013.12.004 |
| [3] | Xu F T, Li H M, Yin Q S, et al. Effect of ginsenoside Rg1 on proliferation and neural phenotype differentiation of human adipose-derived stem cells in vitro[J]. Can J Physiol Pharmacol , 2014, 92 (6) :467–475. DOI:10.1139/cjpp-2013-0377 |
| [4] | 彭彬, 陈茂山, 蒲莹, 等. 人参皂苷Rg1延缓D-半乳糖大鼠脑衰老作用及机制的初步研究[J]. 重庆医科大学学报 , 2011, 6 (4) :419–422. |
| [5] | Challen G A, Sun D, Mayle A, et al. Dnmt3a and Dnmt3b have overlapping and distinct functions in hematopoietic stem cells[J]. Cell Stem Cell , 2014, 15 (3) :350–364. DOI:10.1016/j.stem.2014.06.018 |
| [6] | Wang J, Sun Q, Morita Y, et al. A differentiation checkpoint limits hematopoietic stem cell self-renewal in response to DNA damage[J]. Cell , 2012, 148 (5) :1001–1014. DOI:10.1016/j.cell.2012.01.040 |
| [7] | Chu S F, Zhang J T. New achievements in ginseng resrarch and its future prospects[J]. Chin J Integr Med , 2009, 15 (6) :403–408. DOI:10.1007/s11655-009-0403-6 |
| [8] | Zhu J H, Mu X Y, Zeng J, et al. Ginsenoside Rg1 prevents cognitive impairment and hippocampus senescence in a rat model of D-galactose-induced aging[J]. PLoS One , 2014, 9 (6) :1–12. |
| [9] | 周玥, 杨斌, 姜蓉, 等. 人参皂苷Rg1延缓造血干细胞衰老及其相关机制[J]. 中华医学杂志 , 2010, 90 (48) :3421–3425. |
| [10] | Wang Y, Liu Y, Zhang X Y, et al. Ginsenoside Rg1 regulates innate immune responses in macrophages through differentially modulating the NF-κB and PI3K/Akt/mTOR pathways[J]. Int Immunopharmacol , 2014, 23 (1) :77–84. DOI:10.1016/j.intimp.2014.07.028 |
| [11] | Tanaka Y T, Tanaka K, Kojima H, et al. Cynaropicrin from Cynara scolymus L. suppresses photoaging of skin by inhibiting the transcription activity of nuclear factor-κB[J]. Bioorg Med Chem Lett , 2013, 23 (2) :518–523. DOI:10.1016/j.bmcl.2012.11.034 |
| [12] | Brownl K, Xie S, Qiu X L, et al. SIRT3 reverses aging-associated degeneration[J]. Cell Rep , 2013, 3 (2) :319–327. DOI:10.1016/j.celrep.2013.01.005 |
| [13] | Kaarniranta K, Kauppinen A. Crosstalk between oxidative stress and SIRT1:Impact on the aging process[J]. Antero Salminen Int J Mol Sci , 2013, 14 (2) :3834–3859. DOI:10.3390/ijms14023834 |
 2016, Vol. 47
2016, Vol. 47



