2. 国药集团广东环球制药有限公司, 广东 佛山 528200
2. Sinopharm Group Guangdong Medi-world Pharmaceutical Co., Ltd., Foshan 528200, China
板蓝根Isatidis Radix(IR)来源于十字花科(Cruciferae)菘蓝属Istatis L. 植物菘蓝Isatis indigotica Fort. 的干燥根[1],常用于治疗流感等病毒感染性疾病,临床疗效确切。《中国药典》2015年版采用煎煮法制备供试品溶液,以 (R,S)-告依春为定量指标对其进行质量控制,但在研究过程中发现,板蓝根超声提取时 (R,S)-告依春量高于煎煮法,且不同产地板蓝根超声滤过样品均存在随时间延长(R,S)-告依春的量不断增加、数小时方终止的现象。(R,S)-告依春是表原告依春(epiprogoitrin)、原告依春(progoitrin)在内源性黑芥子酶(myrosinase)催化下的降解产物[2],通常芥子苷通过不同侧链长度和结构的降解产物来发挥生物活性[3],但芥子苷本身是否具有生物活性则鲜有报道。芥子苷-黑芥子酶系统的降解路径及产物相对清晰,其他多种途径如热降解、化学降解、微生物降解等较为复杂,不同条件下的降解产物差异较大。研究表明[4],(R,S)-告依春为已知的芥子苷酶解产物,有明显的抗流感病毒作用,但其前体物质是否具有抗病毒活性,以及其化学成分与抗流感病毒神经氨酸酶(neuraminidase,NA)活性的相关性未见文献报道。流感病毒NA是影响流感病毒复制、感染和致病的关键酶,NA抑制剂可以通过抑制NA活性而有效地控制流感症状和疾病的传播,NA活性可以通过检测荧光的变化被表征,NA活性荧光检测法已发展为抗病毒药物的筛选和活性评价的重要方法[5]。
本实验采用底物荧光法(fluorometric assay with 4-methylumbelliferyl-N-acetyl-α-D-neuraminic acid,FL-MUNANA method)检测板蓝根体外抑制NA的生物活性,建立基于病毒NA活性检测的板蓝根抗病毒活性评价方法[6-7]。通过对化学分析结果与经典的流感病毒NA抑制实验结果进行关联分析,探索板蓝根抗病毒的活性物质,探讨板蓝根提取工艺的合理性。
1 仪器与材料板蓝根药材,批号1311004、1403204、1406408、1407403、1407406、1408403、1504221、1504222和1504223,产地山东;批号1406409、1407404,产地甘肃;批号1406410、1407405,产地黑龙江;批号1407402,产地安徽;批号1407401,产地河南;批号1406403,产地陕西;分别编号为S1~S16,经广东省药物新剂型重点实验室中药组何伟教授鉴定,原植物为十字花科菘蓝属植物菘蓝Isatis indigotica Fort. 的干燥根;达菲胶囊,批号B3017,主要成分为磷酸奥 司他韦,上海罗氏制药有限公司;NA抑制剂筛选试剂盒P0309,批号0802151509、1003191511,江苏碧云天生物技术研究所;(R,S)-告依春对照品(批号111753-201304,质量分数99.9%)、腺苷对照品(批号110876-200204,质量分数100.0%),中国食品药品检定研究院;尿苷对照品,批号8-SCC-56-1,质量分数98.0%,Toronto Research Chemicals Inc.;鸟苷对照品,批号LE20O31,质量分数98.0%,北京百灵威科技有限公司;甲醇,HPLC级,Merck公司;蒸馏水,Watsons公司;其他试剂均为分析纯。
超高效液相色谱仪,美国Waters公司;分析柱为Phenomen Kinetex(100 mm×4.6 mm,2.6 μm);CP225D型电子分析天平、BS224S型电子分析天平,德国Sartorius公司;Varioskan Flash全波长扫描式多功能酶标仪,美国Thermo Scientific公司;96孔荧光酶标板,上海蔚宏生物科技有限公司;微量加样器,50、200、1 000 μL,美国Thermo Scientific公司。
2 方法与结果 2.1 化学成分分析 2.1.1 色谱条件使用Waters Acquity UPLC H-Class液相色谱仪,色谱柱为Phenomen Kinetex(100 mm×4.6 mm,2.6 μm),流动相为甲醇-0.02%磷酸水溶液,梯度洗脱:0~4 min,1%~3%甲醇;4~14 min,3%~8%甲醇;14~15 min,8%~50%甲醇;15~16 min,50%~1%甲醇;16~17 min,1%甲醇;体积流量为0.6 mL/min;柱温为30 ℃;检测波长为254、229 nm;进样量为2 μL。
2.1.2 混合对照品溶液的制备[8]分别取对照品尿苷、鸟苷、(R,S)-告依春及腺苷约10、10、20、12.5 mg,精密称定,共置50 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得混合对照品储备液;精密量取上述溶液1 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,制得含尿苷20.58 μg/mL、鸟苷20.70 μg/mL、(R,S)-告依春40.68 μg/mL及腺苷25.06 μg/mL的混合对照品溶液。
2.1.3 供试品溶液的制备(1)提取溶剂的选择:参考《中国药典》2015年版板蓝根项下配制方法[1],分别选用6种不同溶媒(水,乙醇,5%、10%、30%、50%甲醇)各50 mL进行提取,回流2 h,放冷,用相应溶剂补足减失的质量,考察不同溶剂的提取结果,见表 1。经比较,乙醇提取时色谱峰峰形不佳,纯水和5%、10%甲醇提取率较高且较接近,提取率随着甲醇体积分数的升高而降低。因纯水价廉易得,故选取水为提取溶剂。
|
|
表 1 不同溶剂提取药材 (批号1407403) 比较 Table 1 Comparison on medicinal material (batch 1407403) extracted by different solvents |
(2)提取方法的考察:取同批板蓝根药材(批号1406408),采用水作为溶剂,比较煎煮、超声(功率300 W)、回流3种方法的提取效果,结果见表 2。
|
|
表 2 煎煮法、回流法与超声法结果比较 Table 2 Comparison on decocting,reflux,and ultrasonic methods |
结果表明煎煮法和回流法提取效果相当,超声法30 min已达前2法提取2 h效果,但超声提取的供试品不稳定,其在室温放置过程中,(R,S)-告依春量显著上升,直至12 h后才趋于稳定,这与文献报道的板蓝根中可能存在 (R,S)-告依春的前体,并在自身酶催化下水解相符[8]。因此,选取《中国药典》2015年版规定的煎煮法和超声法为供试品制备方法进一步研究验证。
综上,取药材粉末(过4号筛)约1 g,共2份,精密称定,置具塞锥形瓶中,加入水50 mL,密塞,称定质量,超声提取1 h,对比《中国药典》提取方法煎煮2 h,放冷,再称定质量,用水补足减失的质量,摇匀,滤过,取续滤液,依法进样,0 h和12 h的色谱图见图 1。比较图 1中2种提取法制得样品所采集的254 nm波长色谱图,发现板蓝根超声提取时 (R,S)-告依春量高于煎煮法,且超声提取样品滤过放置后存在 (R,S)-告依春量增长数倍的现象。推测可能存在前体物质,经查阅文献,(R,S)- 告依春是芥子苷类成分表告依春、告依春的酶解产物,芥子苷类最大吸收波长约为229 nm,截取229 nm色谱图(图 2)发现超声提取样品a峰随 (R,S)- 告依春量增加而递减,可能为其前体物质。由图 2可见,超声提取样品放置12 h后,(R,S)-告依春量增至0 h时的数倍,色谱峰a消失,此时 (R,S)-告依春量趋于稳定,其他色谱峰峰面积不变,继续考察至24 h,溶液稳定。而煎煮样品放置12 h后色谱峰无明显变化,该现象与十字花科植物存在的芥子苷酶解反应相符[9-10]。这与胡彦君等[11]报道的板蓝根制剂制备过程中 (R,S)-告依春的变化趋势一致。
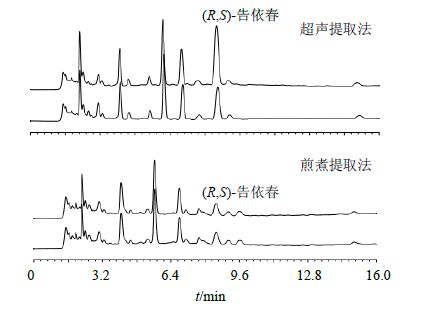
|
图 1 不同提取方法色谱图比较 (λ = 254 nm) Fig.1 Comparison on spectra by different extracting methods (λ = 254 nm) |
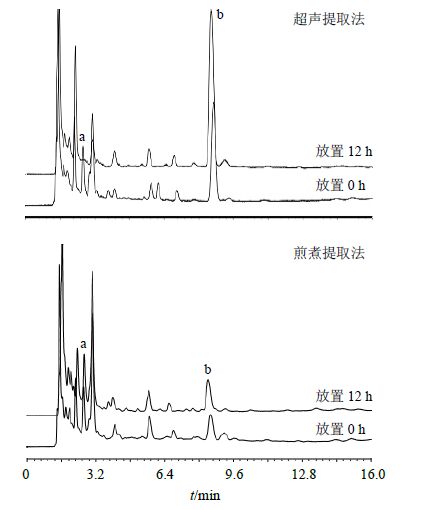
|
a-前体物质 b-(R,S)-告依春 a-precursors b-(R,S)-goitrin 图 2 不同提取方法色谱图比较 (λ = 229 nm) Fig.2 Comparison on spectra by different extracting methods (λ = 229 nm) |
2.1.4 稳定性试验
取超声提取1 h,放置12 h后的同一供试品溶液,分别于0、2、4、6、8、12 h进样,测得供试品溶液中各共有峰相对保留时间的RSD为0.076%~0.25%,相对峰面积的RSD为0.24%~2.2%。
2.1.5 精密度试验取同一批(批号1407406)药材,超声1 h,静置12 h,制得供试品溶液,连续进样6次,考察各特征色谱峰保留时间的一致性,各特征峰相对保留时间的RSD为0.019%~0.40%,相对峰面积的RSD为0.13%~2.1%,表明仪器精密度良好。
2.1.6 重复性试验取批号1407406板蓝根药材,超声1 h,静置12 h,平行制备6份供试品溶液,进样测定。以参比峰腺苷的保留时间和峰面积为参照,计算得供试品溶液中各共有峰相对保留时间的RSD为0.21%~0.96%,相对峰面积的RSD为0.99%~3.2%。
2.1.7 化学指纹图谱的建立本实验采用“中药色谱指纹图谱相似度评价系统2012版”,将14批次的板蓝根药材的色谱图导入软件后,采用“中位数法”导出14批药材指纹图谱的总共有模式,通过色谱峰多点校正方法,对14批药材的指纹图谱色谱峰进行匹配分析并建立起标准对照指纹图谱(R),见图 3[12-13]。结果14批样品与R的相似度分别为0.919、0.894、0.983、0.893、0.956、0.974、0.992、0.981、0.843、0.975、0.957、0.988、0.978、0.940。14批板蓝根药材共检出6个共有峰(峰1~6,表 3),保留时间分别为2.271、4.124、5.920、6.947、7.772、8.532 min,采用对照品对照,结合色谱峰的光谱吸收,鉴定2、3、4、6号色谱峰分别为尿苷、腺苷、鸟苷、(R,S)-告依春,其余为未知峰。
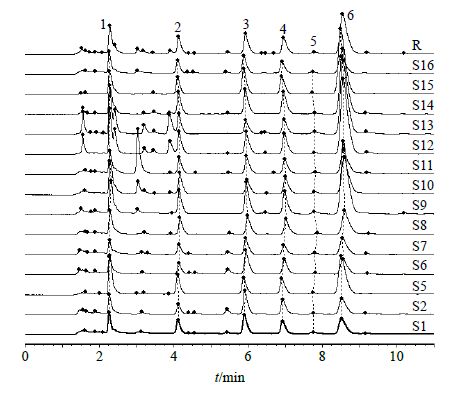
|
图 3 不同产地板蓝根超声提取样品UPLC指纹图谱 Fig.3 UPLC fingerprints of IR from different sources |
|
|
表 3 不同产地板蓝根提取物指纹图谱共有峰相对峰面积 Table 3 Common peak areas of IR fingerprint from different origins |
2.1.8 定量测定[14-15]
按“2.1.3”项下超声法配制供试品溶液,依法进样,计算样品中尿苷、鸟苷、腺苷和 (R,S)-告依春的量,结果见表 4。
|
|
表 4 板蓝根中尿苷、鸟苷、腺苷和 (R,S)-告依春定量测定结果(x±s,n = 3) Table 4 Determination of uridine,guanosine,adenosine,and (R,S)-goitrin in IR (x±s,n = 3) |
2.2 板蓝根提取液对NA活性抑制的检测 2.2.1 检测原理
化合物MUNANA是NA的特异性底物,在NA作用下的产物4M(7-hydroxy-4- methylcoumarin,C10H8O3)在322 nm激发波长下,可以产生450 nm荧光,采用荧光检测器测定该波长荧光强度(fluorescence intensity,FI)的变化,可以灵敏地反映NA的活性[16],从而间接地表征该药物的NA抑制活性。
2.2.2 阳性对照磷酸奥司他韦羧酸盐溶液的制备磷酸奥司他韦(Oseltamivir Phosphate,Tamiflu®,商品名为达菲)是其活性代谢产物的药物前体,口服给药后,在胃肠道被迅速吸收,经肝脏/肠壁酯酶迅速转化为其活性代谢产物磷酸奥司他韦羧酸盐(Oseltamivir Carboxylate)而发挥抗流感病毒作用[17](图 4)。取市售达菲胶囊5粒,精密称定质量,将胶囊内容物研匀,取约相当于25 mg磷酸奥司他韦置25 mL量瓶中,加入水适量,超声至溶解,定容至刻度,振荡摇匀。10 000 r/min离心10 min,取其上清液8 mL至20 mL烧杯,加0.1 g/mL氢氧化钠溶液2 mL,室温搅拌5 h后,用冰醋酸调节pH至7.5左右。参照Lindegårdh等[18]报道的HPLC方法测定磷酸奥司他韦的水解率,确保其水解完全。
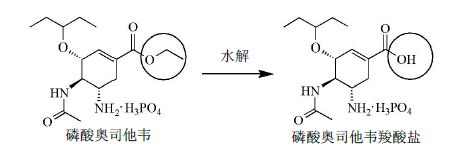
|
图 4 磷酸奥司他韦代谢示意图 Fig.4 Schematic diagram of Oseltamivir to Oseltamivir Phosphate metabolism |
2.2.3 供试品溶液的制备
由于超声和煎煮2种提取方法呈现的差异,提示加热对 (R,S)-告依春的量影响大,为了进一步考察提取方式的影响,除超声和按《中国药典》2015年版方法直接煎煮外,增设先浸泡后煎煮组,进行NA活性抑制的检测。取板蓝根药材粉末约10 g,置具塞锥形瓶或圆底烧瓶中,加100 mL水,密塞,称定质量,分别按超声1 h、煎煮2 h、浸泡12 h后煎煮2 h 3种方法提取,各3份,放冷,用水补足减失的质量,0.22 μm微孔滤膜滤过,取续滤液,静置12 h后逐步2倍稀释成8个质量浓度,分别为100、50、25、12.5、6.25、3.13、1.56、0.781 mg/mL的供试品溶液。
2.2.4 反应条件与加样步骤参照碧云天NA抑制剂筛选试剂盒说明,以底物荧光检测法进行检测。在96孔荧光酶标板每孔中首先加入NA检测缓冲液70 μL和NA 10 μL,每孔再加入0或10 μL待筛选的NA抑制剂样品,加入MIlli-Q水使每孔总体积为90 μL,37 ℃孵育2 min使其充分混合后,每孔加入NA荧光底物10 μL,37 ℃孵育30 min后进行荧光测定。为便于活性比较,同时设酶活性对照组(NA+MUNANA,反应后再加入同样体积样品溶液),背景对照组(样品+MUNANA ,缓冲液补足至相同体积)。用荧光酶标仪检测NA的活性,设定参数:EX=322 nm,EM=450 nm。
2.2.5 药物抑制率的计算将测得的荧光值(取复孔均值,n=4)代入下式计算,即得样品对NA活性的抑制率。
抑制率=(酶活性对照荧光强度―样品干预后荧光强度)/(酶活性对照荧光强度―背景对照荧光强度)
2.2.6 板蓝根抑制NA活性和量效关系考察结果分别用板蓝根和磷酸奥司他韦羧酸盐溶液对NA底物MUNANA进行干预,结果见图 5,板蓝根的量效曲线走向与阳性对照磷酸奥司他韦羧酸盐溶液一致,说明两者有相同作用趋势和规律,验证了板蓝根可通过抑制NA活性,影响病毒的复制、感染,进而发挥抗病毒活性的作用机制。
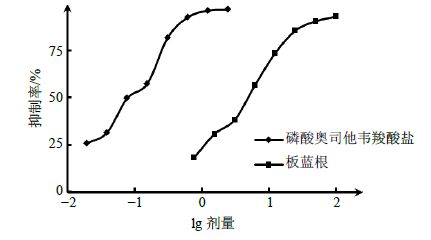
|
图 5 剂量对数与抑制率曲线关系 Fig.5 Linear relationship of logdose-prohibition |
2.2.7 不同提取方法的板蓝根提取液对NA抑制率
的比较 按照上述反应方法测定不同提取方法的板蓝根提取液在相同生药浓度下对NA的抑制活性,以量(生药质量浓度)/效(抑制率)关系作图。由图 6可直观地看出,不同提取方法样品对NA的活性抑制存在明显差异,各质量浓度的抑制率超声提取法相比于直接煎煮法差异显著;在相同生药质量浓度下,超声提取法的抑制率最强(高达93%);浸泡后煎煮法次之,这可能与浸泡时芥子苷与黑芥子酶充分接触,有利于自身酶解反应有关;直接煎煮法最弱。说明超声提取法能更大程度地提取板蓝根中抗病毒有效成分,推测前体药物要转化为 (R,S)-告依春才起效,故下一步选用超声法进行提取,比较不同产地不同批次板蓝根药材对NA活性抑制能力。
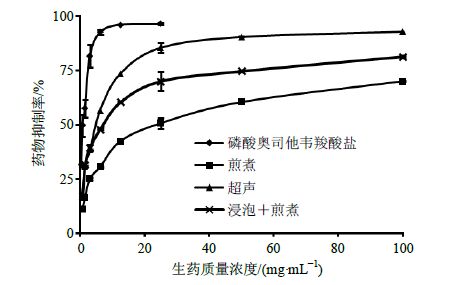
|
图 6 板蓝根抑制NA活性的量效关系曲线图 Fig.6 Dose-effect relationship |
2.2.8 线性关系考察
经不同提取方法量效曲线比较,确定以超声提取法提取板蓝根,测定板蓝根提取液的NA抑制率。以对数生药质量浓度与抑制率作图,可知板蓝根提取液在生药质量浓度3.125~25.000 mg/mL时与其抑制率呈线性相关,回归方程Y=52.831 X+13.513,r=0.991 5,在此质量浓度范围内选取生药质量浓度20.0 mg/mL为检测质量浓度,与定量测定时的质量浓度一致。
2.2.9 精密度考察取同一份板蓝根(批号1407406),按“2.2.3”项下超声法制备供试品溶液,分6次点样于96孔板中参与酶促反应,计算抑制率的RSD为4.5%,精密度试验符合要求。
2.2.10 重复性考察取同一批板蓝根药材(批号1407406),按“2.2.3”项下超声法制成6份供试品,测定的抑制率RSD为9.1%,说明该方法具有较好的重复性。
2.2.11 稳定性考察取同一供试品溶液(批号1407406),按“2.2.3”项下超声法制备供试品溶液,分别于0、2、4 h点样测定,计算抑制率的RSD为4.2%,表明供试品溶液在4 h内是稳定的。
2.2.12 不同来源的板蓝根抑制NA活性的测定取药材粉末(过4号筛)约1 g,精密称定3份,置具塞锥形瓶中,加入水50 mL,密塞,称定质量,超声提取1 h,放冷,再称定质量,用水补足减失的质量,摇匀,滤过,静置12 h后(生药浓度为20 mg/mL);另取含尿苷20.58 μg/mL、鸟苷20.70 μg/mL、(R,S)-告依春40.68 μg/mL及腺苷25.06 μg/mL的混合对照品溶液,依法测定。测得14批板蓝根药材抑制流感NA活性的能力,计算抑制率,结果见表 5。结果表明,不同产地不同批次的板蓝根对NA的抑制率存在差异,抑制率为78.57%~97.76%,平均值为85.87%。其中山东产地的板蓝根药材抑制率均较高,批号1406409药材的抑制率最低。测得对照品抑制率为79.79%,与药材检测结果接近,证明指标成分具备一定的NA抑制活性。
|
|
表 5 不同样品对NA活性抑制率 Table 5 Inhibitory rate of different samples on NA |
2.3 板蓝根化学成分与抑制NA活性的关联分析 2.3.1 灰色关联分析
灰色系统理论[19-20]是对“部分信息已知,部分信息未知”的不确定性系统中有限数据序列进行量化分析,通过灰色关联度来确定系统因素间的影响程度,从而掌握系统整体动态运动的规律。关联系数和关联度是描述系统各因素之间相互关系的主要参数,它可从整体上或动态上定量分析事物之间的关联程度或影响程度。
对于14批药材样品,每个样品的指纹图谱有6个共有峰,构成了6个子序列,再以不同样品的生物效应作为母序列,依据母序列与子序列关联度的大小,可确定诸峰对生物活性的贡献大小。如表 6灰色关联度结果可见,指纹图谱各共有峰与抑制NA活性相关性排序为峰2(尿苷)>峰6[(R,S)-告依春]>峰1>峰4(鸟苷)>峰5>峰3(腺苷),说明已知成分 (R,S)-告依春、尿苷与板蓝根抑制流感病毒NA活性能力紧密相关,与定量测定指标成分较为一致。
|
|
表 6 板蓝根各色谱峰对抗病毒活性贡献关联度 Table 6 Contribution correlation degree between common peaks in IR and antiviral effects |
2.3.2 单因素相关性分析
由上述 (R,S)-告依春定量测定结果与生物检定结果的一致性提示,NA抑制剂筛选试剂盒法可弥补现行质量控制标准的不足,故进一步将板蓝根超声提取液定量测定结果与NA活性抑制结果进行关联分析,旨在阐明化学质量分析与生物活性检测的一致性,使其可靠性得到相互印证。
本研究以各成分量为x,NA抑制活性为y,以14批药材测定结果为统计分析样本,选用Pearson法进行相关性分析,采用SPSS 22.0统计软件计算,结果显示,板蓝根中的尿苷、鸟苷、(R,S)-告依春量与NA活性抑制率均具有显著相关性(表 7),2种检测方法结果总体趋势一致,佐证了选取指标的可靠性,验证了板蓝根中 (R,S)-告依春的量与其抗病毒活性的相关性及将2种方法联合用于评价板蓝根药材品质的可行性[21]。
|
|
表 7 单因素相关性分析 Table 7 Correlation analysis of samples |
3 讨论
板蓝根超声样品放置时间不同所测得 (R,S)-告依春的量差异显著,但放置至12 h后其量较为稳定,前体峰基本消失,故确定供试品配制后放置12 h,保证其转化基本完全。
本实验采用的定量测定方法[9-10],经考察采用定量测定项下色谱条件时,前4 min的强极性物质难以分离,比较了甲醇-水、乙腈-水、甲醇-0.02%磷酸水溶液、甲醇-0.1%磷酸水溶液4种流动相的色谱出峰情况。结果表明,甲醇-0.02%磷酸水溶液系统洗脱可以提高色谱峰分离度,改善峰形,有利于指纹图谱分析。故选其作为流动相系统。
在检测板蓝根提取液对NA活性抑制能力时,比较了《中国药典》2015年版规定的煎煮2 h提取法、超声1 h提取法,并增加了浸泡12 h后煎煮2 h的提取方法,考察在提取过程中不同时间点灭活酶对其抑制NA活性的影响。本实验通过比较超声提取法和煎煮提取法供试品的色谱图,发现在229 nm下超声样品可检出随(R,S)-告依春量增加而递减的前体物质,解释了超声提取有利于降解产物 (R,S)-告依春的生成,导致超声样品中 (R,S)-告依春量高于煎煮法的现象;同时比较了不同提取方法的样品的NA活性抑制量效关系,可知超声样品对NA活性抑制能力优于直接煎煮样品和浸泡后煎煮样品,说明超声法能更大程度地提取抗病毒有效成分,提示降解产物 (R,S)-告依春的抗病毒活性优于其前体,故选取超声提取法制备供试品,并放置12 h待其降解完全后进行检测较为合理,同时提示适当浸泡药材进行提取可促进酶解产物 (R,S)-告依春的生成,更好地发挥抗病毒作用。
本实验通过对14批板蓝根药材的UPLC指纹图谱共有峰相对峰面积与NA活性抑制率进行灰色关联分析,可知已知峰 (R,S)-告依春、尿苷与抗病毒生物效应呈显著相关,佐证将上述成分拟作检测指标的可行性。进一步将降解产物 (R,S)-告依春及各已知成分的量与NA活性抑制结果进行单因素关联分析,结果显示 (R,S)-告依春、尿苷、鸟苷与NA活性抑制结果具有显著相关性,初步验证了 (R,S)-告依春与流感病毒NA活性的相关性,佐证所选指标成分的可靠性。
板蓝根成分复杂,药效物质基础还未明确[22],抗病毒作用机制仍未阐明,常规性状与理化鉴别只能区分药材真伪,难以辨清优劣。据报道[23],表告依春有明显的抗流感病毒作用,而核苷类成分是板蓝根中的活血有效成分,能干扰病毒DNA、RNA的复制,抑制病毒增殖,保护细胞。本实验对板蓝根指标成分,特别是 (R,S)-告依春量与抗流感病毒NA活性的相关性进行了初步探索性研究,相关性良好,提示可将生物测定法应用于药材-中间体-成品的过程监控,掌握生物活性信息的传变规律;但本实验的生物评价方法较单一,可进一步引入鸡胚培养法、血红细胞凝集检测法等加以佐证;还可开展体内实验,研究表原告依春和原告依春在体内的降解路径、降解产物及降解前后活性差异,研究角度有待拓展。相关性较好的成分的活性实验及抗病毒实验方法的拓展有待进一步深入研究。
由于批号1407403、1406408药材样品收集量较少,在前期提取方法考察的研究中已用完,因此后续研究没有这2个批号样品。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | Xie Z Y, Shi Y H, Wang Z T, et al. Biotransformation of glucosinolates epiprogoitrin and progoitrin to (R)- and (S)-goitrin in Radix Isatidis[J]. J Agric Food Chem , 2011, 59 (23) :12467–12472. DOI:10.1021/jf203321u |
| [3] | 杨瑛洁, 李淑燕, 胡国伟, 等. 硫代葡萄糖苷的降解途径及其产物的研究进展[J]. 西北植物学报 , 2011, 31 (7) :1490–1496. |
| [4] | 徐丽华, 黄芳, 陈婷, 等. 板蓝根中的抗病毒活性成分[J]. 中国天然药物 , 2005, 3 (6) :359–360. |
| [5] | 薛冰纯, 王滔, 刘二保. 流动注射化学发光法在药物分析中的应用[J]. 光谱学与光谱分析 , 2006, 26 (5) :816–820. |
| [6] | 李寒冰, 鄢丹, 金城, 等. 基于化学荧光测定的板蓝根抗病毒效价检测方法的建立[J]. 光谱学与光谱分析 , 2009, 29 (4) :908–912. |
| [7] | 李寒冰, 鄢丹, 王伽伯, 等. 基于神经氨酸酶活性检测的板蓝根品质生物评价的研究[J]. 药学学报 , 2009, 44 (2) :162–166. |
| [8] | 任国萍, 李铮, 傅欣彤. HPLC法同时测定板蓝根药材中尿苷、鸟苷、(R,S)-告依春和腺苷[J]. 中国新药杂志 , 2012, 21 (19) :2330–2334. |
| [9] | 谢智勇. 板蓝根中芥子苷的分离纯化与生物转化研究[D]. 上海:上海中医药大学, 2012. |
| [10] | 郑程. 板蓝根中芥子苷类动态变化规律与复方板蓝根颗粒质量标准研究[D]. 上海:上海中医药大学, 2015. |
| [11] | 胡彦君, 王雅琪, 李冰涛, 等. 板蓝根制剂制备过程中成分变化及其药效相关性研究[J]. 中草药 , 2016, 47 (9) :1515–1519. |
| [12] | 谢培山. 中药色谱指纹图谱. 北京:人民卫生出版社[M]. 2005 . |
| [13] | 王飒, 盛萍, 姚蓝, 等. 维药多伞阿魏体外抗胃癌活性部位GC-MS指纹图谱的研究[J]. 中草药 , 2015, 46 (19) :2874–2879. |
| [14] | 池絮影, 傅咏梅, 张蜀, 等. 不同产地板蓝根中(R,S)-告依春及核苷类成分含量的比较[J]. 广东药学院学报 , 2015, 31 (6) :745–748. |
| [15] | 池絮影, 崔曰新, 张蜀, 等. 一测多评法测定板蓝根颗粒中4种成分的含量[J]. 中国生化药物杂志 , 2015, 35 (10) :137–140. |
| [16] | Potier M, Mameli L, Bélisle M, et al. Fluorometric assay of neuraminidase with a sodium (4-methylumbelliferyl-α-D-N-acetylneuraminate) substrate[J]. Anal Biochem , 1979, 94 (2) :287–296. DOI:10.1016/0003-2697(79)90362-2 |
| [17] | 刘瑜. 新型流感病毒神经氨酸酶抑制剂的设计、合成与初步活性研究[D]. 山东:山东大学, 2011. |
| [18] | Lindegårdh N, Hien T T, Farrar J, et al. A simple and rapid liquid chromatographic assay for evaluation of potentially counterfeit Tamiflu®[J]. J Pharm Biomed , 2006, 42 (42) :430–433. |
| [19] | 邓聚龙. 灰色系统理论教程. 武汉:华中理工大学出版社[M]. 1990 . |
| [20] | 刘思峰, 杨英杰, 吴利丰, 等. 灰色系统理论与其应用. 第七版. 北京:科学出版社[M]. 2005 . |
| [21] | 孙琴, 李寒冰, 鄢丹, 等. 基于抗菌效价检测的板蓝根颗粒制备过程质量变化评价[J]. 中草药 , 2012, 43 (2) :259–264. |
| [22] | 国欣, 胡小龙, 王月荣, 等. 板蓝根多糖的系统分离纯化与组成分析[J]. 中草药 , 2016, 47 (9) :1508–1514. |
| [23] | 徐丽华, 黄芳, 陈婷, 等. 板蓝根中的抗病毒活性成分[J]. 中国天然药物 , 2005, 3 (6) :359–360. |
 2016, Vol. 47
2016, Vol. 47


