2. 创新中药关键技术国家重点实验室, 天津 300410
2. State Key Laboratory of Core Technology in Innovative Chinese Medicine, Tianjin 300410, China
根据国家食品药品监督总局(CFDA)近年来批准的中药品种情况,已有多个研究小组关注于近年批准生产的中药品种,并对其总体情况和趋势进行了报道。然而,对于获得临床批准的中药品种的相关分析报道较少,关注程度较低,难以为中药新药的早期研究提供依据。另外,获得临床批准的品种情况一定程度上预示了未来可能获批上市的新药产品的趋势和规律,并且进一步影响着新药研发的方向,对临床批准情况进行分析可以前瞻性地预测新药上市及药品研发的未来动态。因此,本文通过对CFDA从2010—2015年批准临床的中药品种进行检索和整理,结合品种的注册分类、治疗领域、申报周期、剂型分布、申报单位等具体情况进行分析,从当前阶段临床需求及中药临床优势出发,尝试剖析中药新药研发及审评审批的潜在规律,拟对新药的研发定位提供参考,为研发单位确定中药研发方向提供借鉴。
1 数据来源与研究方法获得临床批准的中药品种数据信息来源于米内网中国药品审评数据库、CFDA药品审评中心(CDE)临床试验数据库以及CDE网站发布的年度药品注册审批年度报告,查询和整理2010—2015年CFDA和CDE受理的临床申请和批准临床的中药品种,使用Excel软件对查询的数据信息进行分类排序和计算统计,以获得申报周期、治疗领域、批准品种数量等信息。另外,由于目前临床申请所涉及的中药原料药并不单独作为制剂用于临床治疗,因此原料药临床批件未纳入统计范畴,并且在统计时,同处方不同规格品种按单一样本统计。
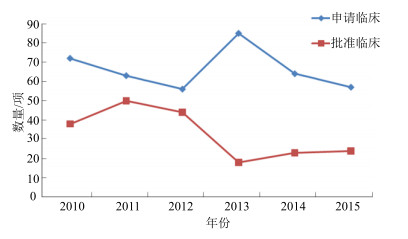
2 2010—2015年CFDA受理和批准的中药新药临床申请总体情况据统计,2010—2015年CFDA共受理中药临床注册申请数量分别为72、63、56、85、64、57件,合计397件,批准临床的中药品种申请数量分别为38、50、44、18、23、24件,合计197件。
图 1展示了各年批准临床的品种数量和总体趋势,2010—2015年,申报临床的品种数量波动较小,除2013年外,年均申报品种基本保持在60~70件。但获得临床批准的品种数量呈明显的下降趋势,尤以2012—2013年下降最为明显,该趋势与当年批准生产的品种数量变化一致[1]。这一现象与CFDA严格中药品种审批,加大审评力度,呼吁和引导中药新药以未满足的临床需求出发,结合中药临床治疗特点和优势治疗领域确定新药定位有关,从审批趋势上引导和鼓励了能够体现中医药临床治疗价值的新药品种的开发。
|
图 1 2010—2015年CFDA受理的中药品种临床注册申请及批准临床数量 Fig.1 Application and clinical approval amounts of CMM by CFDA during 2010—2015 |
3 获批临床的中药品种情况分析 3.1 获批临床中药品种的注册分类情况
中药新药的注册分类根据现行的《药品注册管理办法》(局令第28号)规定共分为9类:未在国内上市销售的从植物、动物、矿物等物质中提取的有效成分及其制剂(1类)、新发现的药材及其制剂(2类)、新的中药材代用品(3类)、药材新的药用部位及其制剂(4类)、未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂(5类)、未在国内上市销售的中药、天然药物复方制剂(6类)、改变国内已上市销售中药、天然药物给药途径的制剂(7类)、改变国内已上市销售中药、天然药物剂型的制剂(8类)、仿制药(9类)。其中注册分类1~6类品种为新药,7、8类按照新药申请程序申报。
根据表 1统计的结果,2010—2015年,获得临床批准的中药品种共197项,其中1类品种共4项、4类品种2项、5类品种14项、6类品种165项、7类品种2项、8类品种9项、9类品种1项。
|
|
表 1 2010—2015年CFDA批准临床的中药品种的注册分类情况 Table 1 Register classifications of clinical approved CMM by CFDA during 2010—2015 |
从数量上看,6类复方新药获批数量最多,占全部批准临床品种的83.75%,而排在第2位的中药5类新药(有效部位)仅占全部的7.11%,证明复方中药品种仍是研发的主要热点。这主要是由于大量的6类新药来自于临床验方,中药材的配伍使用更为贴近临床使用经验、更加能够体现中药治疗特点,并且在一定程度上,处方来源于多年的临床使用,具备了一定的安全性和有效性结果,回顾式的开发方式对于中药6类新药的研发风险相对更低。
2010—2014年各年份,中药5类新药获得临床批准的数量较为稳定,但总体数量较少,年均批准3项左右,而2015年较为特殊,无一例5类新药获得临床批准。类似的情况也出现在中药1类新药的申请当中,由于中药1类新药的开发需要全面地考虑到资源可持续发展、有效成分确定的理由、给药剂量、安全性、药动学行为及临床依从性等问题[2],研发难度和风险较5类新药更高,要求也更为严格,因此近6年来获得临床批准的品种仅有4项,仅占全部批准品种的2.03%。由于《药品注册管理办法》2007版实施后,进一步加强了对改变给药途径、改剂型及仿制药品种的管理和审批,因此近年来8类、9类品种的总体批准数量均较少[3],这也显示出CFDA对低水平改剂型和仿制药品行为的遏制。
此外,2类及3类中药新药品种近年未见批准,根据报道[1-2],近年来2类、3类品种的申报数量也很稀少,证明此类品种的研发关注度很低,笔者推测,造成这种现象的原因一方面是由于新发现的药材或代用品缺少法定药材标准和使用历史,一定程度上很难与具有悠久使用历史的常用中药材相比;另外,由于成功获得批准的数量极少,从开发成功率上看,研发此类品种的风险很高,研究单位的研发热情比较低。
3.2 获批临床中药品种的治疗领域分布按照CDE对中药品种的治疗疾病分类,结合国际疾病伤害及死因分类标准第10版(ICD-10)对获得临床批准的中药品种的治疗领域进行分类统计,以说明各治疗领域的获批分布情况。
根据表 2的数据,呼吸系统、消化系统、心脑血管系统、妇科、肌肉骨骼系统和结缔组织5个治疗领域是中药新药批准临床研究的主要治疗方向,5者的加和占到全部批准临床品种的70.03%,从侧面反映出中药潜在的临床治疗优势领域和研发的热点趋势。除此5大领域之外,神经及精神系统、五官,泌尿生殖,内分泌、营养和代谢,肿瘤等领域也有一定数量的批准品种。值得一提的是,针对儿童使用的中药新药在近6年间仅有4项获得临床批准,3项获批生产[3],数量非常少,结合目前CDE对儿童药品种优先审评的情况来看,从侧面反映出儿童药品种较为缺乏,临床尚有较大需求的现状,这一点值得研发单位予以关注。
|
|
表 2 2010—2015年CFDA批准临床的中药品种治疗领域分布及申报周期情况 Table 2 Indication and declared period of clinical approved CMM by CFDA during 2010—2015 |
另外,从治疗领域来看,肿瘤、肌肉骨骼、心脑血管病、急性传染性疾病、糖尿病、抑郁症等是当前危害人类健康的主要疾病。如何解决临床难点问题,减少死亡率,提高治愈率和患者生活质量,是中药研发单位需要重点思考的问题。值得欣喜的是,随着法规调整以及研究单位的研发能力不断提升,以临床需求为导向,针对重大疾病开展攻关,正逐步成为中药新药的研发导向。
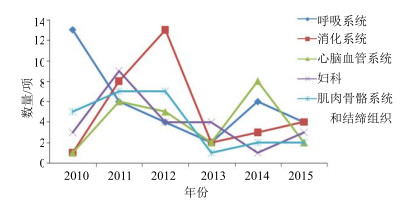
为了更好地说明近年来上述5个主要治疗领域批准临床研究品种的数量和趋势,笔者将各年批准临床品种的治疗领域进行了分类,如图 2所示。从趋势上来看,呼吸系统用药虽然2014年批准数量稍有增加,但批准情况大体呈现逐年递减的趋势,提示此领域市场已逐渐呈现饱和的趋势。消化系统用药在2011—2012年批准数量达到峰值,之后大幅减少,近2年稍有增加。心脑血管系统用药总体趋势较为稳定,各年均有品种被批准进行临床研究,其中2011年与2014年批准数量较多。妇科用药、肌肉骨骼系统和结缔组织疾病用药二者总体数量和趋势较为接近,2011—2012年批准数量较多,总体趋势呈下降状态,近3年年均批准数量不超过4个。这5个领域批准临床品种的总体数量呈现下降趋势,与近6年总体批准数量的变化趋势一致,从侧面反映出中药品种研发风险增加,建议研发单位对新品种的临床适应症选择应尽可能充分体现临床价值,并结合审批趋势和品种自身特点给予更多考虑。
|
图 2 主要治疗领域获批临床品种的数量趋势 Fig.2 Trend of clinical approved CMM in indication domains during 2010—2015 |
3.3 各治疗领域的申报周期
新药申报周期往往因申报年份、治疗领域的不同而有所变化,根据笔者对近6年新药品种申报临床的承办日期与批准日期的对比统计,将中药品种临床申请的申报周期按照年份和治疗领域2个维度进行了分析。其中承办日期以CDE官方网站显示的受理时间为准,批准日期以临床批件发送日期为准,申报周期为批准日期与承办日期的时间间隔。需要注意的是,新药的申报周期受到诸多因素的影响,例如申请后提交完整资料的时间、发补次数及补充研究的时间等,由于不同注册类别的新药技术要求差异较大,因此在申报周期上可能出现较大差异。
从治疗领域上看,由表 2数据显示,皮肤和皮下组织疾病药物品种申报周期最短,为16.91个月(约1.4年),此类品种多为外用药,其剂型与治疗定位较为符合,能够较好地体现出治疗特点;儿科用药申报周期为17.58个月(约1.5年),较短的申报周期进一步显示出临床亟需儿童药品种的现状;呼吸系统、五官科、妇科、心脑血管系统、消化系统、骨骼肌肉系统和结缔组织用药的申报周期均在20~30个月(1.7~2.5年);申报周期较长的为内分泌、营养和代谢以及肿瘤领域用药,申报周期分别为37.37个月(约3.1年)和35.31(约2.9年)。批准临床数量最多的5个治疗领域的申报周期均在1.7~2.5年,接近总体申报周期的平均值(27.36个月,约2.3年)。
按照批准年份划分,2010—2014年,申报周期总体趋势平稳(表 3),保持在20个月左右,2012年申报周期最短,为19.97个月(约1.7年);2013年申报周期呈小幅增加,为29.82个月(约2.5年)。2015年申报周期明显增加,从2014年的21.38个月(约1.8年)增加至2015年的46.92个月(3.9年),申报周期时间增加2.2倍,其中60%的品种承办于2011—2013年,20%的品种承办于2003—2005年,此现象与2015年CFDA出台的一系列着力解决积压品种的政策有关,其审批的重心明显偏重于对历史品种的审批,因此2015年申报周期明显长于以往各年。
|
|
表 3 各批准年份的平均申报周期情况 Table 3 Average declared periods during 2010—2015 |
3.4 获批临床中药品种的剂型情况
根据2010—2015年CFDA批准临床品种的197个品种的剂型统计,将所涉及的剂型种类分为口服固体制剂、口服非固体制剂、局部给药制剂和注射剂4类。表 4的统计数据显示,口服固体制剂为批准品种中最主要的剂型,共批准152项,占全部的77.16%。其中以常规胶囊剂最多,共批准65项,占全部批准品种的32.99%,其次为片剂和颗粒剂,各批准40项,各占全部批准品种的20.30%。外用制剂如贴、巴布膏、软膏、喷雾剂等共批准26项,占13.20%,口服液、合剂、糖浆等非固体口服制剂共批准14项,占7.11%。丸剂(包括滴丸、微丸)、散剂、灌肠剂、栓剂等剂型批准数量均少于7项,审评最为严格的中药注射剂品种仅批准1项,总体而言,获批临床的中药新药品种主要是以传统口服固体制剂(胶囊、片、颗粒)为主。
|
|
表 4 2010—2015年CFDA批准临床的中药品种的剂型情况 Table 4 Formulations of clinical approved CMM by CFDA during 2010—2015 |
从各治疗领域对应的制剂情况来看,呼吸系统用药以口服制剂为主,口服液、合剂、糖浆等非口服固体制剂品种也主要集中在此治疗领域;骨骼肌肉和结缔组织疾病用药、皮肤科用药以外用制剂为主,以贴剂、巴布膏、喷雾剂数量最多,此类剂型较为适合于外用消肿止痛或治疗皮肤病,符合此领域治疗特点;五官科用药多以滴眼液、鼻喷剂为主,体现出局部靶向给药治疗疾病的特点;其他治疗领域则多以口服固体制剂为主,与总体剂型分布趋势一致,在此不做逐一讨论。批准临床的儿科药品种分布于颗粒剂、糖浆及巴布膏4种剂型,相对于胶囊、片剂等口服制剂,颗粒剂和糖浆拥有掩味、便于给药的特点,更适合儿童使用,如2015年批准的小儿蒿芩抗感颗粒及2010年批准的小儿宣肺止咳糖浆;2011年获批临床用于小儿轮状病毒性腹泻的小儿止泻巴布膏为近6年唯一获批临床的儿童外用制剂,其剂型也较易于儿童使用。笔者结合目前儿童药领域总体情况认为,儿童药新药的开发方向更多地体现在适合儿童使用的具有矫味、掩味、提高儿童用药依从性和便捷性的新制剂,以及剂量更为精确、装量更小的儿童制剂方面,此方向值得研发单位关注。另外,剂型的选择应当充分关注该适应症在临床治疗当中的临床依从性,从临床使用的角度出发选择最为合适的制剂剂型。
3.5 获批临床中药品种的申报单位情况为说明近6年间中药品种申报来源的情况,笔者将申报单位的情况进行了分类统计。分类准则如下:根据企业性质,将申报单位分为制药企业、医药科技公司、科研院校和医院4类,申报企业多于1家时,以第1申报单位为准。其中制药企业指具有独立研发、注册、生产的综合性企业;新药开发公司指具有研发、注册申报自主知识产权的小型新药孵化机构,此类企业不具有药物推广能力,主要提供药物早期研发的技术输出;科研院校包括大专院校及公立科研院所;医院类不包括附属公司;另外,获批品种所在地区以第1申报单位的所在地区为准。
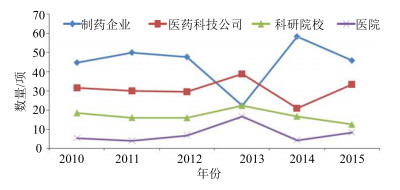
根据图 3显示,获得临床批准的中药新药较多的来自于制药企业和医药科技公司,而来自于科研院所和医院新药数量较少,制药企业和医药科技公司是近年来新药研发的主要力量,医药科技公司具有相对较高的研发效率,但受限于自身经济基础,基础研究相对薄弱,缺乏药物研发中后期的推动力。从整体趋势上分析,制药企业及医药科技公司的整体批准品种数量总体稳定,2013年获批数量较少,医药科技公司反超成为获批主力。从整体上看,科研院校、医院在新药研发方面还存在较大提升空间,医院的验方、院内制剂由于具有较充分的使用经验和临床应用数据,具有适中的开发风险,值得企业和科技公司关注。另一方面,科研院校更加偏重基础研究,缺乏药品注册、临床开展等推广实力,而制药企业和医药科技公司在新药开发方面积累了较多的经验并具备较为完整的研发条件,因此,新开发的品种可以通过从医院、科研院校向企业转让来提高新药开发的成功率和品种安全性。
|
图 3 各类研发单位获批品种数量趋势图 Fig.3 Trend of clinical approved CMM form different R & D facilities during 2010—2015 |
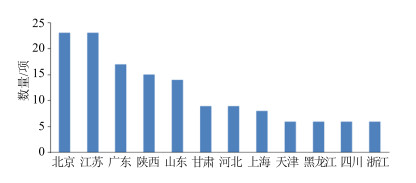
从2010—2015年国内主要省、市获得临床批准的中药品种数量来看(图 4),北京与江苏获批品种数量最多,均为23件。广东、陕西、山东获批数量均在15件左右。甘肃、河北、上海、天津等地获批数量均在10件以下。图 4中所示的地区获批品种的总和为142件,占近6年获批临床品种总数的72.08%,该情况显示,我国中药新药研发具有区域性特点,地区集中度较高,华北的北京、山东、河北,东南的江苏、广东,以及西北的陕西和甘肃是中药新药研发比较集中地区,从事中药新药研究的单位可将目光集中在上述地区,挖掘有潜力的品种进行相应开发。
|
图 4 国内主要省、市获批临床的品种数量 Fig.4 Clinical approval amounts of mainly provinces and cities in China |
4 分析与讨论 4.1 申报数量与注册分类
2010—2015年,中药品种临床申请的数量总体保持在年均60~70项,但批准数量自2012年以后锐减,批准数量从年均40余项迅速减少至20项左右,笔者通过分析2010—2015年CDE及CFDA出台的法规规章与指导原则发现,在批准数量锐减的2012—2013年,并未出台针对中药的重大政策改革或指导原则修订,其原因可能是由于该阶段中药审评严格程度进一步增加,尤其是更加强调中药新药必须结合临床需求和中药特色,体现其临床应用价值,证明药品监管机构对中药新药研发的要求正在逐步提高,新药研发必须以临床的实际需求为立足点。
根据批准临床的中药品种的注册分类,中药复方新药(第6类)获批数量最多,占比高达83.75%,有效部位及其制剂(第5类)排在第2位,占比远低于复方新药,仅占7.10%。中药提取的有效成分(第1类)、药材新的药用部位(第4类)开发的新药品种批准数量较少,6年中仅批准6项,占全部批准数量的3.04%。第7、8、9类即改变给药途径、改变剂型和仿制药品种6年间共批准12项,其中8类药批准临床较多,并且主要集中在2011年、2012年及2015年。新发现的药材(第2类)、中药材代用品(第3类)在6年间无品种获批,由于此类品种的应用历史较为缺乏,其开发风险较高。
4.2 治疗领域与剂型分布2010—2015年,70%获得临床批准的中药品种来自呼吸系统、消化系统、心脑血管系统、妇科、肌肉骨骼系统和结缔组织5个治疗领域,这一趋势与近年来批准生产的中药新药治疗领域分布较为类似[3],结合笔者所统计的具体适应症情况分析,有如下几点原因:(1)上述5个主要疾病领域均为高发或常见疾病领域,患者群体数量庞大、市场规模可观并且具有较大的用药需求,因而成为中药新药开发的热门领域。(2)从具体适应症来看,较多的中药新药品种针对治疗慢性支气管炎、卒中后遗症、冠心病心绞痛、慢性盆腔炎、慢性萎缩性胃炎、软组织挫伤、风湿性关节炎等疾病,此类疾病多为慢性、多因素复杂疾病及化学药治疗缺乏有效手段的疾病领域,中药治疗具有较大的优势和特点,是潜在的中药优势治疗领域。(3)受到国内环境因素、年龄因素及生活方式的影响,上述治疗领域的发病率正在逐年增加,市场增长速度较快,市场规模还存在较大的增长空间,经济效益可观。(4)反观内分泌代谢领域、肿瘤及皮肤病等领域,由于化学药、生物药在治疗效果和靶点方面较为明确,加之对应的疾病种类较为有限,因此批准品种较少。儿童药领域对安全性范围要求更广,且缺少针对性的剂型和精确剂量标示,批准品种也相应较少。(5)从各适应症领域对应的申报周期来看,热门治疗领域的审评时长较短,有利于品种快速开发抢占市场,因此申报和批准的数量较多。
近年批准临床的品种剂型主要分布在胶囊、片、颗粒3种常见的口服固体制剂,占全部批准品种数量的70%以上,其他剂型则呈现较为明显的治疗领域偏向性,如治疗呼吸系统疾病的中药新药普遍采用口服液、糖浆、膏等口服非固体制剂;治疗骨骼肌肉系统和皮肤病的药物多采用巴布贴、喷雾剂及软膏等外用剂型;儿童药则倾向于采用水溶性较好及掩味效果较好的糖浆和颗粒剂。由于中药注射剂的特殊性和潜在安全性风险较大,近年获得临床批准的中药注射剂品种仅有1例,提示中药注射剂开发技术要求高、风险非常大,选择注射剂作为制剂剂型要具备非常充分的理由并且需要重点关注注射剂的安全性和工艺稳定性。
4.3 新药申报单位从统计的已获得临床批准的品种申报单位来看,国内中药新药开发的主要力量来自制药企业和医药科技公司,医院、学校及科研院校的研发能力相对较弱,笔者分析这主要是由于科研院校的配套放大设备及经费较为有限,产业转化经验及独立出资进行研发的条件不足造成,企业和科技公司通过较多品种的开发和转化已经积累了较多经验,在品种选择、立题定位、市场空间把握、工艺开发方面具有较明显的优势。另外,国内的中药新药研发呈现一定的区域性特点,北京、江苏、广东等具有区位及资源优势的地区新药研发能力较强,这些区域往往也是众多医药企业、科技公司的所在地,从事研发的人员以及配套的设备都比较集中,一定程度上推动了所在区域的研发能力。
5 结语目前批准临床的中药品种具体情况尚无公开数据,本研究数据来源于米内网中国药品审评数据库,与CDE审评年报公开数据并不完全一致,且未分别对不同注册类别的药品进行分类统计,同时,统计结果可能受多种因素影响,本文所载数据仅供参考。
从本文的整体统计结果来看,一定程度上能够显示出国内中药新药研发的规律和趋势。近年获得临床批准的中药品种多为复方中药新药,而对于第2类、第3类、第4类新药少有申报和批准,中药仿制药品种(第9类)目前也罕有批准,该现象说明目前的药品注册分类在新药开发当中存在一定限制,并且对于研发品种较少的注册分类还需要配套的技术指导原则来指导研发。在治疗领域分布上,呼吸系统、消化系统、心脑血管系统、妇科、肌肉骨骼系统和结缔组织5个治疗领域获批临床品种数量最多,尤其是慢性支气管疾病、卒中后遗症、慢性妇科病等慢性疾病都是中药潜在优势领域和研发关注的热点。批准品种的剂型主要集中于片、胶囊、颗粒等较为常见口服固体制剂,对于不同适应症的剂型选择也具有一定的针对性,研发单位应在研究时充分考虑所选择的剂型在临床使用中的合理性。由于中药提取物和中间体的性状较为特殊,中药剂型相对较为传统,这提示研发单位新型中药制剂技术和剂型的研究还存在较广阔的空间,尤其在特殊人群用药方面具有重要意义。国内近年来中药新药的申报单位主要以制药企业和医药科技公司为主,并呈现出地区差异性,提示国内中药新药研发的水平和配套资源分布存在不平衡,呈现局部集中的情况。
总体而言,现行的药品注册管理办法实施至今,中药新药审评的严格程度逐渐增加,批准数量明显减少,在此情况下分析和总结新药申报与批准的趋势和规律能够对中药新药的研发起到指导作用,尤其在临床价值挖掘、适应症定位、注册分类选择、剂型确定等方面,建议研发单位更加关注新药批准的趋势情况。此外,对新药而言批准临床是未来申报生产的先决条件,某种程度上预示着未来可能上市的中药品种的趋势,然而,批准进行临床试验与批准上市生产之间还存在很大差异,批准临床关注的重点更偏向于临床定位和安全性方面,批准上市则需要全面关注新药的安全性、有效性及质量可控性,不同研发阶段的研究其侧重点也有所不同。综合审批趋势及现阶段出台的一系列法规和指导原则,笔者建议在今后的新药研发中应更加重点关注中药新药的临床价值,从临床的实际需求出发确定中药新药的研发方向。
| [1] | 张晓东, 周跃华, 刘璐, 等. 近年我国中药新药注册申请情况分析[J]. 中国新药杂志 , 2014, 24 (23) :2845–2848. |
| [2] | 张晓东, 张磊, 王海南. 近年我国中药新药注册申请不批准原因分析[J]. 药事管理 , 2012, 37 (15) :2333–2337. |
| [3] | 张婧波, 李云飞, 邢花. 从2010—2014年国内获批中药新药的治疗领域看中药研发方向[J]. 中草药 , 2015, 15 (46) :2339–2342. |
 2016, Vol. 47
2016, Vol. 47


