2. 重庆医科大学附属第一医院 急诊医学科 & 重症医学科, 重庆 400016
2. Emergency Medicine & ICU, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
内皮细胞也称血管内皮细胞,是衬于血管和血管平滑肌之间的一层连续扁平的细胞,是心脑血管系统屏障的重要组分,将血液与组织分隔开来。而内皮功能损伤是脑膜炎、动脉粥样硬化、脑卒中、心肌梗死等心脑血管疾病发生的初始环节,损伤后主要对内皮细胞的屏障功能造成影响。内皮损伤主要有几个方面:影响正常内皮细胞的分泌功能、促进细胞凋亡、破坏细胞间连接。
黄芪Astragali Radix是蒙古黄芪Astragalus memeranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根,《中国药典》2015年版记载其具有补气升阳、固表止汗、利水消肿、生津养血、行滞通痹、托毒排脓、敛疮生肌的功效。临床上黄芪广泛应用于高血压、心脑血管疾病、糖尿病及其并发症、肾病综合症等疾病的治疗。而现代药理学研究表明,黄芪发挥上述疗效的机制可能在于其对内皮细胞的保护作用[1-4]。因此本文综述黄芪及其有效成分对内皮细胞及其连接的保护作用,为进一步开展相关研究提供参考。
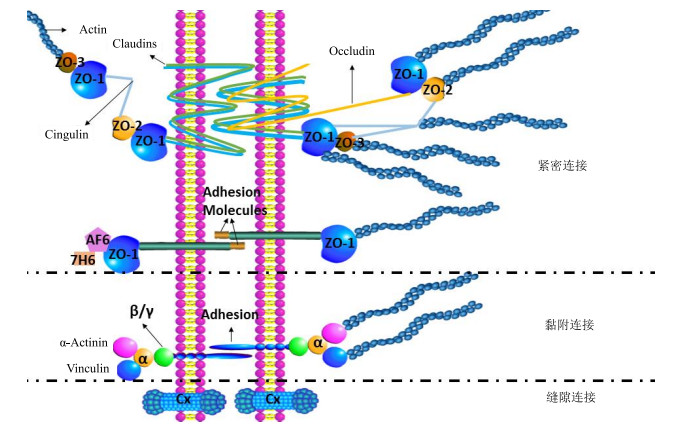
1 内皮细胞连接概述内皮细胞的连接方式有紧密连接(tight junctions,TJ)、黏附连接(adhere junctions,AJ)、缝隙连接(gap junctions,GJ)、纫带连接(syndesmos junctions,SJ),以及整合素家族参与的其他连接方式等[5-6]。其中,前3种连接方式是内皮细胞的3种主要连接方式(图 1)[7],现对其进行简要介绍。TJ通过细胞旁途径调节通透性并维持细胞极性;AJ在接触性抑制内皮细胞生长、白细胞及溶质的细胞旁途径通透方面发挥重要作用;GJ是一种信息交流结构,可以使相邻细胞之间的小分子溶质通过[7]。内皮细胞间的连接共同调控血浆渗漏、白细胞渗出和血管新生等生理和病理过程,参与心脑血管相关疾病的保护和修复[8]。
|
图 1 内皮细胞间连接示意图 Fig.1 Junctions of endothelial cells |
TJ位于细胞质膜的胆固醇富集区域,由多种蛋白复合而成。最外侧由闭合蛋白(Claudins)通过与相邻细胞同型闭合蛋白之间形成二聚体相互结合;咬合蛋白(Occludin)位于细胞膜,与增加跨膜电阻和降低细胞旁渗透性有关;闭合蛋白在细胞膜内通过闭合小环蛋白(Zonula occludens,ZO)与构成细胞骨架的肌动蛋白(Actin)相连;ZO间也会聚合,ZO间可由扣带蛋白(Cingulin)相连,构成TJ处识别蛋白和信号转导蛋白的支持结构;Actin与ZO、Claudins、Occludin都有结合位点。还有一些重要的蛋白,如与ZO-1有关的Ras效应分子AF6,能防止离子和大分子渗漏的磷蛋白7H6[9-11]。这些结构蛋白控制水、离子和其他小分子物质穿过相邻细胞间隙的动态屏障,并限制分子从基顶膜到基底膜的扩散来维持细胞极性[12]。研究显示,调节TJ张弛的信号通路主要有PI3K/Akt/mTOR信号通路[13]、TNF-α/NIK/NF-κB信号通路[14]等。
AJ是跨膜在胞外细胞间的VE钙黏蛋白(VE-cadherin)形成的拉链状结构;胞内,VE-cadherin通过信号蛋白(包括β-连环蛋白、γ-连环蛋白、α-连环蛋白和P120连环蛋白)与细胞骨架F-actin相连。VE-cadherin是细胞黏附分子(cell adhesion molecules,CAM)中钙黏附素的一种[15]。血管内皮细胞与白细胞、血小板、肿瘤细胞等的黏附是炎症、心血管疾病、肿瘤转移等疾病的重要环节[16],如内皮损伤后,活化的内皮细胞表达CAM吸引炎症细胞再经过一系列过程,形成动脉粥样硬化斑块[17]。AJ的调控可通过Rho通路介导[18]。
GJ是相邻细胞间的膜通道结构,它由细胞膜上的连接子相互衔接而成,可以介导细胞间通讯。每个连接子包含6个相同哑铃形蛋白质亚单位——缝隙连接蛋白(Connexin,Cx),连接子即Cx的六聚体所形成的跨膜蛋白通道(图 1)[19]。该跨膜通道可非选择性地通过相对分子质量小于1×103~1.5×103的小分子,在维持细胞间动态平衡,调节细胞生长、发育及分化中发挥重要作用。人类Cxs家族包括约20个成员,大多属于磷蛋白,处于不同的磷酸化水平[20]。GJ能调节内皮损伤后的修复过程,其介导的细胞间直接通讯能调节平滑肌细胞的增殖能力以及平滑肌细胞由合成型向收缩型的转化,在生理条件下参与维持及调节血管张力,在病理条件能够促进血管损伤后新生内膜的过度增生,在血管损伤性疾病的发生、发展过程中具有重要作用[21]。PI3K/Akt/mTOR信号通路中mTORC2的激活能调节GJ,但机制未明[13]。
2 黄芪及其有效成分对内皮细胞及其连接的保护作用黄芪的化学成分十分复杂[22],近年研究发现,黄芪化学成分主要有多糖、皂苷类、黄酮类[23]。其主要提取物和许多活性单体都已被证明对内皮细胞及其连接有保护作用,如黄芪甲苷、毛蕊异黄酮等。有研究表明,一些黄芪中成药制剂也对内皮细胞有保护作用,如单味药成药黄芪注射液。黄芪有效成分主要通过上调TJ相关蛋白表达、下调CAM表达调节内皮细胞连接,另外也通过调节细胞分泌活动、抑制细胞凋亡、促进血管生成中内皮细胞的增殖和迁移等方面参与内皮细胞活动的调控。
2.1 黄芪注射液对内皮细胞及其连接的保护作用黄芪注射液可上调TJ相关蛋白表达、下调CAM表达对内皮细胞产生保护作用。
黄芪注射液能预防和修复链脲佐菌素诱导的糖尿病大鼠血管内皮细胞TJ的损伤,降低高糖腹膜透析液引起的大鼠腹膜血管内皮细胞TJ的损伤[24-25]。其还可减轻对TJ相关蛋白的破坏作用,如黄芪注射液和川芎注射液联用可降低大鼠溶栓对TJ相关蛋白Claudin-1、Claudin-5的破坏作用,且提高二者蛋白的表达[26];能改善高糖引起的人肾小管上皮细胞(HK2)形态改变,降低CAM整合素相关蛋白CD146的表达[27]。
2.2 黄芪有效部位对内皮细胞连接的保护作用 2.2.1 黄芪多糖对内皮细胞及其连接的保护作用黄芪多糖主要包括葡聚糖、杂多糖等多糖成分[22]。黄芪多糖可以通过下调CAM表达、调节细胞的分泌活动、抑制细胞凋亡、促进血管生成中内皮细胞的增殖和迁移对内皮细胞产生保护作用。
缺糖缺氧和复糖复氧条件下,黄芪多糖可下调CAM表达,降低细胞间黏附分子-1(ICAM-1)、血管细胞黏附分子-1(VCAM-1)蛋白和mRNA的表达,从而抑制人心脏微血管内皮细胞(HCMEC)与外周中性粒细胞(PMN)的黏附,保护HCMEC内皮间连接[15, 28-29]。其中,黄芪多糖可下调p38 MAPK信号通路抑制内皮细胞CAM的表达,防止HCMEC与PMN之间的黏附[30]。黄芪多糖也能通过调节分泌活动来维持/增强大鼠肠黏膜微血管内皮细胞及新西兰兔动脉粥样硬化内皮细胞活性[31-32];增加高血压患者血清作用的脐静脉内皮细胞株(ECV-304)释放NO,从而抑制细胞内皮素(ET)释放、增加胞内游离钙浓度[33],保护内皮细胞。黄芪多糖胶原通过激活核转录因子-κB(NF-κB)信号通路抑制人脐静脉血管内皮细胞(HUVEC)凋亡,也能上调血管生成素Ⅰ(Ang I)、血管内皮生长因子(VEGF)和整合素αvβ3的表达,促进血管生成[34-35];黄芪多糖通过VEGF/VEGFR-1和Ang I1/Tie-2信号通路促进大鼠后肢缺血后血管生成[36]。综上所述,黄芪多糖对内皮细胞的保护是多方面的。
2.2.2 黄芪总皂苷对内皮细胞及其连接的保护作用黄芪总皂苷包含黄芪皂苷Ⅰ、Ⅲ、Ⅲ和大豆皂苷等40余种皂苷类成分[22]。黄芪总皂苷可以通过下调CAM的表达保护TJ、调节细胞分泌活动、抑制细胞凋亡保护内皮细胞。
在原代小鼠肾动脉内皮细胞(AECs)中,黄芪总皂苷通过降低细胞表面肿瘤坏死因子受体(TNRF-1)水平,抑制肿瘤坏死因子-α(TNF-α)诱导的炎症反应及其下游信号通路,降低CAM表达水平[3]。另外,黄芪总皂苷还能通过调节mTOR信号通路并下调环氧酶-2(COX-2),显著抑制结肠癌细胞株HCT116和HT-29生长、减少血清中VEGF的量[37],抑制血管生成。TNF-α可以促进PMN的吞噬,COX-2诱导催化前列腺素参与炎症反应,黄芪总皂苷可通过抑制二者对内皮细胞间连接的破坏,发挥内皮保护功能。
2.2.3 黄芪总黄酮对内皮细胞及其连接的保护作用黄芪总黄酮包含槲皮素、异鼠李素、芒柄花素、山柰黄素和芦丁等30多种黄酮类成分[22],主要通过抑制内皮细胞凋亡保护内皮细胞。
黄芪总黄酮提取物可抑制高糖引起的牛视网膜血管周细胞凋亡[38],抑制终末期肾脏病患者[39]、尿毒症患者[40]血清诱导的HUVECs凋亡。
2.3 黄芪单体成分对内皮细胞及其连接的保护作用 2.3.1 黄芪甲苷黄芪甲苷是黄芪总皂苷中的主要活性单体成分之一[3],国内外研究黄芪皂苷对内皮细胞的保护作用大多集中于黄芪甲苷的研究。黄芪甲苷能上调TJ相关蛋白表达、下调CAM表达、抑制细胞凋亡、促进内皮细胞的增殖和迁移,参与血管生成。
黄芪甲苷能够显著抑制大鼠缺血再灌注所引起的TJ相关蛋白Occludin和ZO-1表达的下调,对血脑屏障通透性有保护效应,同时,通过调控NF-κB通路,下调CD11b/CD18和ICAM-1的表达、抑制PMN与内皮细胞的黏附及迁移浸润[41]。黄芪甲苷可改善高糖诱导的内皮屏障功能损伤,并剂量依赖性地减低TNF-α引起的内皮细胞功能损伤,包括抑制细胞代谢活性丧失和细胞凋亡,具有改善内皮功能、治疗糖尿病心血管并发症的潜力,但其机制未明[42]。黄芪甲苷还通过活化PI3K/AKT信号通路激活低氧诱导因子1(HIF-1α),上调VEGF水平,抑制缺氧诱发的内皮细胞凋亡,促进血管内皮细胞的增殖和体外离体管腔的形成[43]。黄芪甲苷可以逆转异丙肾上腺素诱导的心肌梗死中Cx43表达减少和分布紊乱,其机制可能与抗氧化反应有关[44]。
2.3.2 毛蕊异黄酮毛蕊异黄酮通过下调CAM表达、调节细胞分泌活动、抑制细胞凋亡、促进血管新生等方面保护内皮细胞。
毛蕊异黄酮可以抑制ECV304细胞分泌ICAM-1蛋白,同时抑制其受体LFA-1蛋白的表达,从而抑制ECV304与PMN的黏附[45];毛蕊异黄酮还可以呈剂量依赖性地促进TNF-α诱导的ECV304细胞分泌NO,抑制ET-1分泌[46]。另外,毛蕊异黄酮也参与Rho/ROCK通路对HUVECs细胞的调节,通过降低VEGF、VEGFR2和PI3K水平阻断AKT信号通路,稳定细胞骨架结构,抑制细胞凋亡、促进血管生成中内皮细胞的增殖和迁移[47]。
2.3.3 芒柄花素芒柄花素通过调节内皮细胞分泌功能保护内皮细胞。芒柄花素与毛蕊异黄酮-7-O-β-吡喃葡萄糖可抑制血管紧张素Ⅱ(Ang Ⅱ)所致的体外培养HUVECs损伤[48]。芒柄花素在大鼠体内依赖内皮细胞分泌产生NO,调节内皮细胞活性,发挥保护作用[49]。
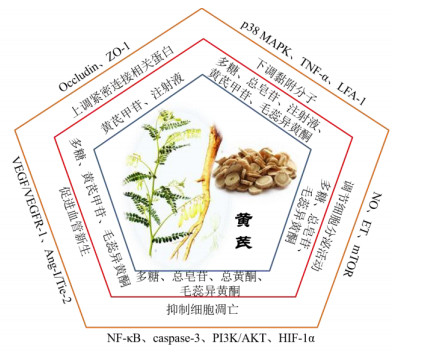
3 结语与展望黄芪提取物和单体成分是通过调节内皮细胞分泌功能、保护内皮细胞间连接、抑制内皮细胞凋亡、促进血管生成中内皮细胞的增殖和迁移等多种机制保护内皮细胞的(图 2),涉及p38 MAPK/NF-κB、Rho/ROCK、PI3K/Akt、VEGF/Ang-1等信号通路多个关键性靶点,其中包括受体TNF-1R、VEGFR2、Tie-2、LFA-1,整合素、生长因子、细胞因子的合成,以及PI3K、RhoA、p38 MAPK等的激活。黄芪对内皮细胞连接的保护主要集中在TJ,也调节CAM抑制单核细胞与内皮细胞产生黏附而破坏内皮连接,关于GJ的保护作用鲜有报道。虽少有文献报道黄芪有效成分对AJ和GJ的直接保护作用,但Ang-1和VEGF对血管通透性通过对VE-cadherin的内化产生的影响[18]或许也能被黄芪有效成分调节,且GJ作为重要的通道在黄芪保护内皮细胞方面也应发挥重要作用。除此之外,3种连接是否存在相互作用,相互作用是通过何种方式实现的,仍未可知。今后,黄芪用药后是否通过多机制、多靶点最终作用于相关连接并使三者之间相互作用加强内皮细胞间连接,这一点将是研究黄芪维护内皮细胞屏障稳态机制的关键点,为黄芪保护内皮细胞作用机制研究的整体性与完整性提供新的方向。
|
图 2 黄芪对内皮细胞的保护机制 Fig.2 Protection mechanism of Astragali Radix on endothelial cells |
| [1] | 张小鸿, 徐先祥, 汪宁卿. 黄芪保护血管内皮细胞作用机制研究进展[J]. 中国药学杂志 , 2013, 48 (18) :1526–1530. |
| [2] | Yin Y, Qi F, Song Z, et al. Ferulic acid combined with astragaloside IV protects against vascular endothelial dysfunction in diabetic rats[J]. BioSci Trends , 2014, 8 (4) :217–226. DOI:10.5582/bst.2014.01081 |
| [3] | Liu Q S, Wang H F, Sun A K, et al. A comparative study on inhibition of total astragalus saponins and astragaloside IV on TNFR1-mediated signaling pathways in arterial endothelial cells[J]. PLoS One , 2014 . DOI:10.1371/journal.pone.0101504 |
| [4] | Wu H W, Fang J, Tang L Y, et al. Quality evaluation of Astragali Radix based on DPPH radical scavenging activity and chemical analysis[J]. Chin Herb Med , 2014, 6 (4) :282–289. DOI:10.1016/S1674-6384(14)60043-5 |
| [5] | 黄焰霞, 刘艾然, 杨毅. 内皮细胞间黏附连接调节机制的研究进展[J]. 中国危重病急救医学 , 2013, 25 (3) :190–192. |
| [6] | 王晓军, 杨宗城. 内皮细胞间连接的研究进展[J]. 生理科学进展 , 1998, 29 (4) :314–318. |
| [7] | Bazzoni G. Endothelial cell-to-cell junctions: molecular organization and role in vascular homeostasis[J]. Physiol Rev , 2004, 84 (3) :869–901. DOI:10.1152/physrev.00035.2003 |
| [8] | de Bruin R G, van der Veer E P, Prins J, et al. The RNA-binding protein quaking maintains endothelial barrier function and affects VE-cadherin and β-catenin protein expression[J]. Sci Rep , 2016 . DOI:10.1038/srep21643 |
| [9] | Huber J D, Egleton R D, Davis T P. Molecular physiology and pathophysiology of tight junctions in the blood-brain barrier[J]. Trends Neurosci , 2001, 24 (12) :719–725. DOI:10.1016/S0166-2236(00)02004-X |
| [10] | González-Mariscal L, Tapia R, Chamorro D. Crosstalk of tight junction components with signaling pathways[J]. Biochim Biophys Acta , 2008, 1778 (3) :729–756. DOI:10.1016/j.bbamem.2007.08.018 |
| [11] | Mandel I, Paperna T, Glass-Marmor L, et al. Tight junction proteins expression and modulation in immune cells and multiple sclerosis[J]. J Cell Mol Med , 2012, 16 (4) :765–775. DOI:10.1111/j.1582-4934.2011.01380.x |
| [12] | Worzfeld T, Schwaninger M. Apicobasal polarity of brain endothelial cells[J]. J Cereb Blood Flow Metab , 2016, 36 (2) :340–362. DOI:10.1177/0271678X15608644 |
| [13] | Li N, Cheng C Y. Mammalian target of rapamycin complex (mTOR) pathway modulates blood-testis barrier (BTB) function through F-actin organization and gap junction[J]. Histol Histopathol , 2016, 31 (9) :961–968. |
| [14] | Al-Sadi R, Guo S, Ye D, et al. TNF-alpha modulation of intestinal tight junction permeability is mediated by NIK/IKK-alpha axis activation of the canonical NF-kappaB pathway[J]. Am J Pathol , 2016, 186 (5) :1151–1165. DOI:10.1016/j.ajpath.2015.12.016 |
| [15] | 徐冰.粘附分子与UAP中医证候相关规律及黄芪多糖干预机理研究[D].北京:北京中医药大学, 2012. |
| [16] | Homrich M, Gotthard I, Wobst H, et al. Cell adhesion molecules and ubiquitination—functions and significance[J]. Biology , 2016 . DOI:10.3390/biology5010001 |
| [17] | 鲍美华. let-7家族在ox-LDL所致人血管内皮损伤中的作用于机制研究[D].长沙:中南大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10533-1014404044.htm |
| [18] | Gavard J, Patel V, Gutkind J S. Angiopoietin-1 prevents VEGF-induced endothelial permeability by sequestering Src through mDia[J]. Dev Cell , 2008, 14 (1) :25–36. DOI:10.1016/j.devcel.2007.10.019 |
| [19] | 宋明宝.缝隙连接在损伤血管修复中作用的实验研究[D].重庆:第三军医大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-90025-2009022747.htm |
| [20] | 王玮.缝隙连接蛋白与动脉粥样硬化性脑梗死的相关性研究[D].长沙:中南大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10533-2010185435.htm |
| [21] | 王荣, 张存泰, 王琳. 缝隙连接蛋白Cx43的磷酸化对缝隙连接通讯的调控[J]. 中国心血管杂志 , 2008, 13 (2) :150–153. |
| [22] | 郭立忠. 中药黄芪化学成份与药理活性研究分析[J]. 中国卫生标准管理 , 2015, 6 (31) :119–121. |
| [23] | 刘德丽, 包华音, 刘杨. 近5年黄芪化学成分及药理作用研究进展[J]. 食品与药品 , 2014 (1) :68–70. |
| [24] | 舒静, 王怡, 张晓云. 黄芪注射液拮抗高糖腹膜透析液对腹膜间皮细胞紧密连接的影响[J]. 上海中医药大学学报 , 2007, 21 (4) :50–53. |
| [25] | 高影.黄芪注射液拮抗高糖损伤作用机制的研究[D].长春:吉林大学, 2009. |
| [26] | 贾翔.芎芪有效成分对脑梗死大鼠溶栓后血脑屏障及Claudin的影响[D].广州:广州中医药大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10572-1015506014.htm |
| [27] | 孙文连, 宋恩峰. 不同剂量黄芪注射液对人肾小管上皮细胞黏附分子CD146表达的影响[J]. 微循环学杂志 , 2014, 24 (2) :35–37. |
| [28] | 陈立新, 朱海燕, 朱陵群, 等. 黄芪多糖对人心脏微血管内皮细胞增殖及再灌注后内皮细胞与中性粒细胞黏附的影响[J]. 中国组织工程研究与临床康复 , 2007, 11 (27) :5382–5386. |
| [29] | 朱海燕.黄芪多糖对人心脏微血管内皮细胞再灌注损伤粘附分子表达及调控的研究[D].北京:北京中医药大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10026-2008114395.htm |
| [30] | Zhu H Y, Gao Y H, Wang Z Y, et al. Astragalus polysaccharide suppresses the expression of adhesion molecules through the regulation of the p38 MAPK signaling pathway in human cardiac microvascular endothelial cells after ischemia-reperfusion injury[J]. Evid Based Complement Alternat Med , 2013 . DOI:10.1155/2013/280493 |
| [31] | 解慧梅, 穆祥, 胡格, 等. 黄芪多糖对大鼠肠黏膜微血管内皮细胞分泌NO的影响[J]. 北京农学院学报 , 2005, 20 (4) :58–60. |
| [32] | 曾国安, 陈玉燕, 李博, 等. 黄芪多糖对兔动脉粥样硬化内皮细胞功能的影响[J]. 中西医结合心脑血管病杂志 , 2010, 8 (10) :1206–1208. |
| [33] | 李眺.川芎嗪、黄芪多糖及其配伍对血管内皮细胞保护作用的研究[D].广州:暨南大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10559-2009010778.htm |
| [34] | 樊炼.黄芪多糖胶原促血管新生作用的实验研究[D].南京:南京中医药大学, 2010. http://mall.cnki.net/magazine/article/jszy201006045.htm |
| [35] | 虞林湘.黄芪多糖胶原促进血管新生与组织修复的实验研究[D].南京:南京中医药大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10315-1014413742.htm |
| [36] | Tu S, Shao A, Ren L, et al. Angiogenesis effect of Astragalus polysaccharide combined with endothelial progenitor cells therapy in diabetic male rat following experimental hind limb ischemia[J]. Chin Med J (Engl) , 2014, 127 (11) :2121–2128. |
| [37] | Law P C, Auyeung K K, Chan L Y, et al. Astragalus saponins downregulate vascular endothelial growth factor under cobalt chloride-stimulated hypoxia in colon cancer cells[J]. BMC Complement Altern Med , 2012 . DOI:10.1186/1472-6882-12-160 |
| [38] | 康英英, 匡洪宇, 马丽丽, 等. 不同浓度的黄芪总黄酮对高糖培养下牛视网膜血管周细胞凋亡的影响[J]. 哈尔滨医科大学学报 , 2008, 42 (2) :135–137. |
| [39] | 郭晓超.黄芪总黄酮对终末期肾脏病患者血清诱导的血管内皮细胞凋亡的影响[D].兰州:兰州大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10730-1014304299.htm |
| [40] | 苏筠霞, 李建华, 刘天喜, 等. 黄芪总黄酮对尿毒症患者血清诱导的内皮细胞凋亡的影响[J]. 国际检验医学杂志 , 2014, 35 (18) :2427–2429. |
| [41] | 李敏.黄芪甲苷对大鼠脑缺血再灌注损伤后血脑屏障及脑的保护作用机制研究[D].西安:第四军医大学, 2012. |
| [42] | 袁巍.黄芪甲苷对糖尿病血管重构的保护作用及其相关机制研究[D].杭州:浙江大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10335-2009165398.htm |
| [43] | 司静文.基于血管新生与成熟的Hif-1α信号机制揭示黄芪甲苷Ⅳ治疗心肌梗死的新机制[D].西安:第四军医大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-90032-1014047009.htm |
| [44] | 李真真.黄芪甲苷对异丙肾上腺素所致心肌梗死的保护作用及Cx43表达的影响[D].兰州:兰州大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10730-1013237656.htm |
| [45] | 唐柏山.毛蕊异黄酮对血管内皮细胞ICAM-1及其受体LFA-1表达的影响[D].兰州:兰州大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10730-1011142650.htm |
| [46] | 宁雅娴.黄芪单体毛蕊异黄酮对TNF-α损伤人脐静脉内皮细胞ET-1/NO的影响[D].兰州:兰州大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10730-1011140659.htm |
| [47] | 李伟.补气活血、清热泄浊中药单体对内皮细胞骨架的影响及其调节机制[D].南京:南京中医药大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10315-1014416372.htm |
| [48] | 梁连生.甘肃黄芪黄酮化合物对内皮细胞损伤的保护[D].兰州:兰州大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10730-2006088174.htm |
| [49] | Sun T, Liu R, Cao Y X. Vasorelaxant and antihypertensive effects of formononetin through endothelium-dependent and-independent mechanisms[J]. Acta Pharmacol Sin , 2011, 32 (8) :1009–1018. DOI:10.1038/aps.2011.51 |
 2016, Vol. 47
2016, Vol. 47


