乳腺癌是女性最常见的癌症之一,虽然临床上有多种化学合成药物如他莫昔芬、赫塞汀等已被广泛地用于治疗乳腺癌,但是由于具有毒性大、容易耐药等问题,临床效果不理想,目前临床上仍亟需高效、低毒、特异性的乳腺癌治疗药物[1]。抑制多聚腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)是一个新的有针对性的治疗策略,可能治疗晚期三阴性乳腺癌[2-3]。三阴性乳腺癌是一种雌激素和孕激素受体(ER、PR)和HER2蛋白表达缺乏的侵袭性乳腺癌,在临床治疗上有很大难度[4-5]。
茯苓为常用中药,为多孔菌科卧孔菌属真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核。茯苓是常用的利尿药和镇静药,茯苓单独或与其他药物组合在临床上用于治疗糖尿病以及其他疾病。现代天然药物化学研究发现茯苓中主要含有三萜类和多糖类化合物,已知的化学成分有茯苓酸、块苓酸、松苓酸、松苓新酸、齿孔酸、麦角甾醇、辛酸、硬烷、月桂酸、十二酸等[6-7]。茯苓酸,又名3-8-乙酰氧基-16-α-羟基-羊毛甾烷-8, 24(31)-二烯-21-酸,是茯苓中量最大的三萜类化合物,具有多种生物学活性,例如抗炎、抗凋亡、抗免疫排斥反应等[8]。近年来国内外学者研究发现,茯苓酸能抑制不同的癌症包括肺癌、结肠癌、乳腺癌和胰腺癌等肿瘤细胞的生长、侵袭、转移[9-10]。因此,对茯苓酸进行深入的药效学和作用机制研究具有重要意义。本研究以三阴性人乳腺癌细胞系为研究对象,研究茯苓酸对细胞增殖及凋亡的影响,拟揭示其抗乳腺癌的作用机制。
1 材料 1.1 真菌原料及样品制备茯苓酸经加热回流提取法制备,取2 kg茯苓(茯苓药材购自于江西樟树药材市场,由江西中医药大学罗光明教授鉴定为多孔菌科卧孔菌属真菌茯苓Poria cocos (Schw.) Wolf的干燥菌核,药材标本保存于江西中医药高等专科学校药学系),加95%乙醇10 L,加热回流提取3次,提取时间分别为60、40、30 min,合并3次提取液后滤过除渣,得茯苓粗提物溶液。减压浓缩回收乙醇后,再通过硅胶柱色谱,以石油醚-丙酮为洗脱剂梯度洗脱,分段收集,再通过半制备型HPLC分离,以C18柱为色谱柱,以甲醇-水(60:40)为流动相洗脱,得到茯苓酸,化合物波谱数据与文献对照[11],证实为茯苓酸。使用时样品溶解于DMSO,用DMEM培养液稀释至所需浓度。
1.2 细胞与试剂人乳腺癌细胞系MDA-MB-231细胞购于中国科学院典型培养物保藏委员会细胞库。RPMI 1640培养液购自北京四季青生物材料研究所;CCK-8试剂盒购于北京索莱宝生物科技有限公司;青霉素、链霉素、胎牛血清购自Invitrogen公司;AnnexinV/PI细胞凋亡检测试剂盒购于Bender公司;细胞浆蛋白抽提试剂盒购于上海碧云天生物技术有限公司;其他试剂(分析纯)购于北京试剂厂。
1.3 实验仪器安捷伦Agilent 1260 Infinity液相色谱仪(安捷伦科技有限公司);Agilent Zorbaxe clipse XDB C18半制备柱(安捷伦科技有限公司);DW-86L286海尔超低温冰箱(南京贝登生物科技有限公司);AUW120D岛津半微量分析天平(岛津企业管理有限公司);Eppendorf-5418高速离心机(深圳市赛亚泰科仪器设备有限公司);UV-1800分光光度计(岛津企业管理有限公司);DYY-6D三恒电泳仪(北京市六一仪器厂);YQX-Ⅱ厌氧培养箱(上海跃进医疗器械有限公司);BD FACSCanto Ⅱ流式细胞仪(上海碧迪医疗器械有限公司);HNY-200B台式全温度恒温高速培养摇床(北京傲松欣实验室设备有限公司);MLS-3751L高压蒸汽灭菌锅MJ-78A(上海旦鼎国际贸易有限公司)。
2 方法 2.1 细胞培养将MDA-MB-231细胞培养于RPMI 1640培养液(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素)中,置于37 ℃、5% CO2,湿度饱和的细胞培养箱内,取对数生长期细胞用于实验。
2.2 细胞增殖抑制实验取1×105/mL对数生长期的乳腺癌细胞,分别接种于96孔板(200 μL/孔),细胞贴壁后每孔加入终浓度为1、2、5 μmol/L的茯苓酸,各质量浓度均设6个复孔,分别继续培养24、48、72 h,以同体积RPMI 1640培养液为对照。每孔加入新鲜培养基(100 μL/孔)和10 μL CCK-8溶液中在37℃下温育1 h,用酶标仪于450 nm测定吸光度(A)值,计算细胞活力(细胞活力=对照组A值/给药组A值)。
2.3 流式细胞术检测细胞凋亡将对数生长期的MDA-MB-231细胞,以1×106/mL浓度接种于6孔细胞培养板内,待细胞贴壁后分别加入终浓度为1、2、5 μmol/L的茯苓酸,继续培养细胞48 h后,收集细胞,离心固定后加入Annexin V-FITC和PI,室温避光条件下染色。筛网滤过后送流式细胞仪进行细胞凋亡的检测。
2.4 Western blotting法检测相关蛋白表达细胞以1、2、5 μmol/L的茯苓酸处理48 h后收集细胞,参照试剂盒说明书进行细胞浆蛋白抽提操作,提取细胞总蛋白并测定浓度,蛋白样品加入1/5体积的5×上样缓冲液,沸水煮沸5 min,根据蛋白浓度以20 μg/孔上样,进行SDS-聚丙烯酰胺凝胶电泳,然后电转至PVDF膜上,用室温封闭1 h,加入1:1 000稀释的PARP蛋白,4 ℃过夜。以β-actin或GAPDH分别作为内参,TBST洗膜3次,加入1:1 000稀释的辣根酶标记的兔抗山羊IgG,室温孵育2 h,同样洗膜3次,ECL发光液显色,观察各条带深浅变化。
2.5 统计学方法应用SPSS 19.0统计软件进行统计处理。计量资料数据用x±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
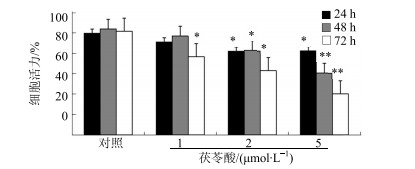
3 结果 3.1 茯苓酸对MDA-MB-231细胞活力的影响如图 1所示,茯苓酸分别处理24、48、72 h,在1~5 μmol/L内均可不同程度抑制MDA-MB-231细胞增殖,且随着茯苓酸浓度的增加和处理时间的延长,抑制细胞活力的作用也逐渐增强,呈浓度和时间依赖效应。
|
与对照组同时间点比较:*P < 0.05 **P < 0.01 *P < 0.05 **P < 0.01 vs control group at the same time point 图 1 茯苓酸对MDA-MB-231细胞活力的影响(x±s, n=6) Fig.1 Effect of pachymic acid on viability of MDA-MB-231 cells (x±s, n=6) |
3.2 茯苓酸对MDA-MB-231细胞凋亡的影响
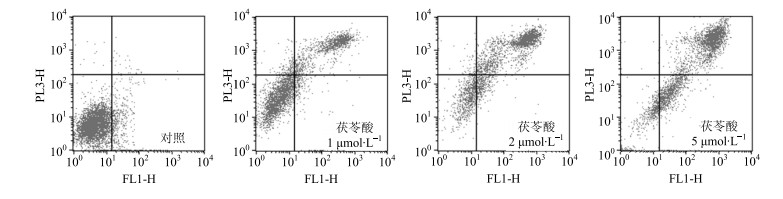
流式细胞仪检测结果显示,茯苓酸能诱导MDA-MB-231细胞凋亡。如图 2所示,1、2、5 μmol/L茯苓酸处理MDA-MB-231细胞48 h后,细胞凋亡(早期凋亡+晚期凋亡)率分别为25.6%、59.4%、87.2%,明显高于对照组凋亡率(5.4%),且其作用具有明显剂量依赖性。
|
图 2 茯苓酸对MDA-MB-231细胞凋亡的影响 Fig.2 Effect of pachymic acid on apoptosis of MDA-MB-231 cells |
3.3 茯苓酸对MDA-MB-231细胞内PARP以及cleaved PARP蛋白表达的影响
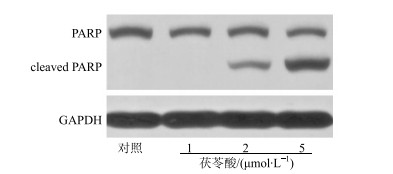
通过Western blotting测定,发现未用茯苓酸处理的MDA-MB-231细胞中cleaved PARP几乎没有表达。茯苓酸(1、2、5 μmol/L)处理MDA-MB-231细胞48 h后,MDA-MB-231细胞cleaved PARP表达量呈剂量依赖性地增加,如图 3所示。
|
图 3 茯苓酸对MDA-MB-231细胞PARP蛋白表达的影响 Fig.3 Effects of pachymic acid on protein expression level of cleaved PARP in MDA-MB-231 cells |
3.4 茯苓酸对MDA-MB-231细胞内凋亡相关蛋白表达的影响
通过Western blotting测定,发现经过茯苓酸(1、2、5 μmol/L)处理后,MDA-MB-231细胞中cleaved Caspase-3、cleaved Caspase-8、cleaved Caspase-9表达量显著上调,抗凋亡蛋白Bcl-2表达量下降,而促凋亡蛋白Bax表达量上升,如图 4所示。

|
图 4 茯苓酸对MDA-MB-231细胞中凋亡相关蛋白表达的影响 Fig.4 Effects of pachymic acid on apoptosis-related protein expression levels in MDA-MB-231 cells |
4 讨论
全球乳腺癌患者发病率一直呈上升趋势,中国虽不是乳腺癌的高发国家,但近年乳腺癌发病率的增长速度很快。全国肿瘤登记地区乳腺癌发病率已经位居女性恶性肿瘤的第1位。如今,乳腺癌患者最佳治疗手段的选择依然面临很大的挑战[12]。与化学药品相比,天然药物除了有着来源广泛、价格低廉和毒副作用低等优点外,在减轻癌症患者临床症状,提高生存质量,提高免疫力,增强放、化疗敏感性,减轻放、化疗不良反应等很多方面都具有优势。近年来中药及其有效部位或成分抗癌研究工作取得了一系列的成果,已成为肿瘤医学的研究热点之一[13-15]。
近年来,从真菌的药用植物次生代谢产物中已分离出许多抗肿瘤活性较高的生物活性物质[16],这表明药用植物内生真菌已成为药物开发的重要资源。从植物内生菌尤其是药用真菌里面寻找高活性的化合物有重要意义,从中发现了很多有前景的抗肿瘤活性成分。本研究选择人乳腺癌细胞为研究对象,检测茯苓中的代表性化合物茯苓酸的抗肿瘤作用,旨在揭示茯苓在乳腺癌治疗中的作用机制。通过CCK-8实验,发现茯苓酸可以显著降低MDA-MB-231细胞活力(呈时间及剂量依赖性),进而通过流式细胞术检测了茯苓酸对细胞的凋亡作用,发现茯苓酸可以诱导MDA-MB-231细胞凋亡。
PARP是半胱天冬酶(Caspase)的切割底物,在DNA损伤修复与细胞凋亡中发挥着重要作用[17]。本研究通过免疫印迹实验发现,茯苓酸呈时间依赖性地增加MDA-MB-231细胞中PARP的活性形式cleaved PARP的表达量。茯苓酸可以浓度依赖性地增加Caspase-3、Caspase-8和Caspase-9的活性形式cleaved Caspase-3、cleaved Caspase-8和cleaved Caspase-9的表达量,提示茯苓酸可能是通过增强细胞Caspase活性从而促进细胞凋亡。此外,茯苓酸可以浓度依赖性地上调促凋亡蛋白Bax的表达量,而下调抗凋亡蛋白Bcl-2的表达量。
综上所述,茯苓酸体外具有抑制乳腺癌细胞MDA-MB-231增殖、促进细胞凋亡的作用,其体内抗乳腺癌作用值得深入研究。
| [1] | Papanikolaou J G. Oncoplastic breast-conserving surgery in breast cancer treatment systematic review of the literature[J]. Ann Ital Chir , 2016, 87 (1) :199–208. |
| [2] | Mazzotta A, Partipilo G, De Summa S, et al. Nuclear PARP1 expression and its prognostic significance in breast cancer patients[J]. Tumour Biol , 2016, 37 (5) :6143–6153. DOI:10.1007/s13277-015-4465-0 |
| [3] | Drew Y, Ledermann J, Hall G, et al. Phase 2 multicentre trial investigating intermittent and continuous dosing schedules of the poly (ADP-ribose) polymerase inhibitor rucaparib in germline BRCA mutation carriers with advanced ovarian and breast cancer[J]. Br J Cancer , 2016, 114 (7) :723–730. DOI:10.1038/bjc.2016.41 |
| [4] | Marmé F, Schneeweiss A. Targeted therapies in triple-negative breast cancer[J]. Breast Care (Basel) , 2015, 10 (3) :159–166. DOI:10.1159/000433622 |
| [5] | Collignon J, Lousberg L, Schroeder H, et al. Triple-negative breast cancer: treatment challenges and solutions[J]. Breast Cancer , 2016, 8 (1) :93–107. |
| [6] | Zheng Y, Yang X W. Poriacosones A and B: two new lanostane triterpenoids from Poria cocos[J]. J Asian Nat Prod Res , 2008, 10 (7/8) :645–651. |
| [7] | Wang F Y, Lv W S, Han L. Determination and pharmacokinetic study of pachymic acid by LC-MS/MS[J]. Biol Pharm Bull , 2015, 38 (9) :1337–1344. DOI:10.1248/bpb.b15-00121 |
| [8] | Kim T G, Lee Y H, Lee N H, et al. The antioxidant property of pachymic acid improves bone disturbance against AH plus-induced inflammation in MC-3T3 E1 cells[J]. J Endod , 2013, 39 (4) :461–466. DOI:10.1016/j.joen.2012.11.022 |
| [9] | Chen Y, Lian P, Liu Y, et al. Pachymic acid inhibits tumorigenesis in gallbladder carcinoma cells[J]. Int J Clin Exp Med , 2015, 8 (10) :17781–17788. |
| [10] | Jeong J W, Lee W S, Go S I, et al. Pachymic acid induces apoptosis of EJ Bladder cancer cells by DR5 up-regulation, ROS generation, modulation of Bcl-2 and IAP family members[J]. Phytother Res , 2015, 29 (10) :1516–1524. DOI:10.1002/ptr.v29.10 |
| [11] | Zheng Y, Yang X W. Two new lanostane triterpenoids from Poria cocos[J]. J Asian Nat Prod Res , 2008, 10 (3/4) :323–328. |
| [12] | Casellas-Grau A, Vives J, Font A, et al. Positive psychological functioning in breast cancer: An integrative review[J]. Breast , 2016, 27 (1) :136–168. |
| [13] | Li N, Cao L, Wang Y R, et al. Induction of solasonine on apoptosis of human breast cancer Bca p-37 Cells through mitochondria-mediated pathway[J]. Chin Herb Med , 2016, 8 (2) :164–172. DOI:10.1016/S1674-6384(16)60026-6 |
| [14] | Wang M L, Liu J E, Su Y L, et al. Experiences and insomnia-associated factors in Chinese breast cancer survivors: a qualitative study[J]. J Clin Nurs , 2016, 25 (13/14) :1923–1930. |
| [15] | 李娇妹, 郑纺, 翟丽娟, 等. 三萜类化合物抗肿瘤活性研究进展[J]. 中草药 , 2014, 45 (15) :2265–2271. |
| [16] | 杨明俊, 李娟, 薛鸿燕, 等. 水仙内生真菌的分离及抑菌和抗肿瘤活性研究[J]. 中草药 , 2014, 45 (6) :819–824. |
| [17] | Dizdar O, Arslan C, Altundag K. Advances in PARP inhibitors for the treatment of breast cancer[J]. Expert Opin Pharmacother , 2015, 16 (18) :2751–2758. DOI:10.1517/14656566.2015.1100168 |
 2016, Vol. 47
2016, Vol. 47

