2. 北京中医药大学中药学院, 北京 100102
2. College of Chinese Materia Medica, Beijing University of Traditional Chinese Medicine, Beijing 100102, China
天麻素为兰科(Orchidaceae)天麻属Gastrodia R. Br.植物天麻Gastrodia elata Bl.的干燥块茎中的活性成分,具有镇静、镇痛、安眠作用,亦能抗惊厥、抗焦虑,能增加脑血流量、减少血管阻力、改善椎-基底动脉供血不足,具有神经保护作用[1-2],临床上广泛应用于眩晕、前庭神经元炎、椎-基底动脉供血不足、头痛、神经衰弱及高血压等疾病的治疗[3]。脑是天麻素的作用靶器官,由于其为水溶性药物,透过血脑屏障(BBB)比较困难。天麻素注射后入脑的量比较少,临床上为达到治疗效果,给药量比较大[4]。
多药转运体是一类三磷酸腺苷(ATP)结合蛋白质超家族,能够识别多种作用机制不同的治疗脑部疾病的药物,主动将药物泵出到BBB以外。P-糖蛋白(P-gp)和多药耐药相关蛋白1(MRP1)是被人们研究最早的2种多药转运体[5-6],可通过加入P-gp和MRPl的特异性拮抗剂干预来提高药物在脑内的浓度。关于P-gp及其底物或抑制剂的机制研究已经持续许多年,也形成了一些关于它们之间相互作用的分子机制假说。P-gp上至少有4个药物结合位点,包括介导药物在细胞膜转运的转运位点、改变P-gp功能的调节位点[7],一些药物会减少细胞内ATP的量,从而抑制P-gp ATPase活性[8]。此外,一些药物可能通过竞争结合位点来发挥P-gp抑制作用。刘瑶[9]研究发现,天麻素由于P-gp介导的外排机制,使其中枢神经系统(CNS)透过量受到很大的限制,难透过BBB,大脑摄取量非常低,但是二者之间的作用机制尚无相关研究报道。
在多药耐药相关蛋白(MRP)家族的9个成员(MRP1~MRP9)中,MRP1被研究得最多。MRP1属于ABC转运载体蛋白家族,具有广泛的生物学功能。MRP1研究较多的是在肿瘤细胞中的表达情况及其与抗肿瘤药物的耐药性的关系。MRP1在肿瘤细胞中的作用与P-gp相似,是依赖ATP的药物外排泵[10]。近年来,MRP1与耐药性癫痫的关系也越来越受到关注[11]。MRP1多数位于上皮细胞,在正常脑组织内MRP1分布于脉络丛上皮细胞和室管膜上皮细胞,参与BBB和血-脑脊液屏障(blood-cerebrospinal fluid barrier,BCB)的保护功能,阻止有害物质或药物进入脑组织。目前,MRP1抑制剂结合的部位和作用机制还不明确,天麻素的转运与MRP1是否有关及其机制尚未见报道。
MDCK-MDR1细胞系是以人多药耐药基因1(MDR1)转染马丁达比犬肾上皮细胞(MDCK)而成,在极性细胞顶端侧特异性高表达P-gp的细胞系,相对于其他细胞系而言,它具有较高的跨膜电阻值(TEER),TEER可达1 000 Ω/cm2甚至更高,细胞之间连接紧密,且其用于药物跨膜转运模型时,实验周期短,一般5~7 d便可用于实验,该细胞系是研究脑部疾病药物跨膜转运及机制的理想模型[12-14]。本实验采用MDCK-MDR1建立体外BBB细胞模型,研究天麻素跨BBB的转运特征;通过P-gp抑制剂维拉帕米、MRP1抑制剂丙磺舒对天麻素跨膜转运特性的影响,并结合Discovery Studio(DS)阐释其跨BBB转运的可能机制。
1 材料 1.1 仪器1260型高效液相色谱仪(美国Agilent公司);Sartorius BT25S十万分之一电子天平(赛多利斯科学仪器有限公司);3-18K高速冷冻离心机(德国Sigma公司);SW-CJ-2F超净工作台(苏州净化设备有限公司);Forma 3111二氧化碳恒温培养箱(Thermo Electron Corporation);Eclipse TS100倒置显微镜(Nikon公司);HHS型恒温水浴锅(上海博迅实业有限公司);TDZ4A-WS型台式低速离心机(湖南湘仪实验室仪器开发有限公司);02270113血球计数板(上海求精生化试剂仪器有限公司);MERS00002跨膜电阻仪(美国Millipore公司);ELX800酶标仪(Biotek公司)。
1.2 药物与试剂天麻素(成都瑞芬思生物科技有限公司,批号130618,质量分数>98%);维拉帕米(中国食品药品检定研究院,批号10023-200102,质量分数>98%);丙磺舒(北京燕京药业有限公司,批号030507,质量分数>98%);Transwell Permeable Supports(美国Costar公司,3460型,孔径0.4 μm,直径12 mm,底面积1.12 cm2);培养瓶(美国Costar公司);DMEM高糖培养基(美国Hyclone,货号SH30022.01B);胎牛血清(FBS,美国Gibco公司,货号10099-141);非必需氨基酸(美国Gibco公司,货号11140-050);双抗(Solarbio公司,货号P1400-100);0.25%胰酶-0.02% EDTA(美国Gibco,货号25200-056);HBSS(Solarbio,含钙离子、镁离子,不含酚红,货号H1025);乙腈为色谱级;水为双蒸水。
1.3 细胞细胞株MDCK-MDR1细胞由浙江大学惠赠,实验所用为35~55代。
2 方法 2.1 细胞培养MDCK-MDR1细胞培养于含10% FBS、1%非必需氨基酸和1%双抗的DMEM培养液中,置于37℃、5% CO2、湿度95%的培养箱中培养。隔天更换培养基,当细胞达到80%~90%融合时,吸弃旧培养液,用37℃的新鲜HBSS清洗2遍,0.25%胰酶-0.02% EDTA消化,按1:3传代。
2.2 MTT法评价天麻素的细胞毒性调整MDCK-MDR1细胞密度在5×104个/mL,每孔200 μL接种于96孔板上,置于37℃、5% CO2细胞培养箱中培养24 h,用HBSS液清洗细胞,排除培养基的干扰,加不同质量浓度(100、200、300、600、800、1 000 μg/mL)的天麻素,对照组加HBSS液,置培养箱中作用4 h,弃去药液并用HBSS液清洗细胞1次;各孔加入20 μL 5 mg/mL的MTT溶液;置培养箱内再作用4 h,弃去孔内的MTT,加入150 μL DMSO,摇床作用15 min溶解蓝紫色甲臜结晶;立即置酶标仪下测定490 nm处的吸光度(A)值,计算细胞存活率(药物组A值/对照组A值)。
2.3 分子对接靶蛋白三维结构从蛋白质数据库PDB(http://www.rcsb.org/pdb/home/home.do)中搜索下载,确定PDB代码分别为3G60(P-gp受体分子,pH 7.8)[15-16]、2CBZ(MRP1受体分子,pH 7.8)的蛋白质结构文件作为分子对接研究的载体[17-18]。利用DS 4.0中的Clean Protein工具对蛋白结构进行以下操作:删去配体分子和水分子、补全不完整残基、删除多余蛋白质构象、加氢和分配相关电荷。并保留3G60的B链用于分子对接。配体天麻素、维拉帕米、丙磺舒分子结构为从NCBI(http://www.ncbi.nlm.nih.gov/pubmed/)中搜索下载的sdf格式文件,在DS中赋予CHARMM力场并按pH 7.8质子化,用于与蛋白结构的分子对接。
查阅文献确定P-gp残基MET68、LEU300、TYR303、PHE332、LEU335、ILE336、PHE339、GLN721、PHE724、PHE728、LEU758、PHE833、TYR949、PHE974、SER975、VAL978、ALA981、MET982、GLY985、GLN986、SER989为P-gp蛋白药物结合位点氨基酸残基,MRP1残基LYS684、GLY683、SER685、SER686、TRP653、ASP793、GLN713、ASP792、HIS827为MRP1蛋白药物结合位点氨基酸残基,在DS中用以上氨基酸残基定义活性口袋。将配体在DS中赋予CHARMM力场并按pH 7.8质子化,用于与蛋白结构的分子对接。利用LibDock工具,Conformation Method参数设置为“BEST”,Docking Preferences参数设置为“High Quality”,其余参数为默认,分别将配体对接到原蛋白的活性口袋中,记录配体在此口袋的打分值LibDock Score。
2.4 HPLC-UV法测定天麻素 2.4.1 色谱条件色谱柱为Phenomenex Kinetex C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(4:96);体积流量1.0 mL/min;柱温30℃;检测波长221 nm;进样量20 μL。
2.4.2 供试品溶液的制备从顶端侧(AP)→基底侧(BL)转运时,在BL侧取转运液500 μL,从BL→AP侧时,在AP侧取转运液200 μL,涡旋1 min,4℃、16 000 r/min离心15 min,待测。
2.4.3 专属性考察在“2.4.1”项色谱条件下,空白HBSS溶液、对照品溶液以及跨膜转运实验样品的色谱图见图 1,天麻素的保留时间约为7.0 min。
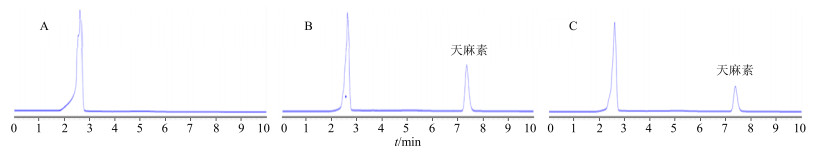
|
图 1 空白介质HBSS液(A)、对照品溶液(B)和转运实验样品(C)的HPLC-UV图 Fig.1 HPLC-UV of blank HBSS (A), reference solution (B), and sample after transportation of GAS (C) |
2.4.4 标准曲线的制备
用HBSS液配制质量浓度为0.2、0.5、1.0、2.0、5.0、10.0 μg/mL的天麻素对照品溶液,涡旋1 min,4℃、16 000 r/min离心15 min,取上清液进行分析。以待测物质峰面积为纵坐标,质量浓度为横坐标,进行线性回归,得标准曲线方程Y=37.791 X+1.251 4,r=1.000 0。结果表明,天麻素在0.2~10.0 μg/mL内线性关系良好。
2.4.5 回收率考察用HBSS液配制质量浓度为0.209、1.045、10.45 μg/mL的低、中、高3个质量浓度天麻素溶液,按“2.4.1”项色谱条件进样测定,以测得的质量浓度与配制质量浓度的比值计算回收率,低、中、高3个质量浓度的回收率分别为114.1%、95.5%、96.4%。
2.4.6 精密度考察用HBSS液配制质量浓度为0.209、1.045、10.45 μg/mL的低、中、高3个质量浓度天麻素溶液,每个质量浓度平行测定6次,低、中、高3个质量浓度样品峰面积的RSD值分别为1.64%、0.62%、0.36%。
2.4.7 重复性考察用HBSS液配制质量浓度为0.209、1.045、10.45 μg/mL的低、中、高3个质量浓度天麻素溶液,同一质量浓度平行6份,测定峰面积,低、中、高3个质量浓度样品峰面积的RSD值分别为1.08%、0.43%、0.59%。
2.4.8 稳定性考察用HBSS液配制质量浓度为0.209、1.045、10.45 μg/mL的低、中、高3个质量浓度天麻素溶液,将样品4℃放置48 h,并分别于0、4、8、24、36、48 h取样,涡旋1 min,4℃、16 000 r/min离心15 min,取上清液进行测定。结果显示,低、中、高3个质量浓度的样品在4℃、48 h内测定结果的RSD值均小于5%,说明样品在4℃、48 h内稳定性良好。
2.5 天麻素体外转运实验取MDCK-MDR1对数生长期的细胞,消化,吹打均匀后计数,调整细胞密度1×105个mL,每孔0.5 mL的密度接种在Transwell内培养7 d左右,每天换液,给药前测定模型的TEER,当TEER为300~500 Ω/cm2时,细胞模型构建成功,可以开始给药。给药前先用37℃的HBSS液清洗各孔3次,最后1次置于培养箱内预孵育30 min。吸收实验是分别向各孔AP侧加入400、600、800 μg/mL天麻素溶液0.5 mL,BL侧加入HBSS液1.5 mL,置于培养箱中培养,分别于30、60、90、120、150 min由BL侧取样0.5 mL,并补加同温HBSS液0.5 mL;外排实验时向BL侧加入400、600、800 μg/mL天麻素溶液1.5 mL,AP侧加入HBSS液0.5 mL,由AP侧取样0.2 mL,并补足同体积HBSS液,其余步骤相同。样品溶液在4℃、16 000 r/min离心15 min,取上清液进行HPLC检测。
2.6 维拉帕米和丙磺舒对天麻素转运的影响按“2.5”项方法构建MDCK-MDR1细胞模型,吸收实验时向各孔AP侧加入400 μg/mL天麻素+100 μg/mL维拉帕米或400 μg/mL天麻素+100 μg/mL丙磺舒的混合溶液各0.5 mL,BL侧加入HBSS液1.5 mL,置于培养箱中培养,于120 min由BL侧取样;外排实验时向各孔BL侧加入400 μg/mL天麻素+100 μg/mL维拉帕米或400 μg/mL天麻素+100 μg/mL丙磺舒的混合溶液各1.5 mL,AP侧加入HBSS液0.5 mL,置于培养箱中培养,于120 min由AP侧取样。其余操作同“2.5”项。
2.7 数据处理表观渗透系数(Papp)采用如下公式计算。外排率(ER,ER=Papp BL→AP/Papp AP→BL)。实验数据采用SPSS 13.0软件进行处理,t检验进行统计分析。
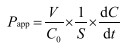
|
V代表加药对侧体积(mL),C0代表初始药物质量浓度(μg/mL),S代表单层膜表面积(cm2),dC/dt代表待测药物转运的速率
3 结果 3.1 细胞形态学观察细胞状态良好,清晰透亮,呈“铺路石”状,规则,多边形,排列紧密,结果见图 2。
|
图 2 倒置显微镜下MDCK-MDR1细胞形态 Fig.2 MDCK-MDR1 cell morphology observed by inverted microscope |
3.2 MTT实验结果
天麻素在100~1 000 μg/mL内作用于MDCK-MDR1细胞4 h后,细胞存活率均>95%,结果见图 3。表明天麻素质量浓度在1 000 μg/mL以下时对MDCK-MDR1细胞的活性无明显影响。
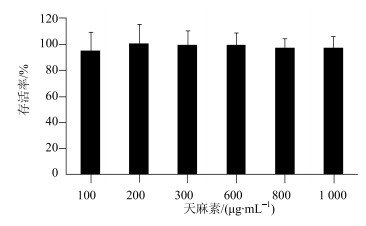
|
图 3 天麻素对MDCK-MDR1活力的影响(x±s, n=6) Fig.3 Effect of GAS on viability of MDCK-MDR1 cells (x±s, n=6) |
3.3 分子对接结果
天麻素与P-gp的氨基酸残基SER729产生氢键相互作用,与VAL978发生疏水作用;维拉帕米与P-gp的氨基酸残基发生GLN721氢键作用,与TYR303、TYR306、LEU335、PHE332、PHE724、MET982、VAL978、PHE728发生疏水作用。天麻素、维拉帕米的LibDock Score分别为111、138。天麻素、维拉帕米与P-gp相互作用结果见图 4。
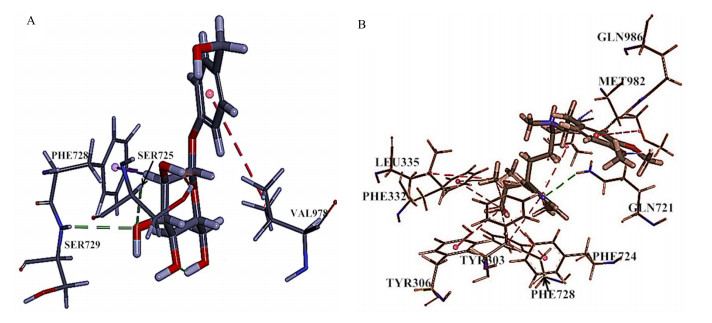
|
图 4 天麻素(A)、维拉帕米(B)与P-gp的相互作用 Fig.4 Interaction between GAS (A), Ver (B), and P-gp |
天麻素与MRP1的SER685、ASP792氨基酸结合位点有氢键相互作用,另外与VAL680、HIS827有疏水作用,与ASP793有静电作用,通过这3种作用力,形成稳定的复合物。丙磺舒与MRP1的LEU795、SER828氨基酸结合位点有氢键相互作用,与TYR831、LEU795、VAL798有疏水作用,与TYR831有静电作用。天麻素、丙磺舒的LibDock Score分别为93、95。天麻素、丙磺舒与MRP1相互作用结果见图 5。
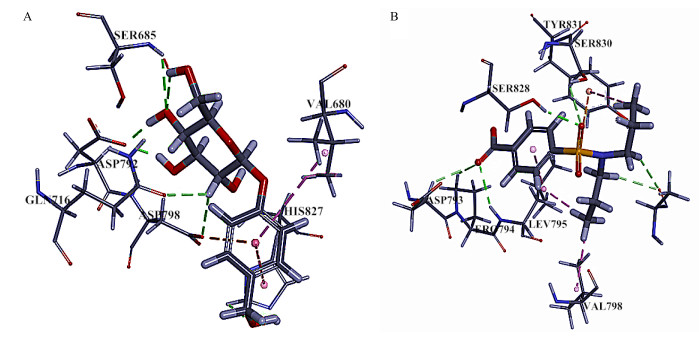
|
图 5 天麻素(A)、丙磺舒(B)与MRP1的相互作用 Fig.5 Interaction between GAS (A), Probenecid (B), and MRP1 |
3.4 不同质量浓度天麻素转运特性
不同质量浓度天麻素双向转运Papp见表 1,不同质量浓度天麻素的Papp AP→BL值差异不显著(P>0.05),且均小于1×10-6 cm/s,表明其口服吸收差,生物利用度低。Papp BL→AP明显高于Papp AP→BL,ER均为1.5左右,表明其转运可能受外排蛋白的参与;天麻素不同质量浓度、不同时间点双侧转运量见图 6。结果显示在150 min内双侧转运量随着质量浓度增加而增大,随孵育时间延长而增大。
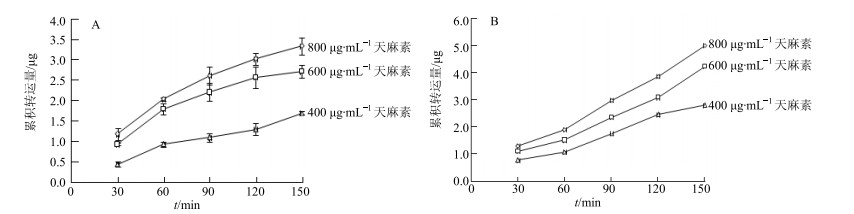
|
图 6 不同质量浓度天麻素AP→BL侧(A)和BL→AP侧(B)的累积转运量(x±s, n=3) Fig.6 Accumulated transportation amount of GAS at different concentration in AP→BL side (A) and BL→AP side (B) (x±s, n=3) |
|
|
表 1 不同质量浓度天麻素在MDCK-MDR1细胞上的转运(x±s, n=3) Table 1 Transportation of GAS at different concentration across MDCK-MDR1 cell (x±s, n=3) |
3.5 维拉帕米和丙磺舒对天麻素转运的影响
400 μg/mL天麻素与100 μg/mL维拉帕米配伍后Papp显著增大(P<0.05),ER显著减少;400 μg/mL天麻素与100 μg/mL丙磺舒配伍后Papp有所增加,ER有所减少(表 2),表明天麻素可能是P-gp蛋白的底物,但天麻素可能不是MRP1蛋白的底物。
|
|
表 2 维拉帕米、丙磺舒对天麻素Papp的影响(x±s, n=3) Table 2 Effects of Ver and Probenecid on Pappof GAS(x±s, n=3) |
4 讨论
天麻素Papp AP→BL<1×10-6 cm/s,按Papp吸收难易的评判标准[19],可判断其吸收量为0~20%,难吸收,说明其口服吸收差,生物利用度低。通过对天麻素的双向转运行为进行研究,结果天麻素各质量浓度Papp无显著性差异,由Papp=(dQ/dt)/(A×C0)得出转运速率与浓度之比为定值,与被动转运公式-dC/dt=kC0相一致;天麻素的累积转运量与给药质量浓度呈正相关,无饱和现象,符合被动转运特征,故确定天麻素以被动转运为主,该结论与文献报道一致[20-21]。
关于药物转运机制的判断还可以通过ER得出,ER为1时,药物以被动转运为主,是否存在载体参与需要进一步验证;ER为1.5时,则可能存在外排蛋白参与;ER小于0.5时,则可能是正向的载体蛋白参与的主动转运。结果表明天麻素ER接近1.5,很可能存在外排蛋白的参与。BBB中主要的外排蛋白有P-gp和MRP1,能将底物泵出细胞外,因此,天麻素的转运很可能受P-gp和MRP调控。
分子对接依据配体与受体作用的“锁-钥原理”(lock and key principle),模拟小分子配体与受体生物大分子相互作用。配体与受体相互作用是分子识别的过程,主要包括静电作用、氢键作用、疏水作用、范德华力作用等。通过计算,可以预测两者间的结合模式和亲和力,从而进行药物的虚拟筛选[22]。本实验采用Discovery Studio软件[23]对天麻素与P-gp蛋白、天麻素与MRP1蛋白进行分子对接,研究发现天麻素可以与P-gp、MRP1蛋白通过分子间的氢键、疏水作用等产生结合,而维拉帕米能与P-gp的多个活性氨基酸位点产生氢键、疏水作用等多个作用力,因此LibDock Score值较天麻素大。丙磺舒与MRP1的结合方式与天麻素类似,LibDock Score值略高于天麻素。当天麻素和维拉帕米同时使用时,由于维拉帕米竞争性与P-gp相结合,从而使得天麻素Papp AP→BL由0.42×10-6 cm/s显著增加到1.08×10-6 cm/s,ER从1.29显著减小到0.79。当天麻素和丙磺舒同时使用时,丙磺舒竞争性与MRP1相结合,从而使得天麻素Papp AP→BL由0.42×10-6 cm/s增加到0.55×10-6 cm/s,ER减小到1.16。
有大量文献报道天麻素与其他药物联用时可以提高天麻素的吸收。Ge等[24]研究发现天麻素与不同处方的益智片联用时天麻素的Cmax与AUC0~∞具有显著性差异。姜丽等[25]研究发现天麻素和葛根素联用相对于葛根素和天麻素单用具有更低的清除率,更长的平均滞留时间及更高的生物利用度,葛根素联用时的相对生物利用度是单用时的10.7倍,天麻素联用时的相对生物利用度是单用时的1.5倍,两者联用可以相互促进吸收。Hu等[26]研究发现阿魏酸、大川芎制剂中的总酚酸、总生物碱能够显著提高天麻素的AUC0~∞。王强等[27]研究发现川芎与天麻配伍后,天麻素可能与川芎中主要活性成分竞争性或非竞争性结合代谢酶而使天麻素代谢减慢,肾排泄率降低,平均滞留时间明显高于其他剂量组。彭尹宣等[28]研究发现天麻多糖对天麻钩藤药对中的天麻素的吸收具有促进作用,这可能与天麻多糖对P450酶系及肠道、肝脏转运蛋白有诱导或促进作用有关。虽然目前天麻素联合用药的研究较多,但大部分都只停留在药效学研究及药动学研究方面,对促进天麻素吸收的机制研究较少,其他成分促进天麻素吸收的可能机制:(1)发挥外排蛋白抑制剂的作用,通过抑制天麻素的外排而增强其吸收作用;(2)通过影响相关转运蛋白的表达,通过增加转运蛋白对天麻素的转运而增加天麻素的吸收;(3)通过竞争性结合代谢酶,减少天麻素的代谢而增加天麻素的吸收;(4)通过对细胞间的紧密连接、细胞膜的流动性等结构的影响而增加天麻素的吸收;(5)改变天麻素油水分配系数和溶解性而增加天麻素的吸收。本研究仅从P-gp抑制剂及MRP1抑制剂的角度说明了P-gp抑制剂及MRP1抑制剂可以增加天麻素跨膜转运,但是否可以通过其他机制增加其转运量还需进一步研究。
| [1] | 鞠桂春. 天麻及其制剂的药理作用和临床应用研究进展[J]. 中国药业 , 2008, 17 (1) :64–66. |
| [2] | 张媛元, 毛瑞阳, 杜晓红, 等. 天麻素对终末糖基化产物诱导神经小胶质细胞炎症因子表达的影响[J]. 中草药 , 2011, 42 (2) :330–334. |
| [3] | 王军玲, 周本宏. 天麻素的药理作用和临床应用研究[J]. 武汉生物工程学院学报 , 2009, 5 (4) :309–313. |
| [4] | 王俏.天麻素和天麻苷元的体内外代谢和脑靶向性研究[D].杭州:浙江大学, 2007. |
| [5] | Lee G, Bendayan R. Functional expression and localization of P-glycoprotein in the central nervous system: relevance to the pathogenesis and treatment of neurological disorders[J]. Pharm Res , 2004, 21 (8) :1313–1330. DOI:10.1023/B:PHAM.0000036905.82914.8e |
| [6] | Loscher W, Potschka H. Blood-brain barrier active efflux transporters: ATP-binding cassette gene family[J]. J Am Soc Exp Neuro Ther , 2005, 31 (2) :86–98. |
| [7] | Martin C, Berridge G, Higgins C F, et al. Conununication between multiple drug binding sites on P-glyeoprotein[J]. Mol Pharmacol , 2000, 58 (3) :624–632. |
| [8] | Batrakova E V, Li S, Vinogradov S V, et al. Methanism of pluronic effect on P-glycoprotein efflux system in blood-brain barrier: contributions of energy depletion and membrane fluidization[J]. J Pharmacol Exp Ther , 2001, 299 (2) :483–493. |
| [9] | 刘瑶. MDCK转染MDR1作为血脑屏障药物透过的快速筛选模型的研究[D].杭州:浙江大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10335-2009053466.htm |
| [10] | 朱俊芳, 马海珍, 刘蓓, 等. MRP1和XIAP基因在急性髓系白血病及细胞株中的表达及临床意义[J]. 兰州大学学报:医学版 , 2014, 40 (4) :31–36. |
| [11] | 颜博, 李国良. miR-133a/b和MRP1在耐药性癫痫患者外周血含量的观察[J]. 中国病理生理杂志 , 2015, 31 (4) :680–684. |
| [12] | Chen Z Z, Lu Y, Du S Y, et al. Influence of borneol and muscone on geniposide transport through MDCK and MDCK-MDR1 cells as blood-brain barrier in vitro model[J]. Int J Pharm , 2013, 456 (1) :73–79. DOI:10.1016/j.ijpharm.2013.08.017 |
| [13] | 刘强, 高小玲, 柴逸峰, 等. 四氢帕马丁在MDCK-MDR1细胞系中的跨膜转运机制[J]. 药学服务与研究 , 2012, 12 (1) :34–37. |
| [14] | 刘瑶, 曾苏. MDCK-MDR1细胞模型及其在药物透过研究中的应用进展[J]. 药学学报 , 2008, 43 (6) :559–564. |
| [15] | 梅梅, 张翼, 任金红, 等. 新型紫杉烷化合物NPB304及其协同维拉帕米逆转耐药的研究[J]. 药学学报 , 2014, 49 (9) :1279–1288. |
| [16] | Aller S G, Yu J, Ward A, et al. Structure of P-glycoprotein reveals a molecular basis for poly-specific drug binding[J]. Science , 2009 (323) :1718–1722. |
| [17] | Ramaen O, Leulliot N, Sizun C, et al. Structure of the human multidrug resistance protein 1 nucleotide binding domain 1 bound to Mg2+/ATP reveals a non-productive catalytic site[J]. J Mol Biol , 2006, 359 (4) :940–949. DOI:10.1016/j.jmb.2006.04.005 |
| [18] | 何其.伪石榴碱的提取及其相关衍生物的合成与应用[D].成都:西华大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10623-1014394843.htm |
| [19] | 孙敏捷, 盛星, 胡一桥. Caco-2细胞单层模型的建立与验证[J]. 中国药学杂志 , 2006, 41 (18) :1431–1434. |
| [20] | 王晓丹, 曾苏. 天麻素在Caco-2细胞及Bcap37、Bcap37/MDR1细胞模型中的转运和摄取[J]. 药学学报 , 2010, 45 (12) :1497–1502. |
| [21] | 黄娟, 罗辉, 龚耘, 等. 天麻苷元肠吸收特性的研究[J]. 中国中药杂志 , 2012, 37 (6) :858–861. |
| [22] | 朱志远, 张燕, 李征, 等. 受体蛋白与药物分子对接的研究进展[J]. 中国临床药理学与治疗学 , 2009, 14 (11) :1308–1313. |
| [23] | 禹菡冰.高喜树碱类化合物三维定量构效关系及其与拓扑异构酶I分子对接研究[D].广州:华南理工大学, 2012. http://cdmd.cnki.com.cn/article/cdmd-10561-1012451714.htm |
| [24] | Ge Z H, Xie Y Y, Liang Q L, et al. Pharmacokinetic comparative study of GAS and rhynchophylline after oral administration of different prescriptions of Yizhi tablets in rats by an HPLC-ESI/MS method[J]. Evid-Based Complement Alternat Med , 2014 (2014) :167253–167263. |
| [25] | 姜丽, 余兰彬, 徐国良, 等. 天麻素和葛根素在大鼠体内联合应用的药动学研究[J]. 中国中药杂志 , 2015, 40 (6) :1179–1184. |
| [26] | Hu P Y, Yue P F, Zheng Q, et al. Pharmacokinetic comparative study of GAS after oral administration of Gastrodia elata Bl. extract and its compatibility with the different indigents of Ligusticum chuan-xiong Hort. to Rats[J]. J Ethnopharmacol , 2016, 6 (7) :1016–1017. |
| [27] | 王强, 沈岚, 马诗瑜, 等. 不同剂量川芎对天麻有效成分在大鼠体内药动学影响[J]. 中国实验方剂学杂志 , 2015, 21 (2) :103–109. |
| [28] | 彭尹宣, 王兴, 杨娟, 等. 天麻多糖对天麻钩藤药对效应成分吸收的影响[J]. 环球中医药 , 2015, 8 (12) :1452–1454. |
 2016, Vol. 47
2016, Vol. 47



