2. 沈阳药科大学药学院, 辽宁 沈阳 110016
2. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China
加味逍遥丸(Jiaowei Xiaoyao Pill,JXP)为收载于《中国药典》2015年版的中药成方制剂,具有疏肝清热、健脾养血之功效;主要用于肝郁血虚、肝脾不和、两胁胀痛、头晕目眩、倦怠食少、月经不调、脐腹胀痛[1]。在临床应用中,该药主要用于妇科疾病的治疗,如更年期综合征[2-3]、肾阴虚型围绝经期综合征[4-5]、肾虚型月经失调[6]、乳腺增生、围排卵期出血、围绝经期情绪障碍、卵巢囊肿等[7-9],现代药理研究表明JXP除了可以治疗妇科疾病外,还对失眠症[10]、糖尿病伴抑郁症[11]、小儿多发性抽动症[12]、脑卒中后抑郁症[13]、HBeAg阴性慢性乙型肝炎[14]、特发性血小板减少性紫癜[15]、心脏神经官能症等具有一定疗效[16]。处方中主要含有柴胡、当归、白芍、栀子、白术、茯苓、甘草、牡丹皮、薄荷9种药材。其中阿魏酸、芍药苷分别是当归和白芍的主要化学成分;甘草酸、甘草苷为甘草的主要化学成分;丹皮酚是牡丹皮的主要特征成分;栀子苷、西红花苷Ⅰ、西红花苷Ⅱ和栀子苷是栀子的主要化学成分。
目前,《中国药典》2015年版中关于JXP的质量标准在定量测定项下仅用芍药苷一种成分的量来控制该药物的质量,通过检索文献发现,关于JXP成分定量研究主要集中在芍药苷、栀子苷[17-18]、甘草苷[19]、丹皮酚[20]中的1种或2种成分的定量测定,未发现利用HPLC-DAD法同时测定JXP中多种成分量的报道。为完善JXP的质量控制标准和方法,本实验利用HPLC-DAD法对其中8种成分进行同时定量分析。
1 仪器与材料1260型高效液相色谱仪,包括DAD检测器、四元低压梯度泵、在线真空脱气机、Chemstation工作站,美国Agilent公司;AUW220D型分析天平,十万分之一,日本岛津精密仪器分析公司;KQ-250DE型超声波清洗器,江苏昆山超声波仪器有限公司。
对照品栀子苷(批号MUST-15022411,质量分数98.13%)、阿魏酸(批号MUST-14102214,质量分数99.36%)、甘草苷(批号MUST-14100910,质量分数99.83%)、芍药苷(批号MUST-15060112,质量分数99.42%)、甘草酸(批号MUST-14091708,质量分数98.69%)、丹皮酚(批号MUST-15020401,质量分数99.30%)、西红花苷Ⅰ(批号MUST-14121204,质量分数98.57%)、西红花苷Ⅱ(批号MUST-14080504,质量分数98.88%),均购于成都曼斯特生物科技有限公司。JXP,批号20150644、20150811、20150810,规格:6 g/袋,由北京同仁堂制药股份有限公司提供;批号1106208、1105122、1105803,规格:6 g/袋,由天津天士力(辽宁)制药有限责任公司提供。柴胡、当归、白芍、栀子、白术、茯苓、甘草、牡丹皮、薄荷9味处方饮片均购自吉林市吉林大药房,由吉林化工学院薛健飞副教授鉴定上述药材均为《中国药典》2015年版记载正品;乙腈(批号20150833,色谱纯)、甲醇(批号20150322,色谱纯)由山东禹王实业有限公司提供;水为市售娃哈哈纯净水,其他试剂均为分析纯。
2 方法与结果 2.1 色谱条件采用色谱柱Plastisil ODS(250 mm×4.6 mm,5 μm),流动相为乙腈-0.2%磷酸水溶液,梯度洗脱:0~10 min,5~8%乙腈;10~15 min,8%~10%乙腈;15~20 min,10%~13%乙腈;20~25 min,13%~16%乙腈;25~28 min,16%~20%乙腈;28~36 min,20~22%乙腈;36~40 min,22%乙腈;40~43 min,22%~27%乙腈;43~51 min,27%~40%乙腈;51~60 min,40%~50%乙腈;60~70 min,50%~75%乙腈;70~75 min,75%~90%乙腈;75~80 min,90%乙腈;检测波长:栀子苷为238 nm、甘草苷和丹皮酚为274 nm、西红花苷Ⅰ和西红花苷Ⅱ为440 nm、芍药苷和甘草酸为228 nm、阿魏酸为324 nm;DAD参比波长为380 nm;体积流量1.0 mL/min;柱温37℃;进样量10 μL。
2.2 溶液的制备 2.2.1 对照品溶液精密称取栀子苷、甘草苷、丹皮酚、西红花苷Ⅰ、西红花苷Ⅱ、芍药苷、甘草酸、阿魏酸对照品适量,加无水甲醇溶解并定容,制成质量浓度分别为栀子苷0.6 mg/mL、甘草苷0.75 mg/mL、丹皮酚0.8 mg/mL、西红花苷Ⅰ 0.24 mg/mL,西红花苷Ⅱ 0.05 mg/mL,芍药苷1.2 mg/mL,甘草酸0.8 mg/mL、阿魏酸0.25 mg/mL的混合对照品储备液,再分别精密吸取2、4、6、8、12 mL储备液置于25 mL量瓶中,流动相定容,制得系列质量浓度的混合对照品溶液,4 ℃避光保存。
2.2.2 供试品溶液取本品研细粉末(过40目筛)约1.0 g,精密称定,置100 mL磨口具塞锥形瓶中,精密加入无水甲醇50 mL,密塞,称定质量,超声处理(功率200 W,频率80 kHz)30 min,放冷,再称定质量,以无水甲醇补足减失的质量,摇匀,离心(12 000 r/min),取上清液,经0.45 μm微孔滤膜滤过,即得。
2.2.3 阴性对照溶液按处方比例及制备工艺分别制备不含柴胡、当归、白芍、栀子、白术、茯苓、甘草、牡丹皮、薄荷的阴性样品,分别按“2.2.2”项下方法操作,即得缺各味药材的各阴性对照溶液。
2.3 专属性实验分别精密吸取“2.2”项下对照品溶液、供试品溶液和阴性对照溶液,按“2.1”项下色谱条件进行分析,结果如图 1所示,供试品溶液中各待测成分色谱峰与其他峰的分离度均大于1.5,阴性对照溶液在相应位置未见色谱峰,方法专属性良好。
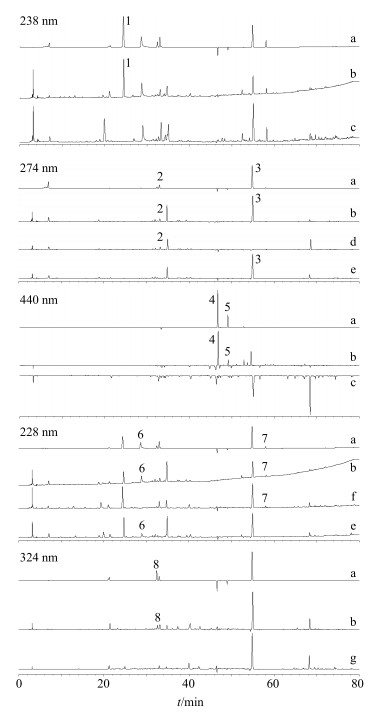
|
1-栀子苷 2-甘草苷 3-丹皮酚 4-西红花苷I 5-西红花苷II 6-芍药苷 7-甘草酸 8-阿魏酸 1-jasminoidin 2-liquiritin 3-paeonol 4-crocin Ⅰ 5-crocin Ⅱ 6-peoniflorin 7-glycyrrhizic acid 8-ferulic acid 图 1 混合对照品(a)、JXP样品(批号1106208, b)及缺栀子(c)、缺牡丹皮(d)、缺甘草(e)、缺白芍(f)、缺当归(g)阴性对照溶液的HPLC图 Fig.1 HPLC of mixed reference substances (a), JXP sample (batch No. 1106208, b), negative controls without Gardenia Fructus (c), without Moutan Cortex (d), without Glycyrrhizae Radix et Rhizoma (e), without Paeoniae Radix Alba (f), and without Angelicae Sinensis Radix (g) |
2.4 线性关系考察
在“2.1”项色谱条件下,分别精密吸取系列质量浓度的对照品溶液10 μL,注入液相色谱仪,记录色谱图,以峰面积为纵坐标(Y),对照品质量浓度为横坐标(X),绘制标准曲线,得回归方程,以信噪比(S/N)为3时对照品质量浓度为检出限,以S/N=10时对照品质量浓度为定量限,结果分别为栀子苷Y=1 366 X+354.2,r=0.999 4,线性范围48~288 μg/mL,检出限0.08 μg/mL,定量限0.25 μg/mL;甘草苷Y=2 260 X+68.543,r=0.999 2,线性范围60~360 μg/mL,检出限0.05 μg/mL,定量限0.14 μg/mL;丹皮酚Y=4 178 X+307.28,r=0.999 8,线性范围64~384 μg/mL,检出限0.04 μg/mL,定量限0.11 μg/mL;西红花苷Ⅰ Y=2 171 X-850.95,r=0.999 2,线性范围19.2~115.2 μg/mL,检出限0.10 μg/mL,定量限0.30 μg/mL;西红花苷Ⅱ Y=1 162 X-138.99,r=0.999 5,线性范围4~24 μg/mL,检出限0.07 μg/mL,定量限0.21 μg/mL;芍药苷Y=1 528 X+348.57,r=0.999 6,线性范围96~576 μg/mL,检出限0.20 μg/mL,定量限0.61 μg/mL;甘草酸Y=2 030.2 X+6.808,r=0.999 7,线性范围64~384 μg/mL,检出限0.09 μg/mL,定量限0.28 μg/mL;阿魏酸Y=2 325 X-57.861,r=0.999 4,线性范围20~120 μg/mL,检出限0.16 μg/mL,定量限0.50 μg/mL。
2.5 精密度试验精密吸取同一混合对照品溶液10 μL,按“2.1”项下色谱条件连续进样5次,分别计算各组分色谱峰面积RSD值,结果栀子苷、甘草苷、丹皮酚、西红花苷Ⅰ、西红花苷Ⅱ、芍药苷、甘草酸、阿魏酸的峰面积RSD值均小于1.2%,表明仪器精密度良好。
2.6 稳定性试验取同一批(批号20150811)供试品溶液,于室温放置0、2、4、6、8、12 h,精密吸取10 μL,按“2.1”项色谱条件进样分析,计算各色谱峰面积的RSD值,结果栀子苷、甘草苷、丹皮酚、西红花苷Ⅰ、西红花苷Ⅱ、芍药苷、甘草酸、阿魏酸各组分峰面积的RSD值均小于1.5%,表明供试品溶液在12 h内稳定性良好。
2.7 重复性试验取同一批次JXP(批号20150811),按“2.2.2”项方法平行制备6份供试品溶液,测定各组分峰面积RSD值,结果栀子苷、甘草苷、丹皮酚、西红花苷Ⅰ、西红花苷Ⅱ、芍药苷、甘草酸、阿魏酸质量分数的RSD值均小于1.4%,表明方法重复性良好。
2.8 加样回收率试验精密称取已测定的JXP样品(批号为20150644)6份,每份0.5 g,置于圆底烧瓶中,分别加入各对照品适量,按“2.2.2”项下方法制备供试品溶液,定容至50 mL,按“2.1”项下色谱条件进行测定,并分别计算各成分的回收率,结果栀子苷、甘草苷、丹皮酚、西红花苷Ⅰ、西红花苷Ⅱ、芍药苷、甘草酸、阿魏酸的平均回收率分别为101.13%、100.52%、101.10%、99.26%、98.98%、103.43%、99.97%、97.92%,RSD分别为1.14%、1.86%、1.11%、1.54%、1.88%、2.44%、2.09%、1.09%。
2.9 样品定量测定分别取不同批次的样品,按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件,分别进样10 μL,记录色谱图,按外标标准曲线法分别计算样品中8个成分的量,结果x±s的形式表示,如表 1所示。
|
|
表 1 JXP中8种成分的测定结果(n=3) Table 1 Content determination of eight components in JXP (n=3) |
从表 1可以看出,各批次的JXP中8种活性成分的量略有差异,但相同厂家的不同批次成分量差异要小于不同厂家的不同批次成分量差异,这可能是由原料药材来源、采收季节、加工贮藏方式差异所导致。
3 讨论《中国药典》2015年版一部中仅在定量测定项下对JXP中芍药苷的量作出了相关规定,同时《中国药典》收载供试品溶液的制备过程中所用溶剂为稀乙醇,由于本研究进行了8种成分的定量测定,其中部分成分在稀乙醇的溶解性较差,因此本实验尝试了以无水甲醇代替稀乙醇为溶剂进行供试品溶液的制备,结果显示以甲醇为溶剂制备供试品后的色谱图基线平稳,8种待测组分均可出峰,且峰高较高,因此最终选择无水甲醇作为溶剂进行供试品的制备。
根据JXP中8种待测成分的理化性质和色谱行为,分别考察了甲醇-水、甲醇-0.5%磷酸水溶液、乙腈-水、乙腈-0.2%磷酸水溶液作为流动相进行梯度洗脱,结果显示,采用甲醇系统时,峰形较差,并且栀子苷、阿魏酸、甘草苷、甘草酸分离度不好,当换用乙腈系统后,上述组分的色谱峰分离度明显改善,通过进一步优化发现当采用乙腈-0.2%磷酸水溶液作为流动相时,各待测组分色谱峰与相邻色谱峰均达到基线分离,且峰形较好;在波长的选择上,采用DAD检测器收集200~400 nm所有待测成分的色谱图,以筛选各待测成分的最大吸收波长,结果显示各待测组分的最大吸收波长分别为栀子苷238 nm,甘草苷和丹皮酚274 nm,西红花苷Ⅰ和西红花苷Ⅱ 440 nm,芍药苷和甘草酸228 nm,阿魏酸324 nm。
由于采用了DAD检测器,并且参比波长为380 nm,因此色谱图上任意时间点任意波长下的信号值都可理解为该时间点在选定波长下的吸光度值与380 nm波长下吸光度值的差,如图 1-a在238 nm下混合对照品、样品、缺栀子阴性液的色谱图中46.5 min和49 min附近有2个倒峰,表明这2个物质在238 nm处吸光度小于380 nm处吸光度,因此呈现倒峰,后经图 1-c证实这两个物质为西红花苷Ⅰ和西红花苷Ⅱ。
本实验采用HPLC-DAD法同时测定JXP中8个成分的量,方法灵敏度高,简单可行,对JXP的质量控制提供了理论依据。从实验结果来看,在相同的制备工艺和测定方法下,不同批次JXP中8种成分的量存在一定差异,可能与原料药材中相关成分的量差异有关,而且不同批次的药品在制剂、储藏、运输过程中的微小差别,都可能会影响最终药品中各组分的量。因此中药制剂生产应按标准要求认真控制原料药材质量,严格按工艺要求操作,保证成品质量的稳定可控,从而保证临床用药的安全与有效。
| [1] | 中国药典[S].一部. 2015. |
| [2] | 陈莉莉. 六味地黄丸合加味逍遥丸治疗更年期综合征临床疗效观察[J]. 世界最新医学信息文摘 , 2015, 15 (51) :135. |
| [3] | 姜岩. 加味逍遥丸联合乌鸡白凤丸治疗更年期综合征疗效观察[J]. 中国冶金工业医学杂志 , 2015, 32 (6) :674–675. |
| [4] | 洪利生, 张冬梅. 六味地黄丸合加味逍遥丸治疗肾阴虚型围绝经期综合征临床观察[J]. 临床军医杂志 , 2012, 40 (5) :1139–1141. |
| [5] | 许琼. 六味地黄丸合加味逍遥丸治疗肾阴虚型围绝经期综合征临床观察[J]. 数理医药学杂志 , 2015, 28 (4) :571. |
| [6] | 李庚锋, 邱永强, 康群招. 加味逍遥丸合六味地黄丸化裁方治疗肾虚型月经失调临床疗效观察[J]. 四川中医 , 2015, 33 (1) :108–109. |
| [7] | 李慧英, 牛学敏. 不同疗程加味逍遥丸治疗围排卵期出血的临床研究[J]. 中国妇幼保健 , 2011, 26 (33) :5141–5142. |
| [8] | 刘秀健, 秦泗关. 加味逍遥丸合云南白药胶囊治疗卵巢囊肿的疗效观察[J]. 中医临床研究 , 2012, 4 (15) :76–77. |
| [9] | 王文慧, 岳利峰, 杜茂生, 等. 加味逍遥丸调节围绝经期情绪障碍的疗效对比评价[J]. 中华中医药杂志 , 2014, 29 (3) :836–839. |
| [10] | 刘秀娟. 杞菊地黄丸加加味逍遥丸辅助针灸治疗失眠症60例分析[J]. 中国疗养医学 , 2011, 20 (12) :1083–1084. |
| [11] | 娄彦珍. 加味逍遥丸联合盐酸舍曲林治疗糖尿病伴抑郁症30例[J]. 中医临床研究 , 2014, 6 (13) :84–85. |
| [12] | 罗爱华, 孙业红. 陈夏六君子丸合加味逍遥丸治疗小儿多发性抽动症的临床疗效观察[J]. 中国民族民间医药 , 2010, 19 (10) :21–22. |
| [13] | 彭贤文. 加味逍遥丸联合氟西汀对脑卒中后抑郁症的临床治疗效果[J]. 实用中西医结合临床 , 2014, 14 (4) :50–51. |
| [14] | 王成刚, 石中顺, 程为玉. 加味逍遥丸联合拉米夫定治疗HBeAg阴性慢性乙型肝炎99例[J]. 中国中西医结合杂志 , 2006, 26 (4) :369–370. |
| [15] | 陈爱玲. 加味逍遥丸加减治疗特发性血小板减少性紫癜的临床观察[J]. 辽宁中医杂志 , 2009, 36 (8) :1352–1353. |
| [16] | 高兴军, 孙书彦. 加味逍遥丸合心通口服液治疗心脏神经官能症临床疗效观察[J]. 中国中医基础医学杂志 , 2005, 11 (3) :229. |
| [17] | 陈玉杰. 高效毛细管电泳法测定加味逍遥丸中芍药苷、栀子苷的含量[J]. 中国实验方剂学杂志 , 2012, 18 (10) :146–149. |
| [18] | 魏龙. 高效液相色谱法测定加味逍遥丸芍药苷的含量测定[J]. 中国医药指南 , 2013, 11 (29) :47–48. |
| [19] | 杜蓉, 张孟佑. HPLC法测定加味逍遥丸中芍药苷与甘草苷的含量[J]. 中国药房 , 2015, 26 (18) :2571–2572. |
| [20] | 李珂, 贾宝秀, 刘彩红, 等. 高效液相色谱法测定加味逍遥丸中丹皮酚的含量[J]. 医药导报 , 2010, 29 (10) :1354–1355. |
 2016, Vol. 47
2016, Vol. 47



