2. 新疆医科大学中医学院, 新疆 乌鲁木齐 830054
2. Institute of Traditional Chinese Medicine, Xinjiang Medical University, Urumqi 830054, China
香青兰Dracocephalum moldavica L.,维吾尔名为巴迪然吉布亚,是新疆地区产的唇形科植物香青兰的干燥地上部分[1-3],其中主要活性成分为木犀草苷[4-5]、迷迭香酸[6-7]和田蓟苷[8-9]。经过多年的药理实验与临床研究,表明其具有明确的抗心肌缺血、抗氧化、抗炎和降压等作用[10-12],在维吾尔医学和民间用于治疗冠心病和心绞痛等疾病[13-16];香青兰总黄酮还具有抗动脉粥样硬化作用[17-18]。目前,已上市药品益心巴迪然吉布亚颗粒(香青兰单味药材)已收载于《中华人民共和国卫生部药品标准•维吾尔药分册》1999年版[19]。同时,课题组现已获其制备工艺的国家发明专利[20]。
但是,根据初步实验表明,香青兰提取物(EDM)体内半衰期短、肠道渗透率不好、口服生物利用度低[21-22]。因此,为了开发其潜能和剂型合理性,本实验对EDM在不同介质中的平衡溶解度、表观油水分配系数(P)和体外胃肠液中的稳定性等理化参数进行测定,为今后进一步设计和开发出改善EDM生物利用度和增加药效的新剂型提供实验数据。
1 仪器与材料赛默飞UltiMate3000型高效液相色谱仪,美国赛默飞世尔科技有限公司;Millipore simplicity-185超纯水器,美国密理博公司;AB135-S梅特勒-托利多电子天平,梅特勒-托利多国际股份有限公司;KQ-100 DE型数控超声波清洗器,昆山市超声仪器有限公司;TGL-16K型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;SHA-B水浴恒温振荡器,金坛市医疗仪器厂。
EDM,新疆西部加斯特药业有限公司,批号20150721;对照品木犀草苷,质量分数>98%,上海一林生物科技有限公司;对照品迷迭香酸,质量分数>98%,批号111871-201001,中国食品药品检定研究院;对照品田蓟苷,实验室自制,其结构是通过1H-NMR和13C-NMR数据与文献报道的数据[4]比对而确定的,质量分数经HPLC归一法测定在98%以上;胃蛋白酶,南京奥多福尼生物科技有限公司,批号20151221;胰酶,河南金诚生物科技有限公司,批号20141001;乙腈,色谱纯,美国Fisher公司,质量分数≥99%;水为超纯水;其他试剂均为分析纯。
2 方法与结果 2.1 EDM分析方法的建立 2.1.1 色谱条件色谱柱为Shim-pack VP-ODS(250 mm×4.6 mm,5 μm);流动相为乙腈-0.5%甲酸水溶液,梯度洗脱:0~30 min,15%乙腈;30~55 min,15%~25%乙腈;55~75 min,25%~35%乙腈;检测波长330 nm;体积流量1.0 mL/min;柱温35℃,进样量10 μL。
2.1.2 溶液的配制(1)木犀草苷对照品贮备液:精密称取对照品2.8 mg,置25 mL量瓶中,加70%乙醇溶解并稀释至刻度,摇匀,得112 μg/mL木犀草苷对照品贮备液,置于4℃冰箱低温避光保存备用。
(2)迷迭香酸对照品贮备液:方法同上,精密称取对照品3.6 mg,得144 μg/mL的对照品贮备液。
(3)田蓟苷对照品贮备液:方法同上,精密称取对照品5.2 mg,得208 μg/mL的对照品贮备液。
(4)混合对照品贮备液:方法同上,精密吸取上述3种对照品贮备液各5 mL,制得22.4、28.2、41.6 μg/mL的木犀草素、迷迭香酸和田蓟苷的混合对照品贮备液。
(5)不同pH值溶液[23]:按《中国药典》2015年版二部附录XV D缓冲液的配制方法,分别配制pH值1.2盐酸溶液和pH值为2.0、3.0、4.0、5.6、6.8、7.0、7.4、8.0的磷酸盐缓冲液(PBS),测定pH值,若有pH值偏离,用H3PO4或NaOH校正。
(6)人工胃液:取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g加水稀释成1 000 mL,即得。同时,配制同体积不含胃蛋白酶的人工胃液。
(7)人工肠液:取磷脂二氢钾6.8 g,加水300 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10 g,加水适量使溶解,将二者混合,加水稀释至1 000 mL,即得。同时,配制同体积不含胰酶的人工肠液。
2.1.3 系统适用性试验精密量取木犀草苷、迷迭香酸和田蓟苷的混合对照品贮备液1 mL于10 mL量瓶中,甲醇稀释至刻度,摇匀。按“2.1.1”项下色谱条件进样,记录色谱峰,见图 1。结果表明在上述色谱条件下木犀草苷、迷迭香酸和田蓟苷峰形对称,保留时间分别为27.31、47.54、66.21 min。
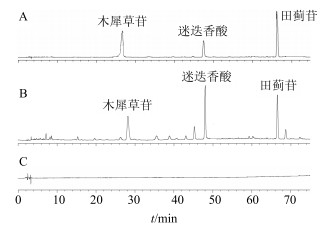
|
图 1 混合对照品(A)、EDM样品(B)和空白对照(C)的HPLC图 Fig.1 HPLC of mixed reference substances (A), EDM sample (B), and blank control (C) |
2.1.4 线性关系考察
精密吸取上述对照品贮备液0.1、0.5、1.0、2.0、4.0、8.0 mL,分别置10 mL量瓶中,加甲醇稀释至刻度,摇匀。按“2.1.1”项下色谱条件分别进行测定,以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得线性回归方程分别为木犀草苷Y=19.379 X+13.988,r=0.999 5;迷迭香酸Y=16.69 X-2.274 4,r=0.999 3;田蓟苷Y=21.147 X-1.214 9,r=0.999 2;结果表明木犀草苷在1.12~89.6 μg/mL、迷迭香酸在1.44~115.2 μg/mL、田蓟苷在2.08~166.4 μg/mL质量浓度与峰面积呈良好的线性关系。
2.1.5 精密度考察分别选择质量浓度为1.12、22.4、89.6 μg/mL的木犀草苷,1.44、28.8、115.2 μg/mL的迷迭香酸和2.08、20.8、166.4 μg/mL的田蓟苷对照品溶液作为低、中、高3种质量浓度,1 d内早、中、晚各进样分析2次,连续测定6 d,考察其日内和日间精密度,结果木犀草苷高、中、低质量浓度的日内和日间精密度分别为0.56%、0.48%、0.73%和0.67%、0.54%、0.68%,迷迭香酸高、中、低浓度的日内和日间精密度分别为0.51%、0.42%、0.89%和0.58%、0.52%、1.23%,田蓟苷高、中、低浓度的日内和日间精密度分别为1.13%、0.66%、1.02%和1.38%、0.84%、1.24%,结果均小于2%,表明日内和日间精密度良好。
2.1.6 稳定性考察用70%乙醇配制质量浓度为500 μg/mL的EDM溶液,置具塞离心管中,37℃水浴振荡器中振摇72 h,分别于0、24、48、72 h取样,10 μL注入高相液相色谱仪,记录各峰面积。结果EDM溶液在37℃可稳定放置72 h,指标成分木犀草苷、迷迭香酸和田蓟苷的RSD分别为0.95%、0.68%、1.03%、0.82%,1.17%、0.49%、0.62%、1.22%,0.77%、0.51%、0.86%、1.37%,表明此方法稳定性良好。
2.1.7 重复性考察取EDM适量,6份,精密称定,分别加70%乙醇定容至25 mL量瓶中,0.22 μm微孔滤膜滤过,取续滤液,按“2.1.1”项色谱条件测定,结果EDM中指标成分木犀草苷、迷迭香酸和田蓟苷质量分数的RSD分别为1.62%、1.45%、2.1%,结果表明此方法重复性良好。
2.1.8 加样回收率考察取EDM适量,9份,精密称定,均分为3组,各组分别精密加入适量混合对照品贮备液,配制成高、中、低质量浓度的供试溶液,按“2.1.1”项色谱条件测定并记录峰面积,比较实测值与理论添加值,计算得EDM中指标成分木犀草苷、迷迭香酸和田蓟苷的平均加样回收率RSD分别为1.85%、2.59%、2.26%,均<3%,符合方法回收率要求。
2.2 EDM在不同溶剂中平衡溶解度测定分别在10 mL具塞锥形瓶中加入5 mL各种溶剂,再分别加入过量EDM,并超声至药物粉末不再溶解为止,分别用封口膜封好后放入37℃恒温水浴振荡器中,振摇72 h,在整个过程中始终保持锥形瓶有药物粉末存在,混悬液在6 000 r/min条件下离心15 min,上清液过0.22 μm微孔滤膜,续滤液用甲醇稀释后按上述色谱条件测定其峰面积,计算木犀草苷、迷迭香酸和田蓟苷在各介质中的平衡溶解度。实验测得木犀草苷、迷迭香酸和田蓟苷在37℃纯水中的平衡溶解度分别为1 026.17、845.21、850.67 μg/mL,其余结果见表 1。
|
|
表 1 EDM在不同溶剂中的平衡溶解度考察 Table 1 Equilibrium solubility of EDM |
2.3 EDM在不同pH值缓冲溶液中的平衡溶解度
分别在10 mL具塞锥形瓶中加入5 mL pH 1.2 HCl溶液及pH值分别为2.0、3.0、4.0、5.6、6.8、7.4、8.0的PBS,处理方法同“2.2”项下操作,计算木犀草苷、迷迭香酸和田蓟苷在各介质中的平衡溶解度,结果表明3种成分的平衡溶解度随pH值的增加而逐渐增大,结果见表 2。
|
|
表 2 EDM在不同pH值缓冲溶液中平衡溶解度 Table 2 Equilibrium solubility of EDM in various buffer solution with different pH values |
2.4 EDM在不同助溶剂溶液中的平衡溶解度
配制2、4、8、16、32 g/L系列质量浓度的聚山梨酯80(T80)、聚乙二醇4000(PEG)和十二烷基硫酸钠(SDS)。取过量EDM样品置于10 mL具塞锥形瓶中,分别加入5 mL不同质量浓度的助溶剂溶液,50℃水浴加热超声1 h至样品不再溶解,放入水浴振荡器中,温度保持37℃振摇72 h。将饱和溶液在6 000 r/min条件下离心15 min,上清液过0.22 μm微孔滤膜,弃去初滤液,取续滤液10 μL注入高效液相色谱仪,按上述色谱条件测定其峰面积,计算木犀草苷、迷迭香酸和田蓟苷在不同助溶剂溶液中的平衡溶解度。在3种不同质量浓度助溶剂溶液(T80、PEG和SDS)中的平衡溶解度如表 3所示,在32 g/L的SDS溶液中,木犀草苷、迷迭香酸和田蓟苷的平衡溶解度分别提高到1 679.61、1 249.2、2 765.3 μg/mL,其增溶效果最好,而其他助溶剂对木犀草苷、迷迭香酸和田蓟苷的增溶能力相对较弱。
|
|
表 3 EDM在不同质量浓度助溶剂下的平衡溶解度 Table 3 Equilibrium solubility of EDM in surfactant with different concentration |
2.5 EDM的P测定
分别取适量EDM加入被水饱和的正辛醇中,超声30 min至EDM充分溶解后,溶液过0.22 μm微孔滤膜,续滤液按上述色谱条件测定,得到各指标成分的质量浓度p0。精密量取该溶液1 mL,置于10 mL玻璃离心管中,再精密加入4 mL水和缓冲液饱和的正辛醇,分别用封口膜封好后放入37℃恒温水浴振荡器中振摇48 h,使其在两相中充分平衡。静置后取下层水液在6 000 r/min离心15 min,溶液过0.22 μm微孔滤膜,取续滤液按上述色谱条件进样,记录峰面积,计算得到各指标成分的质量浓度pw。按照公式计算P[24]。
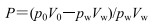
|
p0分别为木犀草苷、迷迭香酸和田蓟苷在正辛醇中的初始质量浓度(mg/L),V0为被水饱和的正辛醇体积(1 mL),pw为药物分配平衡时在水相中测得的木犀草苷、迷迭香酸和田蓟苷质量浓度(mg/L),Vw为水相体积(4 mL)
木犀草苷、迷迭香酸和田蓟苷在正辛醇-缓冲溶液中的P见表 4,木犀草苷、迷迭香酸和田蓟苷在水中的P分别为0.173 1(lgP=−0.761 8)、0.068 4(lgP=−1.165 0)和1.082 9(lgP=0.034 6),在pH 7.4的PBS中的P最大值分别为0.239 9(lgP=−0.619 8)、0.088 1(lgP=−1.055 2)和1.222 9(lgP=0.087 4),在pH 1.2 HCl中的P最小值分别为0.040 1(lgP=−1.397 9)、0.005 1(lgP=−2.301 0)和0.288 0(lgP=−0.540 6)。
|
|
表 4 EDM在不同pH值下的lgP Table 4 lgP of EDM with different pH values |
2.6 EDM的体外胃肠道稳定性考察
取EDM置于预先在37℃水浴中放置了15 min的酶溶液中,保持37℃水浴加热,分别于0、0.5、1.0、2.0、4.0、6.0、12.0 h取样100 μL,加入200 μL酶终止液(胃蛋白酶终止液:pH 1.8的Tris缓冲液,胰蛋白酶终止液:pH 1.8的三氟乙酸溶液),涡旋振荡1 min,5 000 r/min 10 min,取上清液过0.22 μm微孔滤膜,续滤液按上述色谱条件测定,结果见表 5~7。结果表明木犀草苷在人工胃液中不稳定,而在人工肠液中较稳定。迷迭香酸和田蓟苷在人工胃液和人工肠液中均稳定。
|
|
表 5 木犀草苷在人工胃肠液中的稳定性 Table 5 Concentration of luteolin in artificial gastrointestinal fluid |
|
|
表 6 迷迭香酸在人工胃肠液中的稳定性 Table 6 Concentration of rosmarinic acid in artificial gastrointestinal fluid |
|
|
表 7 田蓟苷在人工胃肠液中的稳定性 Table 7 Concentration of tilianin in artificial gastrointestinal fluid |
3 讨论
目前,未见有报道测定EDM的溶解度及P,本实验采用HPLC法测定了EDM(包括木犀草苷、迷迭香酸和田蓟苷)的平衡溶解度和摇瓶法测定其P[25]。通过测定EDM在介质中的量,对EDM的溶解度和P有了初步了解。
良好的药物吸收需要适宜的水溶性和脂溶性,故药物的脂溶性和水溶性是药物吸收重要影响因素,而药物的脂溶性取决于它本身的分子结构及所处pH条件下的分子型比例等[26-27]。
一般认为,对于被动吸收的药物,lgP>5时,亲脂性极强,溶解性极差,药物极不易被吸收;lgP在0~4时,药物吸收理想;lgP<0时,药物亲水性强,亲脂性极弱,药物在肠道中也不易被吸收,仅适于血管注射给药[28-29]。上述实验结果显示,EDM中,木犀草苷、迷迭香酸和田蓟苷在水中的lgP分别为−0.761 8、−1.165 0和0.034 6,由此可推测,木犀草苷和迷迭香酸在肠道中吸收较差,田蓟苷在肠道中吸收较好。
在体外胃肠道实验中,木犀草苷在人工胃液中的剩余量低于人工胃液(不含胃蛋白酶)中的剩余量,而在人工肠液中与人工肠液(不含胰酶)的稳定性基本一致,迷迭香酸和田蓟苷剩余量与在人工胃液(不含胃蛋白酶)和人工肠液(不含胰酶)中基本一致,由此推测迷迭香酸和田蓟苷稳定性好,可避免胃肠道酶破坏,胰蛋白酶对木犀草苷的稳定性影响较小,而pH值的变化才是引起木犀草苷稳定性下降的主要原因。同时,木犀草苷在人工肠液中的稳定性明显高于人工胃液,由此推测,直接口服EDM,从胃到达小肠,只会有一部分木犀草苷具有活性,所以在胃内酸性环境下稳定性差,在制剂时应考虑避免在胃中释放。同时,本实验在考察了EDM在一些常用的助溶剂溶液中溶解度后,建议今后制备田蓟苷制剂时,可使用适量的SDS作为溶出介质。
通过上述实验,有助于了解EDM的基本性质,可为选择新剂型的处方设计与制备工艺、确定溶出度测定方法、预测口服吸收行为提供参考,为今后临床合理用药提供有效指导。
| [1] | 中国药典[S].一部. 1977. |
| [2] | 刘勇民, 沙吾提·伊克木. 维吾尔药志(上)[M]. 新疆: 新疆人民出版社, 1985 . |
| [3] | 中国植物志(第六十五卷, 第二分册) [M].北京:科学出版社, 1983. |
| [4] | 于宁, 何承辉, 邢建国, 等. 大孔吸附树脂分离纯化香青兰提取液工艺研究[J]. 中草药 , 2016, 47 (4) :599–605. |
| [5] | 何玲, 孙桂波, 孙潇, 等. 木犀草苷对阿霉素诱导乳鼠心肌细胞损伤的保护作用[J]. 中国药理学通报 , 2012, 28 (9) :1229–1234. |
| [6] | 李凤琼, 穆敏婕, 张梅, 等. RP-HPLC法测定不同产地香青兰药材中迷迭香酸的含量[J]. 中药与临床 , 2016, 7 (2) :23–27. |
| [7] | 崔海瑛.迷迭香酸对局灶性脑缺血再灌注损伤小鼠的脑保护及作用机制研究[D].石家庄:河北医科大学, 2014. |
| [8] | 郭新红, 曹文疆, 樊鑫梅, 等. 田蓟苷对大鼠心肌缺血再灌注损伤的保护作用[J]. 中国实验方剂学杂志 , 2013, 19 (5) :168–172. |
| [9] | Zeng C, Jiang W, Tan M, et al. Optimization of the process variables of tilianin-loaded composite phospholipid liposomes based on response surface-central composite design and pharmacokinetic study[J]. Eur J Pharm Sci , 2016, 85 :123–131. DOI:10.1016/j.ejps.2016.02.007 |
| [10] | Jiang J, Yuan X, Wang T, et al. Antioxidative and cardioprotective effects of total flavonoids extracted from Dracocephalum moldavica L. against acute ischemia/reperfusion-induced myocardial injury in isolated rat heart[J]. Cardiovasc Toxicol , 2014, 14 (1) :74–82. DOI:10.1007/s12012-013-9221-3 |
| [11] | 孙雅煊, 刘婷, 戴雪伶, 等. 香青兰总黄酮对短暂性脑缺血诱导的炎症反应的影响[J]. 生物物理学报 , 2012, 28 (6) :469–476. |
| [12] | 梁艳, 徐向伟, 赵专友. 香青兰滴丸对冠脉结扎诱发大鼠急性心肌缺血的保护作用[J]. 现代药物与临床 , 2013, 28 (3) :312–316. |
| [13] | Xing J, Peng K, Cao W, et al. Effects of total flavonoids from Dracocephalum moldavica on the proliferation, migration, and adhesion molecule expression of rat vascular smooth muscle cells induced by TNF-α[J]. Pharm Biol , 2013, 51 (1) :74–83. DOI:10.3109/13880209.2012.711839 |
| [14] | 邢建国, 康小龙, 何承辉, 等. 香青兰有效部位滴丸对犬急性实验性缺血心肌的保护作用[J]. 中国中药杂志 , 2011, 46 (15) :1162–1166. |
| [15] | 樊鑫梅, 曹文疆, 邢建国, 等. 香青兰总黄酮对大鼠心肌缺血再灌注损伤保护作用的研究[J]. 中成药 , 2013, 35 (8) :1625–1629. |
| [16] | 谭梦晖, 于波, 谷颖敏, 等. 香青兰不同部位提取物对大鼠实验性高脂血症的影响[J]. 中国实验方剂学杂志 , 2011, 17 (21) :209–213. |
| [17] | 姜雯, 彭克军, 陈强, 等. 香青兰总黄酮对小鼠腹腔巨噬细胞源性泡沫细胞形成的影响及其机制[J]. 中草药 , 2014, 45 (23) :3432–3435. |
| [18] | 姜雯, 何承辉, 邢建国. 香青兰总黄酮微丸制备工艺及释药机制研究[J]. 中草药 , 2013, 44 (21) :3004–3010. |
| [19] | 中华人民共和国卫生部药品标准维吾尔药分册[S].新疆:新疆科技卫生出版社, 1999. |
| [20] | 邢建国, 何承辉, 于宁, 等.香青兰提取物及其制备方法和用途:中国, CN105250366A [P]. 2016-01-20. |
| [21] | 胡宇飞, 刘宣麟, 何承辉, 等. 中心组合设计-效应面法优化香青兰总黄酮磷脂复合物的制备工艺[J]. 中国实验方剂学杂志 , 2014, 20 (10) :36–39. |
| [22] | 黄志巧.香青兰总黄酮在Caco-2细胞吸收特性及大鼠体内药动学研究[D].石河子:石河子大学, 2012. |
| [23] | 中国药典[S].一部. 2015. |
| [24] | GB/T 21853-2008化学品分配系数(正辛醇-水)摇瓶法试验[S].北京:中国标准出版社, 2008. |
| [25] | 万露, 肖云芝, 程玲, 等. 葫芦素B磷脂复合物制备、表征及体外抗肿瘤活性研究[J]. 中草药 , 2015, 46 (1) :48–54. |
| [26] | Martínez-Vázquez M, Estrada-Reyes R, Martínez-Laurrabaquio A, et al. Neuropharmacological study of Dracocephalum moldavica L. (Lamiaceae) in mice: sedative effect and chemical analysis of an aqueous extract[J]. J Ethnopharmacol , 2012, 141 (3) :908–917. DOI:10.1016/j.jep.2012.03.028 |
| [27] | Yang S, Wang L, Guo X, et al. A new flavonoid glycoside and other constituents from Dracocephalum moldavica[J]. Nat Prod Res , 2013, 27 (3) :201–207. DOI:10.1080/14786419.2012.666746 |
| [28] | 贾媛, 马兴苗, 恽菲, 等. 金丝桃苷油水分配系数及大鼠在体肠吸收动力学研究[J]. 中草药 , 2012, 43 (5) :934–939. |
| [29] | Tian S, Liu W, Liu F, et al. Development and validation of an high-performance liquid chromatography-diode array detector method for the simultaneous determination of six phenolic compounds in abnormal savda munziq decoction[J]. Pharmacogn Mag , 2015, 11 (41) :157–162. DOI:10.4103/0973-1296.149732 |
 2016, Vol. 47
2016, Vol. 47


