2. 遵义医学院, 贵州 遵义 563003 ;
3. 四川省食品药品检验检测院, 四川 成都 611000
2. Zunyi Medical University, Zunyi 563003, China ;
3. Sichuan Institute for Food and Drug Control, Sichuan Chengdu 611000, China
麦冬来源百合科沿阶草属植物麦冬Ophiopogon japonicus (L. f) Ker-Gawl. 的干燥块根,是常用中药材之一,主要用于治疗肺燥干咳、阴虚痨嗽、喉痹咽痛、津伤口渴、内热消渴等疾病[1]。主产四川、浙江、湖北、山东、安徽等地,形成了川麦冬、杭麦冬、湖北麦冬、山东麦冬[2-4]等几个具有明显地域特色的品种。干燥是中药材产地加工的最重要环节,随着麦冬药材用量的不断增大,产地加工所带来的问题逐渐被人们重视起来[5]。中药材干燥方法的选择需要根据药材的特性来确定,不同中药品种,特别是针对入药部位不同的中药材,在干燥方法的选择上更需注意[6]。在产地生产过程中对干燥方法的筛选主要以经济、方便为目的,针对中药材质量主要以性状质量作为评价指标[7],而忽略了内在化学组分的变化。本研究旨在通过麦冬内在化学组分的变化特征探讨评价产地加工方法的优劣,为麦冬产地加工方法的筛选和麦冬质量评价提供理论依据。
1 材料与试剂 1.1 麦冬样品新鲜麦冬样品由四川代代为本农业科技有限公司提供,经成都中医药大学李敏教授鉴定均为百合科沿阶草属植物麦冬Ophiopogon japonicus (L. f.) Ker-Gawl. 的块根。
1.2 试剂及仪器Agilent1200高效液相色谱仪,Alltech ELSD-2000蒸发光散射检测器,A580型双光束紫外可见分光光度计;对照品麦冬皂苷D(批号MUST-14052901)、麦冬甲基黄烷酮A(批号 MUST-1406018)、麦冬皂苷D′(批号MUST-14052901)、甲基麦冬高黄酮A(批号 MUST-14080709)、ophiopojaponin C(批号MUST-MUST-14070210)、3-O-α-L-鼠李糖-(1→2) -β-葡萄糖麦冬苷元(批号MUST-14070210)、去乙酰基ophiopojaponin A(批号MUST-14072002)均购自成都曼斯特公司,各对照品质量分数均≥98%;乙腈为色谱纯,水为超纯水,其他均为分析纯。
2 方法 2.1 麦冬的加工麦冬加工共设置14种加工干燥方法,包括晒干(S1)、阴干(S2)、晒半干后烘干(S3)、低温减压干燥(S4)、电烘箱烘干(S5)、煤炭火烘干(S6)、空气源热泵烘干机烘干(S7)、蒸后晒干(S8)、蒸后烘干(S9)、煮后晒干(S10)、煮后烘干(S11)、远红外干燥(S12)、微波干燥(S13)和杀酶后烘干(S14),各种干燥方法干燥条件见表 1。
|
|
表 1 不同干燥方法干燥条件 Table 1 Conditions of different drying methods |
2.2 测定方法 2.2.1 总皂苷、总黄酮和总多糖的测定
总皂苷按照《中国药典》2015年版麦冬项下测定方法进行测定;总黄酮和总多糖按照文献方法[8]进行测定。
2.2.2 麦冬皂苷D量的测定[9](1)对照品溶液的制备:取麦冬皂苷D对照品2 mg,精密称定,加甲醇溶解并定容至5 mL,得对照品溶液。
(2)供试品溶液的制备:分别取麦冬样品粉末(过4号筛)3 g,精密称定,加甲醇50 mL,回流提取1.5 h,滤过,滤液水浴蒸干,残渣用甲醇溶解并定容至2 mL,0.45 μm滤膜过滤得麦冬药材供试品溶液。
(3)色谱条件:ELSD检测器,色谱柱Kromasil 100-5C18(250 mm×4.6 mm,5 μm),柱温30 ℃,漂移管温度100 ℃,气体体积流量3 L/min,进样量15 μL,流动相为乙腈-水(48∶52),体积流量1.0 mL/min。
2.2.3 麦冬甲基黄烷酮A的测定[9](1)溶液制备:按照“2.2.2”项方法制备供试品和对照品溶液。
(2)色谱条件:UV检测器,色谱柱Kromasil 100-5C18(250 mm×4.6 mm,5 μm),柱温30 ℃,检测波长278 nm,进样量15 μL,流动相为乙腈-0.1%磷酸水(58∶42),体积流量1.0 mL/min。
2.3 特征图谱建立 2.3.1 供试品溶液的制备分别取麦冬样品粉末(过4号筛)3 g,精密称定,加甲醇30 mL,静置24 h后超声提取30 min,滤过,滤液水浴蒸干,残渣用甲醇溶解并定容至2 mL,滤膜滤过得麦冬药材供试品溶液。
2.3.2 混合对照品溶液的制备分别取麦冬皂苷D、麦冬甲基黄烷酮A、麦冬皂苷D′、甲基麦冬高黄酮A、ophiopojaponin C、3-O-α-L-鼠李糖-(1→2) -β-葡萄糖麦冬苷元、去乙酰基ophiopojaponin A各2 mg,精密称定,加甲醇溶解并定容至5 mL,得混合对照品溶液。
2.3.3 色谱条件DAD检测器,色谱柱Kromasil 100-5C18(250 mm×4.6 mm,5 μm),柱温30 ℃,检测波长203 nm,进样量15 μL,流动相为乙腈(A)与0.1%磷酸水(B),梯度洗脱,洗脱程序为0~20 min,25%~40% A;20~50 min,40%~50% A;50~60 min,50%~70% A;60~70 min,70% A;70~80 min,70%~100% A;80~90 min,100% A;体积流量1.0 mL/min。
3 结果与分析 3.1 测定结果采用SPSS统计软件对不同方法干燥的麦冬样品各化学成分测定结果进行方差分析,结果见表 2,结果显示不同干燥方法对麦冬化学组分量有显著影响(P<0.05)。
|
|
表 2 不同加工方法麦冬化学组分的测定结果 Table 2 Content determination of chemical composition in Ophiopogonis Radix by different drying methods |
由表 2可知,晒干(S1)、阴干(S2)、低温减压干燥(S4)3种干燥方式加工麦冬的化学组分量均较高,干燥效果最佳;电烘箱烘干(S5)、空气源热泵烘干机烘干(S7)、煤炭火烘干(S6)和蒸煮后干燥(S8~S11)麦冬化学组分相对前3种干燥方法整体有所降低,但变化幅度较微波干燥(S13)和远红外干燥(S12)小;微波干燥(S13)和远红外干燥(S12)对麦冬化学组分的破坏最大。其中总皂苷、总黄酮、麦冬皂苷D以晒干(S1)最高,分别为0.222%、0.458%和0.018 2%,总多糖和麦冬甲基黄烷酮A以阴干(S2)最高,分别为30.55%和0.009 7%,总多糖以远红外干燥(S12)最低,为23.97%,总皂苷、总黄酮、麦冬皂苷D和麦冬甲基黄烷酮A均以微波干燥(S13)最低,分别为0.128%、0.283%、0.010 2%、0.004 6%。不同加工方式对3大类化学组分的影响从大到小依次为总皂苷量>总黄酮量>总多糖量,变异系数分别为19.7%、17.1%、6.9%;不同加工方式对2种单一化学成分量影响表现为麦冬皂苷D>麦冬甲基黄烷酮A,变异系数分别为20.8%、17.6%。此外,干燥方法相近的麦冬样品其化学组分量相近,而干燥方法对麦冬化学组分的影响和干燥温度存在一定的线性关系,干燥温度越高对麦冬化学组分的破坏程度越大。
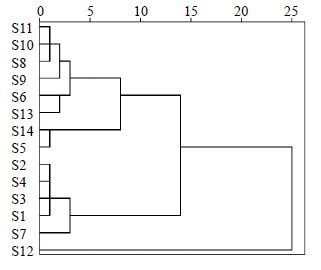
3.2 麦冬HPLC特征图谱对不同干燥方式加工麦冬样品的HPLC色谱图进行对比分析,获得18个共有特征峰,将各色谱峰的峰面积进行量化,如表 3所示,得到14×18阶原始数据矩阵,色谱图见图 1。通过SPSS软件作聚类分析,采用夹角余弦测量,每两样本间用类间平均链锁法连接,输出聚类分析图(图 2)。由图 2可知,当临界值介于5~10时可将干燥方法可分为3大类,其中蒸、煮后干燥(包括烘干和晒干)、煤炭火烘干(S6)和微波干燥(S13)被划为第1类;杀酶后烘干(S14)和电烘箱烘干(S5)被划分为第2大类;阴干(S2)、低温减压干燥(S4)、晒半干后烘干(S3)、晒干(S1)和空气源热泵烘干机烘干(S7)被划分为第3类。在这3类之外,远红外干燥(S12)单独为1类,距离最远。第1大类中,蒸、煮后干燥(S8~S11)的4个麦冬样品距离最近,峰面积总值也相近,在第3大类中,阴干(S2)、低温减压干燥(S4)、晒半干后烘干(S3)、晒干(S1)4个样品距离相同,其峰面积相近且多高于其他样品,说明这4种干燥方法所加工麦冬质量较优。干燥方法差异越小,所加工麦冬样品在HPLC特征图谱上的关系越近,同时干燥方法在HPLC特征图谱中的体现和化学组分测定结果具有一致性。
|
|
表 3 不同干燥方法麦冬HPLC特征峰相对峰面积 Table 3 Relative peak area of HPLC characteristic peaks of Ophiopogonis Radix by different drying methods |
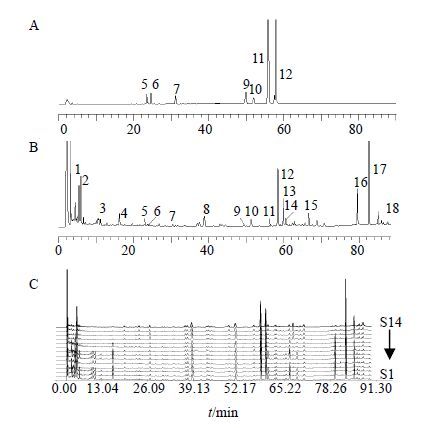
|
5-ophiopojaponin C 6-去乙酰基ophiopojaponin A 7-3-O-α-L-鼠李糖-(1→2) -β-葡萄糖麦冬苷元 9-麦冬皂苷D 10-麦冬皂苷D′11-甲基麦冬高黄酮A 12-麦冬甲基黄烷酮A 5-ophiopojaponin C 6-deacetyl ophiopojaponin A 7-ophiogenin-3-O-α-L-rhamnosyl-(1→2) -β-D-glucoside 9-ophiopogonin D 10-ophiopogonin D′ 11-methylophiopogonone A 12-methylo-phiopogonanone A 图 1 混合对照品溶液 (A)、麦冬HPLC特征图谱 (B) 及样品图谱 (C) Fig.1 Reference solution peak (A), specific HPLC of Ophiopogonis Radix (B), and chromatogram of sample (C) |
|
图 2 麦冬样品的系统聚类分析图 Fig.2 Cluster analysis chart of OphiopogonisRadix sample |
4 讨论
中药材产地加工是影响中药材质量的重要环节[6-7, 10],而干燥则是此环节中的关键。不同种类的中药材对干燥条件的要求不同,传统的干燥方法主要有晒干(S1)和煤炭火(或柴火)烘干(S6)。传统的干燥方式虽在特定的历史时期发挥过十分重要的作用,但其在对药材质量、环境安全等方面存在不可避免的弊端。现代农业的发展大大推动了中药材产地加工的技术发展,种类繁多的干燥设备应用到中药材的产地加工中,针对不同类型的中药材应当选择适当的干燥方法和干燥设备[7, 11],避免造成药材质量降低。当前在麦冬产地干燥方法种类较多,主要有煤炭火烘干(S6)、晒干(S1)和空气源热泵烘干机烘干(S7)3种,其中煤炭火烘干(S6)常因二氧化硫残留超标问题被人诟病。传统的中药材产地加工过程中对干燥方法的筛选主要以经济和方便为目标,在中药材质量方面则多仅注重外观质量,针对内在质量的研究多以单一或单类成分为指标进行评价[12-14]。近年来,以多组分综合评价中药材质量的方法被广泛应用[15-16],本研究将其引入到中药材产地加工方法评价中,作为不同加工方法优劣筛选的指标。主要大类成分和代表单一成分量测定结合特征图谱是分析评价药材质量的有效方法,通过化学组分量变化和HPLC图谱特征研究看,可作为产地加工过程中干燥方法筛选的具体方法和指标,有效的评价麦冬干燥方法的优劣。
从结果分析可以看出,仅考虑药材质量,则晒干(S1)、阴干(S2)和低温减压干燥(S4)对药材化学组分的破坏最小,加工出的药材质量好,但晒干(S1)、阴干(S2)受天气影响大、干燥时间长、晾晒场面积需求大,低温减压干燥(S4)、冷冻干燥对设备要求高、成本高,在实际生产中均受到不同程度的限制。近年来,空气源热泵烘干机烘干(S7)被广泛应用麦冬生产中以替代煤炭火烘干(S6),有效地解决了二氧化硫残留的问题,但与晒干(S1)、阴干(S2)相比较其对麦冬质量有一定的影响,且耗能较传统煤炭火烘干(S6)较大。为保证麦冬药材质量,兼顾经济、方便,可将晒干(S1)和空气源热泵烘干机烘干(S7)相结合应用。
| [1] | 中国药典[S]. 一部. 2015. |
| [2] | 孙志国, 程东来, 钟学斌, 等. 麦冬道地药材的国家地理标志产品保护现状分析[J]. 贵州农业科学 , 2010, 38 (1) :57–59. |
| [3] | 余伯阳, 徐国钧, 金蓉鸾, 等. 麦冬类中药的药源调查和商品鉴定[J]. 中国药科大学学报 , 1991, 22 (3) :150–153. |
| [4] | 金虹, 王化东, 何礼, 等. 川产麦冬及其须根组织学与麦冬皂苷量的对比研究[J]. 中草药 , 2014, 45 (7) :1002–1005. |
| [5] | 宋淑华, 陈淑艳. 各类中药材加工方法[J]. 贮藏加工 , 2003 (9) :35. |
| [6] | 张家春, 林绍霞, 罗文敏, 等. 中药材干燥技术现状及发展趋势[J]. 贵州科学 , 2013, 31 (2) :89–93. |
| [7] | 桑迎迎, 周国燕, 王爱民, 等. 中药材干燥技术研究进展[J]. 中成药 , 2010, 32 (12) :2140–2144. |
| [8] | 林秋霞. 植物生长调节剂对川麦冬质量的影响研究[D]. 温江:成都中医药大学. 2014. |
| [9] | 吴发明, 王盼, 蔡晓洋, 等. 基于产量和有效成分含量分析套作蔬菜对麦冬的影响[J]. 中国药学杂志 , 2015, 50 (23) :2039–2043. |
| [10] | 赵润怀, 段金廒, 高振江, 等. 中药材产地加工过程传统与现代干燥技术方法的分析评价[J]. 中国现代中药 , 2013, 15 (12) :1026–1035. |
| [11] | 邓良平. 中药材产地干燥初加工困境与对策[J]. 农产品加工·学刊 , 2012 (2) :121–123. |
| [12] | 陈倩, 陈科力, 杨旻, 等. 半夏产地加工方法对甾醇类成分的影响[J]. 中药材 , 2010, 33 (11) :1701–1703. |
| [13] | 肖苏萍, 何春年, 曾燕, 等. 干燥方法与采收期对黄芩花中黄酮类化学成分的影响[J]. 中国现代中药 , 2013, 15 (11) :975–980. |
| [14] | 邓寒霜, 高宝云, 王新军, 等. 干燥方法对中药材丹参有效成分含量的影响[J]. 商洛学院学报 , 2007, 21 (2) :54–56. |
| [15] | 贺潇潇, 吴启南, 王新胜, 等. 基于多指标质量评价技术研究不同干燥方法对三棱品质的影响[J]. 中药材 , 2014, 37 (1) :29–34. |
| [16] | 白志川. 不同采收期川丹皮多组分化学成分变化规律研究[J]. 中国农业科学 , 2006, 39 (5) :997–1003. |
 2016, Vol. 47
2016, Vol. 47


