海南粗榧Cephalotaxus mannii Hk. f. 是三尖杉科三尖杉属的高大乔木,是海南的特有植物,也是三尖杉科植物中分布最南的一种[1]。分布在我国境内的三尖杉科三尖杉属植物中,海南粗榧中含有的抗癌活性生物碱三尖杉酯类碱三尖杉酯碱与高三尖酯碱量最高[2]。由于其有较强的抗癌作用,海南粗榧又被称为“抗癌奇木”,是生产抗癌药物三尖杉酯类生物碱的主要原料[3]。三尖杉科植物资源有限,其中有抗癌活性的酯类生物碱的量又极低,远不能满足临床需要。面对日益增长的临床需求,寻找资源保护与开发协调发展的道路具有重大现实意义[4]。
植物细胞悬浮培养技术有不受地理环境、土壤条件、季节变化等因素限制的优势,能确保产物均匀、连续的生产,并且提取方法简单[5-6],是解决我国中药资源问题较有潜力的生产方法。其中促进植物悬浮细胞高效表达次生代谢物的策略主要有:高通量细胞系的选育、培养条件的优化、培养技术的选择、前体物的添加、诱导子和抑制剂的使用、合成代谢过程的优化、强化胞内产物释放、基因工程技术的应用等[7-8]。
芳香族氨基酸酪氨酸和苯丙氨酸是三尖杉酯类碱合成的前体物。代谢途径如图 1所示,植物细胞中磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)(糖酵解途径产物)和赤藓糖-4-磷酸(E4P)(磷酸戊糖途径产物)在3-脱氧-D-阿拉伯庚酮糖-7-磷酸合成酶(3-deoxy-D-arabino-heptulos-onate-7-phosphate synthase,DS)的作用下缩合生成DAHP,然后生成莽草酸,莽草酸转化为分支酸,分支酸分别转化为色氨酸和预苯酸,通过预苯酸生成前体物苯丙氨酸、酪氨酸,经历一个1-苯乙基四氢异喹啉生物碱过程,最终生成三尖杉酯类生物碱[9-10]。从以上合成途径可知,色氨酸是三尖杉酯类碱合成的代谢支路,它的形成会减少三尖杉酯类碱的前体物形成。L-色氨酸和5-甲基-DL-色氨酸(5-MT)是色氨酸代谢支路抑制剂。余龙江等[11]利用5-MT可以抑制由色氨酸产生的相关次生代谢物合成的作用,在红豆杉悬浮细胞培养基中外源添加5-MT等代谢抑制剂,其中添加50 mg/L 5-MT对细胞生长和对紫杉醇合成有较好的促进作用,能使产物紫杉醇产量提高近10倍。
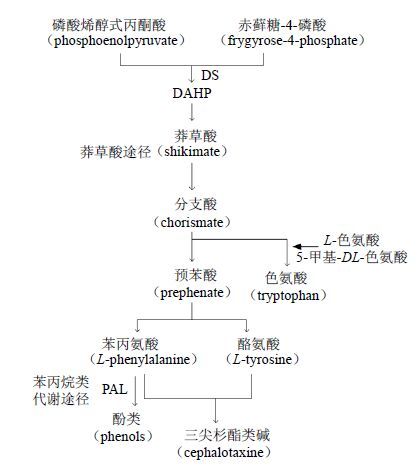
|
图 1 三尖杉酯类碱生物合成途径 Fig.1 Schematic illustration of biosynthetic pathway of cephalotaxus ester alkaloids |
本实验中采用添加代谢支路抑制剂的方法来切断代谢支路,提高目的产物代谢流。本实验将从代谢途径方面来探讨代谢支路抑制剂色氨酸及其衍生物5-MT对海南粗榧悬浮培养细胞生长及产物三尖杉酯类碱生物合成的影响。为提高海南粗榧表达具有抗癌作用次生代谢物提供理论依据。
1 材料与试剂 1.1 材料海南粗榧Cephalotaxus mannii Hk. f. 外植体采自海南省儋州市热带植物园,经海南大学食品学院钟秋平教授鉴定。愈伤组织从其嫩叶中诱导获得[12]。
1.2 仪器JB-CJ-1FC超净工作台(苏州佳宝净化工程设备有限公司);LRH-250S生化培养箱(韶关市泰宏医疗器械有限公司);SYQ-DSX-180B手提式高压蒸汽灭菌锅(上海申安医疗器械厂);TGL.16G台式高速离心机(上海安亭科学仪器厂);T6新世纪紫外分光光度计(北京普析通用仪器有限责任公司);101-1-BS电热鼓风干燥箱(上海跃进医疗器械厂);RE52-99旋转蒸发仪(上海亚荣生化仪器厂)。
1.3 试剂三尖杉酯碱、高三尖杉酯碱对照品(中国食品药品鉴定研究院);L-色氨酸(国药集团化学试剂有限公司);5-甲基-DL-色氨酸(东京化成工业株式会社);MS培养基,青岛日水生物技术有限公司;萘乙酸(NAA)、激动素(KT)、维生素B1、酶水解酪蛋白,磷酸烯醇式丙酮酸(PEP),赤藓糖-4-磷酸(E4P),美国Sigma公司;其他试剂均为国产分析纯。
2 方法 2.1 植物细胞培养基础培养基为MS培养基。在其中添加4 mg/L萘乙酸,0.15 mg/L KT,0.5 g/L PVP,1 g/L酶水解酪蛋白,以及35 g/L蔗糖,固体培养基中另外添加3 g/L植物凝胶。用1 mol/L NaOH调节培养基pH至5.8~6.0[12]。
愈伤组织培养条件为26 ℃黑暗培养,每1个月传代1次。种子液的制备是取500 mL三角瓶装100 mL液体培养基,接种8 g愈伤组织,黑暗培养,转速100 r/min,温度(27±1)℃。种子液在使用前传代3次,每12 d传1代。接种时,用250 mL三角瓶装80 mL液体,接种上述培养3代的植物悬浮培养细胞约6 g。
2.2 代谢抑制剂的制备与添加在海南粗榧悬浮细胞培养第15天,分别添加L-色氨酸至终质量浓度为5、10、50、100 mg/L或5-MT至终质量浓度为1、5、10、50 mg/L,每个质量浓度设3个平行。L-色氨酸及5-MT溶解于0.1% NaOH溶液中,使用前高温灭菌。
2.3 培养液糖质量浓度测定用苯酚-硫酸法测定悬浮培养培养基中残糖量,即离心获得1 mL培养基上清液样品加1 mL 5%苯酚溶液和5 mL浓硫酸,混匀后在室温下反应30 min,以葡萄糖标准液做标准曲线,在480 nm下测定其吸光度(A)[13],计算其量。
2.4 细胞活力的测定采用氯化三苯四氮唑(2, 3, 5-Triphenyltetrazolium Chloride,TTC)还原法测定。离心去上清液获得约200 mg新鲜植物细胞,加入3 mL TTC溶液(取0.6 g TTC溶于100 mL pH 7.5的0.5 mmol/L磷酸缓冲液中),25 ℃下反应24 h,吸去TTC,用蒸馏水清洗2~3次,收集细胞;加入3 mL 95%无水乙醇于60 ℃恒温水浴10 min,以抽提酶反应生成的红色甲臜,离心取上清液,冷却,于492 nm处测定其A值。细胞活力单位以每克湿细胞在492 nm处的A值表示[14]。
2.5 DS酶活测定离心获取新鲜湿细胞约300 mg,加入50 mmol/L Tris-HCl(pH 7.5)和少量石英砂,冰浴研磨后,4 ℃,10 000 r/min离心20 min,收集上清液为酶粗提液。0.5 mL Tris-HCl(pH 7.5)中加入5 mmol/L E4P 50 μL,10 mmol/L PEP 25 μL,混匀后加入酶粗提液100 μL,37 ℃反应10 min,加入0.2 mL 10%三氯乙酸(TCA)终止反应,10 000 r/min离心5 min,取上清液加入25 mmol/L 高碘酸(用125 mmol/L硫酸配制)0.25 mL,室温下放置45 min,加入0.5 mL 2%亚硫酸钠混匀,再加入 2 mL 0.3%硫代巴比妥酸,100 ℃煮沸5 min,离心,于549 nm测A值。测定反应体系中1 min内A值的变化[15]。
2.6 苯丙氨酸解氨酶(Phenylalanine ammonia-lyase,PAL)的测定离心获取新鲜湿细胞约300 mg,加入3 mL酶提取液(含5 mmol/L巯基乙醇,1%聚乙烯吡咯烷酮,0.1 mol/L、pH 8.0的硼酸缓冲液),0.5 g PVP和少量石英砂,在冰上用研钵研磨,然后10 000 r/min离心20 min。上清液为酶粗提液。1 mL酶液加1 mL 0.02 mol/L的苯丙氨酸,2 mL双蒸馏水,总体积4 mL。对照用1 mL蒸馏水代替酶液。反应前在290 nm处测定反应液的A值,反应液在30 ℃恒温水浴中保温0.5 h后再测定反应液的A值,以反应前后每小时A值变化0.01所需的酶量定义为一个单位(U)。细胞酶的活性以每克湿细胞的酶单位(U/g)表示[16]。
2.7 总酚测定取2 mL海南粗榧细胞培养基滤液,加入10 mL醋酸乙酯,超声振荡后静止萃取2 h,取5 mL醋酸乙酯组分自然风干后,残留物溶于3 mL 75%的乙醇中,在280 nm下测量其A值,以3 mL 75%的乙醇为对照,以水杨酸为标准,以1 μg水杨酸在280 nm处的A值代表一个单位的酚积累[17]。
2.8 三尖杉酯类碱的提取与测定 2.8.1 胞内产物提取抽滤收集湿细胞,60 ℃下干燥,加石英砂在研钵中研磨,20 mL甲醇浸泡24 h,在真空条件下浓缩至干,最后用1 mL甲醇复溶,并用0.22 μm滤膜滤过待测。
2.8.2 胞外产物提取加氨水调节培养液pH至8.0左右,用三氯甲烷萃取3次,在真空条件下浓缩至干,最后用1 mL甲醇复溶,并用0.22 μm滤膜滤过待测。
2.8.3 样品测定采用HPLC,色谱条件为XDB C18色谱柱(150 nm×4.6 nm,5 μm)色谱柱,进样量10 μL,体积流量0.8 mL/min,流动相为0.02 mol/L乙酸铵-甲醇(55∶45),柱温25 ℃,检测波长为280 nm[18]。
2.8.4 对照品的制备精密称取三尖杉酯碱、高三尖杉酯碱对照品溶解于甲醇,制成质量浓度为40 mg/L的对照品溶液。
2.9 统计分析本实验中,每个处理重复3次,实验数据用x±s表示。差异显著性分析用Duncan法进行多重比较,P<0.05表示差异显著。
3 结果与分析 3.1 代谢抑制剂对细胞生长和产物合成的影响由图 2可以看出,添加L-色氨酸或5-MT后,细胞生长均受到一定程度的抑制。添加5、10、50、100 mg/L L-色氨酸后,细胞生物量比对照(2.406 g/L)分别降低了33.74%、9.35%、19.70%、23.19%;添加1、5、10、50 mg/L 5-MT后,细胞生物量分别降低了4.03%、18.04%、28.89%、41.48%。说明二者均对海南粗榧悬浮细胞的细胞生长有抑制作用,且抑制作用随抑制剂浓度增高增强。同时,由图 2可以看出,在添加10 mg/L L-色氨酸,5 mg/L 5-MT时产物三尖杉酯类碱量(三尖杉酯碱和高三尖杉酯碱之和)分别达到最高,分别为2.615、2.944 mg/L,是对照(1.343 mg/L)的1.947、2.192倍。表明抑制剂L-色氨酸及其衍生物5-MT对产物三尖杉酯类碱的积累有一定的促进作用,并且5-MT的促进作用略强于L-色氨酸。
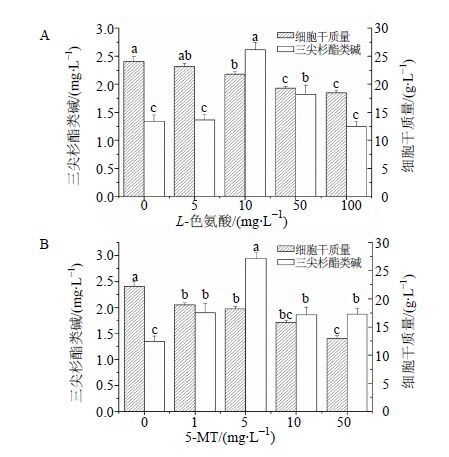
|
不同字母表示差异显著P<0.05,下同 Different lowercase letters indicate significant difference at P < 0.05, same as below 图 2 不同质量浓度L-色氨酸 (A) 或5-MT (B) 对海南粗榧悬浮细胞生长和三尖杉酯类碱合成的影响 Fig.2 Effects of L-tryptophan (A) or 5-MT (B) at different concentration on cell growth and cephalotaxine production of C. mannii |
3.2 代谢抑制剂对细胞活力与培养基糖耗的影响
为考察抑制剂L-色氨酸及其衍生物5-MT对细胞初生代谢的抑制情况,考察它们对细胞活力与糖代谢的影响。结果如图 3所示。在添加抑制剂后,海南粗榧悬浮细胞的细胞活力均受到一定的抑制作用,处理的前3 d抑制作用较小(P>0.05),随培养时间的增加,细胞活力逐渐降低。
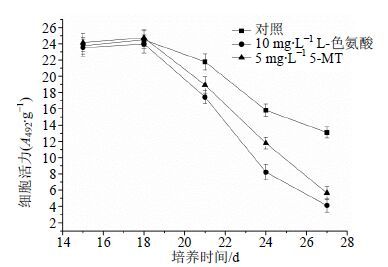
|
图 3 L-色氨酸或5-MT对海南粗榧细胞活力的影响 Fig.3 Effects of L-tryptophan or 5-MT on cell viability of C. mannii |
另外,添加抑制剂后对耗糖影响如图 4所示,糖耗速率与对照相比先慢后快。经抑制剂处理后,前6 d糖耗速率低于对照。添加10 mg/L L-色氨酸或5 mg/L 5-MT后,第6天培养基中残糖量分别为12.6、11.8 mg/mL,比对照(10.4 mg/mL)升高了21.35%、13.04%。随后,耗糖速率与对照相比明显加快。但是细胞活性降低,这说明植物细胞中营养物质可能是从初生代谢转向次级代谢,有利于产物积累。
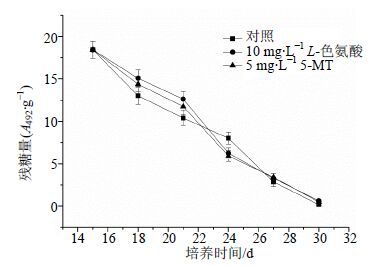
|
图 4 L-色氨酸或5-MT对海南粗榧悬浮培养液糖耗的影响 Fig.4 Depletion curves of sugar in culture medium treated with L-tryptophan or 5-MT in suspension cultures of C. mannii |
3.3 代谢合成途径关键酶DS酶的活性变化
莽草酸途径是三尖杉酯类碱合成的必经途径,包含7步酶催化反应,最终生成分支酸。在分支酸后分为2条途径,一条生成酪氨酸和苯丙氨酸,另一条生成色氨酸。DS是莽草酸途径的第一个酶,通过催化PEP和赤藓糖-4-磷酸(erythrose-4- phosphate,E4P)之间的醛缩反应生成DAHP,是莽草酸途径中重要的限速酶;同时也是该途径的关键酶,受苯丙氨酸、酪氨酸和色氨酸反馈调节作用。
在添加抑制剂48 h后,分别测定DS酶活力,结果如图 5所示,与对照组(0.67 U/mg)相比均有所下降,但添加5 mg/L 5-MT比添加10 mg/L L-色氨酸对DS酶活力影响较小,说明对代谢途径中莽草酸途径的抑制作用小。
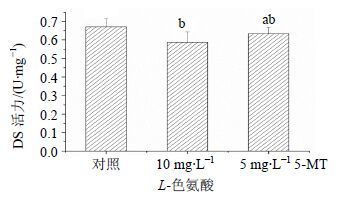
|
图 5 L-色氨酸或5-MT对海南粗榧悬浮细胞DS酶活力的影响 Fig.5 Effects of L-tryptophan or 5-MT on DS enzyme activity of C. mannii |
3.4 对PAL酶活力及酚类物质积累的影响
苯丙烷类代谢途径是植物细胞内经过苯丙氨酸的一条重要代谢途径,它参与合成一系列植物防卫反应相关化合物酚类、苯甲酸、植物信号分子等。在海南粗榧悬浮细胞产三尖杉酯类碱代谢途径中,苯丙烷类代谢途径还属于一条代谢支路,此代谢支路上的碳通量减少有利于产物积累。
PAL是苯丙烷类代谢途径关键酶,在添加抑制剂10 mg/L L-色氨酸及5 mg/L 5-MT 48 h后,PAL酶活性增加,如图 6-A所示,与对照组(78.21 U/g)相比分别增加了37.72%、28.02%。酚类物质是苯丙烷代谢途径的主要产物,其合成受到PAL酶的影响,酚类积累过多会抑制细胞生长,在添加外物时,悬浮细胞中总酚呈现一个快速的积累过程。同样测定48 h后总酚量,如图 6-B所示,与对照(0.359 mg/mL)相比分别增加了19.14%、9.61%。
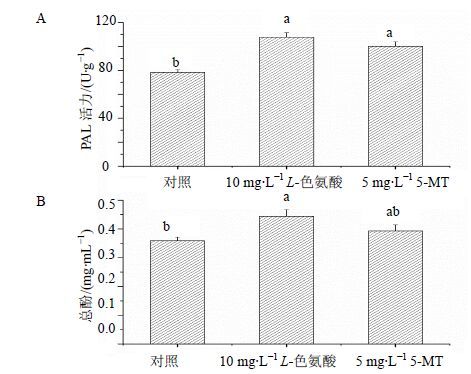
|
图 6 L-色氨酸或5-MT对海南粗榧悬浮细胞PAL酶活 (A)与细胞培养液中总酚积累 (B) 的影响 Fig.6 Effects of L-tryptophan or 5-MTon PAL enzyme activity (a) and phenolics accumulation (B) in C. mannii cell cultures |
4 讨论
在本实验中,期望通过抑制三尖杉酯类碱代谢途径中代谢支路产生的色氨酸量,使得碳通量更多的流向酪氨酸和苯丙氨酸,即产物合成方向。大部分氨基酸合成代谢都有反馈抑制机制,即终产物抑制合成过程中相对独立的第一酶[19-20]。根据此原理,添加L-色氨酸或其衍生物5-MT来抑制产色氨酸代谢通路,从而促进产物三尖杉酯类碱的积累。
本研究表明,添加代谢抑制剂10 mg/L L-色氨酸或5 mg/L 5-MT对海南粗榧产三尖杉酯碱和高三尖杉酯碱都有显著的促进作用。高浓度的L-色氨酸和5-MT对细胞生长的抑制作用较显著(图 2),过低生物量不利于产物的合成。在细胞生长趋于稳定期的第15天[21]添加抑制剂对海南粗榧悬浮细胞的生长抑制作用较小。此时细胞生物量浓度较大,次生代谢能力相对较强,可以在一定程度上抵御外界刺激,对细胞的生长与细胞活力抑制作用较小,并且同时能促进植物细胞初生代谢转向次生代谢,有利于产物的合成。
三尖杉酯类碱合成途径如图 1所示,DS酶是三尖杉酯类碱合成途径中重要的关键酶,决定其合成产率和产量[22]。但是由于DS酶受到色氨酸、苯丙氨酸、酪氨酸的反馈抑制,添加过量的色氨酸或者积累过多的苯丙氨酸和酪氨酸都会引起“瓶颈效应”[23],影响最终产物的合成。本实验研究结果表明,添加10 mg/L L-色氨酸或5 mg/L 5-MT后,对DS酶均有一定的抑制作用。并且,添加5 mg/L 5-MT比添加10 mg/L L-色氨酸对DS酶活力影响小(图 5)。原因是添加浓度较低,低浓度的5-MT能在保证抑制色氨酸合成代谢支路的同时,也最大程度地减少对DS酶活力的影响。另外,色氨酸还是吲哚乙酸(IAA)的前体物,随着色氨酸代谢支路被抑制,IAA的合成相应受到抑制,会抑制细胞的生长,加快细胞初生代谢转向次生代谢[11]。
PAL酶活力增加(图 6-A),在一定程度上PAL酶在较短时间内,活力得到明显的上升,有利于植物抗性形成与相应次生代谢物的合成[24]。随后酶活力由植物自身代谢调节而下降。PAL酶是三尖杉酯类碱合成途径中另外一条代谢支路苯丙烷途径的相关酶,能催化酚类物质的合成。PAL酶活的变化会影响到酚类物质的积累。酚类物质和三尖杉酯类碱有共同前体物苯丙氨酸,酚类物质的过量积累不仅会抑制细胞生长还会消耗三尖杉酯类碱合成的前体物。但是,细胞内适量的酚类积累也能刺激次生代谢。综上,添加代谢抑制剂5 mg/L 5-MT对海南粗榧产三尖杉酯类碱和高三尖杉酯类碱有最显著的促进作用。
| [1] | 傅立国. 中国高等植物(第7卷)[M]. 北京: 科学出版社, 1978 . |
| [2] | 中国医学科学院药物研究所编著. 中草药现代研究第二卷[M].. 北京:北京医科大学中国协和医科大学联合出版社, 1996. |
| [3] | 王有生. 救救抗癌奇木——海南粗榧[J]. 植物杂志 , 1990 (3) :8–9. |
| [4] | 王献溥, 王有生. 海南粗榧濒危的原因和保护措施[J]. 广西植物 , 1994, 14 (4) :369–372. |
| [5] | Gibson D M, Ketchum R E B, Vance N C, et al. Intiation and growth of cell lines of Taxus brevifolia[J]. Plant Cell Rep , 1993, 12 :479–482. |
| [6] | 董娟娥, 张康健, 梁宗锁. 植物次生代谢与调控[M]. 杨凌: 西北农林科技大学出版社, 2009 . |
| [7] | Strohl W R. Biochemical engineering of nature product biosynthesis pathways[J]. Metab Eng , 2001, 3 (1) :4. DOI:10.1006/mben.2000.0172 |
| [8] | Wilson S A, Roberts S C. Recent advances towards development and commercialization of plant cell culture processes for the synthesis of bimolecular[J]. Plant Biotechnol , 2012, 10 :249–268. DOI:10.1111/pbi.2012.10.issue-3 |
| [9] | Gitterman A, Parry R J, Dufresne R, et al. Biosynthesis of the cephalotaxus alkaloids. Investigations of the biosynthesis of deoxyharringtonine, isoharringtonine, and harringtonine[J]. Am Chem Soc , 1980, 102 :2074–2081. DOI:10.1021/ja00526a051 |
| [10] | Parry R J, Chang M N, Schwab J M, et al. Biosynthesis of the cephalotaxus alkaloids. Investigations of the early and late stages of cephalotaxine biosynthesis[J]. Am Chem Soc , 1980, 102 :1099–1111. DOI:10.1021/ja00523a029 |
| [11] | 余龙江, 张长河. 抑制剂促进紫杉醇生物合成的初步研究[J]. 天然产物研究与开发 , 1998, 11 (3) :6–11. |
| [12] | 王成韬. 海南粗榧愈伤组织增殖及抗褐变研究[D]. 海口:海南大学, 2013. |
| [13] | DuBois M, Gilles K, Hamilton J, et al. Colorimetric method fordetermination of sugars and related substances[J]. Anal Chem , 1956, 28 (3) :350–356. DOI:10.1021/ac60111a017 |
| [14] | Iborra J L, Guardiola J, Montaner S, et al. 2, 3, 5-Triphenyltetrazolium chloride as a viability assay for immobilized plant cells[J]. Biotechnol Tech , 1992, 6 :319–322. DOI:10.1007/BF02439319 |
| [15] | Russell J, MeCandliss D, Michael D, et al. 3-Deoxy-D-arabino-heptulosonate 7-phosphate synthase:purification and molecular characterization of the phenyalanine-sensitiveisoenzyme from E. coli[J]. J Biol Chem , 1978, 253 :4259–4265. |
| [16] | Yuan Y J, Li C, Hu Z D, et al. A double oxidative burst for taxol production in suspension cultures of Taxus chinensis var. mairei induced by oligosaccharidefrom Fusarium oxysprum[J]. Enzyme Microb Technol , 2002, 30 :774–778. DOI:10.1016/S0141-0229(02)00057-1 |
| [17] | Anderson A J, Roger K, Teeper C S. Timing of molecular events following elicitor treatment of plant cells[J]. Physiol Mol Plant Pathol , 1991, 38 (1) :1–13. DOI:10.1016/S0885-5765(05)80139-0 |
| [18] | Li Y C. Enhanced cephalotaxine production in Cephalotaxus mannii suspension cultures by combining glycometabolic regulation[J]. Process Biochem , 2014, 2014 :2279–2284. |
| [19] | 王镜岩, 朱圣庚, 徐长法. 生物化学(下册)[M]. 第3版. 北京: 高等教育出版社, 2002 . |
| [20] | 盛祖嘉. 微生物遗传学[M]. 第2版. 北京: 科学出版社, 1997 . |
| [21] | 陈林, 李永成. 海南粗榧细胞悬浮培养体系的建立[J]. 广东农业科学 , 2014, 24 :54–59. |
| [22] | 李永辉. 芳香族氨基酸生物合成代谢途径调控研究[D]. 北京:中国人民解放军军事医学科学院, 2003. http://cdmd.cnki.com.cn/article/cdmd-90106-2003093566.htm |
| [23] | 于金龙. 大肠杆菌芳香族氨基酸生物合成途径的代谢调控研究[D]. 北京:中国人民解放军军事医学科学院, 2008. |
| [24] | 李永成. 东北红豆杉悬浮细胞与内生真菌在紫杉醇合成中相互关系的研究[D]. 无锡:江南大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10295-2009249754.htm |
 2016, Vol. 47
2016, Vol. 47


