2. 中国医学科学院北京协和医学院 药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100193, China
糖类物质主要来源于植物光合作用,其种类丰富多样、分布广泛,对生物体的生命活动至关重要[1-3]。植物经光合作用产生的淀粉是所有生命体的必需能源物质;植物细胞合成的纤维素、半纤维素和果胶等是构成细胞壁的主要组分;糖类还是重要的代谢中间物,在体内转变为氨基酸、核苷酸、脂肪酸等;某些糖亦可作为信号分子介导细胞基因表达与调控;糖也能作为渗透物质调节水分生理进而参与器官发育。然而,糖类在植物等生命体中的有效作用,密切依赖于细胞中糖转运蛋白的表达与精细调控。
在高等植物中,糖转运蛋白按其运输产物差异分为单糖转运蛋白和二糖转运蛋白2类[4-5]。前者转运底物种类较多,亦可分为己糖转运蛋白、肌醇转运蛋白等;目前发现二糖转运蛋白,除了少数转运麦芽糖外,一般高度专性转运蔗糖,其中研究最多当属蔗糖转运蛋白(sucroce carrier/transporter,SUC/SUT)。根据基因结构、功能差异和分子进化,其可分为SUC2/SUT1、SUC3/SUT2、SUC4 3个亚家族,均属寡聚糖/H+共转运家族(oligosaccharide/H+ sympoter,OHS)。单糖、二糖转运蛋白的三维结构较相似,含有12个跨膜结构域,N端和C端一致性较高且均在胞质一侧,属于协助扩散超家族(major facilitator superfamily,MFS)[4]。
1992年,自菠菜SUT基因SoSUT1[6]克隆研究以来,已从十字花科、豆科、茄科、杨柳科及禾本科等科的多种植物中鉴定大量糖转运蛋白基因,包括拟南芥、玉米、水稻、油菜、蒺藜苜蓿和杨树等[7-12]。研究发现,这些基因在染色体、转录、翻译及翻译后修饰等水平进行不同层次精细调控,参与植物细胞各种生理生化代谢过程。拟南芥单糖转运基因AtSTP4基因在根尖分生组织中表达,维持渗透势作为细胞伸长生长的驱动力[13]。拟南芥AtSTP11基因花粉管中特异表达,参与其生长发育[14]。马铃薯StSUT1基因参与韧皮部装载[15]。东方山羊豆GoSUT基因在PEG、NaCl等胁迫处理下上调[16]。此外,有研究还发现蒺藜苜蓿MtST1基因受球囊菌门真菌侵染诱导表达[17]。可见,糖转运蛋白基因在植物细胞生长发育、植物与微生物互作以及植物抗逆胁迫等方面发挥极其重要的作 用。
铁皮石斛Dendrobium officinale Kimura et Migo为兰科(Orchidaceae)石斛属Dendrobium Sw. 多年生草本植物,药用部位为新鲜或干燥茎,具有益胃生津、滋阴清热、润肺止咳、明目强身等作用,是石斛属药用植物中最为珍稀名贵的种[18]。石斛属植物主要含有多糖、生物碱、菧类、酚类以及木质素类等多种活性成分,具有重要的药理活性。石斛多糖作为一类免疫增强剂,具有促进淋巴细胞产生淋巴因子,增强机体体液、细胞免疫,以及抗肿瘤、抗氧化、抑制自由基和自由基等作用,因而是石斛类药材质量鉴定的主要标准之一[19]。前期,本课题组利用SSH技术富集菌根真菌侵染铁皮石斛根的差异表达基因[20],分离得到一条379 bp的EST,BLASTx分析显示其与SUT(GenBank注册号AAD55269)一致性较高(81%)。鉴于SUTs在植物糖生理中的重要作用,该差异基因可能在石斛多糖代谢与调控中起重要作用。本研究利用RACE技术从铁皮石斛分离到一个蔗糖转运蛋白基因DoSUT1的全长cDNA,并进行生物信息学及表达模式分析,为进一步揭示其在石斛多糖运输及各器官分配等方面的生物学作用奠定基础。
1 材料样品采自云南西双版纳,经笔者鉴定为野生铁皮石斛Dendrobium officinale Kimura et Migo,取石斛根、茎、叶组织样品,液氮速冻后置-80 ℃保存备用。
2 方法 2.1 RNA提取和cDNA合成按照EASYspin植物RNA快速提取试剂盒(Aidlab)操作说明制备各样品总RNA,NanoDropTM 2000分光光度计(Thermo Fisher)分析RNA质量、纯度,琼脂糖凝胶电泳检测完整性。按照M-MLV Reverse Transcriptase kit(Promega,USA)操作说明,逆转录合成cDNA第1链,-20 ℃保存备用。
2.2 3’-RACE反应序列分析表明,原始EST的编码肽段包含N末端89个氨基酸,因此只需进行3’-RACE反应。故在该序列起始密码子上游设计2条3’-RACE引物:SUT1-F1为5’-GAATCTGCTGTGATCTTCATCTCCCGC-3’;SUT1-F2为5’-TGTGATCTTCATCTCCCGCCCG-3’(下划线为2个引物的重合序列),按照SMARTerTM RACE cDNA Amplification Kit(Clotech,日本)说明书,分别与试剂盒中提供的3’-CDS引物(能够实现3’-末端扩增)组合进行2次巢式3’-RACE。扩增产物即包含完成的编码区和3’-polyA尾巴,无需再进行RT-PCR全长验证。
2次RACE-PCR反应体系均为25 μL,包括10×Advantage® 2 PCR buffer 2.5 μL,dNTPs(10 mmol/L)0.5 μL,SUT1-F1或SUT1-F2(10 μmol/L)各0.5 μL,10×NUP 0.5 μL,5’-RACE ready cDNA(第1次PCR模板)或第1次PCR产物(第2次PCR模板)各1.0 μL,50×Advatange® 2 Polymerase Mix(5 U/L)0.5 μL,ddH2O 19.5 μL。PCR程序为95 ℃、3 min,95 ℃、30 s,68 ℃、2 min 32个循环;72 ℃、7 min,4 ℃保温。PCR产物经1.5%琼脂糖凝胶电泳,TianGen胶回收试剂盒(TianGen,China)纯化目的条带,连接至pMD18-T vector(Takara,中国),转化大肠杆菌(Escherichia coli)JM109感受态细胞,随机挑选3个克隆并送生工生物工程(上海)股份有限公司测序。
2.3 序列分析使用一系列网络在线工具进行DoSUT1基因核酸及编码蛋白的生物信息学序列分析。利用NCBI的BLASTx(http://www.ncbi.nlm.nih.gov/blast/)和ORF Finder(http://www.ncbi.nlh.nih.gov/gorf/gorf.html)分析cDNA序列;用ExPASy Proteomics Server的InterProScan(http://www.ebi.ac.uk/cgi-bin/iprscan/)和PROSITE SCAN(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_proscan.html)分析DoSUT1蛋白质的结构域和基元;Protparam(http://web.expasy.org/protparam/)和SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/secpred_sopma.pl)分析蛋白质理化性质和二级结构;采用SWISS-MODEL(http://swissmodel.expasy.org/)进行蛋白质三维建模分析;SignalP 4.0(http://www.cbs.dtu. dk/services/SignalP/)和TMHMM(http://www.cbs.dtu.dk/serv-ices/TMHMM-2.0/)预测蛋白质信号肽和跨膜区域;PSORT(http://psort.ims.u-tokyo.ac.jp/form.html)进行蛋白质亚细胞定位分析。用DNASTAR 6.0进行氨基酸序列比对;借助MEGA 4.0构建系统进化树。
2.4 实时定量PCR分析分别用2 μg根、茎、叶样品总RNA反转录合成cDNA,EF1α作为内参基因[21],qPCR分析DoSUT1基因的组织表达模式。qPCR引物SUT1-S 5’-GGGTAGTGTTCTGGGCTATGCT-3’和SUT1-AS 5’-TCCAATCAGTGTCAAAGAGGGT-3’的扩增产物长350 bp。用ABI PRISM 7500实时荧光定量PCR仪(Applied Biosystems,美国)进行qPCR。反应体系25 μL包括2×SYBR® Premix Ex TaqTM Master Mix(Takara,中国)12.5 μL,正反向引物(10 μmol/L)0.5 μL,ROX 0.5 μL,cDNA 2 μL,ddH2O 9 μL。每个反应重复3次,包括不加模板的对照,实验重复3次。PCR程序:95 ℃、30 s,95 ℃、10 s,60 ℃、45 s,40个循环,反应结束绘制熔解曲线。根据ABI PRISM 7500 SDS软件(Applied Biosystems,USA)生成的循环阈值(Cycle threshold,Ct),用2-ΔΔCt方法[22]计算基因的相对表达量。
3 结果与分析 3.1 DoSUT1基因全长克隆经过2次巢式3’-RACE反应,扩增产生长度约为2 000 bp的目标条带(图 1),克隆、测序获得1 920 bp的序列,拼接分析获得了一条1 999 bp的cDNA。BLASTx分析表明其与GenBank中已注册的多种植物SUT有很高的相似性(63%~71%)。该cDNA序列包含的开放阅读框(open reading frame,ORF)长1 671 bp,5’-UTR长110 bp,3’-UTR长273 bp,具有真核生物mRNA加尾信号“AATAA”以及polyA尾巴,起始密码子附近碱基序列GAAATGG(即A/GNNATGG)[23],因此将其定名为DoSUT1,提交GenBank获得注册号KF876839。
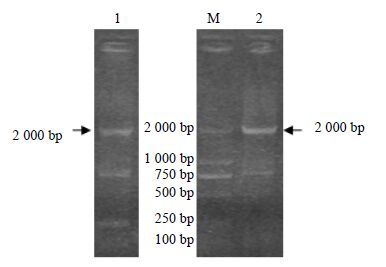
|
图 1 铁皮石斛DoSUT1基因全长cDNA克隆 Fig.1 Clone of full length cDNA of DoSUT1 gene in D. officinale |
3.2 DoSUT1基因的编码蛋白理化特性分析
Protparam预测DoSUT1基因编码的蛋白质的分子式为C2641H4175N689O703S18,包含538个氨基酸残基,相对分子质量57 400,等电点9.61;DoSUT1蛋白带正电残基(Arg+Lys)为44,负电残基(Asp+Glu)为29。该蛋白的不稳定系数为37.64,脂肪系数为109.87,亲水性系数为0.459。SOPMA分析表明,DoSUT1蛋白二级结构主要由α螺旋(alpha1-1次3’-RACE产物 2-2次3’-RACE产物 M-Marker1-1st round 3’-RACE product 2-2nd round 3’-RACE product M-Marker helix,38.29%)、随机卷曲(random coil,33.21%)、延伸链(extended strand,20.33%)和少量的β转角(beta turn,8.17%)组成。
3.3 DoSUT1蛋白结构域、定位和跨膜区分析InterProscan分析结果显示,DoSUT1蛋白含有高等植物蔗糖/H+共转运家族(sucrose/H+ symporter,SUC/SUT)和协助扩散超家族(major facilitator superfamily,MFS)的保守结构域(60-524、63-531),具备高等植物蔗糖转运蛋白的典型结构域特征。PROSITE SCAN分析表明,DoSUT1蛋白含有数目不等的功能基元,包括N-糖基化位点(187-190)、酰胺化位点(129-132)、RGD细胞附着位点(345-347)、亮氨酸拉链(365-386)和脯氨酸富集位点(44-45)各1个,5个蛋白激酶C磷酸化位点(34-36、122-124、202-204、276-278、455-457),7个酪蛋白激酶Ⅱ磷酸化位点(26-29、34-37、202-205、276-279、287-290、288-291、332-335)和17个N-豆蔻酰化位点(74-79、94-99、157-162、223-228、231-236、357-362、364-369、389-394、422-427、427-432、440-445、462-467、464-469、466-471、497-502、505-510、512-517)。
3.4 DoSUT1蛋白亚细胞定位、信号肽和跨膜域预测PROSITE预测DoSUT1蛋白定位在叶绿体类囊体膜的可能性最高为85.4%,定位于质膜为60%,定位于高尔基体、内质网的几率分别为40%和30%。ChloroP 1.1分析结果显示,DoSUT1蛋白具有叶绿体转运肽,表明DoSUT1可能是一个叶绿体蛋白。SignalP 4.0分析DoST蛋白不含信号肽,图 2 TMHMM分析显示DoSUT1具有12个跨膜结构域(64-86、99-121、134-156、171-190、211-233、258-277、306-328、356-378、390-412、427-449、461-483、498-520),这与已报道的植物SUT蛋白结构(12个跨膜区)一致[4, 7]。
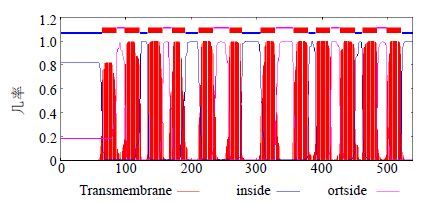
|
图 2 TMHMM分析DoSUT1蛋白的跨膜域 Fig.2 Transmembrane region of deduced DoSUT1 protein analyzed by TMHMM |
3.5 DoSUT1与植物SUTs蛋白的氨基酸序列比对分析
运用DNASTAR 6.0中的MegAlign程序,对DoSUT1基因编码蛋白与代表性植物的7个蔗糖转运蛋白进行多序列比对。图 3结果显示,铁皮石斛DoSUT1蛋白与高粱Sorghum bicolor (L.) Moench SbSUT4(ACX71839)、拟南芥Arabidopsis thaliana (L.) Heynh AtSUC4(NP_172467)和大麦Hordeum vulgare L. HvSUT2(CAB75881)相似性较高,分别为61.5%、59.4%、58.3%;与拟南芥AtSUC1(AEE35247)和烟草Nicotiana tabacum L. NtSUT(BAO47334)相似性为47.6%和46.5%;与高粱SbSUT1(ACY69230)和水稻Oryza sativa L. OsSUT1(Q9LKH3)的相似性较低为39.5%和39.0%。DoSUT1蛋白含植物蔗糖转运蛋白普遍存在的12个保守跨膜域,其中,除VI和IX跨膜域与其他植物SUC/SUTs蛋白差异较大,其余相对高度保守。

|
下划线Ⅰ~Ⅻ为SUT的12个保守跨膜域 Ⅰ—Ⅻ show the 12 underlined transmembrane regions conserved among SUC/SUT proteins 图 3 DoSUT1与植物SUC/SUT蛋白的多序列比对 Fig.3 Multiple sequence alignment of DoSUT1 and SUC/SUT proteins from other plants |
3.6 DoSUT1基因编码蛋白的系统进化树分析
为分析铁皮石斛DoSUT1基因编码蛋白的分子进化关系,从GenBank数据库中选取具有代表性的7个物种的33条糖转运蛋白序列,利用MEGA 6.0构建DoSUT1蛋白的系统进化树。
图 4结果表明,34个糖转运蛋白基因分为2个大群,即单糖转运蛋白(MSTs)与SUT。其中SUT分为3个亚族,分别为SUC2/SUT1、SUC3/SUT2、SUC4。DoSUT1与玉米ZmSUT4(AAT35810)、大麦HvSUT2(CAB75881)、高粱SbSUT4(Sorghum bicolor ACX71839)等单子叶植物亲缘关系最近且聚在一起,所在分支隶属植物SUT SUC4亚族。
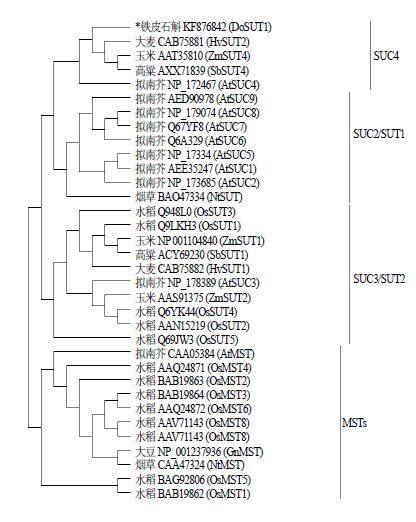
|
SUC2/SUT1、SUC3/SUT2和SUC4为SUT 3个亚家族 SUC2/SUT1, SUC3/SUT2, and SUC4 represent the three subfamilies of sucroce carrier/transporter (SUC/SUT) 图 4 DoSUT1与不同物种糖转运蛋白的进化树分析 Fig.4 Phylogenetic tree of DoSUT1 with sucroce carrier/ transporters from other species |
3.7 基因表达模式分析
分别提取石斛根、茎、叶等样品总RNA,利用qPCR技术检测DoSUT1的组织表达模式。图 5结果表明,DoSUT1在3种器官中为组成型表达,但相对表达量存在差异。以根为校正样本,DoSUT1转录本在石斛叶中的表达量较高,为根中的2.783倍;茎中次之,为根中的2.150倍。
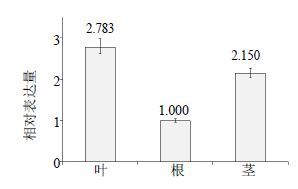
|
图 5 利用qPCR分析DoSUT1基因的组织表达模式 Fig.5 Tissue-specific expression pattern of DoSUT1 gene using qPCR analysis |
4 讨论
SUC/SUTs蛋白介导了蔗糖在植物细胞间短距离或植物体内长距离运输,通过调节糖在源-库器官中的有效合理分布及其利用,进而在植物生长发育、抗逆生理、植物微生物互作等方面发挥着极其重要的作用[4-5, 24]。SUC/SUTs基因系统性分析多来自模式植物和农作物研究,药用植物中尚未见报道。植物SUC/SUTs呈多基因家族,拟南芥、水稻、玉米和蒺藜苜蓿等已鉴定有9、5、6和4个成员[9, 11, 25]。本研究利用RACE技术首次从珍稀濒危铁皮石斛中分离到一个DoSUT1基因cDNA全长其编码蛋白具有高等植物SUT典型的协助扩散超家族、蔗糖/H+共转运保守结构域和多个基序。DoSUT1与多种植物SUT基因一致性较高,分子进化属于SUC4亚家族[26],与玉米、大麦、高粱等单子叶植物亲缘关系较近。这些说明DoSUT1是编码铁皮石斛SUT新的重要基因。
蛋白质结构域和基元是决定其发挥生物学功能的重要基础。系统性研究发现,SUC/SUTs家族是协助扩散超家族的成员之一,属寡聚糖/H+共转运家族[16],佐证了DoSUT1蛋白InterProScan预测结构域的正确性。SUC/SUTs蛋白典型结构都具有12个跨膜结构域和11突环,其N端和C端均在细胞质一侧,N端氨基酸序列与SUT对蔗糖亲和力有重要关联[26],而TMHMM分析揭示DoSUT1蛋白存在12跨膜域,多序列比对显示,DoSUT1蛋白N端与多种植物已知SUT N端保持高度一致,这些特征均与SUC/SUTs蛋白典型结构相一致。已报道的绝大多数SUC/SUTs蛋白的亚细胞定位尚不清楚,一般为生物信息学预测分析结果。番茄LeSUT4(属SUC4亚族)被定位于筛分子质膜[27],SUC4亚族中一些成员定位于液泡膜[26]。PROSITE预测DoSUT1蛋白定位在叶绿体内囊体膜上的几率高达85.4%,结合ChloroP 1.1分析其包含叶绿体转运肽,说明DoSUT1蛋白定位与内囊体膜上执行糖转运功能。分子系统学研究揭示植物SUT包含SUC2/SUT1、SUC3/SUT2、SUC4 3个亚家族,单子叶植物仅含有SUC3/SUT2和SUC4 2个亚族[26],DoSUT1属SUC4亚家族,与单子叶植物聚类在一起符合进化关系。DoSUT1基因的这些分子特征为其生物学功能研究提供参考。
植物SUC/SUTs基因的组织表达模式存在较大差异。不同植物或同一植物的不同器官,SUC/SUTs基因的表达部位和表达量都有差异。拟南芥AtSUT2基因的启动子在叶的维管组织中表达[28],水稻OsSUT1基因的启动子在从旗叶到正在灌浆的谷粒中都有表达,表明基因参与糖的长距离运输[29]。玉米SUT基因ZmERD6基因在不同组织中差异表达,ZmERD6-L基因在花丝和籽粒中相对表达量最高,未成熟胚和根中较高,而在叶中最低。ZmERD6-S基因在各个组织中都有表达,但是表达量较低,说明这2个转录本差异表达决定他们的功能不同[25]。本研究qPCR分析结果显示,DoSUT1基因为组成型表达,在石斛叶、茎中表达量显著高于根中。铁皮石斛的药用部位是富含生物碱和多糖等有效成份的直立茎,DoSUT1基因在石斛茎中的丰度较高,意味着其可能主要调节茎中糖转运与贮存;叶中的高丰度表达特征说明DoSUT1基因在库器官糖转运中发挥一定作用。
目前,SUC/SUTs蛋白在多种植物中均有研究,也发现SUC/SUTs蛋白在植物生命活动中具有多种重要作用。随着人们对多糖功效的不断认识,也加强了人们对SUC/SUTs蛋白的高度关注,目前对其研究多限于模式植物和含糖量较高的植物,而对于药用植物的研究较少。药用植物药用部位糖分转运与积累必定和SUT密切相关。本研究后续将利用RNAi或过量表达技术研究DoSUT1基因在铁皮石斛蔗糖转运以及多糖积累中的生物学功能,为通过遗传工程手段改良铁皮石斛种质奠定基础。
| [1] | Wind J, Smeekens S, Hanson J. Sucrose:metabolite and signaling molecule[J]. Phytochemistry , 2010, 71 (14/15) :1610–1614. |
| [2] | Hill L M, Morley-Smith E R, Rawsthorne S. Metabolism of sugars in the endosperm of developing seeds of oilseed rape[J]. Plant Physiol , 2003, 131 (1) :228–236. DOI:10.1104/pp.010868 |
| [3] | Rolland F, Baena-Gonzalez E, Sheen J. Sugar sensing and signaling in plants:conserved and novel mechanisms[J]. Ann Rev Plant Biol , 2006, 57 :675–709. DOI:10.1146/annurev.arplant.57.032905.105441 |
| [4] | Lorraine E W, Remi L, Norbert S, et al. Sugar transporters in higher plants-a diversity of roles and complex regulation[J]. Trends in plants science , 2000, 5 (7) :283–290. DOI:10.1016/S1360-1385(00)01681-2 |
| [5] | Chen L Q, Hou B H, Lalonde S, et al. Sugar transporters for intercellular exchange and nutrition of pathogens[J]. Nature , 2010, 468 (7323) :527–532. DOI:10.1038/nature09606 |
| [6] | Riesmeier J W, Willmitzer L, Frommer W B. Isolation and characterization of a sucrose carrier cDNA from spinach by functional expression in yeast[J]. EMBO J , 1992, 11 (13) :4705–4713. |
| [7] | Sauer N, Stolz J. SUC1 and SUC2:two sucrose transporters from Arabidopsis thaliana; expression and characterization in baker's yeast and identification of the histidine-tagged protein[J]. Plant J , 1994, 6 (1) :67–77. DOI:10.1046/j.1365-313X.1994.6010067.x |
| [8] | Barker L, Kühn C, Weise A, et al. SUT2, a putative sucrose sensor in sieve elements[J]. Plant Cell , 2000, 12 (7) :1153–1164. DOI:10.1105/tpc.12.7.1153 |
| [9] | Aoki N, Hirose T, Scofield G N, et al. The sucrose transporter gene family in rice[J]. Plant Cell Physiol , 2003, 44 (3) :223–232. DOI:10.1093/pcp/pcg030 |
| [10] | Li F P, Ma C Z, Wang X, et al. Characterization of sucrose transporter alleles and their association with seed yield-related traits in Brassica napus L[J]. BMC Plant Biol , 2011, 11 :168–172. DOI:10.1186/1471-2229-11-168 |
| [11] | Doidy J, van Tuinen D, Lamotte O, et al. The Medicago truncatula sucrose transporter family:characterization and implication of key members in carbon partitioning towards arbuscular mycorrhizal fungi[J]. Mol Plant , 2012, 5 (6) :1346–1358. DOI:10.1093/mp/sss079 |
| [12] | Payyavula R S, Tay K H, Tsai C J, et al. The sucrose transporter family in Populus:the importance of a tonoplast PtaSUT4 to biomass and carbon partitioning[J]. Plant J , 2011, 65 (5) :757–70. DOI:10.1111/tpj.2011.65.issue-5 |
| [13] | Kühn C, Hajirezaei M R, Fernie A R, et al. The sucrose transporter StSUT1 localizes to sieve elements in potato tuber phloem and influences tuber physiology and development[J]. Plant Physiol , 2003, 131 (1) :102–113. DOI:10.1104/pp.011676 |
| [14] | Fotopoulos V, Gilbert M J, Pittman J K, et al. The monosaccharide transporter gene, AtSTP4, and the cell-wall invertase, Atbetafruct1, are induced in Arabidopsis during infection with the fungal biotroph Erysiphe cichoracearum[J]. Plant Physiol , 2003, 132 (2) :821–829. DOI:10.1104/pp.103.021428 |
| [15] | Schneidereit A, Scholz-Starke J, Sauer N, et al. AtSTP11, a pollen tube-specific monosaccharide transporter in Arabidopsis[J]. Planta , 2005, 221 (1) :48–55. DOI:10.1007/s00425-004-1420-5 |
| [16] | Harrison M J. A sugar transporter from Medicago truncatula:altered expression pattern in roots during vesicular-arbuscular (VA) mycorrhizal associations[J]. Plant J , 1996, 9 (4) :491–503. DOI:10.1046/j.1365-313X.1996.09040491.x |
| [17] | 李俊, 王学敏, 董洁, 等. 东方山羊豆蔗糖转运蛋白基因克隆及表达载体构建[J]. 中国草地学报 , 2011, 33 (3) :39–46. |
| [18] | 曾淑华, 文国松, 徐绍忠, 等. 铁皮石斛磷酸烯醇式丙酮酸羧化酶基因的克隆及表达分析[J]. 中草药 , 2012, 43 (4) :766–771. |
| [19] | 陈晓梅, 王春兰, 杨俊山, 等. 铁皮石斛化学成分及其分析的研究进展[J]. 中国药学杂志 , 2013, 48 (19) :1634–1640. |
| [20] | 李标, 唐坤, 张岗, 等. 菌根真菌诱导的铁皮石斛根差减cDNA文库构[J]. 中国药学杂志 , 2012, 47 (22) :1790–1795. |
| [21] | 张岗, 刘思思, 杨新杰, 等. 一个全新的铁皮石斛DoSWEET1基因的分子克隆与特性分析[J]. 药学学报 , 2016, 51 (6) :991–997. |
| [22] | Pfaffl M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res , 2001, 29 (9) :e45. DOI:10.1093/nar/29.9.e45 |
| [23] | Kozak M. An analysis of 50-noncoding sequences from 699 vertebrate messenger RNAs[J]. Nucleic Acids Res , 1987, 15 (20) :8125–8132. DOI:10.1093/nar/15.20.8125 |
| [24] | Braun D M, Wang L, Ruan Y L. Understanding and manipulating sucrose phloem loading, unloading, metabolism, and signalling to enhance crop yield and food security[J]. J Exp Bot , 2014, 65 (7) :1713–1735. DOI:10.1093/jxb/ert416 |
| [25] | 马小龙, 刘颖慧, 袁祖丽, 等. 玉米蔗糖转运蛋白基因ZmERD6 cDNAs的克隆与逆境条件下的表达[J]. 作物学报 , 2009, 35 (8) :1410–1417. |
| [26] | Shiratake K. Genetics of sucrose transporter in plant[J]. Genes, Genomes Genomics , 2007, 1 (1) :73–80. |
| [27] | Weise A, Barker L, Kühn C, et al. A new subfamily of sucrose transporters, SUT4, with low affinity/high capacity localized in enucleate sieve elements of plants[J]. Plant Cell , 2000, 12 (8) :1345–1355. DOI:10.1105/tpc.12.8.1345 |
| [28] | Schulze W, Weise A, Frommer W B, et al. Function of the cytosolic N-terminus of sucrose transporter AtSUT2 in substrate affinity[J]. FEBS Lett , 2000, 485 (2/3) :189–94. |
| [29] | Gottwald J R, Krysan P J, Young J C, et al. Genetic evidence for the in planta role of phloem-specific plasma membrane sucrose transporters[J]. Proc Natl Acad Sci USA , 2000, 97 :13979–13984. DOI:10.1073/pnas.250473797 |
 2016, Vol. 47
2016, Vol. 47


