2. 军事医学科学院放射与辐射医学研究所, 北京蛋白质组研究中心, 蛋白质组学国家重点实验室, 北京 102206 ;
3. 军事医学科学院放射与辐射医学研究所 药理毒理研究室, 北京 100850
2. Beijing Proteome Research Center, State Key Laboratory of Proteomics, Beijing Institute of Radiation Medicine, Beijing 102206, China ;
3. Department of Pharmacology and Toxicology, Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
以细胞色素P450酶(CYP)系为主的药物代谢酶参与大部分药物在体内的药理代谢途径[1],此领域日益受到药理和毒理学研究者的重视。美国FDA要求每个新药在临床前研究其代谢的CYP酶亚型[2]。目前,针对中药药物代谢酶传统定量研究方法具体主要有以下3种:基于免疫印迹法的蛋白丰度定量;基于实时定量聚合酶链反应的mRNA丰度检测;基于探针药物法的酶活性测定。CYP酶家族蛋白丰度较低,同源性高,CYP酶家族高度同源,不同亚型的肽段之间存在3~10个氨基酸的差异[3]。免疫印迹法无法对同源性高,缺乏针对特异抗原决定簇抗体的CYP酶亚型进行定量,例如CYP3A1和CYP3A2,CYP1A2和CYP1A1等;mRNA水平无法正确评估相应蛋白水平,2种实验方法分别存在特异性不强、准确度不高、重现性不好等缺点,基于探针药物法的酶活性测定方法只针对几种主要的CYP酶进行研究,罕见的CYP酶亚型极少有相关报道,因此需要建立新的特异性更强的高通量CYP酶丰度测定方法。中药药理研究中,需要建立评估中药单用及配伍对CYP酶影响的高通量方法。MRM技术具有灵敏度高、重现性好、准确度高及通量高的特点[4],联合同位素标记技术能很好地区分这些序列同源性较高的CYP酶亚型并进行定量,QconCAT法[5]是通过重组质粒表达特定设计的重型同位素肽段作为内标肽段,与人工合成重型同位素肽段相比,成本和纯度上具有优势,质谱通过预设候选靶蛋白特异肽段的离子对信息,对符合规则的离子进行信号记录,计算相关离子峰面积,进而计算目标蛋白的丰度[6]。该方法具有成本低、通量高、准确度高的特点。丹参与人参是临床常使用的两味中药,中药十八反理论研究中,丹参与人参是研究“诸参辛芍叛藜芦”理论中两味常见且临床使用频繁的药物,人参常与多种药物配伍使用,如炮制附子、熟地黄、麦冬、白术[7]等;丹参常与三七、冰片、川芎、葛根配伍使用。丹参与人参配伍的药物种类广泛,因此将丹参与人参作为2个工具药物研究其对CYP酶丰度的影响,评估2味药物对CYP酶的调控作用,为临床药物的合理配伍使用提供参考。
1 材料 1.1 动物SPF级Wistar大鼠18只,体质量180~220 g,雌雄各半,由军事医学科学院实验动物中心提供,许可证号SCXK(军)2014-008。
1.2 药品与试剂人参、丹参药材购自河北安国中药材市场,均经军事医学科学院放射与辐射研究所马百平教授鉴定分别为五加科植物人参Panax ginseng C. A. Mey. 的干燥根,唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge. 的干燥根,均符合《中国药典》2015年版规定。色谱级甲酸、乙腈、甲醇购自Merck Millipore公司;碳酸氢铵、十二烷基硫酸钠、甲叉聚丙烯酰胺和丙烯酰胺、甘氨酸、三羟甲基氨基甲烷均购自Amresco公司;质谱级酶切胰酶Tripsin购自美国Promega公司;SILAC Protein Quantitation Kit-DMEM购自美国Thermo fisher公司;二硫苏糖醇(DTT)和碘乙酰胺(IAA)购自美国Sigma公司;蛋白酶抑制剂Cocktail购自Roche 公司(货号04693132001);谷胱甘肽琼脂糖4B购自GE Healthcare;还原型谷胱甘肽购自美国Sigma公司;BCA Protein Assay Kit购自美国Thermo fisher公司。QconCAT质粒由上海捷瑞生物工程有限公司合成,GST质谱级肽段由北京赛百盛基因技术有限公司合成。
1.3 仪器高分辨率质谱仪AB sciex 5500购自Sciex公司,台式离心机购自Thermo Fisher公司;高速低温离心机购自Scilogex公司;超高速离心机购自Beckman Coulter公司;电泳仪、凝胶成像仪器购自Bio-Rad公司;恒温水浴箱购自北京长风仪器有限公司;MX-5型涡旋振荡器购自Scilogex公司;pH计、精密电子天平均购自Mettler Toledo公司;multiskan MK3酶标仪购自Thermo Fisher公司,真空浓缩仪购自Thermo Fisher公司;Speedvac Plus型超声破碎仪购自Ultral Sonics公司;旋转培养器购自海门其林贝尔公司,超纯水仪购自ELGA公司;分光光度计Smart Spec 3000购自Bio-Rad公司;磁力搅拌器购自上海司乐仪器公司。
2 方法 2.1 药材提取及给药取人参或丹参,称质量后加入10倍量水,浸泡90 min后煎煮3次,每次1 h,提取液合并,旋转蒸发浓缩至生药质量浓度为10 g/L;收集,备用。
大鼠随机分成对照组、丹参组、人参组,每组6只。每组大鼠分别ig给药,丹参组和人参组给药剂量均为10 g/kg[8],连续给药7 d。
2.2 肝微粒体的提取给药结束后,大鼠断头处死,将血放净后迅速在靠近门静脉处取出肝脏,通过门静脉注入生理盐水将肝脏内血冲洗干净,后用清洗缓冲液反复冲洗肝脏数遍,用滤纸将水份吸干,称肝脏湿质量,将处理好的肝脏剪成1~2 mm的细小碎块,按1∶3质量体积比加入匀浆液,将匀浆液倒入匀浆器中,转头匀浆至肝组织完全粉碎呈粉红色糊状,将粉碎的肝组织倒入10 mL离心管中,4 ℃,9 000×g,离心15 min,取上清,将上清液4 ℃,100 000×g,离心60 min,弃上清,得到粉红色沉淀,即为肝微粒体,用重悬缓冲液重悬微粒体沉淀,涡旋混匀分装,蛋白定量,−80 ℃冻存。
2.3 QconCAT质粒的设计与生成根据文献报道[9-10]以及Peptideatlas数据库(www.peptideatlas.org)的鉴定信息,选取相关研究较多,丰度相对较高的9种大鼠CYP450蛋白:CYP1A1、CYP1A2、CYP2B1、CYP2B2、CYP2C6、CYP2C11、CYP3A1、CYP3A2、CYP17A1,对这些目标蛋白筛选特异肽段:(1)根据Peptideatlas数据库质谱鉴定结果,剔除含有漏切肽段的肽段,在NCBI数据库中对这些肽段序列进行比对,选取特异性的肽段[11];(2)肽段序列通过genepattern esp-prediction在线软件(http://www.broadinstitute.org/cancer/software/genepattern/proteomics#esp)[12]预测打分,分数越高即代表肽段在质谱中检出效应越高,挑选大于0.5分的肽段,选择能被质谱良好捕捉到的肽段序列。将这些蛋白质对应的特异性肽段串联在一起,并转化为基因序列,将设计好的基因序列插入到pGEX-4T-2载体上[13],QconCAT质粒设计时带上表达GST蛋白标签,将基因序列送往上海捷瑞生物工程有限公司进行合成。
2.4 QconCAT质粒的转化与表达根据文献报道进行质粒转化实验[14],构建表达该基因的大肠杆菌菌体。取1 mL培养液基因测序,甘油保存。吸取20 μL菌液于2 mL氨苄青霉素的LB培养基振荡培养10 h,150 r/min,37 ℃,待细菌生长期到指数期[细菌培养液吸光度(A)值为0.8],吸取10 μL培养液入SILAC DMEM培养基中[富含重稳定同位素标记精氨酸(L-13C6 Arginine)和重稳定同位素标记赖氨酸(L-13C6 lysine)],振荡培养10 h,45 r/min,37 ℃,待细菌生长期到指数期,吸取10 μL到3 mL SILAC DMEM培养基中,45 r/min,37 ℃,A值到1.0后吸取8 μL异丙基硫代半乳糖苷溶液加入到上述细菌培养液,表达3 h后3 000×g离心收集菌体,加入8 μL的蛋白酶抑制剂,500 μL PBS重悬,冰浴中进行超声破碎(超声0.2 s,停1 s,共6 min),至液体澄清后停止,3 000×g离心10 min,取100 μL谷胱甘肽琼脂糖4B,500×g离心5 min,去除上清液,用PBS反复洗涤2次,将裂解液加入到填料中,4 ℃旋转反应2.5 h。500×g离心5 min,取上清,沉淀中加入500 μL PBS洗涤2次。加40 μL洗脱液,室温反应0.5 h。500×g离心3 min,上清保留。上清为纯化蛋白,使用BCA法进行蛋白定量。
2.5 蛋白的酶切和质谱检测分别取纯化蛋白溶液和肝微粒体蛋白溶液50 μL,加入10 μL 100 mmol/L DTT溶液,56 ℃反应0.5 h,后加入10 μL 100 mmol/L IAA溶液暗处反应0.5 h。加入40 μL胰酶酶切工作液涡旋后于37 ℃水浴反应15 h,酶切结束后冻干除盐,配制100 fmol/μL重标QconCAT肽段溶液,溶剂为A液(0.1% FA+水),取大鼠肝微粒体蛋白质20 μL,使用基于超滤辅助样品制备酶切法[15]。取2 μL酶切肽段,加入重标肽段1 μL,用A液溶解至20 μL,待上质谱。上样量5 μL。
2.5.1 色谱条件色谱柱为C18毛细管分析柱(150 mm×75 µm,5µm),流动相A相为乙腈-水-甲酸(2∶98∶0.1),B相为乙腈-水-甲酸(98∶2∶0.1),梯度洗脱程序:0~5 min,95% A;5~65 min,95%~65% A;65~70 min,65%~5% A;70~75 min,95% A;体积流量350 nL/min,柱温55 ℃;进样量5 μL。
2.5.2 质谱条件正离子模式;喷射电压1 900 V,毛细管温度为240 ℃;采用SRM扫描模式:Q1的分辨率设置为0.7(FWHM);Q2的氩气碰撞压力为0.199 5 Pa(1.5 mTorr);Q3的分辨率设置为0.7(FWHM);循环时间为2 s;质谱扫描范围m/z 250~1 250,质谱采集时间为75 min。
2.6 方法的精密度和准确度评估分别配制3个不同质量浓度的GST肽段(IEAIPQIDK)溶液,分别为10、20、100 fmol/μL。加入1 μL上述溶液到3 μL肝微粒体酶切肽段基质溶液中,再加入内标后质谱检测3次,计算质量浓度值的相对标准偏差(RSD)值和相对误差(RE)值[16],考察方法的精密度和准确度。
2.7 质谱数据分析用skyline软件(版本号v 3.5.1.9926)对质谱原始结果wiff文件进行分析,通过目的肽段峰强度,计算 QconCAT蛋白的标记效率,通过目的蛋白肽段的平均丰度计算目的蛋白实际丰度。
2.8 目的蛋白标准曲线的绘制配制QconCAT轻标蛋白梯度样品,分别为2、10、20、50、200、500 fmol/μL,通过定量结果得到每条CYP450特异肽段的定量检测范围和线性方程。用skyline软件进行分析[17],横坐标为轻标QconCAT的上样量,纵坐标为峰面积,绘制标准曲线,计算线性方程和相关系数。
2.9 大鼠肝微粒体目的蛋白丰度测定将1 μg大鼠肝微粒体蛋白酶切产物与50 fmol重标的QconCAT肽段混合,上质谱,用skyline软件进行数据分析。内标重型同位素肽段与样本中轻同位素肽段在质谱同一个保留时间内洗脱流出,通过内标肽段相应的离子峰面积和样本肽段中离子峰面积进行归一化比较,计算肽段相应的实际丰度,相应的蛋白丰度为肽段实际丰度的中位值,共对大鼠模型肝微粒中9种CYP酶亚型蛋白进行定量,分别为CYP1A1、CYP1A2、CYP2B1、CYP2B2、CYP2C6、CYP2C11、CYP3A1、CYP3A2、CYP17A1。
2.10 数据分析对目的肽段定量结果使用skyline软件对峰面积数据进行处理分析,计算QconCAT蛋白的标记效率,通过目的蛋白肽段的平均丰度计算目的蛋白实际丰度[18]。
3 结果与分析 3.1 QconCAT目的蛋白肽段的设计选取的9个蛋白质对应的21条特异肽段,构建2个QconCAT质粒表达目的蛋白。最终选取出的目的蛋白对应的特异肽段见表 1。
|
|
表 1 QconCAT质粒中的目的肽段 Table 1 Selected specific peptide sequences designed in QconCAT plasmids |
3.2 QconCAT肽段离子对的优化
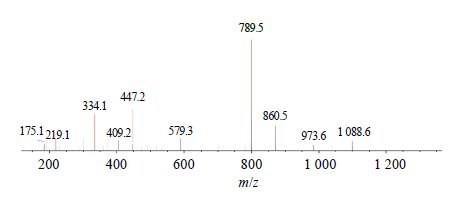
根据前期质谱鉴定信息,针对每条肽段,分别选取信号最强的6个离子对,在质谱上进行验证,选取3个信号最合适的离子对进行定量[19-20]。结果9个蛋白的21条肽段中,被检测到16条,未检测到的肽段多为超过12个氨基酸和含有修饰基团的肽段,检测到的肽段优化后离子对见表 2。以FADLAPIGLPHR为例,二级质谱图见图 1。
|
|
表 2 方法优化后CYP酶的肽段离子对 Table 2 Ion pairs of specific peptide of cypenzyme after optimization |
|
图 1 CYP2B2特征肽段FADLAPIGLPHR的二级质谱图 Fig.1 MS/MS spectra for CYP2B2 specific peptide (FADLAPIGLPHR) |
3.3 方法精密度和准确度的考察
配制3种不同质量浓度的GST肽段溶液(10、20、100 fmol/μL),使用3个浓度样品进行方法定量精确度的考察,用定量方法检测3次,计算浓度值的RSD和RE,具体数据见表 3。低、中、高3个浓度样品的定量RSD在3.11%~5.91%,符合定量要求。
|
|
表 3 GST肽段的定量与方法精确度 Table 3 Quantification of GST peptide and method precision |
3.4 标记效率和标准曲线的考察
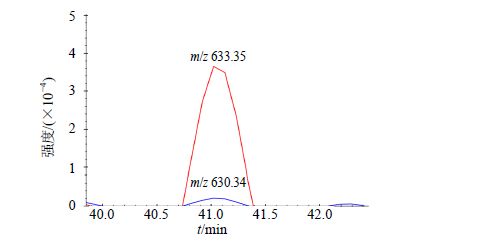
根据标记效率=重标的峰面积/(重标的峰面积+轻标的峰面积)[21-22]分别计算蛋白各肽段的标记效率,以纯化的LSRQGLLQPTK重型同位素标记肽段为例,重标肽段(母离子m/z为633.35)与轻标肽段(母离子m/z为630.34)强度见图 2,20条肽段标记效率均为97%以上,可用于后续实验,具体标记效率结果见表 4,其中16条CYP450特异肽段目的肽段检测丰度与上样量线性关系良好,具体数据见表 5。根据标准曲线定量需要满足在其线性范围内,实验结果显示CYP1A2的肽段NSIQDITGALFK离子对653.8/1 105.6,CYP3A2的肽段DIELDGLFIPK离子对630.3/1 031.5,CYP2C11的肽段IC [CAM] AGEALAR离子对762.9/1 070.6线性范围不好,相关系数(R2)小于0.9,因此在实际计算过程中剔除掉该离子对数据,避免造成干扰。大部分肽段定量曲线呈现很好的线性关系,R2均在0.9以上,满足方法学要求。
|
图 2 QconCAT 重标肽段标记效率 (以LSRQGLLQPTK 肽段为例) Fig.2 Labeling efficiency of QconCAT peptide (LSRQGLLQPTK for exemple) |
|
|
表 4 重标QconCAT肽段的标记效率 Table 4 Labeling efficiency of heavy stable isotope labeled QconCAT peptides |
|
|
表 5 QconCAT肽段的标准曲线信息 Table 5 Standard curves of QconCAT peptides for quantification |
3.5 人参和丹参对大鼠肝脏CYP酶调控作用
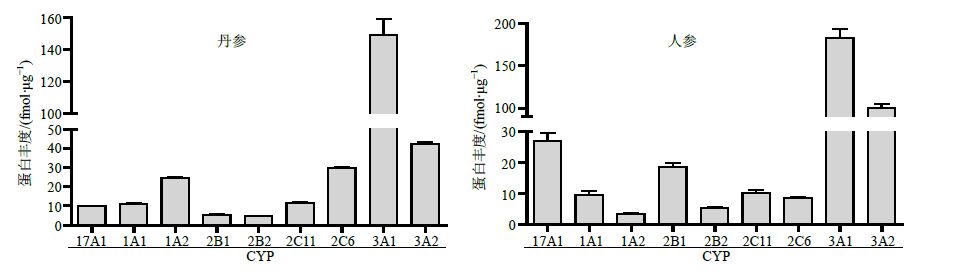
通过skyline软件对数据进行分析并通过标准曲线计算得到丹参作用后大鼠肝脏微粒体中CYP1A1、CYP1A2、CYP2B1、CYP2B2、CYP2C6、CYP2C11、CYP3A1、CYP3A2和CYP17A1平均蛋白浓度分别为10.87、24.34、5.43、4.77、29.73、11.49、149.04、42.19、9.84 fmol/μg;人参作用后的大鼠肝脏微粒体种CYP1A1、CYP1A2、CYP2B1、CYP2B2、CYP2C6、CYP2C11、CYP3A1、CYP3A2和CYP17A1平均蛋白浓度分别为9.62、3.56、18.49、5.60、8.61、10.41、183.01、100.04、27.01 fmol/μg。变异系数(CV)值在25%以内,定量结果见图 3。
|
图 3 丹参与人参作用后大鼠肝脏CYP450蛋白平均丰度 Fig.3 Average abundance of rat liver microsome CYP450 treated with S. miltiorrhiza and P. ginseng |
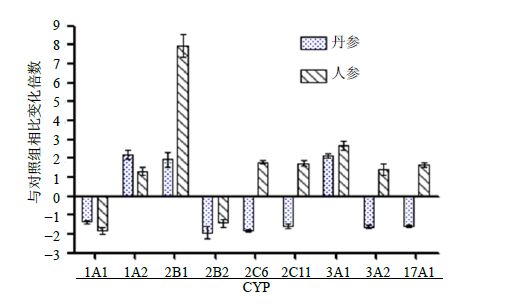
与对照组比较,丹参处理组下调CYP1A1、CYP2B2、CYP2C6、CYP2C11、CYP3A2和CYP17A1蛋白的表达,上调CYP1A2、CYP2B1和CYP3A1蛋白的表达;人参处理组下调CYP1A1和CYP2B2蛋白的表达,上调CYP1A2、CYP2B1、CYP2C6、CYP2C11、CYP3A1、CYP3A2和CYP17A1蛋白的表达。与对照组相比,丹参与人参作用后大鼠肝脏内9种CYP450调控变化见图 4,以CYP2B2肽段FADLAPIGLPH为例,丹参组、人参组与对照组肽段离子对质谱图见图 5。将CYP酶的表达受药物上调或下调调控情况进行归纳总结,结果见表 6。
|
图 4 丹参与人参作用后与对照组肝脏中CYP450丰度比较 Fig.4 Comparison on f CYP450 abundance in liver of rats in control group after administration with S. miltiorrhiza or P. ginseng |
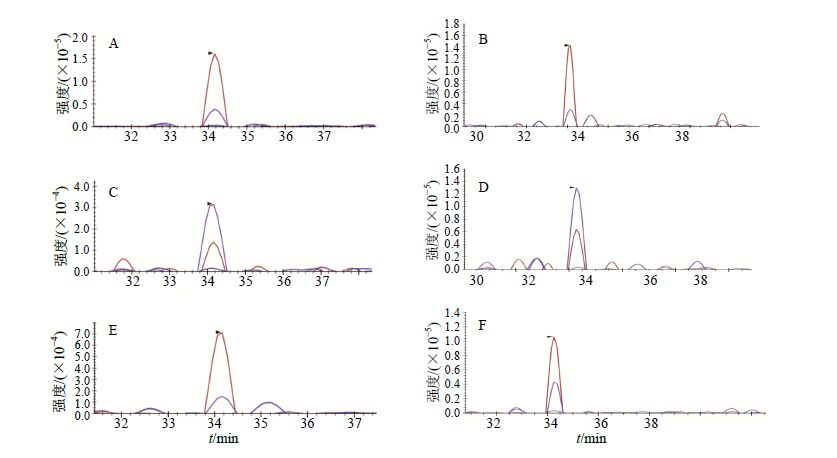
|
A-对照组轻标肽段 B-对照组内标肽段 C-丹参组轻标肽段 D-丹参组内标肽段 E-人参组轻标肽段 F-人参组内标肽段 A-peptide of control B-internal standard peptide of control C-peptide of S. miltiorrhizagroup D-internal standard peptide of S. miltiorrhizagroup E-peptide of P. ginseng group F-internal standard peptide of P. ginseng group 图 5 对照组及丹参与人参作用后肝脏中CYP2B2肽段FADLAPIGLPHR质谱峰强度 Fig.5 MS intensity spectra of CYP2B2 peptide FADLAPIGLPHR in liver of rats in control group after treatment with S. miltiorrhiza or P. ginseng |
|
|
表 6 丹参与人参对大鼠肝药酶CYP450亚型表达调控趋势 Table 6 Regulation impact of S. miltiorrhiza or P. ginseng on subtype expression of rat liver CYP450s isoforms |
4 讨论
通过质谱检测到丹参与人参药物作用前后肝脏CYP酶丰度,可以评估药物作用后对肝药酶的表达产生上调或下调作用,对研究中药的药物相互作用具有重要意义。实验发现丹参与人参对CYP1A1的表达存在下调作用,与前期文献报道一致[23],丹参与人参可上调CYP3A1和CYP3A2蛋白的表达,丹参下调CYP3A2蛋白的表达。虽然丹参与人参同属,但在CYP3A2肝药酶代谢上存在相反作用,两者配伍时需关注由于CYP3A2蛋白引起的药物相互作用。对于CYP1A2,人参作用组和丹参作用组相对对照组蛋白丰度上调接近2倍。CYP2B亚族中,CYP2B1和CYP2B2调控水平存在相反结果,丹参与人参对CYP2B1的表达具有上调效应,但对于CYP2B2的表达具有下调效应。推测CYP2B1与CYP2B2在药物代谢过程中存在互补代偿作用。丹参下调CYP2C6蛋白的表达,与已有报道文献一致[24]。且大鼠源CYP2C6与人源CYP2C9序列相似度高[25],已有报道丹参抑制CYP2C9酶活性[26],从人源到大鼠源推断,相应的调控趋势一致。
药物上调或下调CYP酶表达的机制依然缺乏完整系统的解释原因,最主要的调控机制主要与孕烷X受体(PXR)和组成型雄甾烷受体(CAR)有关,两者是CYP酶表达转录过程中上游蛋白受体,人参可通过结合和激活PXR的表达,从而诱导肝内CYP3A1和CYP3A2转录表达;丹参可能通过抑制PXR的激活,进而下调CYP3A2的表达,人参则通过CAR与视黄酸X受体形成二聚体,诱导CYP2B1转录表达。关于CYP2C11和CYP17A1等相关上游调控机制依然模糊,绝大多数低丰度CYP酶亚型功能报道较少,被诱导或抑制的原因仍有待进一步研究[27]。
丹参与人参同属参类,部分药物代谢酶调控情况一致,但存在不同。心脑血管疾病患者用药时,丹参会与抗凝药物华法林一同服用,丹参下调CYP3A2蛋白的表达,而华法林主要由CYP3A2代谢,因此当丹参与华法林药物同服时,华法林在机体代谢减慢,药物蓄积浓度变高,丹参影响了华法林药物的代谢,所以华法林药物需要酌情减小剂量,避免药物浓度超过治疗窗口阈值。人参是一种具有滋补作用的药物,服用他汀等药物的高血脂患者,会服用人参提高体质。人参上调CYP3A1和CYP3A2两个主要的肝药酶的表达,而他汀类主要经CYP3A家族蛋白代谢,人参的使用诱导了他汀类的代谢,影响他汀类药物的调脂药效,因此应避免两者同时服用或者减少人参用量。由于CYP酶作用产生的影响,是临床配伍用药需要注意的重要事项。不同的药物搭配使用,须避免药物相互作用造成的不良反应。研究药物作用后对CYP酶蛋白丰度的调控作用具有重要意义。实验首次对CYP酶亚型CYP2B1、CYP2B2、CYP17A1丰度进行定量研究,有助于理解其生物功能。本研究在CYP酶参与中药代谢药理研究中产生提示作用。
| [1] | 高月. 基于药物代谢酶的中药毒性研究[J]. 毒理学杂志 , 2007 (4) :282–282. |
| [2] | Hingorani G P, Rhodes S P. 2012 FDA draft guidance for CYP induction of investigational new drug candidates:theory and practice[J]. Drug Metabol Rev , 2012, 44 (9) :78–79. |
| [3] | Deutsch E W. The peptideatlas project[J]. Methods Mol Biol , 2010, 604 (Suppl 1) :285–296. |
| [4] | Bluemlein K, Ralser M. Monitoring protein expression in whole-cell extracts by targeted label-and standard-free LC-MS/MS[J]. Nat Protocol , 2011, 6 (6) :859–869. DOI:10.1038/nprot.2011.333 |
| [5] | Pratt J M, Simpson D M, Doherty M K, et al. Multiplexed absolute quantification for proteomics using concatenated signature peptides encoded by QconCAT genes[J]. Nat Protocol , 2006, 1 (2) :1029–1043. DOI:10.1038/nprot.2006.129 |
| [6] | Peffers M J, Beynon R J, Clegg P D. Absolute quantification of selected proteins in the human osteoarthritic secretome[J]. Int J Mol Sci , 2013, 14 (10) :20658–20681. DOI:10.3390/ijms141020658 |
| [7] | 李孟璇, 孙林, 孟兆青, 等. 人参白术药对配伍前后化学成分变化研究[J]. 中草药 , 2014, 45 (24) :3549–3552. |
| [8] | 王宇光, 高月, 柴彪新, 等. 人参、藜芦合用对大鼠肝P450酶活性及mRNA表达的调控作用[J]. 中国中药杂志 , 2004, 29 (4) :366–370. |
| [9] | Liu X, Hu L, Ge G, et al. Quantitative analysis of cytochrome P450 isoforms in human liver microsomes by the combination of proteomics and chemical probe-based assay[J]. Proteomics , 2014, 14 (16) :1943–1951. DOI:10.1002/pmic.v14.16 |
| [10] | 张丽军, 贾小芳, 尹林, 等. 蛋白质组学方法研究唐草片对微粒体CYP450酶的影响[J]. 中国中药杂志 , 2014, 39 (11) :2136–2139. |
| [11] | Gillette M A, Carr S A. Quantitative analysis of peptides and proteins in biomedicine by targeted mass spectrometry[J]. Nat Methods , 2013, 10 (1) :28–34. |
| [12] | Searle B C, Egertson J D, Bollinger J G, et al. Using data independent acquisition (DIA) to model high-responding peptides for targeted proteomics experiments[J]. Mol Cell Prot , 2015, 14 (9) :2331–2340. DOI:10.1074/mcp.M115.051300 |
| [13] | Chawner R, McCullough B, Giles K, et al. QconCAT standard for calibration of ion mobility-mass spectrometry systems[J]. J Prot Res , 2012, 11 (11) :5564–5572. DOI:10.1021/pr3005327 |
| [14] | Russell M R, Achour B, Mckenzie E A, et al. Alternative fusion protein strategies to express recalcitrant QconCAT proteins for quantitative proteomics of human drug metabolizing enzymes and transporters[J]. J Prot Res , 2013, 12 (12) :5934–5942. DOI:10.1021/pr400279u |
| [15] | Wisniewski J R, Zougman A, Nagaraj N, et al. Universal sample preparation method for proteome analysis[J]. Nat Methods , 2009, 6 (5) :359–362. DOI:10.1038/nmeth.1322 |
| [16] | Turtoi A, Castronovo V. Isotopically labeled proteome as an internal standard for multiple reaction monitoring-based biomarker quantification[J]. Expert Rev Prot , 2012, 9 (3) :245–248. DOI:10.1586/epr.12.27 |
| [17] | MacLean B, Tomazela D M, Shulman N, et al. Skyline:an open source document editor for creating and analyzing targeted proteomics experiments[J]. Bioinformatics , 2010, 26 (7) :966–968. DOI:10.1093/bioinformatics/btq054 |
| [18] | Carroll K M, Simpson D M, Eyers C E, et al. Absolute quantification of the glycolytic pathway in yeast:deployment of a complete QconCAT approach[J]. Mol Cell Prot Mcp , 2011, 10 (12) :293–302. |
| [19] | Schilling B, Rardin M J, MacLean B X, et al. Platform-independent and label-free quantitation of proteomic data using MS1 extracted ion chromatograms in Skyline application to protein acetylation and phosphorylation[J]. Mol Cell Prot , 2012, 11 (5) :202–214. DOI:10.1074/mcp.M112.017707 |
| [20] | 刘喜东, 朱俊, 丛宇婷, 等. 基于蛋白质组学的细胞色素P450和葡萄糖醛酸转移酶亚型绝对定量分析[J]. 分析化学 , 2014, 42 (1) :10–15. |
| [21] | 陆亚丽. 藜芦人参合用对HepG2细胞的增毒效应及肝药酶定量方法的建立[D]. 长沙:中南大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10533-1014144713.htm |
| [22] | Larance M, Bailly A P, Pourkarimi E, et al. Stable-isotope labeling with amino acids in nematodes[J]. Nat Methods , 2011, 8 (10) :849–851. DOI:10.1038/nmeth.1679 |
| [23] | 胡东华, 王宇光, 陈志武, 等. 复方丹参方对大鼠心脏细胞色素P450酶的影响[J]. 中草药 , 2014, 45 (1) :75–80. |
| [24] | 薛清丹, 鞠爱霞, 王鹏, 等. 复方丹参注射液对大鼠肝脏细胞色素P450酶不同亚型的影响[J]. 中国实验方剂学杂志 , 2015, 21 (14) :71–76. |
| [25] | Daniel W A, Haduch A, Syrek M, et al. Direct and indirect interactions between antidepressant drugs and CYP2C6 in the rat liver during long-term treatment[J]. Eur Neuropsychopharmacol , 2006, 16 (8) :580–587. DOI:10.1016/j.euroneuro.2006.01.004 |
| [26] | 徐斌, 赵刚, 位华, 等. 20味中成药对5个人肝微粒体酶活性的影响[J]. 药学实践杂志 , 2009, 27 (5) :353–356. |
| [27] | Luo G, Cunningham M, Kim S, et al. CYP3A4 induction by drugs:correlation between a pregnane X receptor reporter gene assay and CYP3A4 expression in human hepatocytes[J]. Drug Metabol Disp , 2002, 30 (7) :795–804. |
 2016, Vol. 47
2016, Vol. 47


