2. 江苏省中医药研究院 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028
2. Key Laboratory of New Drug Delivery Systems of Chinese Materia Medica, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
丹参为鼠尾草属植物丹参Salviae miltiorrhiza Bunge的干燥根或根茎,具有活血调经、祛瘀止痛、凉血消痈、清心除烦等功效。丹参水溶性物质丹酚酸组分含丹参素、原儿茶酸、原儿茶醛、迷迭香酸、丹酚酸B等近20种成分。药理研究表明,丹酚酸组分有较强的抗氧化活性及对脑缺血有明显的保护作用[1-2],但其治疗脑缺血的物质基础尚未明确。如何从丹酚酸组分中筛选出作用于中枢神经系统(CNS)的活性成分是丹酚酸组分研究的关键问题。
血脑屏障(blood-brain barrier,BBB)是存在于血液和脑组织间的一道生理屏障,对于维持脑的内环境稳定具有重要作用。BBB严格控制血与脑之间物质的交换,对血液中的物质进入脑内有一定的选择和限制,BBB的存在限制了绝大多数药物进入脑或在脑内达不到治疗所需的有效浓度,增加了CNS疾病的治疗难度。在药物化学百科数据库中有超过7 000种药物,其中仅有5%的药物可跨越BBB从血液进入脑内,用于治疗CNS疾病[3],因此,药物通过BBB进入脑脊液,对CNS疾病的治疗将起到积极的作用[4]。
口服药物治疗CNS疾病的前提是有效成分可以被吸收入血,进而作用于脑部位。研究表明,大鼠ig给予丹参水溶性成分后,可在血液中检测到丹参素、原儿茶酸、原儿茶醛、紫草酸、丹酚酸B[5-7];宋敏等[8]研究了ig给药后原儿茶醛和丹酚酸B在大鼠体内的药动学,证明其吸收良好;沈保家[9]研究了咖啡酸和异阿魏酸ig给药后在大鼠体内的药动学行为,证明其在体内生物利用度较低;孙士丰[10]在大鼠ig迷迭香酸后的血浆里检测到迷迭香酸。这些研究结果表明丹参水溶性的丹酚酸组分经po给药能够吸收入血,但是否能够透过BBB,以及具体哪些成分能透过BBB还尚未阐明。故本实验旨在发现丹酚酸组分中能够透过BBB的活性成分,为丹酚酸组分临床用于治疗CNS疾病提供理论依据。
研究中药对BBB的干预作用及其作用机制可以为中医药治疗脑部疾病提供理论基础,目前体内实验很难从细胞或分子水平研究药物的吸收机制,而且研究所需耗药量较大、周期长,不适合药物的早期筛选过程。因而,建立方便快捷的体外药物筛选模型对于研究中药对BBB的干预作用和分析透过BBB的中药活性成分具有重要的意义。本实验采用人脑微血管内皮细胞(HBMEC)、人星形胶质细胞(HA)共培养体系建立作用于CNS疾病药物的BBB筛选模型,从丹酚酸组分中筛选分析透过BBB模型的活性成分,进一步采用LC-MS技术对得到的丹酚酸活性成分进行分析鉴定,对开发作用于CNS疾病新药的筛选以及对中药及复方制剂药效物质基础的明确及质量标准的制定具有一定的意义。
1 材料 1.1 仪器二氧化碳培养箱(Thermo Electrom公司);Labconco Purifier Class II生物安全柜(Biosafety Cabinet);XDS-1B倒置显微镜(重庆留辉科技有限公司);ZW-A型微量振荡器、HH-4数显恒温水浴锅(常州国华电器有限公司);LDZX-50K型立式压力蒸汽灭菌器(上海申安医疗器械厂);LC-MS液相色谱-质谱联用系统(Agilent1100,美国Agilent公司);Bruke Q6000MS(德国Bruke公司);METTLERAL204十万分之一天平(梅特勒-托利多仪器有限公司);高速冷冻离心机(美国Beckman公司);Milli-Q纯水机(美国Millipore公司);电热恒温干燥箱(上海博泰实验设备有限公司);微量移液器(Thermo公司,美国);细胞计数器(XB-K-25,1/400 mm2);24孔板微孔底膜细胞插板(PET膜,1 μm,Millipore公司);Millicell-ERS跨膜电阻仪(美国Millipore公司)。
1.2 细胞来源人脑微血管内皮细胞(HBMEC,货号1000)、人星形胶质细胞(HA,货号1800)均购自广州吉妮欧生物科技有限公司。
1.3 药品与试剂丹酚酸组分(总酚酸质量分数≥80%,批号140714,西安鸿生生物技术有限公司);对照品丹参素钠(批号14030108)、迷迭香酸(批号14020115)、紫草酸(批号14052702)、原儿茶酸(批号14030209)、咖啡酸(批号14030510)、异阿魏酸(批号14072308),均购于成都曼思特生物科技有限公司,质量分数均≥98%。RPMI 1640培养基、DMEM培养基、胰蛋白酶-EDTA消化液(南京凯基生物发展公司);MTT(美国Sigma公司);胎牛血清(Gibco公司,美国);DMSO(美国Sigma公司);NaCl、KCl、Na2HPO4、Na2HPO4·H2O 、KH2PO4(南京化学试剂有限公司)。
2 方法与结果 2.1 体外BBB模型的建立 2.1.1 细胞培养HBMEC的培养:复苏细胞,加入RPMI 1640完全培养基(含10%胎牛血清、谷氨酰胺0.8 g/L、青霉素80 U/mL、链霉素0.08 mg/mL),置37 ℃、5% CO2培养箱中培养,第2天换液,以后每2 d换液,至细胞长至90%传代。HA的培养:复苏细胞,加入DME M低糖完全培养基(含10%胎牛血清、谷氨酰胺0.584 g/L、青霉素80 U/mL、链霉素0.08 mg/mL),置37 ℃、5% CO2培养箱中培养,第2天换液,以后每2 d换液,至细胞长至90%传代。
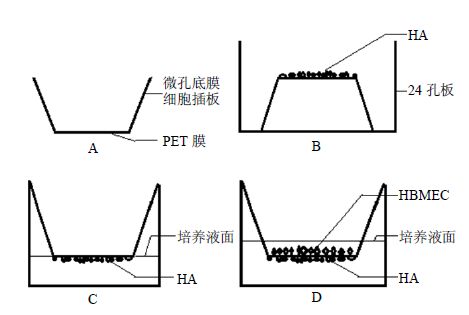
2.1.2 HBMEC/HA共培养将微孔底膜细胞插板(图 1-A)倒置于24孔板中,取生长状态良好的HA,用胰酶将其消化并调整细胞密度至5×105个/mL,接种于倒置的细胞插板的多聚酯膜上,每孔接种80 μL,置37 ℃、5% CO2、相对湿度90%的培养箱中依靠表面张力培养,如图 1-B所示。4 h后待HA细胞贴至多聚酯膜上后将细胞插板按正常位置于24孔细胞培养板中,在小室的外侧加入400 μL DMEM完全培养基培养,如图 1-C所示,2 d换液1次。培养2 d后,取生长状态良好的HBMEC,用胰酶将其消化并调整细胞密度至1×105个/mL,接种于细胞插板的上层,每孔加入RPMI 1640完全培养基400 μL,保证细胞插板内外两侧液面相等,如图 1-D所示,2 d换液1次。每天在固定的时间用Hanks平衡盐溶液(HBSS)替换培养液,用Millicell-ERS电阻仪测定共培养体系的跨内皮细胞电阻(transendothelial electrical resistance,TEER)值[11],同时用倒置相差显微镜观察2种细胞在膜上的生长情况。以加入HBSS溶液至没有生长细胞的Millicell悬挂小室作为空白对照,平行3个实验。
|
图 1 HBMEC/HA共培养示意图 Fig.1 Schematic diagram of coculturing HBMEC/HA |
2.1.3 渗漏实验
选择镜下细胞完整融合的模型作为实验组,同时设无细胞接种的插板为空白对照。
实验开始时向细胞插板中添加培养液,使插板与接收池的液面差为0.5 cm,置37 ℃、5% CO2、相对湿度90%的培养箱中培养4 h后观察液面改变情况,如果插板内外液面差无明显改变,说明HBMEC和HA细胞已经充分融合,可以将其作为BBB体外模型。此渗漏实验结果为阳性,反之判为阴性。
2.1.4 统计学处理实验过程中所有数据均采用SPSS 16.0进行处理,并且各组间数据比较采用t检验,用x±s表示。
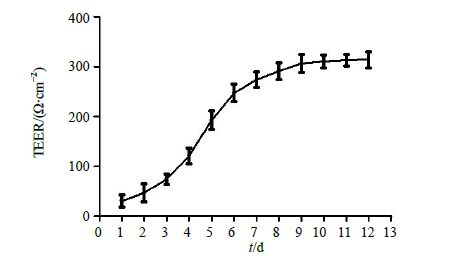
2.1.5 TEER的测定与共培养时间优化选择渗漏实验阳性的插板进行测试。将培养板取出培养箱,并在室温下平衡温度1 h,测试按照Millicell-ERS使用指南,测定体外BBB模型中的TEER。以动态TEER峰值作为判断内皮细胞紧密连接形成的标准。TEER测量=TEER实测-TEER空白,考虑面积影响因素,校正后公式为TEER=TEER测量/S,S为插板底膜面积(24孔插板底面积是0.3 cm2)。用Millicell-ERS电阻仪测定的共培养体系TEER的结果见图 2。TEER值反映的是小离子通透物理屏障的电阻抗,被公认为是测定BBB完整性最精确和敏感的指标[12]。通过测量TEER值反映细胞间紧密连接及BBB模型通透性的改变,当TEER值达到一定程度时,即表明细胞单层膜形成。由图 2可见,TEER在前3 d增加非常缓慢。这时细胞分裂但尚未达到融合;4 d后随着细胞开始融合,TEER急速增加,到第9天达到300 Ω/cm2左右;而后缓慢增加,到第12天基本上仍维持在300 Ω/cm2左右[13, 14]。故选择共培养10 d的体系作为BBB药物筛选模型。
|
图 2 共培养体系中TEER随时间变化曲线 (x±s,n = 8) Fig.2 Variation curve of TEER with time in co-cultured system (x±s,n = 8) |
2.1.6 荧光素钠通透性的测定
采用荧光酶标仪测定荧光素钠0.004、0.02、0.1、0.5、1.0 mg/L分别在激发波长420 nm和发射波长545 nm处的荧光强度,每个样品测定3次,取平均值绘制荧光素钠标准曲线。根据文献报道[15]方法测定并计算荧光素钠体外透过BBB模型的量。选取TEER测定值稳定的模型,测试在37 ℃条件下进行。设实验组和空白对照组(插板中不接种细胞),每组设3个平行插板。首先在接收池中加入800 μL Hanks液,在供给池中加入300 μL含有荧光素钠10 mg/L的Hanks液,置37 ℃、5% CO2、相对湿度90%的培养箱中培养1 h后,从接收池中取300 μL溶液,在同样的激发波长和发射波长下测定荧光强度,再通过荧光素钠标准曲线,计算荧光素钠透过BBB模型的透过率及无细胞对照组的透过率。根据公式计算清除体积(清除体积=CA×VA/CL,CA为接收池质量浓度;VA为接收池体积;CL为供给池初始质量浓度)。以清除体积为纵坐标(Y),以时间(X)为横坐标作图,其斜率表示清除率(μL/min),记作相应的通透性(P)×表面积(S)。荧光素钠体外透过BBB模型的通透性×表面积(PSe)可由以下公式计算得到:1/PSe=1/PSt-1/PSf,其中PSt表示实验组的通透性×表面积,PSf表示无细胞的细胞插板对照组的通透性×表面积,S为微孔底膜细胞插板的膜面积。
从荧光素钠标准曲线得出,荧光素钠质量浓度(X)与荧光强度(Y)的线性关系良好,回归方程为Y=14 417 X+153.25,R2=0.999 9。以荧光素钠在BBB模型中的清除体积对时间(min)作图,得到回归方程为Y=0.516 7 X,荧光素钠在共培养体系中60 min的清除体积为(31.01±5.38)μL;荧光素钠在无细胞对照组中清除体积与时间的回归方程为Y=1.466 7 X,荧光素钠在无细胞体系中60 min的清除体积为(88.20±8.59)μL,通过公式1/PSe=1/PSt-1/PSf即可计算出荧光素钠跨体外BBB模型的渗透系数为(2.659±0.730)×10−3 cm/min,与文献报道的范围相近[15-16]。
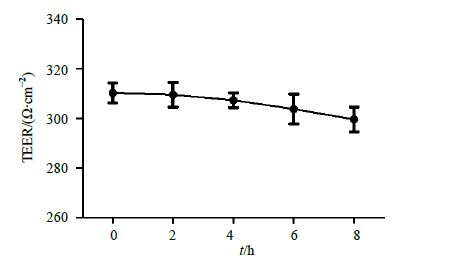
2.1.7 BBB模型的稳定性考察BBB模型经完整性评价合格后,吸去细胞插板内外的培养基,在插板的内外分别加入300、800 μL的HBSS液,置于37 ℃、5% CO2、相对湿度90%的培养箱中培养。分别于0、2、4、8 h时测定TEER值。结果(图 3)显示,BBB模型在HBSS液中4 h内TEER值均在340 Ω/cm2左右,表明该细胞模型在HBSS溶液中至少能稳定4 h,可以满足药物透过性实验时细胞模型稳定性要求。
|
图 3 HBMEC/HA共培养体系稳定性 (x±s,n = 6) Fig.3 Stability of co-cultured HBMEC/HA system (x±s,n = 6) |
2.2 丹酚酸组分样品的制备
精密称取丹酚酸组分2.0 mg,置于50 mL量瓶中,用HBSS溶液定容,混匀,过0.22 μm微孔滤膜,即得丹酚酸组分样品溶液。
2.3 对照品溶液的制备分别精密称取丹参素钠、原儿茶酸、咖啡酸、异阿魏酸、迷迭香酸、紫草酸对照品适量,置于10 mL量瓶中,用甲醇定容至刻度,摇匀,用0.45 μm微孔滤膜滤过,取滤液,即得对照品溶液。
2.4 丹酚酸组分活性成分的筛选HBMEC/HA共培养10 d后,取TEER值符合要求的模型进行实验,用37 ℃预热的HBSS缓冲盐溶液平衡共培养体系30 min[17](加药池300 μL,接收池800 μL)后,吸去插板内外的HBSS溶液,向加药池内分别加入丹酚酸组分样品溶液300 μL,向接收池加入不含药物的空白HBSS溶液800 μL,保持插板内外液面一致。将加好药物溶液和空白HBSS溶液的24孔板微孔底膜细胞插板置于转速为50 r/min的37 ℃恒温摇床中。在60 min时吸取接收池溶液300 μL,同时补足相应的HBSS溶液。实验重复3次,分别将所吸取的样品于离心机中离心15 min(15 000 r/min),取上清,进行HPLC图谱分析和LC-MS分析。
2.5 HPLC色谱分析 2.5.1 色谱条件Hedera ODS-2色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-1.5%甲酸水溶液(B),梯度洗脱程序:0~6 min,5%~13% A;6~13 min,13%~15% A;13~25 min,15%~18% A;25~34 min,18%~21% A;34~50 min,21%~25% A;50~60 min,25%~62% A;体积流量1.0 mL/min;检测波长286 nm;进样量10 μL。
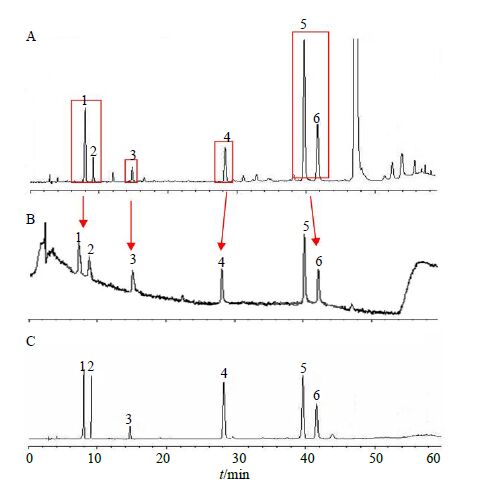
2.5.2 丹酚酸组分及透过BBB活性成分分析分别取对照品溶液、丹酚酸组分样品溶液和丹酚酸组分通过BBB模型筛选液适量,按照“2.5.1”项条件进样测定,进行HPLC分析,得到HPLC图谱,见图 4。色谱图可见丹酚酸组分通过BBB模型筛选后得到的成分较筛选前明显减少,结果显示有6个丹酚酸成分可以穿越BBB模型,丹酚酸组分中量较低的成分如原儿茶酸可以透过体外BBB模型,组分中量较高的成分如丹酚酸B却不能透过BBB模型,这一现象说明BBB模型对所穿越的化合物具有一定的选择性,且选择性不基于化合物浓度的高低。多次重复性实验得到相同的筛选结果,说明建立的体外BBB模型具有良好的重复性和稳定性。
|
1-丹参素 2-原儿茶酸 3-咖啡酸 4-异阿魏酸 5-迷迭香酸 6-紫草酸 1-danshensu 2-protocatechuic acid 3-caffeic acid 4-isoferulic acid 5-rosmarinicacid 6-lithospermic acid 图 4 丹酚酸组分样品溶液 (A)、丹酚酸组分通过BBB模型 筛选液 (B) 和对照品溶液 (C) 的HPLC色谱图 Fig.4 HPLC of total salvianolic acids components (A), drug candidates transfering across BBB (B),and reference substances (C) |
2.6 活性成分鉴定 2.6.1 质谱条件
电喷雾离子化源(ESI源)负离子模式,干燥气为N2,体积流量8.0 L/min,干燥气温度325 ℃,检测电压4 000 V,雾化气电压为241.325 kPa(35 psi),扫描范围为m/z 100~1 085。
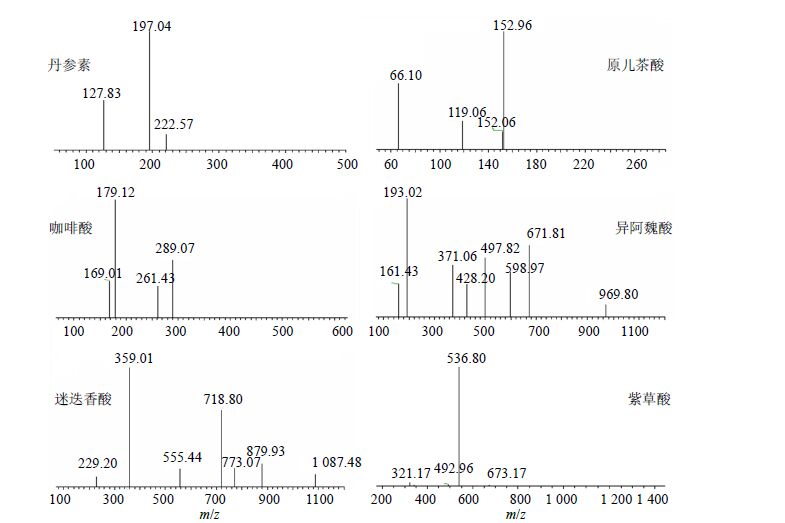
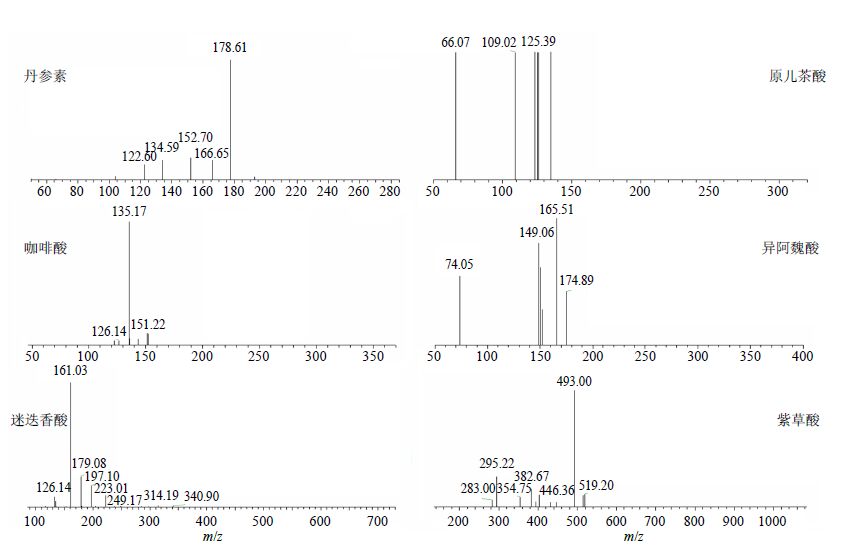
2.6.2 透过BBB成分鉴定用ESI/MS在负离子模式下对能够穿越BBB模型的丹酚酸组分活性成分进行鉴定,质谱图见图 5和6。根据分子离子峰及其特征碎片确定可能分子量,并与文献报道[18-21]的成分结构进行对照,识别出6个成分,分别为丹参素、原儿茶酸、咖啡酸、异阿魏酸、迷迭香酸、紫草酸。
|
图 5 BBB模型筛选的丹参活性成分一级质谱图 Fig.5 Product ion mass spectra of [M-H]− of active components of total salvianolic acids |
|
图 6 BBB模型筛选的丹参活性成分二级质谱图 Fig.6 Product ion mass spectra of [M-H]− of active components of total salvianolic acids |
6个成分解析如下:色谱峰1的保留时间(tR)为8.112 min,确认为丹参素,m/z 197.04为 [M-H]−峰(图 5),178.61为 [M-H-18]−碎片,152.70为 [M-H-44]−碎片(图 6);色谱峰2的tR为8.907 min,确认为原儿茶酸,m/z 152.96为 [M-H]−峰(图 5),109.02为 [M-H-44]−碎片(图 6);色谱峰3的tR为15.106 min,确认为咖啡酸,m/z 179.12为 [M-H]−峰(图 5),151.22为 [M-H-28]−碎片,135.17为 [M-H-44]−碎片(图 6);色谱峰4的tR为29.860 min,确认为异阿魏酸,m/z 193.02为 [M-H]−峰(图 5),174.89为 [M-H-18]−碎片,165.51为 [M-H-28]−碎片,149.06为 [M-H-44]−碎片(图 6);色谱峰5的tR为40.914 min,确认为迷迭香酸,m/z 359.01为 [M-H]−峰(图 5),340.90为 [M-H-18]−碎片,314.19为 [M-H-44]−碎片,249.17为 [M-H-110]−碎片(图 6);色谱峰6的tR为43.013 min,确认为紫草酸,m/z 536.80为 [M-H]−峰(图 5),519.20为 [M-H-18]−峰,493.00为 [M-H-44]−峰,446.36为 [M-H-91]−峰(图 6)。
2.7 正辛醇-水体系分配系数的测定为了进一步从理论上验证丹酚酸组分透过体外BBB模型进行活性成分筛选的可靠性,采用测定化学成分在正辛醇-水体系分配系数,判定其脂溶性大小,也可以初步预测该成分能否透过BBB。按照文献报道[22]方法测定6个化合物的正辛醇-水体系分配系数(logP)。作为治疗CNS疾病的药物分子,正辛醇-水体系logP不小于−2,不大于5[23]。筛选鉴定出来的丹参素、原儿茶酸、咖啡酸、异阿魏酸、迷迭香酸和紫草酸的正辛醇-水体系logP分别为−0.312、1.101、1.310、1.321、1.487、1.758,均符合CNS药物分子的特征。
3 讨论目前检测药物通过BBB的方法按其实验对象主要分为4大类:动物活体检测、离体脑组织检测、体外BBB模型检测、建立数学模型来虚拟筛选。体外BBB模型在很多实验中取代活体动物,省时省力,且能够模拟体内生理状态,在细胞水平研究药物分子通过BBB的吸收、代谢和转运过程,在研究药物通过BBB的动力学方面得到广泛应用。
本实验采用HBMEC/HA共培养建立了模拟药物体内生物活性表达过程的体外药物筛选BBB模型[24]。应用多聚酯膜孔径为1 μm的细胞共培养池,可以使HA的足突通过微孔与HBMEC更充分地直接接触[25],更加接近在体解剖特征,诱导内皮细胞表达BBB特征。同时,孔径为1 μm的Millicell多聚酯膜的特点是在倒置相差显微镜下呈透明状态,可以清晰观察到PET膜上下两侧细胞的生长状态和单细胞层的形成。与采用体内BBB转运药物实验相比,建立体外BBB模型操作条件易于控制,具有较好的实验重现性,且简单、快速、经济,在CNS药物的早期高通量筛选研究方面具有广泛的应用前景。但体外BBB模型也有缺点,它只能作为药物穿越BBB的初步筛选方法,至于化合物通过BBB后产生何种生物效应,需要进一步的体外或体内药理实验验证。
中药在治疗CNS疾病方面有其独特的优势,如标本兼治、副作用小等。某些中药中所含的复杂化学成分可进入以脑为主的CNS,发挥治疗作用。对于中药现代化研究,建立体外BBB模型可以为复杂中药体系中高通量筛选作用于CNS的活性成分提供技术支撑,为提高中药对CNS疾病的治疗作用及治疗CNS类疾病中药的进一步开发提供研究思路。在注重分子水平和细胞水平上研究中药作用的物质基础的今天,体外BBB细胞模型结合LC-MS分析技术有望在中药现代化研究中发挥重要作用。
| [1] | 吴继超, 王彬, 田振, 等. 丹酚酸B对异丙肾上腺素所致乳鼠心肌细胞肥大的保护作用[J]. 中草药 , 2013, 44 (17) :2422–2426. |
| [2] | 贺亚龙, 高焱, 郭晓贤. 丹参多酚酸治疗急性脑梗死的临床研究[J]. 现代药物与临床 , 2016, 31 (9) :1354–1359. |
| [3] | Pardridge W M. Blood-brain barrier drug targeting:the future of brain drug development[J]. Mol Interv , 2003, 3 (2) :90–105. DOI:10.1124/mi.3.2.90 |
| [4] | 张鑫, 汪宁, 晋齐中. 中药及复方通过血脑屏障的研究概况[J]. 亚太传统医药 , 2012, 8 (1) :171–172. |
| [5] | 恽菲, 狄留庆, 李俊松, 等. 复方丹参制剂多组分口服吸收及其相互影响研究的思考[J]. 中草药 , 2011, 42 (10) :2135–2138. |
| [6] | 罗世英, 钟志国, 林坚涛, 等. 丹参水提物在灌胃大鼠血浆和脑组织中浓度测定及药代动力学研究[J]. 中药药理与临床 , 2009, 25 (4) :44–47. |
| [7] | 王小平, 白吉庆, 杨东华, 等. 丹红注射液中迷迭香酸、紫草酸、丹酚酸B在大鼠血浆中的浓度测定[J]. 中国新药杂志 , 2011, 20 (24) :2475–2478. |
| [8] | 宋敏, 杭太俊, 张正行. 丹参提取物有效成分在大鼠体内的药代动力学和相互影响研究[J]. 药学学报 , 2007, 42 (3) :301–307. |
| [9] | 沈保家. 升麻质量评价及药代动力学研究[D]. 南京:南京中医药大学, 2014. |
| [10] | 孙士丰. 丹参中活性成分迷迭香酸的代谢研究[D]. 哈尔滨:黑龙江中医药大学, 2008. |
| [11] | Nazer B, Hong S, Selkoe D J. LRP promotes endocytosis and degradation, but not transcytosis, of the amyloid-β peptide in a blood-brain barrier in vitro model[J]. Neurobiol Dis , 2008, 30 (1) :94–102. DOI:10.1016/j.nbd.2007.12.005 |
| [12] | 陈雪, 王军, 王伟, 等. 体外血脑屏障模型的建立及功能测定[J]. 卒中与神经疾病 , 2014, 21 (4) :195–202. |
| [13] | Lu W, Tan Y Z, Hu K L, et al. Cationic albumin conjugated pegylated nanoparticle with its transcytosis ability and little toxicity against blood-brain barrier[J]. Int J Pharm , 2005, 295 (1/2) :247–260. |
| [14] | 张水华, 季龙凤, 马璟. 非接触式共培养体外血脑屏障模型的跨膜电阻及通透性[J]. 中国药理学与毒理学杂志 , 2012, 26 (6) :882–887. |
| [15] | 赵康峰, 王翀, 孔建, 等. 不同血脑屏障模型的建立及其功能特点[J]. 环境与健康杂志 , 2012, 29 (2) :127–130. |
| [16] | Liu X, Tu M, Kelly R S, et al. Development of a computational approach to predict blood-brain barrier permeability[J]. Drug Metab Dispos , 2004, 32 (1) :132–139. DOI:10.1124/dmd.32.1.132 |
| [17] | 胡绍英. 丹参酚酸体内代谢规律及其穿透血脑屏障特性研究[D]. 南京:南京中医药大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10315-1014416751.htm |
| [18] | Liu A H, Guo H, Ye M, et al. Detection, characterization and identification of phenolic acids in Danshen using high-performance liquid chromatography with diode array detection and electrospray ionization mass spectrometry[J]. J Chromatogr A , 2007, 1161 (1/2) :170–182. |
| [19] | Liu A H, Lin Y H, Min Y, et al. Development of the fingerprints for the quality of the roots of Salvia miltiorrhiza and its related preparations by HPLC-DAD and LC-MSn[J]. J Chromatogr B , 2007, 846 :32–41. DOI:10.1016/j.jchromb.2006.08.002 |
| [20] | 侯鹏飞, 宿树兰, 刘汉清, 等. 液相色谱-质谱联用技术在中药方剂现代研究中的应用进展[J]. 药学与临床研究 , 2008, 16 (2) :129–133. |
| [21] | 王晓明, 张帆, 刘莹, 等. LC-MS/MS法测定升麻中咖啡酸、阿魏酸、异阿魏酸含量的研究[J]. 天津中医药 , 2014, 31 (17) :686–689. |
| [22] | 薛璟, 贾晓斌, 谭晓斌, 等. 雷公藤甲素表观油水分配系数的测定及其对吸收预测的研究[J]. 中国药学杂志 , 2009, 44 (20) :1560–1563. |
| [23] | Hitchcock S A, Pennington L D. Structure-brain exposure relationships[J]. J Med Chem , 2006, 49 (26) :7559–7583. DOI:10.1021/jm060642i |
| [24] | Kuo Y C, Lee C L. Methylmethacrylate-sulfopropyl-methacrylate nanoparticles with surface RMP-7 for targeting delivery of antiretroviral drugs across the blood-brain barrier[J]. Colloids Surf B Biointerfaces , 2012, 90 :75–82. |
| [25] | Demeuse P, Kerkhofs A, Struys-Ponsar C, et al. Compartmentalized coculture of rat brain endothelial cells and astrocytes:a syngenic model to study the blood-brain barrier[J]. J Neurosci Methods , 2002, 121 (1) :21–31. DOI:10.1016/S0165-0270(02)00225-X |
 2016, Vol. 47
2016, Vol. 47


