2. 四川大学药学院, 四川 成都 610041
2. West China School of Pharmacy, Sichuan University, Chengdu 610041, China
鸢尾苷元(tectorigenin,TG)是从鸢尾属Iris L. 植物的根茎中提取得到的一种异黄酮类化合物,化学名为5,7,4′-三羟基-6-甲氧基异黄酮。在古代就有使用鸢尾属植物射干入药的记载。TG作为其中的活性化合物之一,迄今为止已有大量的药理活性方面的报道,包括抗炎[1]、抗病毒及抗菌[2-3]、清除自由基[4]、抗动脉粥样硬化[5-6]、雌激素样作用[7],潘静[8]在对TG抗肿瘤作用进行研究后发现,TG可以抑制人胃癌细胞株SGC7901的增殖,有望开发成为抗肿瘤药物或者抗肿瘤治疗辅助药物。虽然TG具有上述广泛的药理活性,但是经实验室前期考察发现TG的溶解性较差,在水中及油中溶解度均低,属于生物药剂学分类(BCS)第IV类药物。此类药物若制成普通固体口服剂型,经口服后,胃肠道内的溶出和吸收都可能成为其疗效发挥的限制性因素,导致在临床应用中存在一些潜在的弊端,因此如何改善TG溶解性是其成药性的关键,而广泛的药理活性使TG得到了越来越多的关注,成为研究热点。
自微乳制剂即口服自微乳释药系统(self micro- emulsifying drug delivery system,SMEDDS)是由天然或合成油相,固态或液态表面活性剂,另外可能再加入增溶剂/助溶剂制成的各向同性混合物[9-11]。SMEDDS与普通乳剂相比更稳定,而且生产成本低,制备技术简单、重现性强,具备提高药物吸收速度及程度从而改善口服生物利用度的潜力[12-15]。本课题拟从改善TG的生物药剂学缺陷出发,利用自微乳增溶能力强并能促进透膜吸收的优势进行剂型设计,使用D-optimal设计来优化处方,对制备出的TG-SMEDDS进行质量评价,并与原料药在体外的溶出速率进行对比,对TG-SMEDDS在体内的吸收情况进行预测。该设计思路可为难溶性的异黄酮类、萜类、生物碱等天然化合物的成药性评估甚至进一步的新药研发提供新的方法和研究模式。
1 仪器与材料85-2控温磁力搅拌器,常州普天仪器制造有限公司;KQ5200B超声波清洗器,昆山市超声仪器有限公司;LC-20AT高效液相-泵、CTO-10Asvp高效液相-柱温箱、SPD-10Avp高效液相-紫外可见光检测器、AUW 120D电子天平,日本Shimazu公司;ZP-200振荡器,江苏太仓市实验设备厂;pHSJ-3F型酸度计,上海精密科学仪器有限公司;TGL-16高速离心机,上海安亭科学仪器厂;Zetasizer nano激光粒度仪,英国Malvern公司;RO/DI digital实验室纯化水系统,上海和泰仪器有限公司;DV-C数显黏度计,美国Brookflield公司;H-600透射电子显微镜,日本Hitach公司。
TG对照品,批号A0201,质量分数≥98%,成都曼斯特生物科技有限公司;TG-SMEDDS,实验室自制,批号20141114,载药量1.99%;批号20141115,载药量1.93%;批号20141116,载药量1.96%;TG供试品,实验室自制,批号20130914,质量分数98.5%;油酸乙酯,GC测得质量分数75.0%,批号F126003,阿拉丁试剂有限公司;中链甘油三酯(labrafac,批号141469)、丙二醇单辛酸酯(Capryol 90,批号144603)、单亚油酸甘油酯(Masine 35-1,批号141597)、辛酸癸酸聚乙二醇甘油酯(Labrasol,批号144789)、二乙二醇单乙基醚(Transcutol HP,批号143339),法国嘉法狮公司;薏苡仁油,批号HS-131201,广州合诚三先生物有限公司;大豆油,药用级,铁岭北亚药用油有限公司;聚氧乙烯醚氢化蓖麻油(Cremophore RH40),德国巴斯夫公司;磷酸,成都高新区石羊化学制剂厂,分析纯;聚乙二醇400(PEG 400),天津博迪化工股份有限公司;丙三醇,天津市永大化学试剂有限公司;甲醇,美国Honeywell Burdick & Jackson公司,色谱纯。
2 方法与结果 2.1 TG-SMEDDS的制备工艺TG-SMEDDS的具体制备步骤:称取处方量的乳化剂、助乳化剂及油相于烧杯中,室温条件下磁力搅拌均匀,即得空白SMEDDS;最后在空白SMEDDS中加入规定量的TG原料药(相当于载药量20 mg/g),继续搅拌至溶液澄清透明,即得TG- SMEDDS。
2.2 TG-SMEDDS定量测定方法的建立及验证 2.2.1 对照品储备液的制备取TG对照品适量,置于50 mL量瓶中,加甲醇溶解并定容,即得TG质量浓度为485.4 μg/mL的对照品储备液。
2.2.2 色谱条件色谱柱为Kromasil C18柱(250 mm×4.6 mm,5 μm);流动相为水(磷酸调pH至3.0)-甲醇(30∶70);体积流量0.7 mL/min;检测波长268 nm;柱温35 ℃;进样量20 μL。
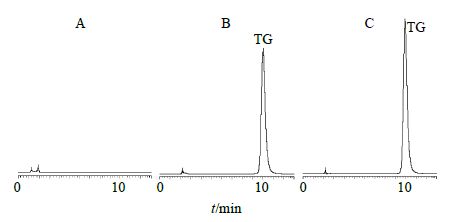
2.2.3 专属性考察将各备选辅料及溶解有TG的辅料溶液,用适量甲醇分别稀释后作为空白辅料溶液及供试品溶液,另取适量TG质量浓度为485.4 μg/mL的对照品储备液,按照“2.2.2”项色谱条件进样进行检测,选取有代表性的3张色谱图如图 1所示,结果表明,在本色谱条件下,TG的保留时间约为10.0 min,峰形良好,各辅料对药物TG测定无干扰。
|
图 1 空白 (A)、对照品 (B) 和样品 (C) 的HPLC图谱 Fig.1 HPLC of specificity of blank solution (A),reference substance (B),and sample (C) |
2.2.4 系统适应性试验
在本色谱条件下,TG峰的理论塔板数均>3 000,拖尾因子在1.10~1.20,分离度>1.5,可满足样品的测定要求。
2.2.5 线性关系考察精密吸取质量浓度为485.4 μg/mL的TG对照品储备液适量,分别用甲醇稀释成质量浓度为48.54、24.27、9.71、2.43、0.24 μg/mL的系列标曲工作液。进样测定后,以TG质量浓度(X)对测得峰面积积分值(Y)进行线性回归,得到标准曲线方程为Y=383 509 X+27 606,r=0.999 7;表明在本方法中TG在0.24~48.54 μg/mL与测得峰面积积分值有较好的线性关系。按信噪比3∶1稀释标曲样品测定,结果表明检测限为1 ng。
2.2.6 供试品溶液的制备取TG-SMEDDS约0.5 g,精密称定,置50 mL量瓶中,用甲醇稀释至刻度后得供试品溶液。
2.2.7 准确度与精密度试验制备空白SMEDDS,分别加入低、中、高质量浓度TG对照品溶液,用甲醇溶解并稀释制得低、中、高质量浓度分别为2.43、9.71、24.27 μg/mL的供试品溶液。按“2.2.2”项下色谱条件进样测定,记录峰面积,计算得到低、中、高质量浓度供试品溶液的平均回收率分别为(101.23±1.89)%、(99.66±0.84)%、(100.14±0.64)%(n=3)。1 d内连续测定6次,计算日内精密度,得到RSD分别为1.86%、0.84%、0.63%(n=6);连续测定5 d,计算日间精密度,得到RSD分别为0.75%、0.49%、0.28%(n=5)。表明方法准确度和精密度良好。
2.2.8 稳定性试验取TG-SMEDDS(含TG 24.27 μg/mL)约0.5 g,精密称定,制备供试品溶液,分别于制备后0、2、4、8、12、16、24 h按照“2.2.2”项下色谱条件进样进行测定,记录峰面积并计算得到其RSD为0.33%,结果表明供试品溶液室温放置至少能稳定24 h。
2.2.9 重复性试验取TG-SMEDDS(含TG 24.27 μg/mL)约0.5 g,精密称定,平行制备6份供试品溶液,按照“2.2.2”项下色谱条件进样分析,结果显示TG平均质量分数为19.81 mg/g,RSD为0.45%,表明重复性较好。
2.3 TG在不同辅料中的平衡溶解度考察及乳化剂筛选分别量取中链甘油三酯、Capryol 90、丙三醇、Cremophore RH40、油酸乙酯、大豆油、Masine 35-1、薏苡仁油、Labrasol、PEG400及Transcutol HP各5 mL置具塞离心管中,加入过量的TG供试品,涡旋混合5 min后,于室温下置摇床中振荡72 h,使溶解达平衡。将各样品于12 000 r/min离心5 min,移取上清液至EP管中,用甲醇稀释后按照前述色谱条件进样测定。TG在不同辅料中的溶解度测定结果分别为(1.231±0.044)、(12.280±0.028)、(0.232±0.004)、(6.892±0.152)、(0.575±0.035)、(0.234±0.009)、(0.762±0.018)、(0.115±0.007)、(9.968±0.045)、(7.749±0.041)、(29.797±0.287)mg/mL(n=3)。根据TG在不同辅料中的溶解度测定结果,选择Capryol 90作为油相,Labrasol及Cremophore RH40作为备选乳化剂,Transcutol HP作为助乳化剂。
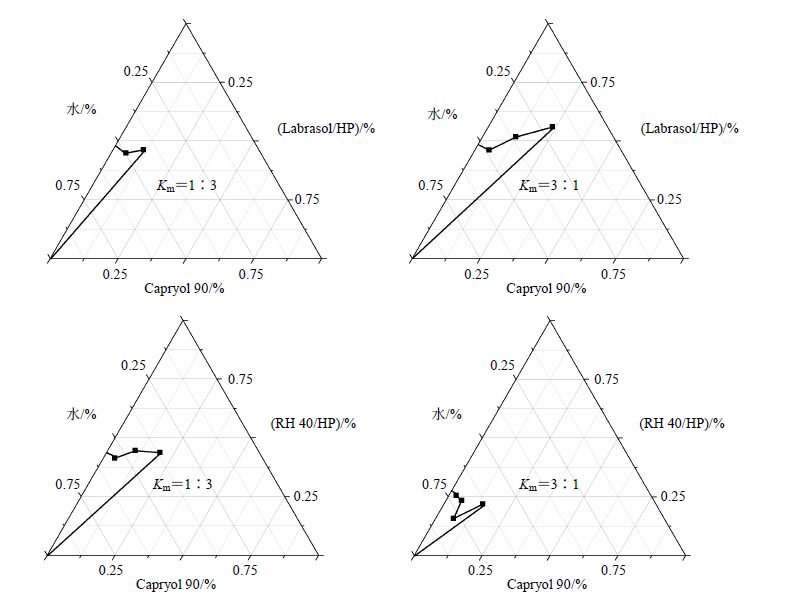
有文献报道,在以Capryol 90为油相,Trancutol HP为助乳化剂时,Cremophore RH40更易与其形成微乳[16],根据参考文献方法[13-16],称取适量的乳化剂Cremophore RH40、Labrasol至烧杯中,与适当比例的助乳化剂Trancutol HP混匀,得到混合乳化剂[乳化剂与助乳化剂的质量比(Km)分别为3∶1、2∶1、1∶1、1∶2、1∶3],按照混合乳化剂与油相质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1的比例分别加入油相Capryol 90,室温下磁力搅拌使均匀。然后边搅拌边滴加蒸馏水,观察并记录体系由浊到清或由清到浊变化的临界点,并记录临界点时各组分的百分比,以油相、水、混合乳化剂为顶点绘制伪三元相图。当混合乳化剂比例越大时越能与更多比例的油相形成微乳,结果如图 2所示。由伪三元相图结果可明显看出,在使用相同油相与助乳化剂,相同Km值及油水比例的条件下,Cremophore RH40能与更多比例的油相形成微乳,成微乳能力优于Labrasol,故选择Cremophore RH40为最终处方的乳化剂进行下一步的处方筛选。
|
图 2 使用不同乳化剂制备伪三元相图 Fig.2 Pseudo-ternary phase diagrams with different surfactants |
2.4 绘制三元相图确定各组分的用量范围
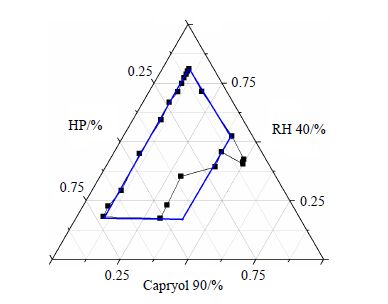
称取适量的Cremophore RH40至烧杯中,与适当比例(Km=8∶1、7∶1、6∶1、5∶1、4∶1、1∶4)的Trancutol HP混匀,按照混合乳化剂与油相质量比1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1的比例分别加入油相Capryol 90,室温下磁力搅拌使均匀,记录成微乳时各组分的用量百分比。以油相、乳化剂、助乳化剂为顶点绘制三元相图,将成微乳时各组分的百分比绘制在三元相图中,连接各临界点,得到成微乳区域。结果如图 3所示,根据矩形框各顶点上3种组分的坐标值确定各组分的百分比用量范围。由三元相图数据可得到各组分的范围分别为Cremophore RH40 17.4%~79.9%,Capryol 90 10.9%~40%,Transcutol HP 9.2%~57.2%。
|
图 3 三元相图中的成微乳区域 Fig.3 Ternary phase diagram with microemulsion existence region |
2.5 处方优化
使用实验设计软件Design-Expert 8.0.6,选择D-optimal设计,由软件给出各实验处方如表 1所示。现以平衡溶解度、稀释后粒径及多分散系数(PDI)为考察指标进行实验,并记录结果如表 1所示,用于最佳处方预测。
|
|
表 1 TG-SMEDDS的D-optimal设计方案及结果 Table 1 D-optimal design and results for TG-SMEDDS |
2.6 最优处方确定
分别对各响应指标与各试验点的百分质量比进行回归方程的拟合,得到最适回归方程类型及方差分析结果。
当响应指标为粒径时,其最适回归方程为3次方程,方程具体为粒径=−2 484.614 20 C-433.542 39 R+2 308.058 79 H+5 150.671 95 CR+6 272.652 81 CH-2 119.535 11 RH-20 486.593 26 CRH+12 776.005 02 CH(C-H)+4 138.827 10 RH(R-H),其中C表示油相Capryol 90所占质量分数,R表示乳化剂RH40所占质量分数,H表示助乳化剂HP所占质量分数。
当响应指标为PDI时,其最适回归方程为2次方程,方程具体为PDI=0.988 46 C+0.306 20 R+1.958 73 H-4.445 46 CH-3.749 99 RH。
当响应指标为溶解度时,其最适回归方程为2次方程,方程具体为溶解度=−122.419 07 C+39.323 90 R+245.167 79 H+337.929 94 CR-406.222 38 RH。
理论上,应当选择对TG溶解度最大的处方,以确保制剂具有最大的载药量。在本课题的实际操作过程中发现,当助乳化剂用量增加时,TG的溶解度明显增大,但同时处方在稀释时更易析晶产生沉淀,或者导致处方稀释后粒径及PDI过大,无法满足纳米制剂的粒径要求。因此,在进行处方优化时,选择PDI及稀释后粒径最小为最优先满足指标,溶解度最大为次优先满足指标,经软件拟合给出最优处方各组分百分比分别为Capryol 90 13.0%,Cremophore RH40 47.7%,Transcutol HP 39.3%,预测该处方对TG的最大溶解度为44.00 mg/g,载药量为20 mg/g时,稀释后的粒径为13.69 nm,PDI为0.114。
2.7 TG-SMEDDS的初步质量评价 2.7.1 TG-SMEDDS的外观及微观形态本研究自制的TG-SMEDDS外观呈均一透明黄色液态,稍黏。取适量用纯水稀释后,滴加至覆盖有碳膜的铜网上,用2%磷钨酸负染色10 min,晾干后置透射电子显微镜(TEM)下对其微观形态进行观察(由于TEM观测对象为负染色后晾干得到的微乳痕迹而非液态微乳,因此只能用于微乳微观形态观察,不能用于粒径大小分析),所得结果如图 4所示。由图可见,TG-SMEDDS在遇水稀释后,形成的微乳呈圆球状,边缘光滑,界限分明,分布较均匀。

|
图 4 TG-SMEDDS透射电镜图 (×200 000) Fig.4 TEM photo of TG-SMEDDS (× 200 000) |
2.7.2 溶解度、Zeta电位、平均粒径及PDI
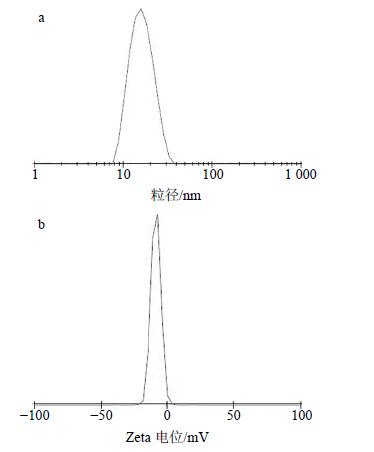
取3批自制样品(批号分别为20141114、20141115、20141116),按照“2.5”项下的最佳处方制备载药量为20 mg/g的TG-SMEDDS,用纯水稀释10倍,使用Zetasizer nano激光粒度仪进行平均粒径、PDI及Zeta电位测定,记录结果,粒径分布及电位测定结果如图 5所示。测得样品的溶解度为(43.43±1.22)mg/g(n=3),Zeta电位为(−12.53±0.80)mV(n=3),平均粒径为(14.95±0.31)nm(n=3),PDI为0.116±0.013(n=3)。并将测得的结果与“2.5”项下的优化处方预测结果进行对比,结果溶解度、平均粒径及PDI的偏差[偏差=(实测值-预测值)/预测值]分别为1.3%、9.2%及1.8%。由上述结果可见,3个指标的预测值均非常接近实验测得值,表明本方法预测准确度较高,可成功应用于SMEDDS的设计与优化。
|
图 5 载药量为20 mg/g的TG-SMEDDS (批号20141114) 用水稀释10倍后的粒径分布 (a) 及Zeta电位图 (b) Fig.5 Size distribution (a) and Zeta potential (b) of TG- SMEDDS (lot. 20141114) containing 20 mg/g TG after being diluted by 10 times of water |
2.7.3 3批TG-SMEDDS样品的定量测定
按照最终处方制备3批TG-SMEDDS(批号201401114、20141115、20141116),分别取适量,置100 mL量瓶中,用甲醇稀释至刻度后按照“2.2.2”项下色谱条件进行定量测定。并计算TG测定量占标示量的百分比。TG-SMEDDS的实际测定量占标示量的(99.03±0.70)%。
2.7.4 稳定性考察取TG-SMEDDS样品(含TG 9.71 μg/mL)适量,分别考察室温放置24 h及−20 ℃放置10 d时样品的稳定性。操作方法同“2.2.8”项。结果室温放置24 h后稳定性RSD为0.55%(n=3),−20 ℃放置10 d后相对偏差(RD)为−0.82%,表明TG-SMEDDS室温放置至少能稳定24 h,−20 ℃放置至少能稳定10 d。
2.8 TG-SMEDDS体外溶出度研究 2.8.1 线性关系考察精密移取TG质量浓度为48.5 μg/mL的对照品储备液适量,用pH 1.2盐酸溶液及pH 6.8磷酸盐缓冲液分别稀释成质量浓度为0.12、0.24、1.21、2.42、4.85 μg/mL的系列对照品溶液,按照“2.2.2”项下条件进样测定,以峰面积为纵坐标(Y),TG质量浓度为横坐标(X)进行线性回归,得到pH 1.2盐酸缓冲液中的标准曲线方程为Y=96 231 X-1 960.8,r=0.999 9;得到pH 6.8磷酸盐缓冲液(PBS)中的标准曲线方程为Y=96 302 X-1 822.4,r=0.999 9。表明TG峰面积与质量浓度在0.12~4.85 μg/mL有良好的线性关系。
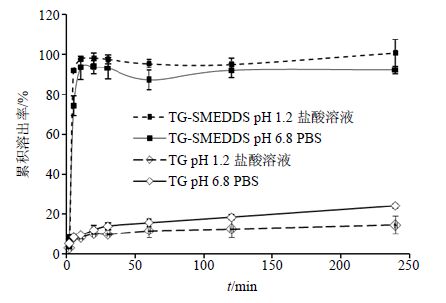
2.8.2 TG-SMEDDS在不同介质中的溶出行为考察及与TG原料药的对比研究按照前述制备方法制备TG-SMEDDS装胶囊,平行制备6份,使每粒胶囊中含TG约7 mg,为供试制剂;另称取适量TG原料药装胶囊,平行制备6份,使每粒胶囊中含TG约7 mg,为参比制剂。按照《中国药典》2015年版四部附录0931溶出度测定第一法,以pH 1.2盐酸溶液及pH 6.8 PBS分别作为溶出介质,转速为100 r/min,水浴温度为(37.0±0.5)℃,分别于2、5、10、20、30、60、120、240 min时取样10 mL,同时在介质中补充等温等体积的溶出介质,立即用0.45 μm微孔滤膜滤过,弃去5 mL初滤液,取续滤液按照“2.2.2”项下条件进样测定,计算出累积溶出率。以取样时间为横坐标,累积溶出率为纵坐标绘制溶出曲线,结果如图 6所示。
|
图 6 TG-SMEDDS及TG原料药在不同介质中的溶出曲线 (n = 6) Fig.6 Cumulative dissolution percentage of TG-SMEDDS and TG in different dissolution media (n = 6) |
由图 6的溶出曲线可见,TG-SMEDDS在2种介质中均可在短时间内达到溶出平衡,10 min的累积溶出率分别为(97.88±0.12)%及(93.38±5.69)%,差异无统计学意义(P>0.05)。2种介质分别模拟了人胃中的酸性环境及小肠中的弱碱性环境,因此由该溶出曲线结果可以预测TG-SMEDDS经口服后可在胃中迅速被稀释成微乳液,且在较长时间内未见药物析出,有利于药物在胃及小肠中的吸收。
TG原料药在2种介质中均较难溶出,240 min时TG原料药在2种介质中的累积溶出率分别仅为(14.45±4.44)%及(23.88±1.18)%,且差异具有统计学意义(P<0.05)。
在2种介质中TG-SMEDDS的溶出速率及累积溶出率均较TG原料药有明显改善,TG原料药由于油溶性及水溶性差的特性导致口服难以吸收,前期研究发现TG原料药口服后的生物利用度仅为11.19%。结合上述结果,将TG制备成TG-SNEDDS后将有望改善其口服吸收情况,使口服生物利用度有望得到提高。
3 讨论乳化剂是O/W型自微乳中所占比例较大的辅料,也是文献报道造成微乳具有慢性毒性及胃肠道刺激性的主要原因[17],关于乳化剂的安全用量范围目前还未有统一的标准,然而本研究所选择的乳化剂Cremophore RH40经查阅《药用辅料手册》[18]和其他文献资料后,表明其大鼠口服半数致死量(LD50)>16.0 g/kg,安全性较高,为制备TG-SMEDDS的最佳乳化剂。
在三元相图的构建过程中,查阅了国内外相关文献后出现了关于微乳区域是否应当包含乳化剂及助乳化剂顶点的疑问[19-21]。实验结果表明,当体系中只有乳化剂Cremophore RH40存在,或油相比例过低(<1∶9)时,会形成黏性较大的凝胶,这一结果也与其他文献中当表面活性剂比例过高会形成凝胶的报道相一致。尽管也有研究表明此凝胶相在进一步稀释后会形成微乳[22],但是由于本研究的最终剂型SMEDDS在进入胃肠道后接触到的胃肠液有限,无法保证是否有足够的胃肠液将凝胶相稀释为微乳,因此在三元相图中的微乳区域未包含乳化剂、助乳化剂顶点及低油相区域。
240 min内TG在pH 6.8 PBS中的累积溶出率要显著大于pH 1.2盐酸溶液(P<0.05),这一结果可能与TG的化学结构有关,其结构中的3个羟基具备给予质子的能力,使TG溶液呈弱酸性,因此在碱性介质中成盐而更易溶解。
本实验结果为TG-SMEDDS在大鼠体内的药动学研究的可行性提供了数据支持。制剂遇水微乳化后的粒径小于50 nm,可以预见其在进入胃肠道与胃肠液接触后也可微乳化形成粒径为纳米级的微乳液,相对于原药物溶液将更易于经肠上皮黏膜吸收进入体循环,从而促进TG的口服吸收,提高TG的口服生物利用度。后期可以设计在体肠吸收及药动学实验来对该制剂的可能吸收作用及机制进行更深入的研究。
| [1] | Conforti F, Rigano D, Menichini F, et al. Protection against neurodegenerative diseases of Iris pseudopumila extracts and their constituents[J]. Fitoterapia , 2009, 80 (1) :62–67. DOI:10.1016/j.fitote.2008.10.005 |
| [2] | 苏妙贤, 李药兰, 周艳晖, 等. 瑶药"野葛花"的抗病毒和抑菌活性[J]. 暨南大学学报 , 2006, 27 (2) :204–208. |
| [3] | Oh K B, Kang H, Matsuoka H. Detection of antifungal activity in Belamcanda chinensis by a single-cell bioassaymethod and isolation of its active compound, tectorigenin[J]. Biosci Biotechnol Biochem , 2001, 65 (4) :939–942. DOI:10.1271/bbb.65.939 |
| [4] | Kang K A, Lee K H, Chae S, et al. Cytoprotective effectof tectorigenin, ametabolite formed by transformation of tectoridin by intestinal microflora, on oxidative stress induced by hydrogen peroxide[J]. Eur J Pharmacol , 2005, 519 (1/2) :16–23. |
| [5] | 王金凤, 杨翠艳, 张艳萍, 等. 鸢尾苷元抗血管平滑肌细胞增殖及抗动脉粥样硬化机制的研究[J]. 解放军药学学报 , 2010, 26 (3) :203–205. |
| [6] | 王金凤, 薄华本, 孟祥颖, 等. 鸢尾苷元对急性心肌梗死小鼠心肌的保护作用[J]. 中国新药与临床杂志 , 2010, 29 (2) :99–103. |
| [7] | Shim M, Bae J Y, Lee Y J, et al. Tectoridin from Maackia amurensis modulates both estrogen and thyroid receptors[J]. Phytomedicine , 2014, 21 (5) :602–606. DOI:10.1016/j.phymed.2013.10.022 |
| [8] | 潘静. 川射干化学成分及体外抗肿瘤活性的研究[D]. 武汉:湖北中医学院, 2009. http://cdmd.cnki.com.cn/article/cdmd-10507-2009157994.htm |
| [9] | Goyal U, Arora R, Aggarwal G. Formulation design and evaluation of a self-microemulsifying drug delivery system of lovastatin[J]. Acta Pharm , 2012, 62 (3) :357–370. |
| [10] | 赵丹丹, 黄挺, 黄绳武. 依托泊苷过饱和自微乳化释药系统的制备工艺及质量评价研究[J]. 中草药 , 2015, 46 (6) :822–831. |
| [11] | 陈小新, 原素, 谢称石, 等. 葛根素自微乳给药系统的制备及其质量评价[J]. 中草药 , 2011, 42 (8) :1512–1516. |
| [12] | Aungst B J. Novel formulation strategies for improving oral bioavailability of drugs with poor membrane permeation or presystemic metabolism[J]. J Pharm Sci , 1993, 82 (10) :979–987. DOI:10.1002/jps.2600821008 |
| [13] | 卢秀霞, 何琳, 陈锦娜, 等. 丹参酮ⅡA口服自微乳的制备及其体外溶出度评价[J]. 中草药 , 2014, 45 (22) :3256–3265. |
| [14] | 王章姐, 胡容峰, 王国凯, 等. Box-Behnken设计-效应面法优化柚皮素自微乳给药系统[J]. 中草药 , 2014, 45 (17) :2461–2466. |
| [15] | 轩肖玉, 王亚静, 张伟玲, 等. 芒果苷自微乳给药系统的制备及其大鼠体内药动学研究[J]. 药物评价研究 , 2013, 36 (3) :166–170. |
| [16] | Goyal U, Arora R, Aggarwal G. Formulation design and evaluation of a self-microemulsifying drug delivery system of lovastatin[J]. Acta Pharm , 2012, 62 (3) :357–370. |
| [17] | 郑俊民. 药用辅料手册[M]. 北京: 化学工业出版社, 2005 . |
| [18] | 张楠, 周宏兵, 全东琴. 自微乳释药系统提高药物生物利用度的机理与应用[J]. 中国医药生物技术 , 2009, 4 (1) :47–50. |
| [19] | 李洪松, 张学顺, 傅春升, 等. 苦参碱自微乳化制剂的制备工艺研究[J]. 中草药 , 2013, 44 (4) :414–419. |
| [20] | 赵岚, 沈駸. 微乳及其应用[J]. 化学教育 , 2006 (2) :3–5. |
| [21] | 刘伟星, 李宁, 高崇凯. 葛根素自微乳化渗透泵控释胶囊的制备[J]. 中草药 , 2013, 44 (12) :1568–1573. |
| [22] | Prajapati H N, Dalrymple D M, Serajuddin A T M. A comparative evaluation of mono-, di-and triglyceride of medium chain fatty acids by lipid/surfactant/water phase diagram, solubility determination and dispersion testing for application in pharmaceutical dosage form development[J]. Pharm Res , 2012, 29 (1) :285–305. DOI:10.1007/s11095-011-0541-3 |
 2016, Vol. 47
2016, Vol. 47


