2. 潍坊医学院药学院, 山东 潍坊 261053 ;
3. 潍坊医学院附属医院 耳鼻喉头颈外科, 山东 潍坊 261031
2. College of Pharmacy, Weifang Medical University, Weifang 261053, China ;
3. 潍坊医学院附属医院 耳鼻喉头颈外科, 山东 潍坊 261031
鼻咽癌(nasopharyngeal carcinoma,NPC)是鼻咽部最常见的上皮细胞恶性肿瘤[1],发病机制不明确,早期结合逆向调强放疗(intensity modulated radiation therapy,IMRT)或氧疗等辅助手段可以提高局部控制率[2],晚期辅助化疗因分子靶向性低、患者依从性及顺应性差等原因,治疗效果不佳[3]。近年来分子靶向治疗鼻咽癌方面开展了多项临床研究[4],但临床常用的抗肿瘤药物价格昂贵且选择性低,在杀伤肿瘤细胞的同时也对机体产生许多严重的毒副作用[5],因此,寻找具有靶向抗肿瘤作用、低毒且高效的新型靶向治疗药物是临床所需。
盐酸小檗碱(berberine hydrochloride,BH)是一种天然生物碱,已知的药理活性包括抗炎、抗胆碱能、抗菌、抗高血压、抗氧化应激和抗包括鼻咽癌在内的多种类型肿瘤活性[6-7],有关BH作为抗肿瘤制剂应用于临床治疗各种晚期癌症的研究受到越来越多的关注[8]。但BH为季胺盐类生物碱,稳定性差,药物剂型及给药方式大多以片剂及im和静脉滴注为主,易被胃肠道中的黏蛋白吸附而影响吸收,生物利用度低,难以达到其发挥药理作用的有效浓度[9];剂量增大易引起过敏性休克、药疹等不良反应,临床应用受到很大限制[10]。因此,研发适用于临床应用的BH制剂以增加BH的稳定性、提高生物利用度、减少给药剂量、降低毒副作用以及实现对肿瘤组织的靶向性和缓控释性尤为重要。
叶酸(folic acid,FA)/FA受体可在多种类型的细胞中高表达,而在正常组织中几乎不表达[11]。利用FA受体能特异性识别配体这种特性,制备针对FA受体的主动靶向制剂以提高药物的靶向性[12-13]。壳聚糖(chitosan,CTS)是一种带正电的天然高分子化合物多糖,来源丰富且价格便宜,具有良好的生物相容性、无毒性、可降解性和生物黏附性,越来越广泛地应用到生物医用材料缓释、靶向给药等领域[14-16]。本研究选用CTS为载体,用离子交联法制备载BH的FA偶联CTS纳米粒(BH/FA-CTS- NPs)(图 1),并优化制备工艺,检测其理化特性及评价其对人鼻咽癌CNE-1细胞的生长抑制及诱导凋亡作用,以期对临床鼻咽癌的治疗提供新的理论依据。
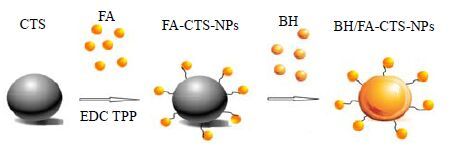
|
图 1 BH/FA-CTS-NPs模式图 Fig.1 Schematic formation of BH/FA-CTS-NPs |
1 仪器与材料
Mastersizer 2000激光粒度分析仪,英国马尔文公司;85-2恒温磁力搅拌器,江苏金坛市环宇科学仪器厂;MCFD5508冷冻干燥机,美国西盟公司;自动酶标仪,美国伯腾仪器有限公司;HNA- 122DTABAI型CO2恒温培养箱,日本三洋公司;EL204型电子天平,梅特勒-托利多仪器有限公司;UV-8000/8000A/8000S双光束紫外分光光度计,Ultraviolet Spectrophotometric,上海元析仪器有限公司;FIIR-650傅里叶变换红外光谱,天津港东科技发展股份有限公司。
CTS,脱乙酰度≥96.5%,山东莱州市海力生物制品有限公司;冰乙酸,分析纯,青岛海滨试剂;BH,200911,质量分数93%,北京华清美恒天然产物技术开发有限公司;磷酸二氢钠、磷酸氢二钠,分析纯,上海化学试剂公司;FA、三聚磷酸钠(TPP)、N-羟基丁二酰亚胺(NHS)、N′-二环己基碳二亚胺(DCC)、无水二甲基亚砜(DMSO),上海阿拉丁生化科技股份有限公司;其余试剂均为分析纯,水为超纯水。CNE-1细胞,北京解放军总医院实验室赠送;胎牛血清,杭州四季青生物技术公司;DMEM培养基,美国Gibco公司;BH/FA-CTS-NPs(自制)以2%冰醋酸溶解,配制母液浓度5 mmol/L,0.45 μm微孔滤膜滤过灭菌,−20 ℃冻存,临用前用细胞培养基稀释至所需浓度。MTT试剂盒、Annenxin V-FITC试剂盒,南京凯基生物试剂有限公司。
2 方法与结果 2.1 BH/FA-CTS-NPs的制备 2.1.1 CTS-NPs的制备[17]称取50 mg CTS溶于1%醋酸溶液中,得到1 g/L CTS醋酸水溶液,用6 mol/L NaOH溶液调pH至5.5,过0.45 μm滤膜。称取适量TPP溶于超纯水配制成1 g/L TPP溶液,过0.45 μm滤膜。持续匀速磁力搅拌作用下,将TPP溶液逐滴缓慢滴入CTS醋酸水溶液中,搅拌20 min,得到具有淡蓝色透明乳光的CTS-NPs。
2.1.2 FA活性酯的制备[18]三乙胺1 mL加入10 mL DMSO中混合均匀,加入FA10 mg避光搅拌过夜。次日,将25 mg DCC和12.5 mg NHS溶解在10 mL DMSO中,两溶液混合后暗处搅拌过夜。加入0.5 mL冰乙酸,继续反应4 h(除去多余DCC)后,静置冷藏0.5 h,抽滤并收集滤液所得即为FA活性酯。
2.1.3 FA-CTS冻干粉末及其纳米粒的制备称取100 mg CTS溶于50 mL 10%的醋酸溶液中,逐滴滴加10.0 mol/L的NaOH将溶液的pH值调至6.0。磁力搅拌下缓慢加入得到的FA活性酯的DMSO溶液(10 g/L),室温下避光搅拌过夜。反应结束后用10 mol/L的NaOH溶液调节pH至9.0,离心并用蒸馏水洗涤数遍,冷冻干燥,得到淡黄色固体粉末即为FA-CTS冻干粉。利用傅里叶变换红外光谱仪,将冷冻干燥的FA-CTS置于室温下KBr压片。同样制备FA、CTS样品作对比。结果见图 2,FA-CTS偶合物是以CTS分子链上质子化的氨基与FA分子结构上脱质子化的羧基之间利用静电作用结合在一起。图中FA-CTS偶合物曲线上1 605、1 462 cm−1出现类似芳环骨架伸缩导致的振动峰波,说明FA与CTS偶合成功。FA的1 706 cm−1羰基峰(-COOH)消失可以说明CTS中的氨基与FA分子的羧基是静电作用相互结合在一起。用FA-CTS代替CTS后按“2.1.1”项方法制备FA-CTS-NPs。
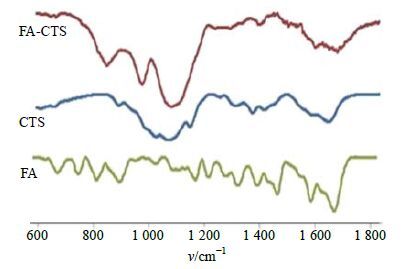
|
图 2 FA-CTS、CTS和FA的红外光谱图 Fig.2 IR spectra of FA-CTS,CTS,and FA |
2.1.4 BH/FA-CTS-NPs溶液的制备[19]
将FA-CTS冻干粉末溶于1%醋酸溶液中得1 g/L FA-CTS溶液。称取处方量BH粉末溶于适量无水乙醇中,超声至完全溶解,得BH无水乙醇溶液。将两者混合,室温持续搅拌下,缓慢加入TPP溶液,搅拌30 min,得到BH/FA-CTS-NPs混悬液。CTS代替FA-CTS后,同样的方法制备BH/CTS-NPs。
2.1.5 正交试验优化BH/FA-CTS-NPs处方在纳米粒的制作过程中,粒径的大小是纳米粒制作成功与否的重要指标之一,在制作出合适粒径的纳米粒之后,再用包封率和载药量等理化特性对所制备的纳米粒进行综合评价[20-21]。本实验以BH为模型药物,前期曾以粒径为指标,通过单因素实验考察各工艺因素对纳米粒粒径的影响后,根据实验过程中得知药物载体比例(BH/FA-CTS)及添加剂(TPP)用量,再以FA-CTS用量(A)、BH用量(B)、交联剂TPP用量(C)为3个因素,每个因素设3个水平,以粒径为筛选指标,L9(34) 正交设计表进行处方优化。正交试验设计及结果见表 1,方差分析见表 2。极差(R)值越大表示该因素的影响越明显,由表 1可知各影响因素的主次顺序为B>C>A;由表 2可知,因素B的影响最具有显著性(P<0.05),因素A、C无显著性;最优处方为A1B1C1,即FA-CTS为0.5 g/L、BH为0.5 g/L、TPP为0.5 g/L。
|
|
表 1 正交试验设计及结果 Table 1 Design and results of orthogonal test |
|
|
表 2 方差分析 Table 2 Analysis of variance |
2.2 BH/FA-CTS-NPs的形态学特征及粒径分布
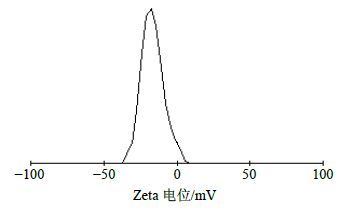
按最优处方量制备得到BH/FA-CTS-NPs。室温下透射电镜(TEM)观察其形态,使用激光粒度分析仪测定其平均粒径、Zeta电位和粒径分散指数(PDI)。所制得的BH/FA-CTS-NPs形态圆整、大小均一,为球类粒子(图 3),平均粒径为(282.4±4.5)nm(n=6)(图 4),Zeta电位为(−17.3±1.2)mV(n=6)(图 5),PDI为0.043±0.016(n=6),粒度分布均匀呈单峰。
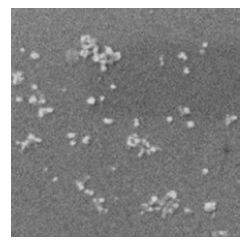
|
图 3 BH/FA-CTS-NPs的TEM图 Fig.3 TEM photogram of BH/FA-CTS-NPs |
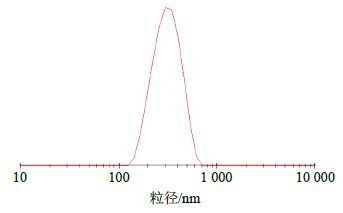
|
图 4 BH/FA-CTS-NPs平均粒径分布 (n = 6) Fig.4 Mean particle size distribution of BH/FA-CTS-NPs (n = 6) |
|
图 5 BH/FA-CTS-NPs的Zeta电位图 (n = 6) Fig.5 Zeta potential of BH/FA-CTS-NPs (n = 6) |
2.3 BH/FA-CTS-NPs包封率、载药量的测定 2.3.1 BH特征吸收波长的选择
称取BH对照品适量,蒸馏水溶解后紫外分光光度仪在200~800 nm进行扫描,得最大吸收波长在421 nm处。
2.3.2 标准曲线的绘制用蒸馏水配制0.5 g/L的BH标准溶液储备液。分别精密移取上述储备液0.2、0.6、0.8、1.0、1.4、1.8 mL,移入50 mL量瓶中定容,即得质量浓度为2.0、6.0、8.0、10.0、14.0、18.0 mg/L的标准溶液供试液。在421 nm波长处分别测定不同质量浓度BH供试液的吸光度(A)值,以A值对质量浓度(C)进行线性回归,回归方程为A=0.013 8 C+0.015 2(R2=0.999 6,n=3),当BH质量浓度在2.21~19.31 μg/mL时,线性关系良好。
2.3.3 BH载药纳米粒的包封率、载药量的测定将制备的BH/FA-CTS-NPs水分散体系,5 000 r/min超速离心20 min。收集上清,定容至50 mL量瓶中,通过紫外可见光光度计测定421 nm下的A值,带入标准曲线计算游离BH的量。BH包封率与载药量分别按下式计算,结果包封率和载药量分别为(89.82±2.91)%和(9.16±1.01)%(n=3)。
包封率=(BH总量-游离BH的量)/BH总量
载药量=(BH总量-游离BH的量)/纳米粒子的量
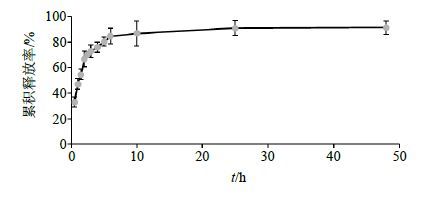
2.4 BH/FA-CTS-NPs中BH的体外释放取一定量BH/FA-CTS-NPs悬液于透析袋中,采用转篮法测BH的体外释放。转速50 r/min,温度(37.0±0.5)℃。释放介质:PBS缓冲液(pH 7.4)。间歇收集释放液2 mL,同时补充等量的释放介质。将收集的释放液稀释,其中BH的定量测定方法见“2.3”项。A值均以未载药微球同样条件下的释放介质为参比。结果见图 6,可以看出BH/FA-CTS-NPs中BH有很好的缓控释作用。BH在最初的几小时内有一个快速释放,0.5 h内累积释放率分别为(32.91±3.91)%,5 h内累积释放率为(80.32± 3.24)%,这可能是吸附于纳米粒表面的药物释放所致,这一特性有利于药物的快速起效;中期的5 h至24 h间接近匀速释放,24 h内累积释放率分别为(90.92±5.21)%,说明包裹在纳米粒内部的BH通过纳米粒中孔隙的扩散所致;24 h后释放非常缓慢,25 h后释放基本结束。
|
图 6 BH/FA-CTS-NPs的体外释放 (PBS pH 7.4,n = 3) Fig.6 Release profile of BH/FA-CTS-NPs (PBS pH 7.4,n = 3) |
药物从骨架型缓控释系统中释放的评价方法不同。Yasir等[22]曾用Higuchi方程进行氟哌啶醇固体脂质纳米粒经鼻入脑的体外药物释放和药物动力学评价,发现一级释放模型和Higuchi方程拟合,且后者能更好地描述壳聚糖纳米粒的体外释放曲线。为了进一步探讨BH纳米粒体外释放机制,采用Higuchi方程拟合其体外释放曲线后发现,BH/FA- CTS-NPs的体外释放标准曲线为Y=0.653 5 X+47.169,R2=0.378 6,表明BH从固体骨架剂载药体系中非匀速释放,遵循单位面积的释放量与时间的平方根成直线关系,具有较好的缓释效果,符合水不溶性骨架的释药性能,适合应用于缓控释药物制剂。
2.5 MTT法测定BH/FA-CTS-NPs对CNE-1细胞的抑制率 2.5.1 细胞培养人鼻咽癌CNE-1细胞株培养于含10%胎牛血清的DMEM培养基中,置于5% CO2细胞培养箱中,恒温37 ℃培养。每1~2 d换液1次,使用0.25%胰蛋白酶消化传代,取对数生长期的细胞进行实验。
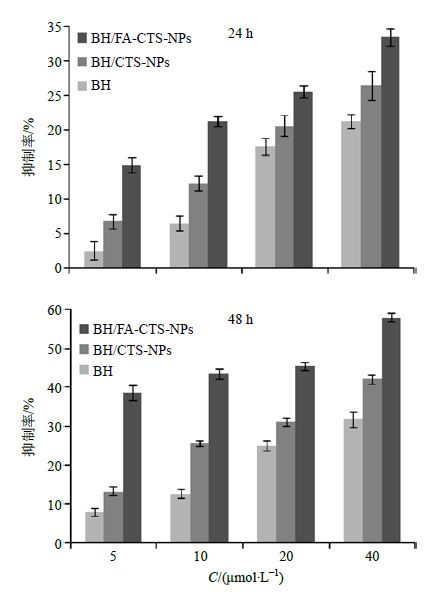
2.5.2 MTT法测定BH/FA-CTS-NPs对CNE-1细胞的抑制率取处于对数生长期的CNE-1,胰酶消化后进行细胞计数并将细胞的浓度调整为1×105个/mL,用新鲜培养液制备成单细胞悬液,按照每孔100 μL接种于96孔板中,放置于37 ℃、含5% CO2的二氧化碳培养箱中培养24 h观察细胞贴壁情况,弃去原培养液,加入不同物质。分组如下:未处理组,只接种细胞;空白对照孔,只加DMSO、MTT培养液,不接种细胞;实验组1,接种细胞并每孔加入含BH浓度为5、10、20、40 μmol/L的BH混悬液50 μL、培养液50 μL,每组设3个复孔;实验组2,接种细胞并加入含BH浓度为5、10、20、40 μmol/L的BH/CTS-NPs 50 μL、培养液50 μL,每组设3个复孔;实验组3,接种细胞并加入含BH浓度为5、10、20、40 μmol/L的BH/FA-CTS-NPs 50 μL、培养液50 μL,每组设3个复孔。同样条件培养24、48 h,取出培养板,每孔加入10 μL新鲜配制含5 mg/mL MTT的培养液,继续培养4 h,弃上清液终止培养,每孔加150 μL DMSO溶解,水平摇床上振荡混匀,未处理孔调零,酶标仪测定波长为490 nm时A值,用下面公式计算药物对细胞的抑制率。结果见图 7。
细胞增殖抑制率=(对照组平均A值-给药组平均A值)/ 对照组平均A值
|
图 7 MTT法测定24 h和48 h时BH/FA-CTS-NPs对CNE-1的增殖抑制作用 (x±s,n = 3) Fig.7 Inhibitory rates of BH/FA-CTS NPs on CNE-1 cells at different time points by MTT (x±s,n = 3) |
由结果可知,各组BH制剂在不同时间作用于CNE-1细胞后,细胞的生长均受到不同程度明显的抑制作用,随着制剂浓度增大,作用时间延长,细胞的生长抑制作用也更为明显,可以看出BH制剂对CNE-1细胞的生长抑制作用具有较明显的量效和时效关系;不同BH制剂对细胞抑制作用也具有明显差异,BH/FA-CTS-NPs对细胞的抑制作用强于BH/CTS-NPs和BH原料药组,这可能是由于FA可以与肿瘤细胞表面的FA受体特异性结合增强了BH对CNE-1细胞的靶向性而导致。
2.6 BH/FA-CTS-NPs对CNE-1细胞迁移能力影响调整细胞浓度为1×107个/mL,吸1 mL细胞悬液接种于6孔板,加入DMEM培养6 h,待细胞呈单层贴壁生长状态时,用10 μL Eppendorf Tip在细胞板上划痕,培养液洗细胞3次,依次加入含BH浓度为20 μmol/L的BH溶液、BH/CTS-NPs、BH/FA-CTS-NPs及0.05% DMSO(对照)组,另设未处理组,每组设3个复孔,放入37 ℃、5% CO2培养箱中培养24 h后,取样并拍照,用Image-Pro Plus 6.0软件测量划痕的距离,计算平均值与标准差。以DMSO组为 对照,进行组间比较。细胞的迁移能力以迁移率表示,结果见图 8。
迁移率=(原划痕宽度-现划痕宽度)/原划痕宽度

|
图 8 BH/FA-CTS-NPs对CNE-1细胞迁移能力的影响 Fig.8 Effectof BH/FA-CTS-NPs on migration of CNE-1 cells |
实验结果显示,未处理组、对照组以及20 μmol/L的BH溶液、BH/CTS-NPs、BH/FA-CTS-NPs处理组在0 h时,划痕距离大体相同。24 h后,未处理组(迁移率100%)与对照组[迁移率(98.00±1.41)%]划痕距离明显缩短,两者相比差异无统计学意义(P>0.05)。而各20 μmol/L的BH制剂处理组划痕距离增宽[BH、BH/CTS-NPs、BH/FA-CTS-NPs组迁移率分别为(58.00±2.24)%、(35.00±2.10)%、(16.00±1.45)%],与未处理组和DMSO组相比迁移率明显降低,差异均有统计学意义(P<0.05)。各BH制剂组间相比较划痕距离差异也具有统计学意义(P<0.05)。
2.7 BH/FA-CTS-NPs对CNE-1细胞凋亡的影响分别收集含BH浓度为20 μmol/L的BH、BH/CTS-NPs、BH/FA-CTS-NPs作用24 h的CNE-1细胞,用胰酶消化,1 000 r/min离心5 min,4 ℃预冷的PBS洗2次,1 000 r/min离心5 min,弃上清收集细胞。另设未处理组和DMSO(对照)组。
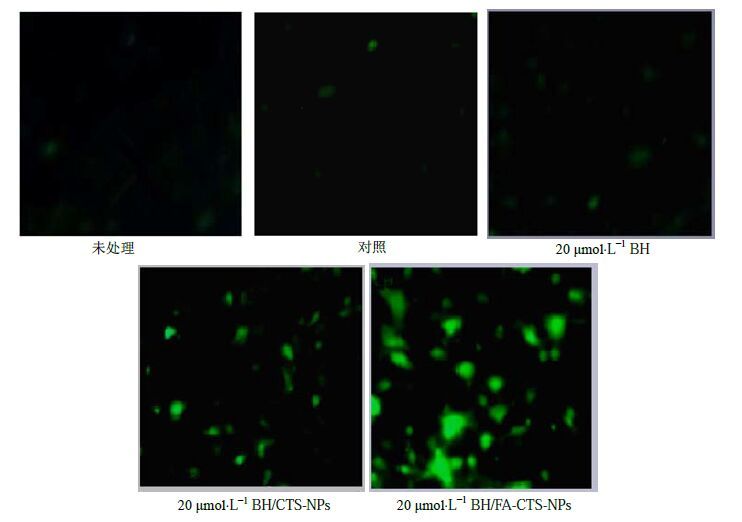
加入250 mL的Binding Buffer重悬细胞,取100 μL的细胞悬液于5 mL流式管中,加入5 μL Annexin V/FITC混匀后室温避光孵育5 min。滴一滴上述细胞悬液于载玻片,盖玻片盖上细胞并将盖玻片倒置后,于荧光显微镜下观察,结果如图 9所示。结果显示,各加药组的细胞凋亡率[BH、BH/CTS-NPs、BH/FA-CTS-NPs组凋亡率分别为(10.36±1.21)%、(28.31±2.07)%、(62.41±2.11)%]比未处理组[(0.13±0.01)%]和对照组[(0.16±0.01)%]明显增高(P<0.05)。在作用24 h,未处理组与对照组细胞凋亡数量较少,两者相比,差异无统计学意义(P>0.05),而各BH制剂处理组凋亡细胞数量与对照组和DMSO组相比明显增加,差异均有统计学意义(P<0.05)。各BH制剂组间相比较凋亡细胞数量差异也具有统计学意义(P<0.05)。且细胞凋亡率的程度与MTT结果一致,证明了实验的可靠性。
|
图 9 BH/FA-CTS-NPs诱导的CNE-1细胞凋亡 Fig.9 Apoptosis in CNE-1 cells induced by BH/FA-CTS-NPs |
3 讨论
本实验通过偶联法制备BH/FA-CTS-NPs。即先制备FA活性酯,与CTS上的氨基反应得到FA-CTS,然后与TPP通过离子交联法制得FA-CTS- NPs,最后用吸附法将抗肿瘤药物BH进行包埋(图 1)。You等[17]用该方法制备了FA修饰靶向抗肿瘤纳米粒的粒径小且形态均匀呈球形,本实验在其方法基础上,优化药物载体比例,所制备的纳米粒粒径在200~400 nm,粒径与之前的研究相比要小且均一。谢黎崖等[18]用离子交联法制备CTS-NPs时发现,在相同条件下粒径的大小随着CTS的相对分子质量增大而变大,本实验前期分别采用3个相对分子质量CTS(1.1×106、9.0×105、6.0×105)进行制备,发现在其他实验条件相同的情况下,CTS相对分子质量越小,所形成的纳米粒粒径越小,这与之前的研究是相同的,且本实验过程中发现,纳米粒的平均粒径越小,包封率相对较大,这可能是因为粒径越小,表面积越大,表面载药或者内部包裹的药物相对增多,这与Kim等[8]对于纳米粒粒径大小的研究相一致。
Cosco等[23]发现纳米粒粒径愈大,被包封于内的药物量愈多,相对释放的量愈少,如果CTS纳米粒的粒径在几十天内未发生变化,只靠药物的缓慢渗透而使药物释放率发生变化很慢,这时需要添加辅酶来帮助释放。而本实验所得纳米粒24 h累积释放率达到90%,说明在无添加辅酶的情况下大部分药物可以完全释放,释放性能较好,较适合制备成缓控释制剂进一步应用于临床研究。Yasir等[22]发现Higuchi方程能更好地描述CTS纳米粒的体外释放曲线,本实验所制纳米粒拟合其体外释放曲线后发现BH从固体骨架剂载药体系中非匀速释放,遵循单位面积的释放量与时间的平方根成直线关系,这种较好的缓释效果符合水不溶性骨架的释药性能,适合应用于缓控释药物制剂。
在比较BH/FA-CTS-NPs、BH/CTS-NPs和BH原料药抑制CNE-1细胞增殖作用之前,先进行预实验筛选出NPs和原料药的有效作用浓度范围及IC50,以此设立BH/FA-CTS-NPs的浓度梯度后,采用MTT法测定不同纳米粒组不同剂量浓度对CNE-1细胞的生长抑制率。与BH原料药和BH/CTS-NPs同浓度组相比较,含BH 20 μmol/L的BH/FA-CTS抑制CNE-1细胞增殖、体外迁移及诱导大量细胞凋亡作用显著,这可能因为纳米级的BH在溶液中的分散性优于普通BH,FA特异性靶向肿瘤表面配体的同时,使得FA-CTS载药NPs更容易附着到更多细胞表面或进入细胞内发挥作用,故而相等的药物浓度中经FA修饰的纳米级药物的作用得到显著提升,说明经FA修饰的载BH纳米粒,具备更好的抗肿瘤转移治疗效果。Li等[24]的研究证明了BH原料药对于CNE-1细胞的抑制作用具有时间和浓度依赖性,而本实验中抑制CNE-1细胞增殖所需要的BH/FA-CTS-NPs中BH的浓度和时间均低于前期的研究报道[25],说明BH/FA-CTS-NPs与单纯原料药BH相比,能更好地抑制CNE-1细胞迁移及促进其凋亡。但本实验未能进一步明确观察FA-CTS/BH-NPs对CNE-1细胞的疗效显著提高是否确切为FA介导所致,这可以通过激光共聚焦,或游离FA竞争抑制等实验技术方法在以后的实验中进一步证实。
| [1] | Segawa Y, Oda Y, Yamamoto H, et al. Close correlation between CXCR4 and VEGF expression and their prognostic implications in nasopharyngeal carcinoma[J]. Oncol Rep , 2009, 21 (5) :1197–1202. |
| [2] | Peng G, Wang T, Yang K Y, et al. A prospective, randomized study comparing outcomes and toxicities of intensity-modulated radiotherapyvs conventional two-dimensional radiotherapy for the treatment of nasopharyngeal carcinoma[J]. Radiother Oncol , 2012, 104 (3) :286–293. DOI:10.1016/j.radonc.2012.08.013 |
| [3] | Fountzilas G, Ciuleanu E, Bobos M, et al. Induction chemotherapy followed by concomitant radiotherapy and weekly cisplatin versus thesame concomitant chemo-radiotherapy in patients with nasopharyngeal carcinoma:a randomized phase Ⅱ study conducted by the Hellenic Cooperative Oncology Group (He COG) with biomarker evaluation[J]. Ann Oncol , 2012, 23 (2) :427–435. DOI:10.1093/annonc/mdr116 |
| [4] | Chen C Y, Zhao C, Gao L, et al. An open-labeled, multicentric clinical study of cetuximab combined with intensity-modulated radiothera-py (IMRT) plus concurrent chemotherapy in locoregionally advanced (LA) nasopharyngeal carcinoma (NPC):a 2-year follow-up report[J]. J Clin Oncol , 2012, 30 (Suppl) :5535–5541. |
| [5] | Chen L, Hu C S, Chen X Z, et al. Concurrent chemoradiotherapy plus adjuvant chemotherapy versus concurrent chemoradiotherapy alone inpatients with locoregionally advanced nasopharyngeal carcinoma:a phase 3 multicentre randomised controlled trial[J]. Lancet Oncol , 2012, 13 (2) :163–171. DOI:10.1016/S1470-2045(11)70320-5 |
| [6] | Tan W, Li Y, Wang Y, et al. Berberine hydrochloride:anticancer activity and nanoparticulate delivery system[J]. Int J Nanomed , 2011, 6 (1) :1773–1777. |
| [7] | 万强, 周凤华, 崔小冰, 等. 小檗碱通过JNK通路降低内脏脂肪素诱导人脐静脉内皮细胞分泌IL-6和TNF-α的研究[J]. 中草药 , 2015, 46 (7) :1012–1017. |
| [8] | Kim S, Oh S J, Lee J, et al. Berberine suppresses TPA-induced fibronectin expression through the inhibition of VEGF secretion in breast cancer cells[J]. Cell Physiol Biochem , 2013, 32 (5) :1541–1550. DOI:10.1159/000356591 |
| [9] | 尤静, 余丽丽, 杨黎燕. 盐酸小檗碱β-环糊精微球的制备及体外释药研究[J]. 应用化工 , 2013, 42 (3) :447–452. |
| [10] | 姚金铭, 宋秀玲, 王焕君. 黄连素(小檗碱)治疗糖尿病肾病疗效和安全性的系统评价[J]. 中华临床医师杂志 , 2015, 9 (13) :4396–4401. |
| [11] | 杜长丽, 顾月清. 叶酸靶向的肿瘤治疗研究进展[J]. 药物生物技术 , 2012, 19 (3) :261–264. |
| [12] | 于莲, 杜妍, 平洋, 等. 叶酸修饰的水飞蓟宾固体脂质纳米粒体内药动学及靶向性研究[J]. 中草药 , 2014, 45 (8) :1110–1114. |
| [13] | 于莲, 杜妍, 田丽华, 等. 叶酸修饰水飞蓟宾固体脂质纳米粒的制备及其对A549细胞抑制作用研究[J]. 中草药 , 2013, 44 (2) :158–164. |
| [14] | Singh T, Vaid M, Katiyar S K, et al. Berberine, an isoquinoline alkaloid, inhibits melanoma cancer cell migration by reducing the expressions of cyclooxygenase-2, prostaglandin E and prostaglandin E receptors[J]. Carcinogenesis , 2011, 32 (1) :86–92. DOI:10.1093/carcin/bgq215 |
| [15] | 张亚会, 李喜香, 包强, 等. 甘草次酸-壳聚糖纳米粒的制备及其质量评价[J]. 中草药 , 2015, 46 (15) :2232–2237. |
| [16] | 潘永毅, 刘强, 蔡保塔, 等. 密闭性中药海绵敷料的制备研究[J]. 中草药 , 2014, 45 (4) :485–489. |
| [17] | You H, Fu S, Qin X, et al. A study of the synergistic effect of folate-decorated polymeric micelles incorporating Hydroxycamptothecin with radiotherapy on xenografted human cervical carcinoma[J]. Colloids Surf B Biointerfaces , 2016, 1 (140) :150–160. |
| [18] | 谢黎崖, 胡权, 吴永良. 叶酸和聚乙二醇双修饰的壳聚糖纳米粒的制备及其性能表征[J]. 中国现代应用药学 , 2013, 30 (3) :284–289. |
| [19] | Kim Y, Park J H, Lee H, et al. How do the size, charge and shape of nanoparticles affect amyloid β aggregation on brain lipid bilayer?[J]. Sci Rep , 2016, 19 (6) :141–153. |
| [20] | 邢志华, 方桂珍, 苏玲, 等. 羟基喜树碱叶酸-壳聚糖纳米粒的制备及其性能研究[J]. 功能材料 , 2012, 43 (1) :322–326. |
| [21] | Haggag Y, Abdel-Wahab Y, Ojo O, et al. Preparation and in vivo evaluation of insulin-loaded biodegradable nanoparticles prepared from diblock copolymers of PLGA and PEG[J]. Int J Pharm , 2015, 30 (499) :236–246. |
| [22] | Yasir M, Sara U V. Solid lipid nanoparticles for nose to brain delivery of haloperidol:in vitro drug release and pharmacokinetics evaluation[J]. Acta Pharm Sin B , 2014, 4 (6) :454–463. DOI:10.1016/j.apsb.2014.10.005 |
| [23] | Cosco D, Cilurzo F, Maiuolo J, et al. Delivery of miR-34a by chitosan/PLGA nanoplexes for the anticancer treatment of multiple myeloma[J]. Sci Rep , 2015, 1 (5) :175–179. |
| [24] | Li C H, Wu D F, Ding H, et al. Berberine hydrochloride impact on physiological processes and modulation of twist levels in Nasopharyngeal Carcinoma CNE-1 cells[J]. Res Art , 2014, 15 (4) :1815–1821. |
| [25] | Eom K S, Hong J M, Youn M J, et al. Berberine induces G1 arrest and apoptosis in human glioblastoma T98G cells through mitochondrial/caspases pathway[J]. Biol Pharm Bull , 2008, 31 (4) :558–562. DOI:10.1248/bpb.31.558 |
 2016, Vol. 47
2016, Vol. 47


