2. 首都医科大学附属北京佑安医院, 北京 100069
2. Beijing You'An Hospital, Capital Medical University, Beijing 100069, China
近年来,随着中草药在全球的广泛应用及药品不良反应监测体系的不断完善,中药、天然药物及其相关制剂药物引起肝损伤的报道呈增加趋势,中草药相关因素引起的药物性肝损伤(drug-induced liver injury,DILI)越来越受到重视[1]。由中草药相关因素引起的肝损伤被称为中草药相关肝损伤(herb-induced liver injury,HILI),是指由中药、天然药物及其相关制剂引发的肝损伤。
由于缺少特异性诊断指标,DILI的准确诊断仍然是国际性难题。目前DILI的临床诊断主要是采用RousselUclaf因果关系评估法(RUCAM)和结构化专家意见诊断系统(Structured Expert Opinion Process,SEOP)[1-2],2015年中华医学会发布了以RUCAM评分法为基础的《药物性肝损伤诊治指南》。限于中草药组成和临床用药的复杂性,在临床实际应用中,常出现国内外现有的DILI诊断标准难以满足HILI诊断需求的现象,致使客观证据不充分而难以准确诊断或诊断不准确等。特别值得一提的是,影响中草药肝损伤诊断的混杂因素众多[3-4],如部分中草药药名混淆(三七和土三七)、质量参差不齐导致中草药混伪劣品存在,有毒物质污染、与化学药联合应用造成HILI的错诊和误诊的发生,中草药成分复杂、多为复方配伍导致中草药肝毒性机制难以阐释明确,另外个体特异性体质的差异等因素,均导致HILI临床确诊尤为困难。根据笔者前期回顾性文献分析,国内外HILI相关临床文献中有相当部分的病例诊断结果均为不确定性结果[5, 6],缺少直接和确凿的客观证据,总体来看准确度和可信度高的HILI临床诊断并不多。HILI诊断不准确可能导致2种后果:(1)本来是HILI但没有及时和准确诊断,不利于临床及时有效对患者进行治疗;(2)本来不是HILI但被误诊为HILI,既误导医生、患者,又误导舆论,不利于中医药事业健康可持续发展。
因此,建立符合中医药特点的HILI诊疗策略与方法,为HILI诊断提供客观、规范的依据,是中药肝损伤评价首先需要解决的关键问题,对于提高HILI诊断水平,减少肝损伤的发生,保证中草药在临床的安全、合理使用以及对促进中医药事业的健康发展具有重要意义。鉴于以上对HILI临床诊疗与研究现状的分析,中华中医药学会研究并发布了国内外首个专门针对HILI的诊疗技术团体标准——《中草药相关肝损伤临床诊疗指南》(T/CACM005-2016)(以下简称《指南》)。本文针对《指南》内容,分析解读可能导致HILI误诊的影响因素,重点解读该《指南》所推荐采用的中草药肝损伤客观诊断证据链策略的技术适用性及优势,为中、西医医务人员和科研人员更好地使用该指南提供参考。
1 HILI诊断和研究面临的问题和挑战 1.1 HILI诊断的分类统计应有规范的标准目前,尚缺少可靠的DILI及HILI发病率数据,HILI占DILI构成比的报道数据也有较大差异。根据2002年法国和2013年冰岛流行病学调查研究,DILI总体发病率为0.0139%~0.024%[7],更大范围的DILI发病率数据尚不清楚;由于中草药产品的获取途径和应用方式多样,存在大量非医疗机构的应用,HILI发病率较DILI更难估计[8-10]。值得一提的是,国内外有关HILI在DILI所占构成比报道的数据相差很大,而一些非专业媒体大量选择性地转载和引用这些构成比显著偏高的报道,片面报道中草药是我国药物性肝病的主要致病因素,给科学评估中草药安全性带来较大的舆论误导。
仔细调查国内外文献发现,HILI占DILI构成比计算的差异性主要源于中西药分类比较的方式不一致,也和国内外用药习惯差异、药物统计口径不同有关。特别是目前大多数文献报道将中草药作为一个整体与某一类化学药(如抗结核药),甚至某一种化学药(如对乙酰氨基酚)比较,从数字上夸大了HILI在DILI的贡献比例。针对这一问题,《指南》建议对致肝损伤药物进行科学合理的分类比较:一级分类将损肝药物分为中草药、化学药和生物制剂;二级分类将中草药、化学药分别按功效进行分类比较;三级分类将中草药和化学药的某一具体品种进行对比。统一规范的分类方法将可以有效避免HILI构成比夸大的舆论误导,有利于对药物性肝损伤的科学认识。按照一级分类比较,以解放军第三〇二医院统计病例为例,近年来HILI占DILI构成比在20%左右,显著低于化学药占DILI的构成比。
1.2 影响因素的复杂性对HILI准确诊断提出了更高要求HILI的影响因素包括中草药本身因素、药物使用合理性、患者机体差异、中西药联合用药等,给HILI的准确诊断带来更大困难。
1.2.1 中草药直接肝毒性、品种混用、质量或与毒性发生相关某些中草药含有对肝脏有明显毒副作用的成分,即直接肝毒性,如含吡咯里西啶类成分的菊三七(又名土三七)[11],含倍半萜生物碱类成分的雷公藤[12]等,但是这些具有肝毒性中草药的肝脏损伤机制尚不完全清楚。另外,某些中草药如何首乌[13]、补骨脂等有肝脏损伤病例报道,但并不是所有使用者均出现肝脏损伤,很有可能是特异质肝损伤(idiosyncratic drug-induced liver injury),需要更加翔实可靠的临床病例研究以及适宜的特异质肝损伤评价方法进行实验研究。
除了直接肝毒性之外,引起HILI的中草药因素还包含中药品种混用(表 1),如绵马贯众的肝毒性大于紫萁贯众,误以土三七作为三七、独角莲作为天麻使用而造成肝脏损伤;同种中草药因产地、采集、贮存不同而肝毒性亦存在差异,如寄生于桑树等无毒植物的桑寄生无肝毒性,但寄生于马桑等有毒植物者可能含有相应毒性成分。
|
|
表 1 品种混用导致中毒的部分中药 Table 1 Some Chinese materia medica of varieties mixed leading to poisoning |
因中药炮制、储藏不当引起的质量问题也是导致肝损伤的影响因素之一。如生首乌不规范炮制肝损伤发生风险高于规范炮制的何首乌[14]。中草药在生长、加工、炮制、运输、储藏等环节上受到污染或发生变质,可能导致中草药产品中农药、重金属和微生物毒素等超标,由于这些外源性有害物质本身具有肝毒性,长期使用相关受污染的中草药产品可能引发肝脏损伤[15, 16]。
1.2.2 是否合理辨证施治、明确配伍禁忌是影响HILI发生的因素之一在中草药临床应用过程中,药证不符、超常规剂量或疗程、药物配伍不当、中草药与化学药联合应用可能增加肝损伤风险[17]。中医理论特别强调辨证施治,有“用之得宜,皆有功力,用之失宜,参术亦能为害”的认识。对中医辨证施治原则的理解和应用不当,忽略中医理论对临床用药的指导作用,忽略个体差异,出现药证不符的情况可能大大增加中草药及其相关制剂发生肝损伤的风险[18-19]。相反地,如果辨证准确、用药对证、用法用量适宜,毒剧药物也可以安全地治疗疾病。笔者课题组曾以药性峻猛的中药大黄为例,探讨了机体病证状态对药物安全性的影响,研究发现大黄在肝肾损伤模型上的耐受性大于正常动物[20-22],科学澄清了大黄既有肝肾毒性报道又广泛用于肝肾疾患治疗的“悖论”,正如《黄帝内经•素问》中“有故无殒”理论对中药毒/效的认识——有病病受之,无病体受之;充分说明了辨证用药对于保障中草药临床安全性的重要意义。此外,中草药配伍不当可增加肝毒性,如延胡索与马钱子配伍可增加马钱子的毒性。中药“十八反”“十九畏”提出了中草药配伍禁忌;中草药与化学药联合应用也会存在配伍不当导致肝毒性增强,应予以注意。
1.2.3 患者机体状态差异可能造成HILI的易感性因患者存在体质差异,不同人群对HILI易感程度表现不一。少数特异质机体对某些中草药存在易感性。例如,服用何首乌引起的肝损伤可能与遗传性肝脏代谢酶缺陷、遗传多态性[23]和免疫损伤有关[24];也有报道称,合并病毒性肝炎等基础肝病是HILI发生的重要因素之一[25];另外,自身免疫性肝病可能存在与HILI的相互诱发或转化。
1.2.4 中西药联合应用造成HILI的临床误诊和舆论误导部分中草药和化学药可能存在相互作用而导致肝损伤风险增加;服用中草药的同时服用可致肝损伤的化学药如他汀类调血脂药物,难以分清引起肝损伤的明确药物;部分不规范的中成药制剂,实际为中西药复方制剂,并且含有可致肝损伤的化学药,如个别治疗感冒的中西药复方制剂含有可致肝损伤的对乙酰氨基酚。由于中西药的联合应用,难以辨别引起肝损伤的药物是否为中草药或中西药相互作用引起肝损伤,从而出现HILI临床误诊和舆论误导,应注意区别。
2 现有HILI和DILI诊断标准的对比分析目前国内外可供诊断药物性肝损伤的诊疗依据主要是American College of Gastroenterology(ACG)2014年发布的《特异质药物性肝损伤诊断和管理指南》,中华医学会2015年发布的《药物性肝损伤诊治指南》以及中华中医药学会2016年发布的《中草药相关肝损伤临床诊疗指南》。
RUCAM因果评分法最早形成于1993年,中华医学会《药物性肝损伤诊治指南》推荐该方法用于药物和肝损伤之间因果关系的评价[26]。RUCAM评分方法采用量化的RUCAM量表,以分值高低作为相关性强度的评价依据,具有可量化评价的优势,对于用药史明确或药物种类相对简单的DILI诊断,结论一般较为可靠。但在用药史的定义上存在模棱两可、过度考虑再用药的权重、计分繁杂不易使用的问题,临床医生自身水平对该方法的诊断结果也有较大影响。针对中草药的复杂性,一方面中草药在临床上大多复方使用,难以将每味药物单独评价打分;另一方面对于中草药不良反应的既往记录或文献报告多数不详等,造成HILI诊断时往往难以根据RUCAM评分的高低得出可靠性的诊断结论。此外特别需要注意的是,由于RUCAM评分法的诊断结果是相关性,最高评分也是高度相关(highly probable),因此事实上没有确定性诊断,而只是疑似诊断,限制了该方法的临床应用。
2009年,美国药物肝损伤研究网络(Drug-Induced Liver Injury Network,DILIN)提出SEOP法用于DILI诊断,该方法被ACG推荐用于DILI诊断。SEOP法的优势在于通过专家组的判断提高最终诊断的一致性,有利于提高诊断的总体水平和准确性,特别是基于专家一致性经验,SEOP法最高级别诊断标准是确定诊断(definite)。不足之处是该方法依靠专家意见难以避免专家的主观倾向,且由于该方法并没有增加诊断证据的数量及强度,从客观证据的角度来,并不能增加诊断的客观性和可信度。
DILIN曾比较过RUCAM评分与SEOP 2种诊断方法的诊断结果,发现2种诊断方法总体上呈现一定的相关性[27](图 1),但2种方法间的差异很大,极端的数据点可以看到有的病例RUCAM评分达到9分(highly probable),但SEOP得到的是排除性诊断结果(unlikely)。由此可以看出,如果不增加客观诊断证据的数量或强度,目前RUCAM评分与SEOP 2种诊断方法在临床诊断过程中还有一定的不确定性。为了更好地适应HILI诊断的复杂性,《指南》在诊断策略、流程和标准方面做了较大方法学改进。

|
图 1 RUCAM与SEOP诊断结果的对比 Fig.1 Comparison on diagnosis of RUCAM and SEOP |
在诊断策略方面,首次提出采用整合证据链(integrated evidencechain-based causality identification algorithm,IECCIA)的诊断策略[28-29],使HILI诊断从主观经验向客观证据链发展,减少临床误诊。具体来说,借鉴法律诉讼领域的证据链理念,针对性地解决HILI诊断过程中混杂因素多、客观证据力不足的问题,包括2个要求:一是有充足的客观证据,二是证据之间能够互相印证、有秩序的衔接组成证据链,从而确定HILI诊断的合理结论或排除对HILI诊断的合理怀疑。
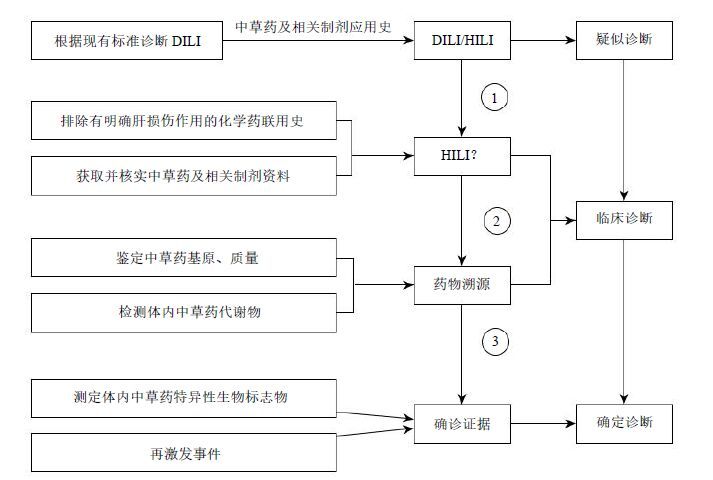
在诊断流程方面,首次提出采用RUCAM评分、中西药联合用药排查、中草药品种质量鉴定、体内特征代谢物检测和生物标志物分析诊断流程[29-30](图 2),增加HILI诊断的客观评价环节和证据数量,提高HILI诊断的客观性、规范性和可操作性。通过对中西药联合用药史的排查和甄别,排除中西药联合用药致肝损伤对HILI诊断的干扰,减少因联合用药引起的HILI误诊;通过中草药品种质量鉴定、体内特征代谢物检测,确定HILI的致病药源,减少因药物质量、误用等引起的HILI误诊;通过特异性生物标志物分析,以直接的客观证据确诊HILI,促进和鼓励HILI诊断向精准医学发展。

|
图 2 HILI诊断流程图 Fig.2 Flow charts of HILI diagnosis |
在诊断标准方面,首次采用疑似诊断、临床诊断、确定诊断3级诊断标准,使HILI诊断从以往的相关性诊断向确定性诊断发展,提高HILI诊断的科学性。以往DILI诊断标准主要是相关性诊断,即以评分或相关性级别作为DILI诊断的结果,从本质上讲仍然是或然性,在临床实际操作中难以确定中草药与肝损伤的因果关系,既不利于提高HILI临床诊断水平,也不利于深入研究和评价相关中草药的肝毒性问题,有时还可能造成医患纠纷。将HILI诊断标准分为疑似诊断、临床诊断、确定诊断3级,与上述证据链策略和诊断流程配合,很好地解决了证据力强度与诊断结论可靠性的相互吻合,既符合临床上复杂的实际情况,同时考虑到了临床诊断的可操作性。
总之,《指南》基于整合证据链思想,通过增加客观证据、构建证据链以及明确诊断标准,大大提高HILI诊断的可靠性和科学性。尤其值得提出的是,《指南》不仅适用于中草药肝损伤诊断,同样适用于化学药肝损伤诊断。在进行DILI诊断时,将《指南》流程里的中草药与化学药互换,即如果能够明确化学药用药史、排除中草药联合应用的干扰、检测化学药质量、体内特征代谢物和生物标志物等,同样可以获得基于整合证据链的DILI诊断,提高DILI诊断的可靠性和科学性。
3 基于整合证据链的HILI诊疗策略与方法的适用性分析由于HILI致病因素的复杂性,缺少临床-实验室整合证据链的支持等因素,往往造成HILI诊断证据力不足,主要体现在以下2个方面:一方面,患者的药物使用情况往往难以追溯或难以鉴别和分辨,如中草药常与化学药联合应用,中成药混杂有化学药成分[31],部分中草药药名混乱、质量参差不齐,为中草药混合粉末等,特别是患者能够提供的服药情况多数组成、来源、剂量等资料记录不详,即便能够明确的中草药,也缺少对损肝中草药的生药学溯源,导致HILI难以确诊或误诊频频出现。另一方面,以往的诊断流程多依据患者主诉和临床排除性检查,缺少特异性指标,如何确定是中草药造成的而不是其他化学药物或是由于联合用药造成,仍是HILI的诊断难点。
针对HILI诊断可能存在的主观偏倚和药源检测技术的欠缺,对HILI发生的相关影响因素逐层解析,提出了基于整合证据链的HILI诊疗策略和方法[28],通过加强中草药应用史的详细调查,将中西药联合应用情况的甄别、可疑肝损伤中草药的溯源鉴定、有害物质污染的检测,并通过检查患者血液和尿液标本中的疑似肝损伤中草药体内特征代谢物及肝损伤特异性标志物而最终确定致病药源,形成HILI客观诊断的整合证据链(图 3)。这一方法通过延长诊断证据链,保证了规范诊断证据的完整性,大大提高HILI诊断的客观性、科学性、准确性,并有助于进一步阐明导致肝损伤的药物成分和发生机制。
|
图 3 基于整合证据链的中草药相关肝损伤诊疗策略 Fig.3 HILI strategy based on IECCIA |
HILI临床诊疗中多数患者存在中草药与化学药联合应用或交叉使用,很难厘清二者的肝毒性以及是否存在肝脏协同损伤作用。虽然西医对于此类患者笼统的诊断为DILI,但常常难以发现导致DILI的药源,这在一定程度上很难避免再激发事件的发生。目前排除中草药及其相关制剂与化学药联合应用主要依靠病史采集方法,由于大部分患者无医学背景,临床医师在病史采集过程中可能存在一定的主观偏倚。在排除化学药联合使用和明确肝毒性的前提下,对于可疑损肝中草药及其相关制剂资料的掌握对于明确药源具有极其重要的作用。
参照图 3中①即达到《指南》中的“疑似诊断”——通过收集可疑损肝中草药及其相关制剂的批准文号、处方组成、购买来源、炮制方法、用法用量及余留药材等信息,最大程度地避免了病史采集过程中临床医师对病情判断可能发生的主观偏倚,排除联用化学药引起的不明药源DILI或者HILI的不实诊断。
图 3中②即《指南》的“临床诊断”——可确定可疑引起药物性肝损伤的中药药源,或排除中药质量因素,减少HILI的过度诊断。中草药基原、混伪品鉴定的主要方法包括药物批准文号的核实,中药饮片、粉剂、提取物等宏观性状鉴定、粉末显微鉴别、DNA分子鉴定、化学成分分析等生药学鉴定等。对于非正规渠道购买的中草药及其相关制剂可能残留农药、重金属和微生物毒素等有害物质,建议将药物送至毒物检测机构检测农药残留、重金属和微生物毒素,以排除有害物质污染对HILI的误诊。
图中③即《指南》的“确定诊断”——对于确由中草药引发的相关肝损伤,可提供基于药物特征标志物和体内代谢物诊断的双重证据,保证诊断的准确性。这一步骤最具有HILI诊断直接证据力,通过收集患者血尿临床标本,检测疑似肝损伤中草药体内特征代谢物及特异性生物标志物,以诊断HILI并确定致病中草药药源。
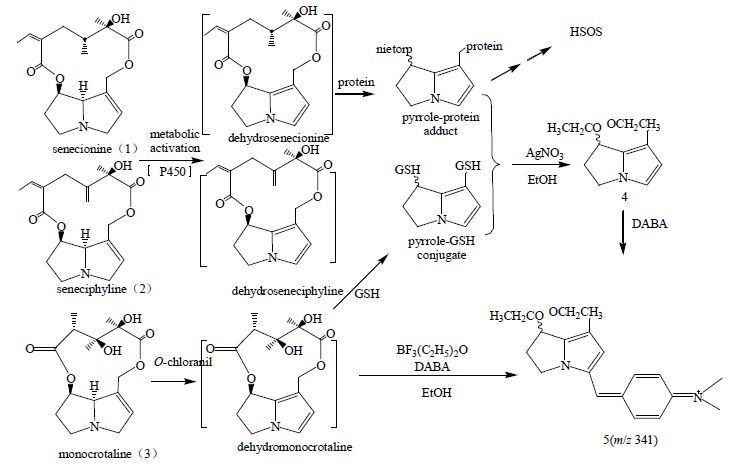
4 生物标志物检测在确诊HILI的意义和前景针对中草药本身因素所致HILI的诊断问题,通过进行可疑肝损伤中草药品种鉴定、质量分析检测、有害物质污染的检测、体内特征代谢物、生物标志物分析等可为临床诊断提供较为可靠的客观证据。例如,Lin等[11]采用超高效液相-质谱的方法,首次从误用含吡咯里西啶类生物碱的菊三七(土三七)患者病人血液中检测到吡咯里西啶类代谢产物与蛋白形成的加合物(图 4),该研究为诊断菊三七引起的肝窦阻塞综合征(sinusoidal obstruction syndrome,SOS)提供了客观准确的证据,从另一方面可以为中药肝毒性特异生物标志物的实验室检测提供研究基础(图 5)[11]。尽管目前HILI的特异性生物标志物检测还处在起步阶段,但随着检测技术的不断进步和国际精准医学的快速发展,生物标志物检测在HILI和DILI的诊断将发挥越来越重要的作用,是HILI基础研究和临床实践的重要发展方向。
|
图 4 血清吡咯里西啶类代谢产物与蛋白加合物化学结构 Fig.4 Chemical structures of adduct of pyrrolizidine metabolites and protein in serum |

|
图 5 吡咯里西啶类代谢产物与蛋白加合物 (A~G) 的UPLC-MS图[11] Fig.5 UPLC-MS of adduct of pyrrolizidine metabolites and protein (A—G) |
5 基于整合证据链的HILI诊疗策略与方法的初步应用
该诊疗策略目前已由笔者研究团队应用于HILI临床诊疗试行流程。研究共收集解放军第三〇二医院2002—2013年肝功异常患者12 307例,DILI确诊患者2 391例,其中40例为可疑何首乌致肝损伤。依据RUCAM评分诊断后,上述可疑何首乌致肝损伤的病例仅22.5%(9/40)可能与何首乌高度相关(RUCAM评分≥8),仅依靠RUCAM评分高低判断其与中草药相关肝损伤诊断的相关性,证据力显然不足。40例可疑何首乌致肝损伤的病例中,20例为前瞻性研究。将20例前瞻性研究的病例根据整合证据链的方法进行诊断,1例疑似何首乌致肝损伤的病例经过药物基原和混伪品鉴定,确定为何首乌伪品,最终得到何首乌致肝损伤确诊病例19例[28](图 6)。以何首乌致肝损伤为示例开展的HILI诊断研究结果可以看出,《指南》的提出以及推广的可期性将对于HILI诊断水平的提高、中草药毒效的客观辨识、临床合理用药具有重要的指导意义,也将会成为保护中医药事业健康持续发展的重要标准和武器。

|
图 6 基于整合证据链的何首乌致肝损伤诊断研究 Fig.6 Diagnostic study on Polygoni Multiflori Radix-induced liver injury based on IECCIA |
6 展望
虽然基于整合证据链的HILI诊疗策略与方法的提出已在一定范围内体现出其优势和积极性,仍需在未来的临床诊疗与研究工作中加以广泛实践和继续完善;该方法是基于DILI现行诊断标准的扩展,与ACG的结构性专家诊断程序以及RUCAM评分方法的差异值得进一步研究比较,相互借鉴优化。另一方面,HILI基于整合证据链的诊断方法可以弥补药品不良反应监测体系自发性报告数据难以溯源的局限,通过HILI监测和报告制度的进一步完善也将极大地促进HILI诊断水平的提高。科学理性地对待中药肝毒性,构建规范化管理的高证据质量的HILI数据库,实现数据的共享,完善中药不良反应的监测体系,加强对中药特别是中成药安全性及毒副作用的监测,最终有效降低乃至避免HILI的发生才是该疾病诊疗与研究发展进步的最终目标。
| [1] | Chalasani N P, Hayashi P H, Bonkovsky H L, et al. ACG Clinical Guideline:the diagnosis and management of idiosyncratic drug-induced liver injury[J]. Am J Gastroenterol , 2014, 109 (7) :950–966. DOI:10.1038/ajg.2014.131 |
| [2] | Danan G, Benichou C. Causality assessment of adverse reactions to drugs-I. A novel method based on the conclusions of international consensus meetings:application to drug-induced liver injuries[J]. J Clin Epidemiol , 1993, 46 (11) :1323–1330. DOI:10.1016/0895-4356(93)90101-6 |
| [3] | Navarro V J, Lucena M I. Hepatotoxicity induced by Herbal and dietary supplements[J]. Semin Liver Dis , 2014, 34 (2) :172–193. DOI:10.1055/s-00000069 |
| [4] | Teschke R, Frenzel C, Glass X, et al. Herbal hepatotoxicity:a critical review[J]. Br J Clin Pharmacol , 2013, 75 (3) :630–636. |
| [5] | 朱云. 药物性肝损伤临床特征及治疗预后分析[D]. 北京:中国人民解放军医学院, 2012. http://cdmd.cnki.com.cn/article/cdmd-90115-1015401454.htm |
| [6] | 朱云, 李永纲, 王葽, 等. 595例中药导致药物性肝损伤临床分析[J]. 中国中西医结合杂志 , 2016, 36 (1) :38–42. |
| [7] | Regev A, Seeff L B, Merz M, et al. Causality assessment for suspected DILI during clinical phases of drug development[J]. Drug Saf , 2014, 37 (S1) :47–56. DOI:10.1007/s40264-014-0185-4 |
| [8] | Dağ M S, Aydınlı M, Oztürk Z A, et al. Drug-and herb-induced liver injury:a case series from a single center[J]. Turk J Gastroenterol , 2014, 25 (1) :41–45. DOI:10.5152/tjg |
| [9] | Teschke R, Schwarzenboeck A, Eickhoff A, et al. Clinical and causality assessment in herbal hepatotoxicity[J]. Expert Opin Drug Saf , 2013, 12 (3) :339–366. DOI:10.1517/14740338.2013.774371 |
| [10] | Teschke R, Eickhoff A. Herbal hepatotoxicity in traditional and modern medicine:actual key issues and new encouraging steps[J]. Front Pharmacol , 2015, 6 :72. |
| [11] | Lin G, Wang J Y, Li N, et al. Hepatic sinusoidal obstruction syndrome associated with consumption of Gynura segetum[J]. J Hepatol , 2011, 54 (4) :666–673. DOI:10.1016/j.jhep.2010.07.031 |
| [12] | 赵庆国, 王艳辉, 马致洁, 等. 基于肝细胞毒价检测的雷公藤质量评价方法研究[J]. 中草药 , 2015, 46 (3) :378–383. |
| [13] | 俞捷, 谢洁, 赵荣华, 等. 何首乌肝脏不良反应研究进展[J]. 中草药 , 2010, 41 (7) :1206–1210. |
| [14] | 涂灿, 蒋冰倩, 赵艳玲, 等. 何首乌炮制前后对大鼠肝脏的损伤比较及敏感指标筛选[J]. 中国中药杂志 , 2015, 40 (4) :654–660. |
| [15] | Efferth T, Kaina B. Toxicities by herbal medicines with emphasis to traditional Chinese medicine[J]. Curr Drug Metab , 2011, 12 (10) :989–996. DOI:10.2174/138920011798062328 |
| [16] | Stickel F, Shouval D. Hepatotoxicity of herbal and dietary supplements:an update[J]. Arch Toxicol , 2015, 89 (6) :851–865. DOI:10.1007/s00204-015-1471-3 |
| [17] | 胡义扬, 黄甫. 中草药与药物性肝损伤[J]. 中华肝脏病杂志 , 2012, 20 (3) :173–175. |
| [18] | Tu C, Gao D, Li X F, et al. Inflammatory stress potentiates emodin-induced liver injury in rats[J]. Front Pharmacol , 2015, 6 :233. |
| [19] | Ke-Yong N, Min L. Application of morbid animal model in drug safety evaluation of traditional Chinese medicine[J]. Front Pharmacol , 2015, 6 :37. |
| [20] | Wang J B, Zhao H P, Zhao Y L, et al. Application of morbid animal model in drug safety evaluation of traditional Chinese medicine[J]. Front Pharmacol , 2015, 6 :37. |
| [21] | 王艳辉, 赵海平, 王伽伯, 等. 基于"有故无殒"思想的熟大黄对肝脏量-毒/效关系研究[J]. 中国中药杂志 , 2014, 39 (15) :2918–2923. |
| [22] | Zeng L N, Ma Z J, Zhao Y L, et al. The protective and toxic effects of rhubarb tannins and anthraquinones in treating hexavalent chromium-injured rats:The Yin/Yang actions of rhubarb[J]. J Hazard Mat , 2013, 246 . |
| [23] | Ma K F, Zhang X G, Jia H Y. CYP1A2 polymorphism in Chinese patients with acute liver injury induced by Polygonum multiflorum[J]. Genet Mol Res , 2014, 13 (3) :5637–5643. DOI:10.4238/2014.July.25.19 |
| [24] | 申国庆, 江丽, 龚春燕. 何首乌致肝损害案例追溯分析与临床监控[J]. 中国医院用药评价与分析 , 2010, 10 (11) :1040–1042. |
| [25] | Seeff L B. Herbal hepatotoxicity[J]. Clin Liver Dis , 2007, 11 (3) :577–596. DOI:10.1016/j.cld.2007.06.005 |
| [26] | 中华医学会肝脏病学分会药物性肝病学组. 药物性肝损伤诊治指南解读[M]. 上海: 上海科学技术出版社, 2015 . |
| [27] | Rockey D C, Seeff L B, Rochon J, et al. Causality assessment in drug-induced liver injury using a structured expert opinion process:comparison to the Roussel-Uclaf causality assessment method[J]. Hepatology , 2010, 51 (6) :2117–2126. DOI:10.1002/hep.23577 |
| [28] | Wang J, Ma Z, Niu M, et al. Evidence chain-based causality identification in herb-induced liver injury:exemplification of a well-known liver-restorative herb Polygonum multiflorum[J]. Front Med , 2015, 9 (4) :457–467. DOI:10.1007/s11684-015-0417-8 |
| [29] | 王伽伯, 李春雨, 朱云, 等. 基于整合证据链的中草药肝毒性客观辨识与合理用药:以何首乌为例[J]. 科学通报 , 2016, 61 (9) :971–980. |
| [30] | 中华中医药学会. 中草药相关肝损伤临床诊疗指南[M]. 北京: 中国中医药出版社, 2016 . |
| [31] | Ernst E. Adulteration of Chinese herbal medicines with synthetic drugs:a systematic review[J]. J Int Med , 2002, 252 (2) :107–113. DOI:10.1046/j.1365-2796.2002.00999.x |
 2016, Vol. 47
2016, Vol. 47


