2. 浙江大学 化学系, 浙江 杭州 310028
2. Department of Chemistry, Zhejiang University, Hangzhou 310028, China
从中药提取分离得到的多数有效成分活性较强,在治疗相应的疾病中均有较好的疗效,如熊去氧胆酸对原发性胆汁性肝硬化具有良好的活性[1],紫杉醇用于卵巢癌和乳腺癌及非小细胞肺癌的一线和二线治疗[2, 3]等。但是临床观察显示,许多分离纯化得到的中药有效成分因其水溶性差而导致口服给药后生物利用度低,影响了临床疗效的发挥,成为制约中药制剂应用和国际化的瓶颈之一。
为了解决中药有效成分的水溶性差和生物利用度低的问题,药学工作者尝试了很多方法,如固体分散体技术、自微乳化技术、超微粉碎技术、液固压缩技术等[4]。但是目前这些方法仍然存在一些问题[5, 6],如使用超临界反流体技术制备超微粉体材料时有机溶剂难以去除,固体分散体存储过程中易有老化现象,液体压缩技术不适用于高剂量难溶性药物的制备等,在一定程度上限制了中药难溶性有效成分药效的发挥和剂型的开发。因此,解决中药难溶性有效成分溶解吸收差的问题是当前药学工作者面临的主要挑战之一。
近几十年,随着晶体工程和超分子化学的迅猛发展,药物化学家将晶体工程与超分子化学的原理和方法应用于药物晶体的设计和开发中,成就了药物活性成分的又一大种类——药物共晶。药物共晶[7]是药物活性成分(active pharmaceutical ingredient,API)和共晶形成物(co-crystal former,CCF)在氢键或其他非共价键的作用下而形成的具有特定理化性质的新的结晶形式,它可以改善药物活性成分的诸多性质,如熔点、稳定性、机械性质、溶解性、固有溶出速率及生物利用度等[8, 9, 10]。药物共晶在药剂学中最大的应用价值就是无需改变药物分子的共价结构,即能达到修饰药物理化性质的目的,这也为改善中药难溶性有效成分的溶解性和生物利用度提供了一个新的解决方案。
当前,药物共晶的研究热点主要集中在化学药物的共晶制备、形成过程、结构的表征及其理化性质的影响等方面,而有关中药难溶性有效成分共晶的研究报道较少。本文综述了各类中药难溶性有效成分共晶对其理化性质和生物学性质的影响,为药物共晶在中药难溶性有效成分中的应用提供参考和借鉴。
1 黄酮类药物共晶黄酮类化合物为中药所含的一类低相对分子质量的有效活性成分,以游离态或与糖结合为苷的形式存在,不仅数量种类繁多,而且结构类型复杂多样,表现出多种多样的药理活性,但是大多数黄酮类化合物的溶解性差、生物利用度低,限制了其广泛应用。黄酮类化合物分子结构大多含有多个酚羟基,既可作为质子受体,又可作为质子给体,可与CCF形成各种分子间氢键。黄芩素、槲皮素、染料木黄酮和杨梅酮是4种典型的黄酮类化合物,其结构见图 1,黄酮类化合物中典型的氢键合成元结构见图 2。
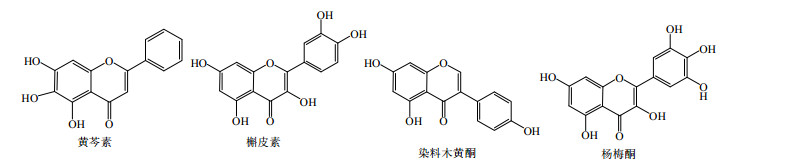 | 图 1 几种主要黄酮类化合物的结构 Fig.1 Structures of mainly flavonoids |
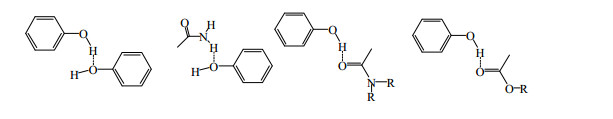 | 图 2 黄酮类药物共晶中典型的氢键合成元 Fig.2 Typical hydrogen bounded elements in pharmaceutical co-crystals observed in flavonoids |
黄芩素(baicalein)是传统中药黄芩中量最高的黄酮类化合物之一,也是黄芩发挥功效的主要活性成分之一[11]。相关研究[12, 13, 14]证实,黄芩素具有抗菌、抗病毒、抗氧化、解热镇痛、抗炎、抗肿瘤、保护心脑血管及神经元、保肝、预防或治疗糖尿病及其并发症等作用。
然而,由于黄芩素水溶性和脂溶性均较差,胃肠道吸收受限,导致口服生物利用度低,且由于多酚羟基结构的存在,导致易氧化变质,使其在新药开发及临床应用上受到较大限制。为了改善其水溶性,将黄芩素与烟酰胺(NCT)制备成黄芩素-NCT共晶,实验显示,该共晶在不同pH介质中的溶解度和溶出速率较黄芩素都有显著提高,且小鼠体内药动学实验表明,黄芩素-NCT共晶血药达峰浓度(Cmax)和血药浓度-时间曲线下面积(AUC0-24 h)分别是黄芩素的2.49倍和2.80倍,证明了制备的黄芩素-NCT共晶能够显著提高黄芩素的生物利用度[15, 16]。
1.2 槲皮素共晶槲皮素(quercetin)是一种多羟基黄酮类化合物,不仅具有抗氧化及清除自由基的作用,还具有抗癌、抗炎、抗菌、抗病毒、降血糖、降血压、调节免疫功能及保护心血管等作用[17, 18, 19, 20]。但该化合物含有多个极性羟基,亲脂性弱,同时由于羟基在分子间形成氢键,晶格能较高,亲水性较差(槲皮素在水中溶解度为7 mg/L),导致其生物利用度极低,至今难以在临床上作为药物广泛使用[21]。
Veverka等[22]将槲皮素制成多种共晶,并在不同湿度下考察共晶的稳定性,发现槲皮素与L-脯氨酸形成的共晶稳定性最好,在20 ℃、相对湿度为95%和40 ℃、相对湿度为70%的条件下都能稳定存在。抗氧化活性实验显示,槲皮素-依达拉奉共晶的自由基半数清除浓度(IC50)为11.3 μmol/L,分别是槲皮素(IC50=16.2 μmol/L)和依达拉奉(IC50=32.0 μmol/L)的70%和35%,是生育酚(IC50=34.7 μmol/L)的33%。细胞毒性实验显示,槲皮素-曲酸共晶对HeLa、Caco-2和NIH-3T3细胞的半数抑制浓度(IC50)分别是槲皮素的69%、65%、65%。张建军等[23]将槲皮素和咖啡因制备成的槲皮素-咖啡因共晶,其在50%乙醇水溶液中的溶解度为3.627 mg/mL,为槲皮素溶解度的13.58倍(槲皮素在该溶剂中的溶解度为0.267 mg/mL),说明将槲皮素制备成槲皮素-咖啡因共晶能够显著地提高其溶解度。
1.3 染料木黄酮共晶染料木黄酮(genistein)是从大豆中提取得到的一种具有抗氧化、抗炎、抑菌,有弱雌激素活性的成分,能有效预防和治疗各种肿瘤、骨质疏松、妇女更年期综合征及心血管疾病等多种疾病的发生[24]。按照美国FDA颁布的生物药剂学分类系统(BCS),其属于II类药物,水中的溶解度仅为3×10−6 mol/L,且生物利用度低。
将染料木黄酮分别与异烟碱和咖啡因制成共晶后考察其溶解度[25, 26],发现染料木黄酮-咖啡因共晶在水-乙醇溶液(1∶1)的溶解度是染料木黄酮的1.5倍,且该共晶在水-乙醇溶液(1∶1)中24 h内能保持稳定。
1.4 杨梅酮共晶杨梅酮(myricetin)是一类主要的黄酮类化合物,具有抗病毒、抗菌、抗氧化、抗炎、防肠虫、抗肿瘤和促进海马长时程增强等作用,广泛分布于杨梅树皮、葡萄、洋葱等植物中[27, 28]。然而杨梅酮极低的溶解度(2 mg/L)限制了其在临床的应用。
Hong等[29]研究表明,杨梅酮分别与咖啡因、异烟碱、烟酰胺、4-氰基吡啶形成共晶后,杨梅酮在不同介质中的溶解度提高了3~80倍,达到最大浓度所需的时间减少到10~20 min,大大改善了杨梅酮的溶解性能。
综合所述,当黄酮类化合物与适当的CCF形成共晶后,可以明显改善黄酮类化合物的溶解度、溶出速度和生物利用度。此外,黄酮类化合物还可作CCF与其他药物形成共晶,显著改善药物的物理化学性质,如吡拉西坦为脑代谢改善药,但其极易溶于水,脂溶性极小,对药物透过血脑屏障发挥药效有一定的阻碍作用。Sowa等[30]将吡拉西坦制备成杨梅酮-吡拉西坦共晶,并将对其性质进行考察,以期增加吡拉西坦的脂溶性,利于药效发挥。
2 生物碱类药物共晶生物碱是一类含氮杂环的碱性天然有机物,广泛存在于药用植物内,大多数生物碱具有显著的生物活性,如抗HIV、治疗类风湿性关节炎、降低血压、抗寄生虫等。其可分为亲脂性生物碱、亲水性生物碱和具有特殊官能团的生物碱,其中亲脂性生物碱数量较多。但是,目前对难溶性生物碱共晶的研究较少,研究的代表性成分是咖啡因和茶碱,其分子结构见图 3,生物碱类化合物中典型的氢键合成元结构见图 4。
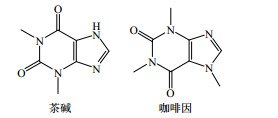 | 图 3 几种主要生物碱类化合物的结构 Fig.3 Structures of main alkaloids |
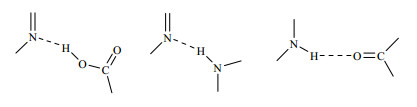 | 图 4 生物碱类药物共晶中典型的氢键合成元 Fig.4 Typical hydrogen bounded elements in pharma- ceutical co-crystals observed in alkaloids |
由于生物碱呈碱性,因此,成盐仍是目前改善难溶性生物碱溶解度的主要方法。但是在有些情况下,成盐后并不一定能增加药物的溶解度,甚至还会带来负面效果。例如,在胃液和空肠中存在大量的氯离子,所以口服给药的盐酸盐,由于同离子效应,溶解度和溶出速率会受到抑制;而且药学上可用的酸有限。
生物碱分子结构中含有多个胺基(N原子),是良好的氢键给体和受体,为其形成共晶提供了极大的可能。本课题组正在进行喜树碱与合适的CCF进行共晶设计制备研究,由于喜树碱属于中性生物碱,不溶于水且不易与酸成盐,其结构见图 5,因此期望通过共晶技术提高其水溶性,增加其生物利用度。
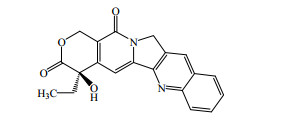 | 图 5 喜树碱的结构 Fig.5 Structure of camptothecin |
茶碱(theophylline)是存在于茶叶、咖啡等植物中的一种生物碱,具有松驰支气管平滑肌、抗炎、抗疲劳、改善慢性阻塞性肺疾病(COPD)患者膈肌收缩力等作用[31]。然而,茶碱存在多种晶型,对湿度也较为敏感,在一定的湿度条件下,茶碱的无水合物和水合物之间会发生相互转变,这一互变过程对质量的控制非常不利[32, 33, 34, 35]。
Lu等[31]制备并考察了茶碱-烟酰胺共晶理化性质,发现该共晶在25 ℃水中的溶解度比茶碱提高了约1.5倍,而且在相对湿度为90%的条件下,能够保持共晶稳定,不发生转晶现象。Trask等[34]将茶碱与有机酸制成共晶后,考察不同湿度下茶碱与共晶的稳定性,实验发现,在相对湿度≤75%的条件下,共晶都不会发生任何转晶现象,在相对湿度为98%的条件下,茶碱在1 d之内转变成水合物,茶碱-草酸共晶可以保持7周内晶型不发生转变。茶碱共晶大大改善了茶碱溶解性和对湿度的稳定性。
茶碱也可作为其他药物活性成分的CCF,形成药- 药共晶。对茶碱-二氟尼柳(DIF)共晶、茶碱-双氯芬酸(DIC)共晶和茶碱-对乙酰氨基酚(ACE)共晶的研究表明,在37 ℃、pH 7.4的缓冲溶液中,茶碱- DIF共晶的固有溶出速率与原药相当,而最大溶解度是DIF的2.3倍;茶碱-DIC共晶的固有溶出速率是原药的1.3倍,最大溶解度是DIC的1.6倍;并且在相对湿度为100%的条件下,这2种共晶可以保持2个月内晶型不发生转变[35];茶碱-ACE共晶在37 ℃水中的溶解度分别是茶碱和ACE的2.88倍和1.47倍[36]。
2.2 咖啡因共晶咖啡因(caffenine)是从茶叶、咖啡果、可可中提取出来的一种黄嘌呤生物碱,具有兴奋中枢神经和利尿、预防高血压、心肌梗死,解毒、抗氧化、抗衰老、减肥等作用,研究和开发天然咖啡因已成为食品、医药界的热点[37]。通常咖啡因以无水晶型(α晶型和β晶型)和水合晶型存在,其中稳定晶型β型在高温条件下可转化为亚稳的α晶型,咖啡因水合物和非水合物之间在湿度条件不同的情况下也发生相互转变[38]。同时,咖啡因较差的可压性和可塑性也给其生产带来较大困难[39]。
为提高咖啡因的稳定性和可压性,Aher等[39]进行了咖啡因-草酸共晶的研究,稳定性实验显示,咖啡因-草酸共晶在相对湿度为98%的条件下,能稳定存在7周;但是可压性实验表明,当压力为1 000~1×104 N时,共晶的抗压强度随着压力的增加而增加,当压力为2×104 N时,共晶的抗压强度会迅速减小,而弹性恢复会陡然上升,与咖啡因单体相似,这说明咖啡因-草酸共晶的可压性相比于咖啡因单体并没有明显改善。然而,当咖啡因与没食子甲酸形成共晶时,其可压性较咖啡因单体有显著提高[40],原因是咖啡因-没食子甲酸共晶为层状晶体。
由于引入的CCF性质不同,共晶也有可能减缓药物的释放。咖啡因与龙胆酸形成共晶后,在水中溶出较慢,将共晶制成咀嚼片后,能很大程度减弱咖啡因的苦味[41],大大改善了片剂的口感;这正是由于共晶减缓了咖啡因在口腔中的释放造成的。咖啡因不但可以与不同的CCF形成共晶,也可作为CCF与其他药物形成共晶,改善其他药物的理化性质。咖啡因-呋塞米共晶在30 ℃的10%乙醇水溶液中的溶解度是呋塞米的6~10倍,其片剂的溶出速率是普通呋塞米片剂的2倍左右[42]。
3 萜类药物共晶萜类化合物是由异戊二烯(isoprene)单元组成的化合物及其含氧衍生物,在自然界中广泛分布,研究发现,该类成分具有较好的抗菌、抗病毒、抗肿瘤等活性。萜类化合物的代表穿心莲内酯和齐墩果酸分别属于二萜类和三萜类化合物,其分子结构见图 6。萜类药物共晶中典型的氢键合成元见图 7。
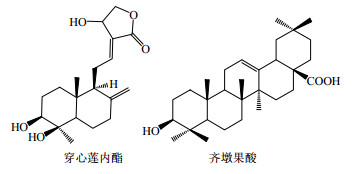 | 图 6 穿心莲内酯与齐墩果酸的结构 Fig.6 Structures of andrographolide and oleanolic acid |
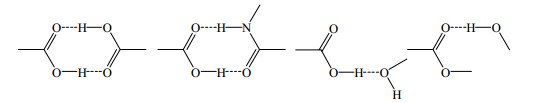 | 图 7 萜类药物共晶中典型的氢键合成元 Fig.7 Typical hydrogen bounded elements in pharmaceutical co-crystals observed in terpenes |
穿心莲内酯(andrographolide)是从爵床科植物穿心莲中提取的二萜内酯类化合物,是穿心莲的主要有效成分之一,具有清热解毒、凉血消肿、治疗心血管疾病、保肝利胆等功能[43]。由于穿心莲内酯的疗效确切且不产生耐药性,被誉为天然抗生素,其临床应用日趋广泛,但穿心莲内酯难溶于水(3.16±1.2 mg/L),口服后生物利用度仅有44%,目前采用化学结构修饰的办法制备各种穿心莲内酯盐制剂,但是这些化学结构的改变降低了穿心莲内酯的药理学活性,增加了毒副作用[43, 44, 45]。
Suresh等[46]将穿心莲内酯分别与香草醛、香草酸、水杨酸、间苯二酚和愈创木酚制成共晶,研究显示,在37 ℃、25%乙醇水溶液中,穿心莲内酯-水杨酸共晶的溶解度和固有溶出速率相比于穿心莲内酯分别提高了12倍和3倍,且在溶液中24 h内能稳定存在,显著改善了穿心莲内酯的水溶性。
3.2 齐墩果酸共晶齐墩果酸(oleanolic acid)是一种五环三萜类化合物,在女贞子、大枣、丁香等植物中以糖苷或游离形式存在。虽然齐墩果酸的药理作用显著,临床上已用齐墩果酸片治疗急、慢性肝炎,但其极差的水溶性,使其口服制剂很难被胃肠道吸收,其生物利用度仅为0.7%[47, 48, 49]。当齐墩果酸与富马酸制成共晶后,该共晶在室温下的溶解度为(6.78±0.11)mg/L,是齐墩果酸的1.5倍,极大地提高了其水溶性[50]。
大多数萜类化合物的分子结构中含有羟基、羧基等,这些官能团附属的氢键供体和受体位点有利于形成氢键合成元。因此,可与多种安全、有效的CCF(包括环糊精、氨基酸、维生素以及具有相应作用的化学合成药等)形成共晶,从而改善其理化性质,提高生物利用度。
4 多酚类药物共晶天然多酚类化合物具有多种多样的生理活性,如抗氧化、抗感染、抗肿瘤等,但大部分多酚类化合物溶解性差、口服生物利用度不高。姜黄素(curcumin,图 8)是一种广泛存在于姜科植物姜黄根茎中的一类典型的多酚类物质,具有多种生物活性[51]。研究证明[52],姜黄素可以抑制多种肿瘤细胞的生长,显著减少肿瘤数目、缩小瘤体体积,因此美国国立肿瘤研究所已将姜黄素列为第3代肿瘤化学预防药物。但是,由于姜黄素难溶于水,在中性和碱性环境中易水解,导致口服姜黄素后,生物利用度低,阻碍其在医药中的应用[53]。
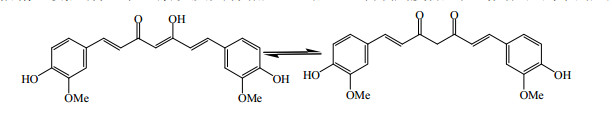 | 图 8 姜黄素的结构 Fig.8 Structure of curcumin |
Sanphui课题组对姜黄素与间苯二酚和邻苯三酚形成的共晶进行研究,发现与姜黄素晶型I相比,这2种共晶在30 ℃、40%乙醇水溶液中的固有溶出速率分别是晶型I的5倍和12倍,溶解度是晶型I的2倍和5倍[53, 54]。当姜黄素分别与烟酰胺(NAM)、阿魏酸(FA)、对苯二酚(HQ)、对羟基苯甲酸(PHBA)和L-酒石酸(TA)等形成共晶时,各种共晶在30 ℃、40%乙醇-水溶液中的固有溶出速率和AUC0-5 h较姜黄素有显著提高[51]。
5 展望药物共晶是利用晶体工程和超分子化学原理进行设计的一种新的固体形态,其能显著改善药物的理化性质及生物利用度,适用于非解离和弱解离药物,并且作为新的固体形态,可以突破原研专利的保护,使其在医药市场有更广阔的前景与价值。随着共晶基础理论研究的深入发展,可将药物共晶技术应用于中药难溶性有效成分,以增加其溶解度、提高生物利用度,扩大共晶技术在中药创新药物的研究和应用,进一步推动了中药难溶性有效成分在药学领域的发展。
虽然国内外现在已开启中药共晶技术的研究,有很多成功改造中药难溶性有效成分的范例,但是目前仍然存在一些问题,如在此前的研究中,研究者们大多都选择烟酰胺、异烟碱、邻苯三酚等非天然化合物作为CCF,但是由于非天然化合物的毒副作用,使共晶研究受到一定程度的限制;同时,中药有效成分复杂多变,也为共晶制备、结构表征以及检测带来很大的困难。
随着对药物共晶技术的不断探索,新的、安全的CCF不断涌现,作为药用辅料的微粉硅胶与氢氯噻氰形成共晶后,大大提高了氢氯噻氰的溶出速率[8];此外,对人体有益的氨基酸也是优良的CCF,如当大黄酸与精氨酸形成共晶后,不仅提高了大黄酸的纯度,减少有关物质的数量和含量,改善了大黄酸的理化性质,减缓了大黄酸的释放,延长药效,而且大黄酸与精氨酸的共晶结合对治疗糖尿病并发症具有协同作用[55]。传统中药的使用已有千年历史,其用药安全性经受了长期的考验,大部分的中药有效成分可作为潜在的CCF,与具有相应治疗作用的化学合成药形成药-药共晶,在改善化学合成药的理化性质和生物利用度的同时,发挥协同治疗作用。
目前,市场上的共晶制剂极少,只出现过2种,即甘氨酸茶碱钠片Asbron®和伊格列净脯氨酸片Suglat®。共晶的生物活性研究与药动学研究、大规模的共晶药物的制备以及产品的在线检测、质量标准制定是共晶研究领域的热点也是难点。由于共晶的诸多优势,如何将共晶投入工业化生产,得到稳定的、高纯度的药物共晶是研究工作者未来研究的另一个热点。
| [1] | Zhu G Q, Shi K Q, Huang S, et al. Network meta-analysis of randomized controlled trials: efficacy and safety of UDCA-based therapies in primary biliary cirrhosis [J]. Medicine (Baltimore), 2015, 94(11): 1-9. |
| [2] | Kumar A, Hoskins P J, Tinker A V. Dose-dense paclitaxel in advanced ovarian cancer [J]. Clin Oncol, 2015, 27(1): 40-47. |
| [3] | Arpino G, De P S, De A C. Nab-paclitaxel for the management of triple-negative metastatic breast cancer: a case study [J]. Anti-Cancer Drugs, 2015, 26(1): 117-122. |
| [4] | 郝海军, 张红芹, 贾幼智, 等. 采用制剂新技术提高中药磷脂复合物的溶出度和生物利用度研究进展 [J]. 中草药, 2013, 44(17): 2474-2479. |
| [5] | 陈周全, 张 宁. 固体分散体技术在中药制剂中的应用概况 [J]. 中国药房, 2012, 23(15): 1427-1429. |
| [6] | 罗 丹, 李小芳, 罗丽佳, 等. 液固压缩技术运用于难溶性中药的前景展望 [J]. 中成药, 2014, 36(12): 2587-2591. |
| [7] | Springuel G, Robeyns K, Norberg B, et al. Cocrystal formation between chiral compounds: How cocrystals differ from salts [J]. Cryst Growth Des, 2014, 14(8): 3996-4004. |
| [8] | El-Gizawy S A, Osman M A, Arafa M F, et al. Aerosil as a novel co-crystal co-former for improving the dissolution rate of hydrochlorothiazide [J]. Int J Pharm, 2015, 478(2): 773-778. |
| [9] | Zhang T T, Wang H T, Jia J T, et al. Syntheses and pharmacokinetics properties of an iloperidone pharmaceutical cocrystal [J]. Ingorg Chem Commun, 2014, 39: 144-146. |
| [10] | Karki S, Friscic T, Fabian L, et al. Improving mechanical properties of crystalline solids by cocrystal formation: new compressible forms of paracetamol [J]. Adv Mater, 2009, 21(38/39): 3905-3909. |
| [11] | Chirikova N K, Olennikov D N, Tankhaeva L M. Pharmacognostic study of aerial parts of Baikal skullcap (Scutellaria baicalensis Georgi) [J]. Russ J Bioorg Chem, 2010, 36(7): 909-914. |
| [12] | Deng Y X, Shi Q Z, Chen B, et al. Comparative pharmacokinetics of baicalin in normal and the type 2 diabetic rats after oral administration of the Radix Scutellariae extract [J]. Fitoterapia, 2012, 83(8): 1435-1442. |
| [13] | Naveenkumar C, Raghunandhakumar S, Asokkumar S, et al. Baicalein improves antioxidant status and membrane-bound enzymes during oxidative stress in benzo (a) pyrene-induced lung carcinogenesis in mice [J]. Biomed Prev Nutr, 2012, 2(2): 138-144. |
| [14] | 云宝仪, 周 磊, 谢鲲鹏, 等. 黄芩素抑菌活性及其基质的初步研究 [J]. 药学学报, 2012, 47(12): 1587-1592. |
| [15] | Huang Y T, Zhang B W, Gao Y, et al. Baicalein-nicotinamide co-crystal with enhanced solubility, dissolution, and oral bioavailability [J]. J Pharm Sci, 2014, 103(8): 2330-2337. |
| [16] | Sowa M, Slepokura K, Jon E M. A 1: 1 co-crystal of baicalein with nicotinamide [J]. Acta Crystallogr C, 2012, 68(7): 262-265. |
| [17] | Prasad V G N V, Krishna B V, Swamy P L, et al. Antibacterial synergy between quercetin and polyphenolic acids against bacterial pathogens of fish [J]. Asian Pac J Trop Med, 2014, 4(Suppl 1): S326-S329. |
| [18] | Mohammed A I, Robert W S, Simi G, et al. An update on the cardiovascular effects of quercetin, a plant flavonoid [J]. Curr Nutr Food Sci, 2014, 10(1): 36-48. |
| [19] | Pandey S K, Patel D K, Thakur R, et al. Anti-cancer evaluation of quercetin embedded PLA nanoparticles synthesized by emulsified nanoprecipitation [J]. Int J Biol Macromol, 2015, 75: 521-529. |
| [20] | Heo D J, Shon M S, Kim G N, et al. Effect of UV irradiation on the antioxidant and anti-adipogenic activities of quercetin [J]. Food Sci Biotechnol, 2015, 24(10): 341-345. |
| [21] | Abraham M H, Acree J W E. On the solubility of quercetin [J]. J Mol Liq, 2014, 197: 157-159. |
| [22] | Veverka M, Dubaj T, Gallovic J, et al. Cocrystals of quercetin: synthesis, characterization, and screening of biological activity [J]. Monatsh Chem, 2015, 146(1): 99-109. |
| [23] | 张建军, 刘 娟, 郑雪琴, 等. 槲皮素咖啡因共晶: 中国, CN 103980276 A [P]. 2014-08-13. |
| [24] | Saha S, Sadhukhan P, Sil P C. Genistein: A Phytoestrogen with multifaceted therapeutic properties [J]. Mini Rev Med Chem, 2014, 14(11): 920-940. |
| [25] | Sowa M, Slepokurab K, Jon E M. A 1: 2 cocrystal of genistein with isonicotinamide: crystal structure and Hirshfeld surface analysis [J]. Acta Crystallogr C, 2013, 69(11): 1267-1272. |
| [26] | Sowa M, Slepokura K, Jon E M. Solid-state characterization and solubility of a genistein-caffeine cocrystal [J]. J Mol Struct, 2014, 1076: 80-88. |
| [27] | 贺文彬, 张俊龙, 薛 薇, 等. 黄酮类化合物杨梅酮促进大鼠海马长时程增强的作用 [J]. 中国新药杂志, 2009, 18(24): 2306-2315. |
| [28] | Li Y, Ding Y. Minireview: Therapeutic potential of myricetin in diabetes mellitus [J]. Food Sci Human Wellness, 2012, 1(1): 19-25. |
| [29] | Hong C, Xie Y, Yao Y S, et al. A novel strategy for pharmaceutical cocrystal generation without knowledge of stoichiometric ratio: Myricetin cocrystals and a ternary phase diagraml [J]. Pharm Res, 2015, 32(1): 47-60. |
| [30] | Sowa M, Slepokura K, Matczak-Jon E. A 1: 1 pharmaceutical cocrystal of myricetin in combination with uncommon piracetam conformer: X-ray single crystal analysis and mechanochemical synthesis [J]. J Mol Struct, 2014, 1058: 114-121. |
| [31] | Lu J, Rohani S. Preparation and characterization of theophylline-nicotinamide co-crystal [J]. Org Process Res Dev, 2009, 13(6): 1269-1275. |
| [32] | Eddleston M D, Hejczyk K E, Bithell E G, et al. Determination of the crystal structure of a new polymorph of theophylline [J]. Chemistry, 2013, 19(24): 7883-7888. |
| [33] | Singh V B. Spectroscopic signatures and structural motifs in isolated and hydrated theophylline: a computational study [J]. RSC Adv, 2015, 5(15): 11433-11444. |
| [34] | Trask A V, Motherwell W D S, Jones W. Physical stability enhancement of theophylline via cocrystallization [J]. Int J Pharm, 2006, 320(1/2): 114-123. |
| [35] | Surov A O, Voronin A P, Manin A N, et al. Pharmaceutical co-crystals of diflunisal and diclofenac with theophylline [J]. Mol Pharm, 2014, 11(10): 3707-3715. |
| [36] | Lee H G, Zhang G G, Flanagan D R. Cocrystal intrinsic dissolution behavior using a rotating disk [J]. J Pharm Sci, 2011, 100(5): 1736-1744. |
| [37] | Walton C, Kalmar J, Cafarelli E. Caffeine increases spinal excitability in humans [J]. Muscle Nerve, 2003, 28(3): 359-364. |
| [38] | Madusanka N, Eddleston M D, Arhangelskis M, et al. Polymorphs, hydrates and solvates of a co-crystal of caffeine with anthranilic acid [J]. Acta Crystallogr B, 2014, 70(1): 72-80. |
| [39] | Aher S, Dhumal R, Mahadik K, et al. Effect of cocrystallization techniques on compressional properties of caffeine-oxalic acid 2:1 cocrystal [J]. Pharm Dev Technol, 2013, 18(1): 55-60. |
| [40] | Sun C C, Hou H. Improving mechanical properties of caffeine and methyl gallate crystals by cocrystallization [J]. Cryst Growth Des, 2008, 8(5): 1575-1579. |
| [41] | Higuehi T, Pitman I. Caffeine complexes with low water solubility: Synthesis and dissolution rates of 1:1 and 1:2 caffeine-gentisic acid complexes [J]. J Pharm Sci, 1973, 62(1): 55-58. |
| [42] | Pal S, Roopa B N, Abu K, et al. Thermal studies of furosemide-caffeine binary system that forms a cocrystal [J]. J Therm Anal Calorim, 2014, 115(3): 2261-2268. |
| [43] | Aromdee C. Andrographolide: progression in its modifications and applications-a patent review (2012-2014) [J]. Expert Opin Ther Pat, 2014, 24(10): 1129-1138. |
| [44] | Thakur A K, Chatterjee S S, Kumar V. Adaptogenic potential of andrographolide: An active principle of the king of bitters (Andrographis paniculata) [J]. J Tradit Complem, 2015, 5(1): 42-50. |
| [45] | Thingale A D, Shaikh K S, Channekar P R, et al. Enhanced hepatoprotective activity of andrographolide complexed with a biomaterial [J]. Drug Deliv, 2015, 22(1): 117-124. |
| [46] | Suresh K, Goud N R, Nangia A. Andrographolide: Solving chemical instability and poor solubility by means of cocrystals [J]. Chem Asian J, 2013, 8(12): 3032-3041. |
| [47] | Pollier J, Goossens A. Oleanolic acid [J]. Phytochemistry, 2012, 77: 10-15. |
| [48] | Shanmugam M K, Dai X Y, Kumar A P, et al. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer: Preclinical and clinical evidence [J]. Cancer Lett, 2014, 364(2): 206-216. |
| [49] | Jeong D W, Kim Y H, Kim H H, et al. Dose-linear pharmacokinetics of oleanolic acid after intravenous and oral administration in rats [J]. Biopharm Drug Dispos, 2007, 28(2): 51-57. |
| [50] | 任天坤, 张宇睿, 刘晓亚, 等. 齐墩果酸共晶的制备及热力学研究 [J]. 中国医药工业杂志, 2014, 45(7): 649-652. |
| [51] | Goud N R, Suresh K, Sanphui P, et al. Fast dissolving eutectic compositions of curcumin [J]. Int J Pharm, 2012, 439(1/2): 63-72. |
| [52] | Odot J, Albert P, Carlier A, et al. In vitro and in vivo anti-tumoral effect of curcumin against melanoma cells [J]. Int J Cancer, 2004, 111(3): 381-387. |
| [53] | Mishra M K, Sanphui P, Ramamurty U, et al. Solubility-hardness correlation in molecular crystals: curcumin and sulfathiazole polymorphs [J]. Cryst Growth Des, 2014, 14(6): 3054-3061. |
| [54] | Sanphui P, Goud N R, Khandavilli U B R, et al. Fast dissolving curcumin cocrystals [J]. Cryst Growth Des, 2011, 11(9): 4135-4145. |
| [55] | 丛晓东. 大精酸共晶物、其制备方法、纯化方法及其在制备治疗糖尿病并发症药物中的应用: 中国, CN102603575 A [P]. 2012-07-25. |
 2016, Vol. 47
2016, Vol. 47


