益气养阴活血中药(参麦注射液与丹参注射液联合应用,YYH)临床常用于治疗休克、冠心病、心肌缺血再灌注(I/R)损伤、心力衰竭、急性脑梗死等[1, 2, 3, 4]。研究显示,急性心肌梗死患者冠状动脉介入治疗后早期联合应用参麦注射液与丹参注射液能够降低患者丙二醛(MDA)水平、升高超氧化物歧化酶(SOD)活性,减少白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等细胞因子,减轻炎症反应,减轻心肌I/R损伤,对缺血心肌具有一定的保护作用[1]。
线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)是存在于线粒体内膜的一种非特异性通道,众多研究证实,mPTP开放是引起心肌I/R损伤的关键因素,缺血心肌的功能恢复也与mPTP开放程度相关,故抑制其开放成为心肌保护作用的最终效应器[5, 6]。导致mPTP开放的因素主要包括线粒体钙超载、线粒体源性活性氧类物质爆发产生引起的脂质过氧化反应。PI3K-Akt和ERK1/2信号通路成为心肌I/R损伤中介导心肌保护的重要信号转导通路[7, 8],再灌注期间激活PI3K-Akt及ERK1/2信号通路,能够抑制mPTP开放,在线粒体水平发挥心肌保护作用[9, 10]。
大鼠离体心脏I/R损伤模型通过灌流液的调整或阻断模拟全心I/R,是常用的研究I/R的体外模型。本实验应用此模型,观察YYH对心脏的保护作用,及其通过激活PI3K-Akt与ERK1/2信号通路,抑制mPTP开放,发挥心肌保护作用的机制。
1 材料 1.1 动物健康雄性SD大鼠,体质量300~340g,北京华阜康生物科技股份有限公司提供,合格证号SCXK(京)2009-0004。
1.2 药品与试剂YYH,即参麦注射液(批号1107201)、丹参注射液(批号1208162)按1∶1配制,两种注射液均由正大青春宝药业有限公司提供。环孢素A(CsA,批号C3662-5mg)、2,3,5-三苯基氯化四氮唑(TTC)、PD98059、钙离子载体A23187,Sigma-Aldrich公司;肌酸激酶(CK)、乳酸脱氢酶(LDH)试剂盒,中生北控生物科技股份有限公司;Akt、p-Akt(Ser-473)、ERK1/2、p-ERK1/2、GSK-3β、p-GSK-3β(Ser-9)抗体,Cell Signaling Technology,Inc.;PI3K选择性抑制剂LY294002(LY),Apollo Scientific有限公司;线粒体提取试剂盒、抗霉素,北京索莱宝科技有限公司。
Krebs-Henseleit(K-H)缓冲液(mmol/L):NaCl 118、NaHCO3 24.0、KCl 4.7、MgSO4 1.2、KH2PO4 1.2、葡萄糖11.1、CaCl2 2.5,实验前1~2h通入95% O2、5% CO2混合气体,维持pH值7.2~7.4。
线粒体肿胀液(mmol/L):①KSCN 150、3-(N-吗啉基)丙磺酸20、Tris 10、次氮基三乙酸2、鱼藤酮0.5 μmol/L、抗霉素0.5 μmol/L、A23187 2 μmol/L(pH值为7.2)。②KCl 120、Tris或Tris-HCl 10、丙磺酸20、KH2PO4 5。
线粒体重悬液(mmol/L):蔗糖 320、Tris-HCl或Tris 10(pH值为7.4)。
1.3 仪器Langendorff离体心脏灌流系统、MLP844压力换能器,澳大利亚ADInstrument Pty有限公司;日立7020全自动生化分析仪,日本HITACHI公司;Philips EM400ST型透射电子显微镜,荷兰Philips Tecnai公司;LKB-V型超薄切片机,瑞典LKB公司;UC750超声波破碎仪,美国SONICS公司;蛋白电泳转印系统、多板制胶机,BIO-RAD;Enspire多功能读板机,美国Perkinselmer公司。
2 方法 2.1 大鼠离体心脏的制备按照文献方法制备大鼠离体心脏[11],戊巴比妥钠(50mg/kg,ip)麻醉大鼠,开胸迅速取出心脏,置于4 ℃ K-H缓冲液中,剥离残留的肺脏或周围组织,立即将心脏连接到灌流装置,并将主动脉与灌流装置针头固定,K-H缓冲液逆行灌流。MLP844压力换能器监测冠脉灌注压。将一自制的封闭球囊置于左心室,进行等容心室内压力监测,反映心脏功能[12]。调节球囊大小,使左心室舒张压(LVEDP)维持在0.66~1.33kPa,心脏功能用LVEDP、左心室收缩压(LVSP)、左室发展压(LVDP)、左心室内压最大上升速率(+dp/dtmax)、左心室内压最大下降速率(−dp/dtmax)及心率压力乘积(RPP)等指标进行评价[13]。调节冠脉流量在10~15mL/min内,使灌注压维持在8.64 kPa左右,进行恒压灌注[12]。
2.2 分组及I/R模型的制备采用全心停灌30 min,再灌注60min的方法建立I/R模型。具体灌流方法:对照组以K-H缓冲液灌流120min;模型组以K-H缓冲液平衡心脏30min,停止灌流30min,再灌注60min;YYH低、中、高剂量组以K-H缓冲液平衡心脏20min,用含终体积分数为2.5、5、10 μL/mLYYH的K-H缓冲液灌流心脏10min,灌流冲洗,停灌、再灌注同模型组;YYH+LY组:心脏平衡15min后,用含15 μmol/L LY的K-H液灌流心脏15min,后10min同时灌流10 μL/mL YYH,停灌、再灌注同模型组;LY组:心脏平衡15min后,用含15 μmol/L LY的K-H液灌流心脏15min,停灌、再灌注同模型组;mPTP开放实验,设立阳性药组:心脏平衡25min后,1 μmol/L的mPTP特异性抑制剂CsA灌流5min,停灌、再灌注同模型组。停止灌流期间,心脏用37 ℃K-H液恒温浸泡。
2.3 心脏功能的测定实验分组为对照组,模型组,YYH低、中、高剂量组,YYH+LY组,LY组,方法同“2.2”项。检测±dp/dtmax、LVSP、LVEDP、心率(HR),计算LVDP、RPP。
LVDP=LVSP-LVEDP
RPP=LVDP×HR
2.4 心脏流出液CK、LDH活性的测定实验分组为对照组,模型组,YYH低、中、高剂量组,方法同“2.2”项。分别在心脏灌注平衡20min,再灌注5、10、20、30、60min收集冠脉流出液,全自动生化分析仪测定CK、LDH活性。
2.5 TTC染色观察心肌梗死面积实验分组为模型组、YYH高剂量组、YYH+LY组,方法同“2.2”项。TTC染色法[14]确定心肌梗死面积。−20 ℃冷冻心脏20min,取出后沿心脏短轴切成横切面1~2mm厚的切片。切片放入1%TTC(pH7.4,温度37 ℃)中染色15min,10%甲醛固定隔夜,数码相机拍照。砖红色为正常区域,白色或灰白色为梗死区域。
2.6 心肌超微结构观察实验分组为对照组、模型组、YYH高剂量组,方法同“2.2”项。取约1.5mm3大小新鲜固定部位心尖部组织,3%戊二醛固定(0.1mol/L PBS,pH7.2,4℃)过夜,磷酸缓冲液(0.1mol/L PBS,pH7.2,4℃)漂洗10min,共漂洗3次,用1%四氧化锇固定2h,再用磷酸盐缓冲液(0.1mol/L PBS,pH7.2,4℃)漂洗15min,共漂洗3次,经30%~100%梯度乙醇(4℃)逐级脱水,以包埋剂SPI-PON 812环氧树脂包埋,40℃ 24h浸透,60℃ 48h聚合,LKB-V型超薄切片机制作超薄切片,柠檬酸铅-乙酸双氧铀双染色后,在Philips EM400ST型透射电子显微镜下观察心肌细胞超微结构。
2.7 Westernblotting检测心肌组织蛋白表达再灌注10min,迅速取下心脏,取左室组织约100mg,置于预冷的组织裂解液中尽快剪碎,用组织匀浆机制成10%匀浆,匀浆液4 ℃,14000×g离心15min,吸取上清液,Bradford法进行蛋白浓度测定。每4 μL蛋白样品加入1 μL SDS-PAGE蛋白上样缓冲液混合,沸水3~5min,使蛋白充分变性,取40 μg样品上样至12.5% SDS-PAGE凝胶电泳,随后电转膜至硝化纤维膜,Western封闭液封闭6h,分别用Akt、p-Akt、ERK1/2、p-ERK1/2及GSK-3β、p-GSK-3β一抗4 ℃孵育24h,二抗室温缓慢振荡孵育2h,显色后底片进行数码拍摄,并用ImageJ 1.37软件进行半定量灰度分析。
2.8 心肌线粒体的制备采用差速分级离心法分离线粒体[15]。将大鼠左心室剪为碎块,匀浆,1000×g离心5min;取上清,1000×g再次离心5min;取上清12000×g离心10min,线粒体沉淀在管底;加入线粒体重悬液重悬沉淀,1000×g离心5min;取上清,12000×g离心10min,高纯度的线粒体沉淀在管底。所有操作均低温进行,考马斯亮蓝测定蛋白量。
2.9 无能量条件mPTP开放的检测取下I/R心脏制备线粒体,mPTP的开放以线粒体在200 μmol/LCaCl2作用下肿胀产生的520nm处吸光度(A)值的下降来反映[16]。取线粒体用线粒体肿胀液①稀释至0.5g/L蛋白,于25 ℃,200 μmol/L CaCl2作用于线粒体,连续观察A值的变化。该变化反映线粒体肿胀程度,提示mPTP的开放情况。当mPTP开放时,导致线粒体通透性增加,肿胀液中的溶质内流入线粒体基质,引起线粒体膨胀,体积增大,外膜破裂,A值下降[17]。
提取对照组、缺血30min/再灌注3、120min心脏线粒体,进行线粒体在无能量条件下mPTP开放实验以确定再灌注时间;进而按照“2.2”项方法设置模型组、YYH高剂量组、阳性药组,进行线粒体在无能量条件下mPTP开放实验(再灌注时间为3min)。
2.10 药物与线粒体孵育检测mPTP的开放mPTP的开放以线粒体肿胀产生的A值下降来反映[15, 17]。制备正常大鼠心脏线粒体,取线粒体与0、2.5、5、10、20 μL/mL YYH或参麦注射液、丹参注射液体外25 ℃孵育10min,1 μmol/L CsA和线粒体孵育5min作为阳性药组。用线粒体肿胀液②稀释至0.25g/L蛋白,200 μmol/L CaCl2作用于线粒体诱发mPTP的开放,连续观察A值的变化,反映mPTP的开放情况。
2.11 统计学处理实验数据用 x±s表示,应用SPSS 17.0统计软件,多组间比较用单因素方差分析,两组间比较用t检验。
3 结果 3.1 对离体心脏功能的影响再灌注5、10、20、30、40、60min,模型组RPP、±dp/dtmax绝对值、LVDP显著降低。YYH 10 μL/mL组上述指标显著升高,与模型组比较,差异显著(P<0.05、0.01)。YYH与LY同时应用,YYH对心脏功能指标的改善作用部分或完全抵消;LY单独应用无显著影响,结果见表 1~4。
| 表 1 YYH对大鼠离体心脏再灌注不同时间RPP的影响 Table 1 Effects of YYH on RPP at different time points after reperfusion of rat isolated heart |
| 表 2 YYH对大鼠离体心脏再灌注不同时间+dp/dtmax的影响 Table 2 Effects of YYH on +dp/dtmax at different time points after reperfusion of rat isolated heart |
| 表 3 YYH对大鼠离体心脏再灌注不同时间−dp/dtmax的影响 Table 3 Effects of YYH on −dp/dtmax at different time points after reperfusion of rat isolated heart |
| 表 4 YYH对大鼠离体心脏再灌注不同时间LVDP的影响 Table 4 Effects of YYH on LVDP at different time points after reperfusion of rat isolated heart |
再灌注5、10、20、30、60min,模型组CK、LDH释放量显著升高(P<0.01)。再灌注60min时,YYH5 μL/mL组CK、LDH释放量显著降低,再灌注20、60min时,YYH10 μL/mL组CK、LDH释放量显著降低,与模型组比较,差异显著(P<0.05、0.01)。结果见图 1。
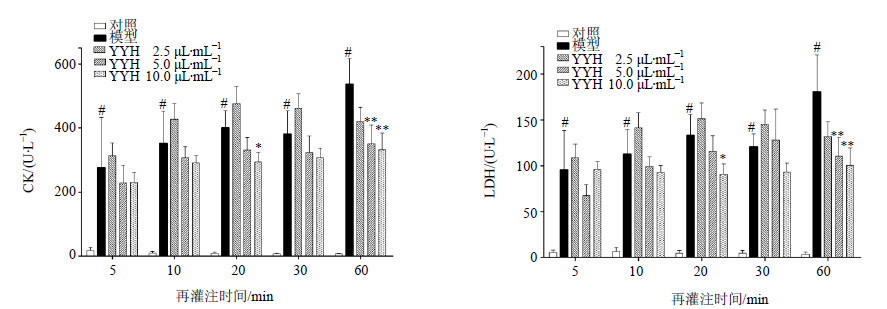 | 图 1 YYH对大鼠离体心脏冠脉流出液体CK和LDH水平的影响( x±s, n = 6) Fig.1 EffectsofYYHonCK and LDHlevelsincoronaryeffluentofratisolated heart( x±s, n = 6) |
1%TTC染色后,模型组心脏缺血区域呈白色或灰白色,YYH10 μL/mL组白色或灰白色区域减少,鲜红色或砖红色区域增多。YYH与LY同时灌流,YYH对心脏的保护作用被部分或完全抵消,见图 2。
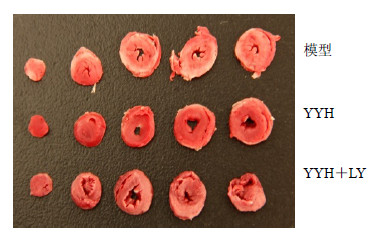 | 图 2 离体大鼠心脏TTC染色 Fig.2 TTCstainingofratisolated heart |
对照组大鼠心肌微观结构基本正常,细胞无水肿,细胞核无肿胀,核膜完整,异染色质和常染色质清晰可见。肌纤维排列较整齐,肌丝和肌小节结构清晰,可见A带、I带与H带及M线与Z线;线粒体膜完整,聚集在一起,嵴密集;糖原颗粒较多;心肌间小血管结构正常,偶有肌膜肿胀呈指状突起现象。模型组心肌细胞水肿,肌浆网扩张,空泡化;细胞核固缩、周边凝集,核染色质溶解;肌小节明暗带模糊不清,肌丝多发性灶性坏死、溶解断裂,部分细胞肌膜崩解;线粒体肿胀、嵴溶解,可见灶性空化,基质内有钙盐样致密颗粒。YYH10μL/mL组病变显著减轻,肌原纤维排列整齐,偶见小区域灶性溶解,肌小节结构清晰,线粒体稍肿胀,嵴规则致密;肌浆网轻度扩张。结果见图 3。
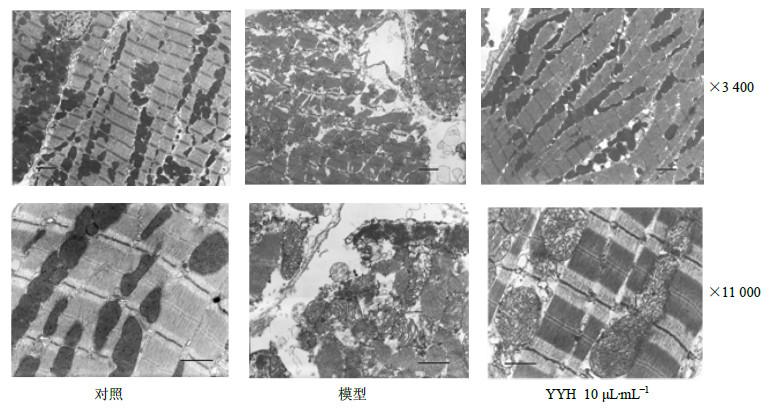 | 图 3 透射电镜观察心肌超微结构改变Fig.3 Transmission electron micrographs of myocardial ultrastructure |
Western blotting结果显示,各组Akt、ERK1/2、GSK-3β蛋白表达无显著差异。与对照组比较,模型组p-Akt/Akt、(p-ERK1/2)/ERK1/2蛋白表达升高;YYH预处理后p-Akt/Akt、(p-ERK1/2)/ERK1/2、p-GSK-3β/GSK-3β升高,提示YYH能上调3种蛋白磷酸化表达;YYH+LY组p-Akt、p-GSK-3β蛋白表达显著降低,提示LY阻断了YYH诱导的p-Akt、p-GSK-3β蛋白表达上调,结果见图 4。
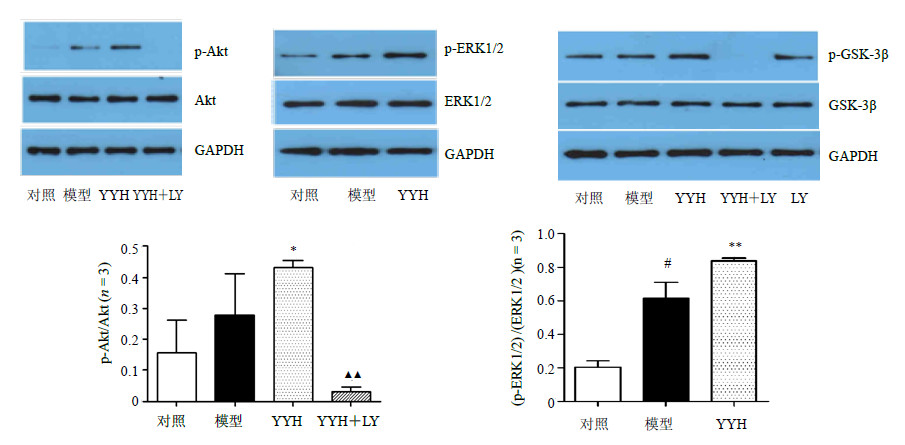 | 图 4 离体大鼠心脏p-Akt、Akt、ERK1/2、p-ERK1/2、p-GSK-3β、GSK-3β蛋白表达 Fig.4 Expression of p-Akt, Akt, ERK1/2, and p-ERK1/2 protein in rat isolated heart |
对照组心脏线粒体A值显著下降,线粒体肿胀率很高,提示在外源性钙刺激下mPTP大量开放;再灌注120min组线粒体肿胀率较低,与对照组比较,差异显著(P<0.01)。再灌注3min组线粒体肿胀率较高,与对照组比较,差异不显著。结果见图 5。选择再灌注3min进行接下来的实验。
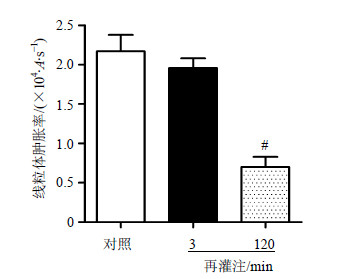 | 图 5 缺血再灌注损伤心肌线粒体去能量条件下mPTP开放实验 ( x±s,n=4) Fig.5 mPTP opening in isolated de-energised mitochondria with I/R injuried myocardia ( x±s,n=4) |
10 μL/mL YYH组心脏分离线粒体,A值显著下降,与模型组比较,更容易开放,差异显著(P<0.01);CsA部分抑制了A值显著下降,与模型组比较,差异显著(P<0.05),结果见图 6。
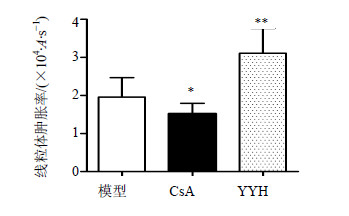 | 图 6 YYH对缺血再灌注损伤心肌线粒体mPTP开放的影响( x±s,n=6) Fig.6 Effects of YYH treatment of perfused rat hearts on mPTP opening in subsequently isolated mitochondria ( x±s,n=6) |
CsA、YYH(2.5、5、10、20 μL/mL)、参麦注射液(2.5、5、10、20 μL/mL)均显著抑制A值下降,线粒体肿胀率与对照组比较,差异显著(P<0.01)。丹参注射液(2.5、5、10、20 μL/mL)对线粒体肿胀率无显著影响。结果见图 7。
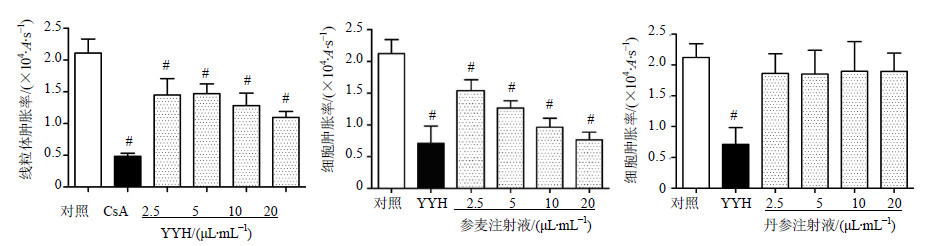 | 图 7 YHH、参麦注射液和丹参注射液体外对正常心肌线粒体mPTP开放的影响( x±s,n=6)Fig.7 Effects of YYH, Shenmai Injection, and Danshen Injection on mPTP opening in isolated mitochondria ( x±s,n=6) |
参麦注射液可以显著降低急性心肌梗死患者病死率、心衰发生率、再灌注心律失常发生率等[18]。丹参具有抑制血小板聚集、降低血黏度、改善微循环、保护缺血缺氧心肌细胞的作用。二者合用具有益气养阴、活血化瘀的功效,符合祖国医学“扶正祛邪”的治疗原则。药物处理后的离体心脏提取线粒体,常用“无能量条件mPTP开放实验”,考察药物对mPTP的抑制情况,文献报道[19],心脏遭受I/R损伤后提取的线粒体在Ca2+诱发下,A值显著下降,而心脏保护药物、缺血预处理、低温预处理能显著抑制A值下降,抑制mPTP的开放。也有文献报道[20],缺血预处理后提取的心脏线粒体在体外更容易开放。
故首先提取了未经缺血、缺血后再灌注3min、再灌注120min心脏线粒体,进行了mPTP开放实验,结果提示,未经缺血的心脏线粒体,在外源性钙刺激下A值急剧降低、mPTP大量开放;再灌注120min的线粒体A值下降不明显,可能由于mPTP在体时已经基本全部开放,细胞已经发生凋亡或坏死。并参考相关文献报道[19, 21],故选取了缺血30min/再灌注3min进行离体心脏给药后mPTP开放实验。结果表明,YYH处理的离体心脏mPTP更容易开放,表明其含有较多未开放的线粒体,提示YYH在体时可能减少了诱发mPTP开放的因素,如再灌注期间活性氧类物质的产生及线粒体钙超载,从而“间接”抑制了mPTP开放,减少了其凋亡或坏死的发生,保护了线粒体完整性;而CsA抑制mPTP开放的机制可能是CsA通过和CyP-D的结合,抑制CyP-D氨基脯氨酸顺反异构酶活性,阻止CyP-D和ANT的结合,防止了有利于mPTP开放的ANT胞浆构象的形成,因而其处理过的心脏分离的线粒体对外源性Ca2+不敏感[22],即使在体外mPTP也不容易开放。结果提示,YYH抑制mPTP开放的作用机制可能与CsA不完全相同。
除“间接”抑制mPTP开放外,YYH也可能通过作用于mPTP的结构蛋白,提高了线粒体对引起mPTP开放因素刺激的耐受性,从而“直接”抑制mPTP开放,如同CsA一样。为了进一步研究YYH对mPTP的抑制作用及发挥作用的主要药物,进行了YYH、参麦及丹参注射液与线粒体孵育后mPTP开放检测。结果显示,YYH、参麦注射液与线粒体孵育能直接抑制mPTP开放。
mPTP开放是引起心肌I/R损伤的关键因素,PI3K-Akt和ERK1/2通路是在其损伤中介导心肌保护的重要信号转导通路,再灌注期间激活PI3K-Akt及ERK1/2信号通路,能够抑制mPTP开放,在线粒体水平发挥心肌保护作用。结果显示,YYH能够改善离体心脏I/R后血流动力学恢复,降低CK、LDH的释放,减少心肌梗死面积,减轻心肌组织超微结构损伤。当YYH与PI3K选择性抑制剂LY同时应用时,YYH改善血流动力学、减少心肌梗死面积的作用被部分或完全消除,YYH能上调心肌p-Akt、p-ERK1/2、p-GSK-3β蛋白表达,而LY阻断了YYH诱导的p-Akt、p-GSK-3β蛋白表达上调,可见增加Akt、ERK1/2及GSK-3β磷酸化蛋白表达可能在YYH减轻心脏I/R损伤中发挥了重要作用。
综上所述,YYH可能主要通过激活PI3K/Akt和ERK1/2信号通路,抑制mPTP的开放,在线粒体水平发挥心肌保护作用,从而减轻心脏I/R损伤;其抑制mPTP开放的作用机制与CsA不完全相同;发挥直接抑制mPTP开放的药物是参麦注射液。
| [1] | 耿庆信, 朱兴雷, 张兴华, 等. 参麦注射液及复方丹参注射液合用对急性心肌梗死患者介入治疗后再灌注损伤的影响 [J]. 中国中西医结合杂志, 2004, 24(6): 496-499. |
| [2] | 崔文鹏, 杜 冰, 曲 锐. 参麦与丹参注射液治疗冠心病心绞痛的Meta分析 [J]. 时珍国医国药, 2010, 21(11): 2990-2991. |
| [3] | 张存林, 董耀荣. 参麦注射液联合丹参注射液治疗心力衰竭的疗效观察 [J]. 中国实用医药, 2008, 3(18): 137-138. |
| [4] | 舒建中, 王恰如. 参麦注射液和复方丹参注射液治疗急性脑梗死的Meta分析 [J]. 现代中西医结合杂志, 2008, 17(7): 973-976. |
| [5] | Halestrap A P, Clarke S J, Javadov S A. Mitochondrial permeability transition pore opening during myocardial reperfusion-a target for cardioprotection [J]. Cardiovasc Res, 2004, 61(3): 372-385. |
| [6] | Heusch G, Boengler K, Schulz R. Inhibition of mitochondrial permeability transition poreopening: the holy grail of cardioprotection [J]. Basic Res Cardiol, 2010, 105(2): 151-154. |
| [7] | Hauseuloy D J, Tsang A, Yellon D M, et al. The reperfusion injury salvage kinase pathway: A common target for both ischemic preconditioning and postconditioning [J]. Trends Cardiovasc Med, 2005, 15(2): 69-75. |
| [8] | Hausenloy D J, Tsang A, Mocanu M M, et al. Ischemic preconditioning protects by activating pro-survival kinases at reperfusion [J]. Am J Physiol Heart Circ Physiol, 2005, 288(2): 971-976. |
| [9] | Bopassa J C, Ferrera R, Gateau-Roesch O, et al. PI3-kinase regulates the mitochondrial transition pore in controlled reperfusion and postconditioning [J]. Cardiovasc Res, 2006, 69(1): 178-185. |
| [10] | Davidson S M, Hausenloy D, Duchen M R, et al. Signalling via the reperfusion injury signalling kinase(RISK)pathway links closure of the mitochondrial permeability transition pore to cardioprotection [J]. Int J Biochem Cell Biol, 2006, 38(3): 414-419. |
| [11] | Morrison R R, Teng B, Oldenburg P J, et al. Effects of targeted deletion of A1 adenosine receptors on postischemic cardiac function and expression of adenosine receptor subtypes [J]. Am J Physiol Heart Circ Physiol, 2006, 291(4): H1875-H1882. |
| [12] | Meng X, Ao L, Brown J M, et al. Nitric oxide synthase is not involved in cardiac contractile dysfunction in a rat model of endotoxemia without shock [J]. Shock, 1997, 7(2): 111-118. |
| [13] | Boles Ponto L L, O'Leary D S, Koeppel J, et al. Effect of acute marijuana on cardiovascular function and central nervous system pharmacokinetics of [15O] water: effect in occasional and chronic users [J]. J Clin Pharmacol, 2004, 44(7): 751-766. |
| [14] | Freeman I, Grunwald M A, Robin B, et al. Effect of early reperfusion on use of triphenyltetrazolium chloride to differentiate viable from non-viable myocardium in area of risk [J]. Cardiovasc Res, 1990, 24(2): 109-114. |
| [15] | Tanonaka K, Iwai T, Motegi K, et al. Effects of N-(2-mercaptopropionyl)-glycine on mitochondrial function in ischemic-reperfused heart [J]. Cardiovasc Res, 2003, 57(2): 416-425. |
| [16] | Halestrap A P, Woodfield K Y, Connern C P. Oxidative stress, thiol reagents, and membrane potential modulate the mitochondrial permeability transition by affecting nucleotide binding to the adenine nucleotide translocase [J]. J Biol Chem, 1997, 272(6): 3346-3354. |
| [17] | Baines C P, Song C X, Zheng Y T, et al. Protein kinase Ce interacts with and inhibits the permeability transition pore in cardiac mitochondria [J]. Circ Res, 2003, 92(8): 873-880. |
| [18] | 黄美施. 参麦注射液对急性心肌梗死病死率及其并发症影响的Meta分析 [D]. 广州: 南方医科大学, 2010. |
| [19] | Townsend P A, Davidson Sean M, Clarke Samantha J, et al. Urocortin prevents mitochondrial permeability transition in responseto reperfusion injury indirectly by reducing oxidative stress [J]. Am J Physiol Heart Circ Physiol, 2007, 293(2): H928-H938. |
| [20] | Javadov S A, Clarke S, Das M, et al. Ischaemic preconditioning inhibits opening of mitochondrial permeability transition pores in the reperfused rat heart [J]. J Physiol, 2003, 549(Pt 2): 513-524. |
| [21] | Clarke S J, Khaliulin I, Das M, et al. Inhibition of mitochondrial permeability transition pore opening by ischemic preconditioning is probably mediated by reduction of oxidative stress rather than mitochondrial protein phosphorylation [J]. Circ Res, 2008, 102(9): 1082-1090. |
| [22] | Halestrap A P, Mcstay G P, Clarke S J. The permeability transition pore complex: another view [J]. Biochimie, 2002, 84(23): 153-166. |
 2016, Vol. 47
2016, Vol. 47


