2. 清华大学, 北京 100084
2. Tsinghua University, Beijing 100084, China
赤芍和白芍为常用中药,根据《中国药典》2015年版规定[1],白芍为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根,置沸水中煮后除去外皮或去皮后再煮,晒干使用;赤芍为毛茛科植物芍药Paeonia lactiflora Pall.或川赤芍Paeonia veitchii Lynch.的干燥根,晒干使用。临床应用白芍、赤芍植物来源基本一致,主要区别为白芍为栽培品,赤芍为野生品。在中医临床应用上,白芍、赤芍同是寒性药,具有清热的共性,但白芍属补虚药,长于补血平抑肝阳,具有养血调经、平肝止痛、敛阴止汗之功。赤芍属清热药,功偏清热凉血祛瘀。《注解伤寒论》[2]曾指出“芍药白补而赤泻,白收而赤散也”。现代研究表明[3],白芍和赤芍均以单萜苷及多元酚类化合物为代表性成分,这是相近的生物基原所决定的。但是由于生长环境的不同及药材采收后加工处理方式的差异,导致这些成分在2味药材中的量、结构有所变化。由此可知,赤芍、白芍植物主要来源相近、化学成分相似,但功效及临床应用各有偏重。中医讲究辨证论治,为保证临床用药安全有效,建立2种药材快速有效的鉴别方法显得极为重要。
近年来,傅里叶变换红外光谱法(FT-IR)在中药鉴别研究中的应用受到了越来越多的关注[4],其重现性好,样品处理简单,灵敏度高,加之现在已开发出便携式红外光谱仪,扩展了红外光谱仪的使用范围,给广大野外中药资源普查者带来了便利。孙素琴等[5-7]采用FT-IR和二维相关红外技术已成功地对多种药材进行了鉴别研究。本实验采用“红外光谱三级鉴别法”(红外原谱、二阶导数谱及二维相关谱结合)对白芍、赤芍进行红外光谱鉴别研究,旨在为白芍、赤芍的分析鉴定提供一种新方法。
1 材料与方法 1.1 材料白芍与赤芍均购自河北省安国市路路通中药饮片有限公司,经北京中医药大学王晶娟副教授鉴定白芍为毛茛科植物芍药Paeonia lactiflora Pall.除去栓皮的干燥根,赤芍为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根;芍药苷对照品(批号110736-201035)购自中国食品药品检定研究院;实验所用试剂均为分析纯。草酸钙与淀粉由清华大学化学实验室提供,购自西格玛奥德里奇贸易有限公司
1.2 仪器设备Spectrum GX FTIR光谱仪(Perkin-Elmer公司),测定范围4 000~400 cm−1,DTGS检测器,光谱分辨率4 cm−1,扫描信号累加次数16次,OPD速度为0.2 cm/s,扫描时实时扣除H2O和CO2的干扰。变温附件为50-886型Portable Controller可编程温度控制单元(Love Control公司),控温范围50~120 ℃。
1.3 样品制备白芍、赤芍分别干燥粉碎,过200目筛,每种各取5 g,用50%乙醇100 mL超声提取30 min,提取液回收乙醇后60 ℃减压干燥至恒定质量,即得醇提物样品。将白芍、赤芍的原药材粉末和醇提物粉末用KBr压片,红外光谱测定,分别获得相应的红外光谱图。
1.4 数据处理红外图谱采用Spectrum for windows软件;二阶导数谱采用Spectrum v3.02操作软件,13点平滑。采用清华大学分析中心红外光谱组自行设计的二维红外相关光谱分析软件获得二维相关红外光谱。
2 结果与讨论 2.1 白芍和赤芍原药材粉末的一维红外光谱分析草酸钙作为植物生长发育过程中的次级代谢产物,广泛存在于植物细胞中;淀粉作为植物的能量储存物质,大量富集在种子和根茎中。赤芍表现了草酸钙的三尖峰(1 621、1 317、780 cm−1),它们分别是草酸根负离子中C-O键的反对称伸缩振动、对称伸缩振动与弯曲振动,白芍只在1 318、780 cm−1处有吸收峰,且强度较低,可初步推断白芍、赤芍中均含有草酸钙晶体,赤芍中量较高(图 1)。同时,两者也表现了淀粉的阶梯峰(1 200~950 cm−1),但峰形和峰位稍有差异,白芍1 079 cm−1和1 024 cm−1左侧的小肩峰均不明显,而赤芍1 076 cm−1和1 016 cm−1的左侧有明显的肩峰1 104 cm−1和1 049 cm−1出现(图 2)。
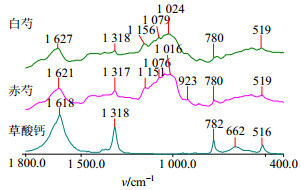
|
图 1 草酸钙、白芍和赤芍的一维红外光谱图 Fig.1 FT-IR spectra of calcium oxalate and samples |
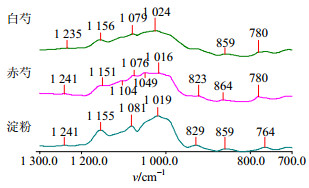
|
图 2 淀粉、白芍和赤芍的一维红外光谱图 Fig.2 FT-IR spectra of starch, Paeoniae Radix Alba and Paeoniae Radix Rubra samples |
2.2 白芍和赤芍原药材粉末的二阶导数谱分析
二阶导数红外光谱可以呈现出许多被掩盖谱峰的斜率变化特征,提高谱图分辨率。在白芍与赤芍原药材粉末的二阶导数谱中,白芍与赤芍位于1 317(1 316)、781(781)、518(517)cm−1的草酸钙特征峰完全被分离出来,3个峰的强度为赤芍大于白芍,进一步证明了赤芍中草酸钙的量相对较高(图 3)。
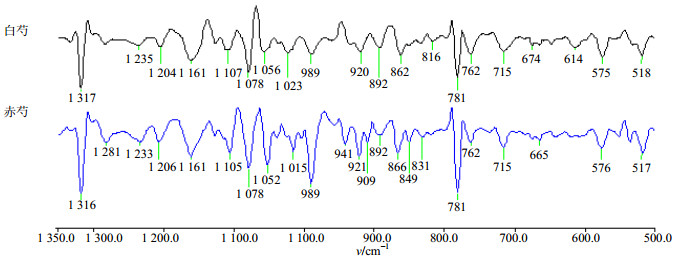
|
图 3 白芍和赤芍的二阶导数光谱图 Fig.3 SD-IR spectra of Paeoniae Radix Alba and Paeoniae Radix Rubra samples |
相同地,白芍与赤芍在1 200~950 cm−1波数内的差异被显著放大,淀粉的典型特征吸收峰(1 161、1 079、989 cm−1)也可以清晰地观察到。赤芍在1 161、1 105、1 078、1 052、1 015、989 cm−1等处的峰强度均高于白芍,且峰形与白芍也不尽相同。这可能与两者的采收加工有关,白芍采收后要置沸水中煮至透心去外皮晒干使用,在煮制过程中有序及无序态的淀粉分子间的氢键断开,具有胶束结构的β淀粉转化成了可溶性的α淀粉,可溶性的α淀粉部分溶于水中被除去,降低了白芍淀粉的量,同时还可能有转化的中间产物糊精生成,故在高分辨率的二阶导数谱上白芍的950~1 200 cm−1与赤芍有较大差异。
2.3 白芍、赤芍醇提物的红外光谱分析由图 4可以看出,白芍和赤芍在1 716(1 710)、1 451(1 451)、1 344(1 350)、1 278(1 279)、715(715)cm−1处的吸收峰与芍药苷位于的1 716,1 451、1 347、1 277、714 cm−1处的吸收峰类似,初步表明两者均含芍药苷。此外,白芍、赤芍都有一系列的C-O吸收峰,且与芍药苷的峰形不完全一致,说明白芍和赤芍中除了含有芍药苷以外,还含其他苷类和大量糖类;在C-O吸收处,赤芍有明显的1 051 cm−1和993 cm−1吸收峰,而白芍只在1 050 cm−1处有吸收峰但不明显,993 cm−1处更是弱化为一个肩峰,说明赤芍中所含的糖(苷)类比白芍的多。
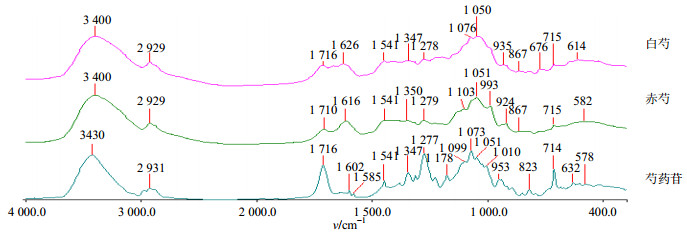
|
图 4 白芍、赤芍醇提取物和芍药苷的一维红外光谱 Fig.4 FT-IR spectra of alcohol extracts of Paeoniae Radix Alba and Paeoniae Radix Rubra samples |
二阶导数谱给出了更全面的信息(图 5),可见1 719(1 716)cm−1(C=O伸缩振动);1 602(1 603)、1 584、1 452 cm−1(苯环骨架振动);1 385(1 386)cm−1(-CH3弯曲振动);1 283(1 282)cm−1(单萜苷类中C-O-C的反对称伸缩振动);1 179 cm−1(单萜苷类中C-O-C的对称伸缩振动);715 cm−1(单取代苯)等芍药苷特征峰。从图 5中还可看出白芍、赤芍经二阶导数处理后峰形差别较大,在980~900 cm−1波数内,生白芍有强度一高一低2组峰,分别为962、949 cm−1(强度低),935、919 cm−1(强度高),而赤芍只有一组高强度的峰(941、920 cm−1);另外,在白芍中,1 079 cm−1与1 052 cm−1的强度比为1 079>1 052 cm−1,而赤芍中同一组峰强度比为1 078≈1 051 cm−1;赤芍在1 141 cm−1处有一中强峰,而白芍的相应位置未出峰,此波数范围内峰形和峰强的不同主要是由两者所含糖(苷)类化合物的量和结构有差异所引起的。
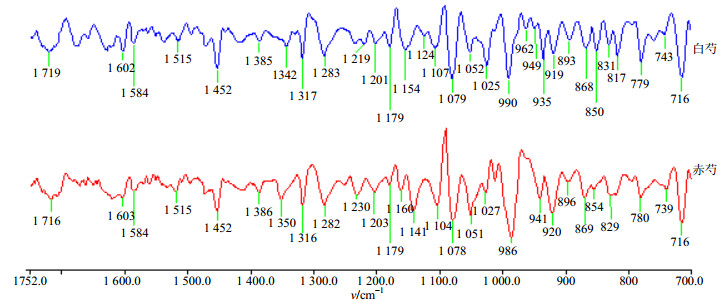
|
图 5 白芍和赤芍醇提物的二阶导数光谱 Fig.5 SD-IR spectra of alcohol extracts peoniflorin of samples |
2.4 白芍、赤芍醇提物的二维红外光谱分析
二维相关图使用微扰来扩大差异的方法。从图 6(a-1)可以清楚地看见白芍明显的自动峰有5个,分别在887、968、1 008、1 190、1 305 cm−1,其中1 190 cm−1的自动峰强度最大,其他自动峰强度较小,它们的交叉峰均为正。图 6(b-1)赤芍中有一个5×5的峰簇,该峰簇是由对角线上的5个自动峰892、968、1 018、1 088、1 186 cm−1彼此相关形成的,其中968 cm−1的自动峰强度最大,它们的交叉峰均为正。这说明两者的糖(苷)类基团受温度的影响是不同的,从样本的二维分析也进一步佐证了两者所含的糖(苷)类化合物有差异。
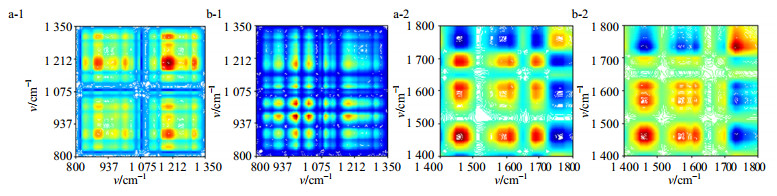
|
a-白芍b-赤芍1-800~1 350 cm−1 2-1 400~1 800 cm−1 a-Paeoniae Radix Alba b-Paeoniae Radix Rubra 1-800—1 350 cm−1 2-1 400—1 800 cm−1 图 6 白芍、赤芍醇提物在不同波数围内的二维红外光谱图 Fig.6 2D-IR spectra of alcohol extracts of samples in different wavelength ranges |
从图 6(a-2)看出,白芍有1 458、1 611、1 686 cm−13个强的自动峰,且1 458 cm−1自动峰强度最大,形成3×3矩阵;图 6(b-2)中赤芍含有1 465、1 563、1 609、1 729 cm−1 4个强自动峰,但其最强的自动峰出现在1 729 cm−1处。两者自动峰位置和相对峰强度不同,说明2药材的芳香类化合物对温度的敏感程度不同,也说明了两者所含的芳香基团不尽相同。综上,可以根据两者自动峰峰位及强度的差异来区分白芍和赤芍。
3 讨论从药材原粉末红外光谱中可以看出白芍和赤芍中都含有草酸钙和淀粉,其中赤芍中草酸钙量较多;二阶导数光谱进一步佐证了该结果并分析出白芍在采收加工过程中淀粉有损失,并可能有糊精生成。白芍、赤芍的醇提物红外光谱图中,有较明显的芍药苷吸收峰,通过比较1 051 cm−1和993 cm−1处赤芍与白芍的吸收,可看出赤芍中所含糖(苷)类比白芍多。分析白芍、赤芍在900~1 100 cm−1处的二阶导数光谱,两者相应吸收峰处的峰形、峰强度均有不同,与两者所含糖(苷)类化合物存在差异有关。
通过白芍、赤芍醇提物的二维红外光谱分析,进一步佐证了两者所含糖(苷)类化合物存在差异;且也证明了两者所含的芳香基团有一定差异。
综上,采用红外光谱技术并结合二阶导数谱和二维红外光谱可以获得白芍和赤芍的整体结构信息,递进式的验证了两者所含物质结构和量的差异,初步地鉴定白芍和赤芍,为今后系统完整的鉴定研究工作打下基础,也为基原相近、易混淆的中药鉴别提供了一个可发展的方向。
| [1] | 中国药典[S].一部.2015. |
| [2] | 汉·张仲景. 注解伤寒论[M]. 北京: 人民卫生出版社, 2012 . |
| [3] | 杨柳, 许舜军, 吴金雄, 等. 白芍、赤芍的比较研究概况[J]. 中药新药与临床药理 , 2011, 22 (5) :577–580. |
| [4] | 闫珂巍, 王福, 梅国荣, 等. 基于近红外光谱技术快速定性鉴别广陈皮模型的建立[J]. 中草药 , 2015, 46 (20) :3096–3099. |
| [5] | Liu X H, Xu C H, Sun S Q, et al. Discrimination of different genuine Danshen and their extracts by Fouriertransform infrared spectroscopy combined with two-dimensional correlationinfrared spectroscopy[J]. Spectrochim Acta Part A , 2012, 97 :290–296. DOI:10.1016/j.saa.2012.06.013 |
| [6] | Xu C H, Jia X G, Xu R, et al. Rapid discrimination of Herba Cistanches by multi-step infraredmacro-fingerprinting combined with soft independent modelingof class analogy[J]. Spectrochimica Acta Part A , 2013, 114 :421–431. DOI:10.1016/j.saa.2013.05.024 |
| [7] | Wang Y, Xu C H, Wang P, et al. Analysis and identification of different animal horns by a three-stage infraredspectroscopy[J]. Spectrochim Acta Part A , 2011, 83 :265–270. DOI:10.1016/j.saa.2011.08.029 |
 2016, Vol. 47
2016, Vol. 47


