2. 陕西省咸阳市实验中学, 陕西 咸阳 712000
2. Xianyang Shiyan Middle School, Xianyang 712000, China
珠子参Panacis Majoris Rhizoma(PMR)系五加科植物珠子参Panax japonicus C. A. Meg var. major (Burk.) C. Y. Wu et Feng ex C. Chow的干燥根茎,别名扣子七、钮子七、竹鞭三七、疙瘩七等。民间习用其干燥根状茎入药。珠子参味苦、甘,微寒,归肝、肺、胃经,具有补肺养阴、祛瘀止痛、止血等功效,主治气阴两虚、烦热口渴、虚劳咳嗽、关节痹痛、咯血、吐血、衄血、崩漏及外伤出血等[1]。主要化学成分为皂苷类化合物,主要为齐墩果烷型皂苷,如竹节参皂苷IVa;以及达玛烷型皂苷,如人参皂苷Rb1、Rd(原人参二醇型),人参皂苷Re、Rgl(原人参三醇型),珠子参苷R1、R2(奥可提罗型)[2]。现代药理学研究显示,珠子参具有较广泛的药理作用,表现在抗炎(抑制生物及化学炎症)、中枢神经系统抑制(镇痛)、抗肿瘤、增强免疫功能、保护心血管系统以及增强造血功能等[3-8]。尤其在抗肿瘤作用方面,相关研究表明,珠子参中的皂苷成分能够显著抑制体外肿瘤株(如HL-60细胞)的增殖。同时,珠子参提取物还具有诱导人肝癌细胞凋亡,增加抑癌基因p53和p21表达的作用[9-10]。因此,对于珠子参中皂苷类成分的测定有助于今后珠子参制剂的进一步开发与利用。本研究采用高效液相色谱-电喷雾-三重四级杆质谱联用(HPLC-ESI-MS/MS)的方法,同时测定了珠子参中15种主要皂苷类成分(人参皂苷Rb2、Re、Ro、Rd、Rg1、Rb3、Rb1、Rc、Rh2、F2、Rg3、Rf,三七皂苷R1,姜状三七皂苷R1,竹节参皂苷IVa的量,有利于全面、有效地控制珠子参药材的质量。
1 仪器与试药 1.1 仪器Agilent 1260型高效液相色谱串联AB SCIEX 4500 Qtrap三重四级杆线性离子阱质谱仪(美国Agilent公司,美国AB SCIEX公司);KQ-300DE型数控超声波清洗器(昆山市超声仪器有限公司);GeneVac miVac低温离心浓缩仪(英国GeneVac公司);Sartorius CPA225D十万分之一电子分析天平(德国赛多利斯科学仪器有限公司)。
1.2 试药皂苷对照品人参皂苷Re(批号110754-200320),三七皂苷R1(批号110745-200109),人参皂苷Rg1(批号110703-200322),人参皂苷Rb1(批号110704-200921)购自中国食品药品检定研究院;人参皂苷Rb2(批号A0235)、人参皂苷Ro(批号A0522)、人参皂苷Rd(批号A0245)、人参皂苷Rb3(批号A0236)、人参皂苷Rc(批号A0243)、人参皂苷F2(批号A0449)、人参皂苷Rh2(批号A0241)、人参皂苷Rg3(批号A0239)、人参皂苷Rf(批号A0522)购自成都曼思特生物科技有限公司,质量分数均大于98%。竹节参皂苷IVa(批号20140518,质量分数98%)购自宝鸡市辰光生物科技有限公司。姜状三七皂苷R1为实验室自制,质量分数大于97%。乙腈(色谱纯,Fisher公司),甲酸(色谱纯,Fluka公司),其他试剂均为分析纯。实验用水为娃哈哈纯净水。珠子参药材采自陕西省太白县,经陕西中医药大学陕西省中药资源产业化协同创新中心刘世军副教授鉴定为珠子参Panax japonicus C. A. Meg var. major (Burk.) C. Y. Wu et Feng ex C. Chow的干燥根茎。
2 方法与结果 2.1 色谱条件色谱柱为Waters Sunfire TM C18柱(150 mm×1.5 mm,5μm),流动相为0.05%甲酸-水溶液(A)-0.05%甲酸乙腈溶液(B),梯度洗脱程序为0~5 min,10%~23% B;5~15 min,23%~35% B;15~20 min,35%~48% B;20~25 min,48%~96% B;25~28 min,96%~10% B;28~30 min,10% B。柱温30 ℃;体积流量为0.8 mL/min,进样量5 μL。
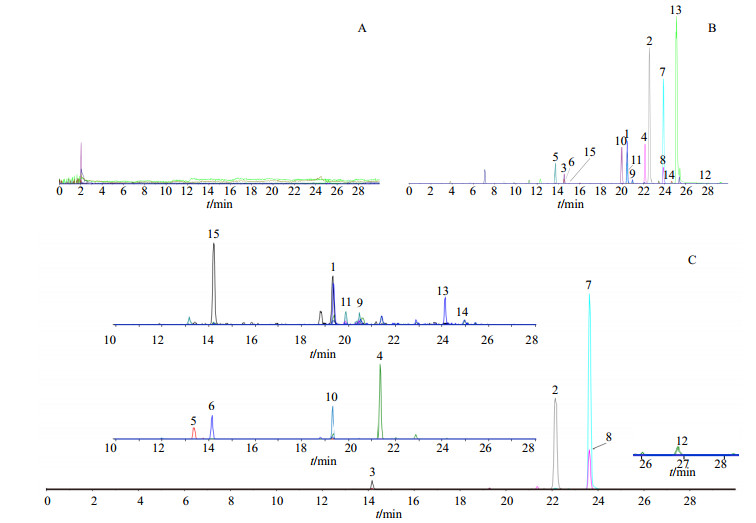
2.2 质谱条件质谱采用ESI负离子模式进行扫描,检测模式为多反应检测(MRM)。离子化参数为离子喷雾电压,负离子模式−4 500 V;雾化气和辅助气为氮气;辅助气温度650 ℃,气帘气温度35 ℃,化合物离子对,优化后的采集参数去簇电压(DP)、碎裂能量(CE)和碰撞池出口电压(CXP)等信息见表 1,样品、对照品MRM提取离子流谱图见图 1。
|
|
表 1 15种皂苷类化合物多反应检测参数 Table 1 Optimized MS parameters for 15 ginsenosides |
|
1-人参皂苷Rb2 2-人参皂苷Ro 3-人参皂苷Re 4-人参皂苷Rd 5-三七皂苷R1 6-人参皂苷Rg1 7-姜状三七皂苷R1 8-竹节参皂苷IVa 9-人参皂苷Rb3 10-人参皂苷Rb1 11-人参皂苷Rc 12-人参皂苷Rh2 13-人参皂苷F2 14-人参皂苷Rg3 15-人参皂苷Rf 1-ginsenoside Rb2 2-ginsenoside Ro 3-ginsenoside Re 4-ginsenoside Rd 5-Panax notoginseng saponins R1 6-ginsenoside Rg1 7-Panax zingiberensis saponins R1 8-chikusetsusaponin IVa 9-ginsenoside Rb3 10-ginsenoside Rb1 11-ginsenoside Rc 12-ginsenoside Rh2 13-ginsenoside F2 14-ginsenoside Rg3 15-ginsenoside Rf 图 1 空白溶液(A)、混合对照品溶液(B)和珠子参样品溶液(C)的MRM提取离子流图 Fig.1 MRM chromatograms of blank solution (A), mixed reference solution (B), and PMR sample solution (C) |
2.3 对照品溶液制备
分别取15种皂苷类成分对照品适量,精密称定,加90%甲醇溶液制成每毫升含人参皂苷Rb2 1.08 mg、人参皂苷Ro 8.86 mg、人参皂苷Re 0.08 mg、人参皂苷Rd 0.05 mg、三七皂苷R1 0.44 mg、人参皂苷Rg1 0.47 mg、姜状三七皂苷R1 4.98 mg、竹节参皂苷IVa 0.19 mg、人参皂苷Rb3 1.22 mg、人参皂苷Rb1 0.16 mg、人参皂苷Rc 1.17 mg、人参皂苷Rh2 0.06 mg、人参皂苷F2 0.27 mg、人参皂苷Rg3 0.41 mg、人参皂苷Rf 0.36 mg的对照品储备液,于4 ℃保存。分别取不同体积上述对照品储备液,转移至10 mL棕色量瓶中,以10%甲醇水溶液制成含人参皂苷Rb2 81.381 1 μg/mL、人参皂苷Ro 2 952.592 3 μg/mL、人参皂苷Re 6.123 9 μg/mL、人参皂苷Rd 26.402 0 μg/mL、三七皂苷R1 34.137 6 μg/mL、人参皂苷Rg1 37.602 3 μg/mL、姜状三七皂苷R1 1 652.511 9 μg/mL、竹节参皂苷IVa 13.725 9 μg/mL、人参皂苷Rb3 94.027 0 μg/mL、人参皂苷Rb1 12.226 5 μg/mL、人参皂苷Rc 90.695 2 μg/mL、人参皂苷Rh2 0.887 2 μg/mL、人参皂苷F2 20.856 7 μg/mL、人参皂苷Rg3 31.558 6 μg/mL、人参皂苷Rf 27.841 6 μg/mL的混合对照品溶液,于4 ℃保存。
2.4 供试品溶液制备参考《中国药典》2015年版一部对珠子参样品溶液的制备方法,称取珠子参药材适量,研细,取本品粉末(过2号筛)约0.1 g,精密称定,置具塞锥形瓶中,精密加入60%乙醇25 mL,称定质量,35 ℃超声处理(功率180 W,频率40 kHz)45 min,放冷,再称定质量,用60%乙醇补足减失的质量。于4 ℃用低温离心浓缩仪浓缩至近干,残渣用10%乙腈水溶液溶解,制成4 mg/mL的样品溶液。溶液移入离心管中,以12 000 r/min离心5 min,0.22 μm滤膜滤过,取续滤液,作为待测供试品溶液。
2.5 标准曲线、检出限和定量限以空白样品为检测对象,添加不同体积的混合对照品溶液,按照选定的最优分析条件进行测定并分别计算检出限(LOD,S/N≥3)和定量限(LOQ,S/N≥10)。结果表明LOD范围为0.003~626.554 ng/mL,LOQ为0.075~1 762.150 ng/mL。
精密吸取“2.3“项下混合对照品溶液,按7个梯度体积稀释,同体积进样,进样量为5 μL,按照选定的最优分析条件进行测定,以峰面积为纵坐标(Y),化合物质量浓度为横坐标(X)绘制标准曲线,得到各成分的标准曲线方程和线性范围。结果表明,15种皂苷在质量浓度0.000 9~2 952.592 3 μg/mL线性范围内,r>0.999 6。15种皂苷的线性方程、r、方法检出限及定量限见表 2。
|
|
表 2 珠子参15种皂苷同时测定方法线性方程、检出限和定量限 Table 2 Linearity equation, range of determination with detection and quantitation limits results of 15 ginsenosides from PMR |
2.6 精密度试验
精密移取“2.3”项下混合对照品溶液,连续进样6次,按照本方法所确定的实验条件,进行精密度试验。15种皂苷类化合物响应信号的RSD在0.91%~7.94%,保留时间的RSD在0.07%~0.12%。
2.7 稳定性试验取同一批供试品(批号20150602),分别于制备后0、3、6、9、12、24 h,按照本方法所确定的实验条件进行测定,不同皂苷相应峰面积RSD在3.46%~5.55%,保留时间RSD在0.04%~0.12%。
2.8 重复性试验取同一供试品6份(批号20150602),按“2.4”项下方法分别制备供试品溶液,按照本方法所确定的实验条件进样,记录不同皂苷相应信号强度,计算质量分数。结果表明,各成分信号响应面积RSD 1.24%~2.71%,保留时间RSD在0.19%~0.30%。
2.9 加样回收率试验精密称取已测定的珠子参药材0.1 g,平行称定9份。分别精密加入相当于80%、100%和120%混标含量的对照品溶液,按照本方法所确定的实验条件进样,记录不同皂苷相应信号强度。结果表明,各成分平均加样回收率在98.15%~101.12%,RSD为0.83%~2.15%,表明方法准确度较好。
2.10 样品测定采用上述建立的方法,对3批珠子参药材进行测定。按照“2.4”项下方法分别制备供试品溶液,按照本方法所确定的实验条件进样,记录不同皂苷相应信号强度,按照外标法计算各成分质量分数,结果见表 3。
|
|
表 3 3批珠子参药材中15种皂苷类成分测定结果(n=3) Table 3 Determination for target 15 ginsensides in three batches of PMR samples (n=3) |
3 讨论 3.1 超声提取方法的选择
为了保证样品中的多种皂苷成分得到充分的提取,试验考察了不同超声提取时间、对成分提取率的影响,分别为15、25、35、45和55 min,结果显示15种皂苷类化合物中多数化合物在45 min时的提取率最高,因此选择超声提取时间为45 min。此外,还比较了提取温度和提取次数对提取率的影响,结果表明,超声池温度35 ℃时,药材中目标化合物提取效率较高,且单次提取率与重复提取率没有明显差别。因此,实验将提取时间和温度定为45 min和35 ℃。
3.2 浓缩方式优化提取液浓缩处理是样品前处理的重要步骤,常用低温离心浓缩、氮气吹干、旋转蒸发等方法,实验比较了上述3种方法对多种皂苷提取效果的影响。结果显示,低温离心浓缩与其他2种浓缩方式对大部分目标物的富集效果相差较为明显,采用氮气吹干和旋转蒸发方法,对于个别皂苷如姜状三七皂苷R1提取率下降,原因可能为加热温度较高,导致其在吹干或旋转蒸发过程中发生损失。因此,实验采用低温离心浓缩的方式进行样品溶液预浓缩。
3.3 色谱柱对分离效果的影响珠子参中15种皂苷混合物具有多种结构且性质相似,虽然MRM模式对化合物分离度不做要求,但仍要求化合物的基线分离和充分洗脱。实验比较了不同品牌不同类型色谱柱对这些化合物的分离情况:Thermo BDS hypersil C18柱(250 mm×4.6 mm,5μm)、Agilent 5 TC-C18(2)柱(250 mm×4.6 mm,5μm)、Waters Sunfire TM C18柱(150 mm×1.5 mm,5 μm)和岛津Inert Sustain C18柱(150 mm×4.6 mm,5 μm)等色谱柱对15种皂苷类化合物的分离效果,4种色谱柱对化合物的分离效果均较好,但Waters柱对分离人参皂苷,尤其是R1和Re效率较高,且峰形较好,能够提供较好的色谱峰形,因此实验选用Waters Sunfire TM C18柱。
3.4 流动相对分离效果的影响采用Waters Sunfire TM C18柱,考察了初始比例相同的甲醇-水、乙腈-水等流动相体系对皂苷化合物的分离效果,结果表明,乙腈洗脱皂苷的能力优于甲醇,且色谱峰形较好。另外,在质谱条件优化过程中发现,加入0.01%~0.05%甲酸能增强皂苷化合物的响应信号。因此,在乙腈-水流动相体系的水相中分别添加0.01%~0.05%的甲酸。结果显示,加入甲酸后,部分皂苷信号增强,洗脱能力和峰形都有不同程度的提高。优化结果表明,加入0.05%比例甲酸能获得更好的洗脱能力和信号强度,因此,确定采用0.05%甲酸/水-乙腈溶液作为流动相。在此基础上,进一步优化流动相初始比例,将初始梯度比例由5%乙腈逐步增加至15%,最终确定10%乙腈作为初始的有机-无机流动相比例。
3.5 质谱条件优化实验采用多反应检测方法进行质谱信号采集,能够通过对化合物母离子进行碰撞诱导,去除其他子离子干扰,只采集选定特异子离子的质谱信号。因此,得到化合物的信息特异性、灵敏度和准确度都很高。实验采用50%乙腈水溶液配置适当浓度的标准溶液,采用单质谱针泵,以ESI正负2种离子模式,恒流方式进样。根据皂苷化合物母离子质荷比采集二级质谱信号,找到子离子,选择丰度较高子离子作为特异性子离子,然后进行MRM采集参数DP、CE、CXP的优化,一般平行优化两次后得到确切结果。
4 结论本研究建立了同时检测珠子参中15种皂苷类化合物的液质联用方法。采用Waters Sunfire TM C18色谱柱,以含0.05%甲酸的水-乙腈溶液为流动相,负离子MRM模式采集化合物离子对信号,对目标化合物同时进行定性定量分析。本实验建立的检测方法前处理简单,结果灵敏度、准确度高、检测快捷,各项指标均可满足珠子参中多种皂苷的检测要求。
| [1] | 许苗苗, 宋蓓, 杨新杰, 等. 高效液相色谱法同时测定珠子参中4种化学成分的含量[J]. 中南药学 , 2014, 12 (8) :796–799. |
| [2] | Chan H H, Hwang T L, Reddy M V, et al. Bioactive constituents from the roots of Panax japonicus var.major and development of a LC-MS/MS method for distinguishing between natural and artifactual compounds[J]. J Nat Prod , 2011, 74 (4) :796–802. DOI:10.1021/np100851s |
| [3] | 陈涛, 胡卫, 崔帮平, 等. 珠子参对小鼠H22肝癌抑制作用及机制[J]. 世界华人消化杂志 , 2007, 15 (24) :2597–2601. |
| [4] | 贺海波, 石孟琼, 陈涛, 等. 珠子参水提物抗炎镇痛作用的实验研究[J]. 第三军医大学学报 , 2010, 32 (20) :2224–2227. |
| [5] | 王薇, 刘超, 崔九成, 等. 珠子参种质资源遗传多样性的ISSR分析[J]. 中草药 , 2014, 45 (17) :2525–2529. |
| [6] | 杨扬, 余汶静, 光梦凯, 等. 珠子参有效止血部位探究及其对内源途径凝血因子的作用[J]. 现代预防医学 , 2011, 38 (20) :4235–4237. |
| [7] | 张继红, 邓为, 石孟琼, 等. 珠子参皂苷对四氯化碳致大鼠肝纤维化的保护作用[J]. 中药药理与临床 , 2014, 30 (5) :73–78. |
| [8] | 包中文, 覃慧林, 石孟琼, 等. 珠子参总皂苷对心肌梗死保护作用机制研究[J]. 中药材 , 2015, 38 (6) :1230–1236. |
| [9] | 陈涛, 龚张斌. 珠子参对人早幼粒白血病HL-60细胞增殖的抑制和诱导分化作用的研究[J]. 中国中医药科技 , 2009, 16 (4) :278–279. |
| [10] | Song X, Wang W, Zhang X, et al. Deglucose chikusetsusaponin IVa isolated from Rhizoma Panacis Majoris induces apoptosis in human HepG2 hepatoma cells[J]. Mol Med Rep , 2015, 12 (4) :5494–5500. |
 2016, Vol. 47
2016, Vol. 47


