山药Dioscorea opposite L.又名薯蓣,为一年生或多年生缠绕性草质藤本,是中国传统的药食同源植物,主要食用部位为地下部肥大的肉质块茎[1],其味甘,性平,归脾、肺、肾经,具有补脾养胃、生津益肺、补肾涩精的功能,主治脾虚泄泻、食少浮肿、肺虚咳喘、消渴、肾虚尿频、遗精、带下等症[2-3]。山药块茎主要含有皂苷、黏液质、胆碱、山药碱、淀粉、糖蛋白、自由氨基酸、维生素C、碘质及各种氨基酸,并有人体不可缺少的碘、钙、铁和磷等微量元素[4]。山药中最主要的活性物质为多糖(包括黏液质及糖蛋白)、尿囊素、胆碱多酚氧化酶等多种活性成分[5]。其中山药多糖是目前公认的山药主要活性成分,也是近年来山药研究的热点,具有促进肠胃功能、保护肝脏、降血糖、抗衰老、抗氧化、抗突变、抗肿瘤及提高免疫力等生理活性[6]。随着人们生活水平的日益提高以及对食品营养、安全、保健意识的逐渐增强,人们对山药产品的需求量越来越大,对山药研究也受到重视。
江西是我国正品山药的地道和主要产区之一,出产的山药品质优良,在国内外享有盛誉。当前,江西生产上推广应用的主要为地方品种,但品种退化严重,病虫害抗性降低,江西山药产业发展遇到了前所未有的挑战[7]。江西种植的山药品种繁多,但大多为江西传统名优地方品种,如南城县的南城药薯和南城淮山药、瑞昌的瑞昌山药、永丰的永丰山药、广丰的千金薯、泰和的竹篙薯等。这些山药的品质较好,口感纯正,销售价格高,种植效益较好,有些已成为产区的地理标志和品牌性品种资源。但目前江西山药品种较多,市场上存在同物异名和同名异物的混乱现象,而且假冒山药的现象日益严重。
近二三十年来,植物组培技术对于作物种质资源的收集、繁殖和保存起着重要的作用,并且显示出其实用价值。但在植物组织培养过程中,体细胞无性系变异普遍存在,这些变异有的是不能遗传的变异即表观遗传变异,但大多数是可遗传变异,这样就有可能存在遗传完整性损失的危险[8]。因此,研究江西山药资源的遗传多样性及其组培苗的遗传稳定性对山药的引种育种、资源改良、资源鉴定和生产加工等具有重要意义。
DNA分子标记能够揭示物种核苷酸序列水平的遗传变异差异,具有可靠、精确、多态性高等诸多优势,在植物的鉴别、监管、多样性分析等中成为当前主要技术手段[9]。RAPD是在1990年由Williams[10]和Welsh[11]同时开发出来的一项遗传标记技术,由于其具有易扩增、多态性高、操作简便、无种属限制等优点而被广泛应用于不同类型植物遗传多样性和遗传稳定性研究中[12]。
目前,关于山药种质资源遗传多样性和遗传稳定性分子标记分析的研究少见报道,在国内,华树妹等[13]对34份福建山药种质资源的遗传多样性进行了RAPD分析,周延清等[14]、黄玉仙等[15]和李齐向等[16]分别对28份山药种质资源、94份山药种质资源以及90份山药种质资源的遗传多样性进行了ISSR和SRAP分析,但关于江西山药种质资源的分子标记分析尚未见报道。本研究采用RAPD技术研究江西山药种质资源遗传多样性及其组培苗遗传稳定性,旨在为江西山药引种育种、资源改良、品种鉴定、种质保存以及其种苗培育提供可靠依据。
1 材料和方法 1.1 材料供试材料为上饶师范学院生命科学学院课题组提供的11份来自江西不同地区的山药资源均由上饶师范学院生命科学学院王艾平教授完成鉴定,见表 1。江西山药各个品种微型块茎萌发的实生苗(对照组)及其带芽茎段连续继代6次后的组培苗(处理组)用于本实验的RAPD分析。
|
|
表 1 用于RAPD分析的江西山药种质资源 Table 1 Dioscorea opposita germplasm resources from Jiangxi province used for RAPD analysis |
黄独微型块茎萌发的实生苗、黄独带芽茎段连续继代6次后的组培苗、瑞昌山药微型块茎萌发的实生苗、瑞昌山药带芽茎段连续继代6次后的组培苗、南城山药微型块茎萌发的实生苗、南城山药带芽茎段连续继代6次后的组培苗、南城淮山药1微型块茎萌发的实生苗、南城淮山药1带芽茎段连续继代6次后的组培苗、南城淮山药2微型块茎萌发的实生苗、南城淮山药2带芽茎段连续继代6次后的组培苗、广丰药薯微型块茎萌发的实生苗、广丰药薯带芽茎段连续继代6次后的组培苗、广丰千金薯微型块茎萌发的实生苗、广丰千金薯带芽茎段连续继代6次后的组培苗、上饶信州山药微型块茎萌发的实生苗、上饶信州山药带芽茎段连续继代6次后的组培苗、泰和竹篙薯微型块茎萌发的实生苗、泰和竹篙薯带芽茎段连续继代6次后的组培苗、永丰淮山药微型块茎萌发的实生苗、永丰淮山药带芽茎段连续继代6次后的组培苗、铁棍山药微型块茎萌发的实生苗、铁棍山药带芽茎段连续继代6次后的组培苗分别编号,依次为S1~S22。
1.2 方法 1.2.1 基因组DNA的提取采用CTAB法提取样品S1~S22基因组DNA。在65 ℃水浴锅中预热CTAB提取液;在液氮中迅速研磨样品,将粉末状材料转入2 mL离心管中,加入预热的CTAB提取液(每克样品加入3~5 mL的提取液),65 ℃保温30~60 min,每隔10 min轻轻颠倒混匀;11 000 r/min条件下离心5 min,取上清转入新离心管;加入等体积酚-氯仿(1:1),充分混匀,12 500 r/min离心10 min,取上清转入新离心管;加入等体积氯仿,充分混匀,11 000 r/min离心10 min,取上清转入新离心管;重复以上步骤(加入等体积酚-氯仿以及加入等体积氯仿);加入2/3体积的异丙醇混匀,室温放置,沉淀15 min;11 000 r/min条件下离心6 min,弃上清;将沉淀用70%的乙醇漂洗1次,室温条件下11 000 r/min离心2 min,弃上清,重复洗一次;提取产物取2~3 μL用2.0%琼脂糖凝胶电泳检测,其余置于-20 ℃保存备用。
1.2.2 RAPD分析PCR扩增体系(20 μL)为DNA模板2 μL,引物1 μL,蓝色Mix 10 μL,去离子水7 μL。PCR扩增程序为94 ℃预变性3 min,然后进行40个循环:94 ℃变性30 s,36 ℃复性50 s,72 ℃延伸1.5 min;循环结束后72 ℃延伸10 min,4 ℃保存。
1.2.3 RAPD扩增产物的检测在华树妹等[13]的基础上,对24对引物进行筛选,并从中筛选出扩增条带清晰、多态性好的20对引物对22个江西山药样品进行PCR扩增,引物信息见表 2,将PCR产物在2.0%的琼脂糖凝胶电泳中检测。
|
|
表 2 RAPD分析随机引物编号与序列 Table 2 Random primer numbers and sequences used for RAPD analysis |
1.2.4 数据统计分析
PCR扩增产物的电泳位置在凝胶的某个相同迁移率位置上有DNA条带记为1,无DNA条带记为0。每次试验重复2次,只有稳定、清晰的多态性DNA条带才能用于数据分析。统计分析江西山药各品种对照组和处理组的扩增条带,计算江西山药各品种处理组的变异率(变异率=变异条带数/总条带数)。利用N TSYS2pc(Version 2.10e)软件,计算材料间的遗传相似系数,对得到的遗传相似性矩阵进行非加权组法(UPGM A)聚类分析,建立江西山药种质资源的聚类分析树状图。
2 结果与分析 2.1 DNA质量检测采用超微量核酸蛋白检测仪在260、280 nm测定江西山药DNA各个样品吸光度,其比值(A260nm/A280nm)介于1.7~1.9,表明提取的DNA可用于后续的实验。
2.2 江西山药遗传多样性分析 2.2.1 RAPD多态性分析图 1为引物XZJ-5、XZJ-6、XZJ-7和XZJ-8的PCR扩增产物检测结果。RAPD标记遗传多样性参数见表 3。
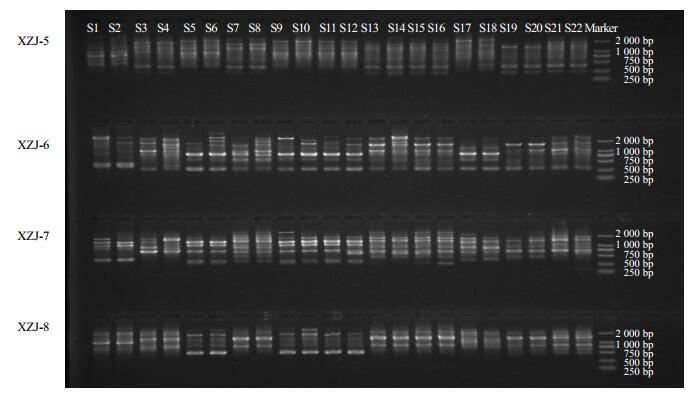
|
图 1 引物XZJ-5 、XZJ-6 、XZJ-7和XZJ-8的PCR扩增产物检测结果 Fig.1 PCR amplification product detection results of primers XZJ-5, XZJ-6, XZJ-7, and XZJ-8 |
|
|
表 3 江西山药种质资源RAPD标记遗传多样性参数 Table 3 Genetic diversity parameters for RAPD marker in D. opposite germplasm resources from Jiangxi province |
从表 3可知,用筛选出的20对随机引物(XZJ1~XZJ20)共扩增出238个条带,其中234个为多态性带,平均每个引物扩增出多态性带11.7条,平均多态性条带比率(PPB)为98.32%,平均每个位点的有效等位基因数为1.533 9,Nei基因多样性指数平均为0.319 2,平均Shannon表型多样性指数为0.485 2。RAPD分子标记的分析结果表明,在物种水平上11个江西山药品种的遗传差异性较大。
2.2.2 亲缘关系分析在NTSYS软件中计算样品间的遗传相似系数(GS),得到供试材料遗传相似矩阵(表 4)。遗传相似系数越大,表明亲缘关系越近,遗传相似系数越小,表明亲缘关系越远。由表 4可知11个山药品种的GS值为0.512 6~0.970 6,平均相似系数为0.723 1。
|
|
表 4 22个江西山药样本的遗传相似系数矩阵 Table 4 Genetic similarity coefficient matrix of 22 samples of D. opposite from Jiangxi province |
从表 4可知,在江西山药不同品种中,泰和竹篙薯(S17)和瑞昌山药(S3)的遗传相似系数最小,只有0.512 6,这说明这两者的亲缘关系最远,南城淮山药1(S8)和黄独(S1)的遗传相似系数也仅为0.521 0,说明两者的亲缘关系也比较远。信州山药(S15)和千金薯(S13)的遗传相似系数最大,高达0.928 6,说明这两者的亲缘关系最近,广丰药薯(S11)和南城山药(S6)的遗传相似系数也可达0.873 9,说明这两者的亲缘关系也比较近。信州山药和千金薯以及广丰药薯和南城山药均有可能是相互引种及地方种叫法多样引起。
2.2.3 聚类分析利用NTSYS软件对22份江西山药种质资源进行UPGMA聚类分析,结果如图 2所示。在0.717 3的遗传相似系数上22份材料可以聚成5大类群,即类群I~V。其中第I类群只包含1份材料,即黄独(S1和S2);第II类群也只包含1份材料,即瑞昌山药(S3和S4);第III类群共包含5份材料,分别是南城淮山药1(S7和S8)、千金薯(S13和S14)、信州山药(S15和S16)、永丰淮山药(S19和S20)和铁棍山药(S21和S22);第IV类包含6份材料,分别是南城山药(S5和S6)、南城淮山药2(S9和S10)和广丰药薯(S11和S12);第V类群同样只包含1份材料,即泰和竹篙薯(S17和S18)。
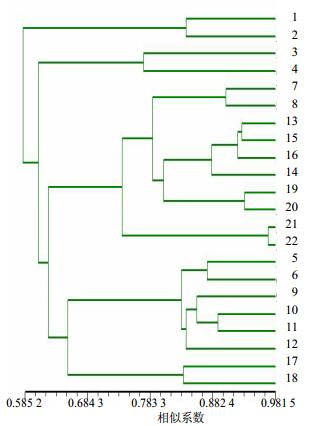
|
图 2 基于RAPD标记的江西山药22个样本的UPGMA聚类分析 Fig.2 UPGMA cluster analysis of 22 samples of D. opposite from Jiangxi province based on RAPD markers |
2.3 江西山药组培苗遗传稳定性分析
用筛选出的20条RAPD引物对江西山药微型块茎萌发的实生苗(对照组)及其带芽茎段连续继代6次后的组培苗(处理组)基因组DNA样品进行扩增,结果见表 5。从表 5中可知,11份山药品种均扩出126~179条可辨认的条带,每个品种的处理组和对照组出现了5~18条变异条带数,这表明,江西山药各个品种带芽茎段连续继代6次后的组培苗与微型块茎萌发的实生苗之间有一定程度上的变异,可能是江西山药各个品种在组织培养过程中发生了一定的体细胞无性系变异。
|
|
表 5 22个江西山药样本基因组DNA样品的扩增条带 Table 5 Amplified bands of genomic DNA samples of 22 samples of D. opposite from Jiangxi province |
从表 4可知,在江西山药同一品种中,黄独对照组(S1)和处理组(S2)的GS值为0.840,瑞昌山药对照组(S3)和处理组(S4)的GS值为0.773,南城山药对照组(S5)和处理组的GS值(S6)为0.874,南城淮山药1对照组(S7)和处理组(S8)的GS值为0.903,南城淮山药2对照组(S9)和处理组(S10)的GS值为0.853,广丰药薯对照组(S11)和处理组(S12)的GS值为0.853,千金薯对照组(S13)和处理组(S14)的GS值为0.870,信州山药对照组(S15)和处理组(S16)的GS值为0.924,泰和竹篙薯对照组(S17)和处理组(S18)的GS值为0.836,永丰淮山药对照组(S19)和处理组(S20)的GS值为0.933 3,铁棍山药对照组(S21)和处理组(S22)的GS值为0.971。这表明江西山药各个品种带芽茎段连续继代6次后的组培苗在组织培养过程中虽然存在着一定的体细胞无性系变异,但它们与微型块茎萌发实生苗的GS还是比较高,说明它们的遗传性状还是比较稳定的,并未影响到其基因型。
3 讨论山药品种较多,市场上存在同物异名和同名异物的混乱现象。因此,研究山药遗传多样性对山药引种改良、品种鉴定和生产加工等均具有重要意义。周延清等[14]利用ISSR标记技术对河南温县农业科学研究所的28个山药品种进行了遗传多样性分析,将28个山药品种划分为4组,并将江西南城与铁棍山药归入第4组,结果表明,江西南城与铁棍山药在同一组,而实验结果也表明,南城淮山药1、千金薯、信州山药、永丰淮山药与来源于河南焦作市温县的铁棍山药亲缘关系较近,这说明河南温县农业科学研究所保存的江西南城有可能为本实验中的南城淮山药1。黄玉仙等[15]也对94份山药种质资源进行了SRAP标记分析,当遗传相似系数为0.822时,可将94份山药资源分为5类,而江西瑞昌山药也被归于第I类,即薯蓣类。1996年,江西农业大学蔡余辉教授主持完成的国家自然科学基金课题“山药品种资源调查”也表明,在全国80多个山药品种中,江西瑞昌山药品质最优,其外观形色、口感风味、营养成分及保健效果都处于前列。本实验结果支持此观点,基于RAPD标记分析,第II类群只包含1份江西山药材料,即瑞昌山药,这个结果表明,江西瑞昌山药具有独特的品种特异性。在江西山药不同品种中,泰和竹篙薯和瑞昌山药的GS最小,只有0.512 6,这说明这两者的亲缘关系最远,南城淮山药1和黄独的遗传相似系数也仅为0.521 0,说明这两者的亲缘关系也比较远。信州山药和千金薯的遗传相似系数最大,只有0.928 6,说明这两者的亲缘关系最近,广丰药薯和南城山药的的遗传相似系数也可达0.873 9,说明这两者的亲缘关系也比较近。信州山药和千金薯以及广丰药薯和南城山药均有可能是相互引种及地方种叫法多样引起。根据UPGMA聚类分析结果,可在0.717 3的遗传相似系数上,将11份山药种质资源聚成5大类群,即类群I~V。其中第I类群只包含黄独;第II类群只包含瑞昌山药;第III类群包括南城淮山药1、千金薯、信州山药、永丰淮山药和铁棍山药,这说明南城淮山药1、千金薯、信州山药、永丰淮山药与来源于河南焦作市温县的铁棍山药亲缘关系较近;第IV类包括南城山药、南城淮山药2、广丰药薯;第IV类只包括泰和竹篙薯。这个结果表明江西山药种质资源遗传多样性还是比较丰富的。
在植物组织培养过程中,植物细胞生长是一个动态的过程,植株经过多次的转接继代后,会出现一些不正常的变异苗。试管苗的变异不是在某一代直接出现的,而是伴随着转接继代的次数增加,变异苗逐步增加[17]。18棵刺槐组培苗经RAPD检测,结果表明,植株间的GS为0.86~0.96,存在着体细胞无性系变异[18]。二乔刺槐扦插苗与组培苗、四倍体刺槐扦插苗与组培苗的遗传距离分别为0.18和0.17,二乔刺槐与四倍体刺槐两者的遗传距离为0.25,可见,尽管组培苗与扦插苗有一定程度的变异,但并未影响到其基因型[19]。啤酒花茎尖分生组织培养获得的再生植株经RAPD检测也出现1株试管苗发生变异[20]。香蕉试管苗连续继代10次时,变异率高达72%[21]。邱婧等[22]对不同继代次数(1~4代)的霍山石斛试管苗进行分析,结果表明,以成熟种子和茎段为材料的继代培养,未探查到变异,具有较高的遗传稳定性。以愈伤组织为材料的继代培养,其试管苗后代从第4代开始,部分引物带型发生变化,但变化甚微,仅是带型强弱的改变。但本试验结果与其不一致。江西山药各个品种带芽茎段连续继代6次后的组培苗与微型块茎萌发的实生苗之间有一定程度上的变异,但它们的遗传相似系数还是比较高,说明它们的遗传性状还是比较稳定的。究其原因,可能是培养基中的植物生长调节剂的成分组成及浓度对体细胞无性繁殖产生了较大的影响。在江西山药各个品种组培苗带芽茎段离体快繁的过程中,经常会发现带芽茎段下部切口愈伤化并随后在愈伤处形成不定根的现象,而愈伤化恰恰容易引起植物体细胞无性系变异。因此,在江西山药各个品种的组培中,必须注意调整培养基中的细胞分裂素的量,尽量避免江西山药组培苗带芽茎段切口愈伤化的出现,以维持江西山药地方品种资源的遗传稳定性。
总之,RAPD技术是一种鉴定江西山药种质资源遗传多样性及其组培苗遗传稳定性的有效和实用的工具,它能够检测到较高的多态性。用其所得到的多态条带有利于识别不同山药品种和同物异名、同名异物山药品种,杜绝生产中假冒伪劣品种造成危害,加强知识产权的保护,对江西山药特色地方品种种质的开发利用以及优质种苗的工厂化培育均具有重要的指导意义。
| [1] | 李丽红, 华树妹, 陈芝华, 等. 福建山药地方品种表型性状的遗传多样性研究[J]. 云南农业大学学报:自然科学版 , 2016, 30 (2) :257–262. |
| [2] | 尹明华, 王丽, 徐玉琴, 等. 江西产山药微型块茎萌发苗耐盐性隶属函数及主成分分析[J]. 中草药 , 2016, 47 (14) :2526–2533. |
| [3] | 中国药典[S].一部.2010. |
| [4] | 高启禹, 赵英政. 山药多糖对昆明种小鼠生长性能及肠道菌群的影响[J]. 中国老年学杂志 , 2015, 35 (20) :5685–5687. |
| [5] | 张亚锋, 舒蕊华, 王苑桃, 等. HPLC-MS/MS法测定山药中尿囊素的量[J]. 中草药 , 2014, 45 (24) :3627–3629. |
| [6] | 刘璐, 乔宇, 汪兰, 等. 山药多糖的抗氧化作用研究[J]. 食品科技 , 2014, 39 (12) :212–216. |
| [7] | 涂伟凤, 汤洁, 涂玉琴, 等. 江西山药生产现状及发展优势[J]. 江西农业学报 , 2012, 24 (11) :21–24. |
| [8] | 赵冬兰, 郑立涛, 唐君, 等. 甘薯种质资源遗传稳定性及遗传多样性SSR分析[J]. 植物遗传资源学报 , 2011, 12 (3) :389–395. |
| [9] | 王洪振, 王姝, 邝盼盼, 等. DNA分子标记技术及其在植物育种中的应用[J]. 吉林师范大学学报:自然科学版 , 2016, 37 (1) :108–111. |
| [10] | Williams J G, Kubelik A R, Livak K J, et al. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J]. Nucleic Acids Res , 1990, 18 (22) :6531–6535. DOI:10.1093/nar/18.22.6531 |
| [11] | Welsh J, Mc C M. Finger printing genomes using PCR with arbitrary primers[J]. Nucleic Acids Res , 1990, 18 :7213–7218. DOI:10.1093/nar/18.24.7213 |
| [12] | 王剑锴, 李明杰, 王建明, 等. 金线莲RAPD-SCAR标记的开发和种质遗传多样性评价[J]. 中草药 , 2016, 47 (1) :122–129. |
| [13] | 华树妹, 涂前程, 雷伏贵. 福建山药种质资源遗传多样性的RAPD分析[J]. 植物遗传资源学报 , 2009, 10 (2) :195–200. |
| [14] | 周延清, 景建洲, 李振勇, 等. 用ISSR标记技术分析山药品种遗传多样性[J]. 实验生物学报 , 2005, 38 (4) :324–330. |
| [15] | 黄玉仙, 黄姗, 梁康迳, 等. 基于SRAP标记的山药种质资源遗传多样性分析[J]. 中国野生植物资源 , 2011, 30 (6) :48–54. |
| [16] | 李齐向, 华树妹, 雷伏贵, 等. ISSR与SRAP在山药遗传多样性分析上的应用比较[J]. 福建农业学报 , 2013, 28 (9) :876–883. |
| [17] | 王炜, 杨随庄, 叶春雷, 等. 小麦体细胞无性系HMW-GS组成、蛋白质和赖氨酸含量及SSR位点变异分析[J]. 麦类作物学报 , 2016, 36 (2) :157–164. |
| [18] | Kanwar K, Bindiya K. Random amplifyied polymorphic DNA (RAPDs) markers for genetic analysis in micropropagatedplants of Robinia pseudoacacia L[J]. .Random amplifyied polymorphic DNA (RAPDs) markers for genetic analysis in micropropagatedplants of Robinia pseudoacacia L , 2003, 132 (1) :41–47. |
| [19] | 黄茶英, 刘青林. 刺槐体细胞无性系变异的RAPD检测[J]. 分子植物育种 , 2006, 4 (2) :251–254. |
| [20] | Patzak J. Assessment of somaclonal variability in hop (Humulus lupulus L.) in vitro meristem cultures and clones by molecular methods[J]. Euphytica , 2003, 131 (3) :343–350. DOI:10.1023/A:1024096401424 |
| [21] | Bairu M W, Fennell C W, Staden J V. The effect of plant growth regulators on somaclonal variation in Cavendish banana (Musa AAA cv.'Zelig')[J]. Sci Horticul , 2006, 108 (4) :347–351. DOI:10.1016/j.scienta.2006.01.039 |
| [22] | 邱婧, 樊洪泓, 秦自清, 等. 利用分子标记检测霍山石斛不同继代次数试管苗的遗传稳定性[J]. 分子植物育种 , 2008, 6 (3) :532–536. |
 2016, Vol. 47
2016, Vol. 47


