2. 湖南省植物功能成分利用协同创新中心, 湖南 长沙 410128
2. Hunan Co-Innovation Center for Utilization of Botanical Functional Ingredients, Changsha 410128, China
青蒿素(artemisinin)是一种含有过氧基团的倍半萜内酯抗疟药物,主要由我国菊科艾属植物黄花蒿Artemisia annua L.中提制而来[1-4]。青蒿素在黄花蒿中的生物合成可分为3个阶段:首先是从乙酰CoA经异戊烯基焦磷酸(IPP)、二甲基烯丙基焦磷酸(DMAPP)、法呢基焦磷酸到合成紫穗槐-4, 11-二烯,然后是从紫穗槐-4, 11-二烯到合成双氢青蒿酸,最后是从双氢青蒿酸到合成青蒿素[5-6]。第一阶段IPP的形成是萜类化合物生物合成的共有途径,青蒿素生物合成前体IPP的形成主要通过甲羟戊酸(MVA)途径[7],其过程为:2个乙酰CoA硫解后再与1个乙酰CoA在HMG-CoA合酶的作用下生成3-羟基-3-甲基戊二单酰CoA(HMG CoA),再经HMG CoA还原酶(HMGR)催化HMG-CoA形成甲羟戊酸,甲羟戊酸经焦磷酸化及脱羧脱水作用形成IPP[8]。由于MVA的形成是一个不可逆过程,因而HMGR被认为是青蒿素生物合成中最先起作用的关键酶[9]。研究证实,HMGR的活性与青蒿素的生物合成量密切相关[10],如Aaquil等[11]过表达HMGR基因获得了青蒿素量比野生型高22.5%的黄花蒿植株,Nafis等[12]通过组成型表达HMGR基因获得了青蒿素量高于野生型38.9%的植株等,但目前尚未见有关HMGR启动子活性及其核心序列的研究报道。本研究以β-葡萄糖苷酸酶(GUS)基因为报告基因,通过构建HMGR启动子不同长度表达载体,以及农杆菌介导法转化烟草GUS染色等方法,分析了黄花蒿HMGR启动子的活性表达及核心序列,以期为黄花蒿青蒿素的高效生物合成提供科学依据。
1 材料与方法 1.1 材料黄花蒿Artemisia annua L.和野生型烟草Nicotiana tobacum L.由湖南农业大学朱卫平副教授惠赠并鉴定,大肠杆菌Escherichia coli DH5α、根瘤农杆菌GV3101、不含35 S启动子且含GUS报告基因的质粒PCX-GUS-P由湖南农业大学国家植物功能成分利用工程技术研究中心实验室提供;限制性内切酶、连接酶试剂盒均购自Thermo Scientific公司;培养基购自Duchefa公司;各种抗生素和激素购自上海生工生物工程有限公司;质粒提取试剂盒、琼脂凝胶DNA回收试剂盒购自北京全式金生物技术有限公司;引物合成与DNA测序由生工生物工程(上海)股份有限公司完成。5-溴-4-氯-3-吲哚葡萄糖苷酸(X-gluc)购自Sigma-Aldrich公司;其他化学药品均为国产分析纯。
1.2 HMGR启动子系列缺失片段的获得及重组质粒的构建根据HMGR启动子序列,采用5’端系列缺失方法[13],设计5对特异引物(引物序列见表 1),以黄花蒿DNA为模版分别进行PCR,反应扩增序列,反应条件如下:94 ℃、5 min,94 ℃、40 s,55 ℃、1 min,72 ℃、1 min,共30个循环;72 ℃、10 min。0.75%琼脂糖凝胶电泳回收纯化目标片段。再根据试剂盒方法将目标片段与经过Xcm I酶切的PCX-GUS-P质粒在16 ℃下用T4连接酶连接过夜,构建重组质粒。采用热激法[14]将重组质粒转化大肠杆菌DH5α。固体LB [100 mg/L卡那霉素] 37 ℃倒置培养过夜。挑取单菌落进行PCR验证,扩增引物为HybF(5’-TGTCCTGCGGGTAAATAGC-3’),HybR(5’-GTCCATCACAGTTTGCCA GT-3’)。挑取PCR验证的阳性克隆进行测序分析,测序所用引物为GUSP-seqF(5’-ACCAGACGTTGCCCGCATAA-3’),GUSP-seqR(5’-GCAAGGCGATTAAGTTGGGT-3’)。
|
|
表 1 HMGR启动子不同长度片段引物序列及大小 Table 1 Primer sequence and size of different length fragment of HMGR promoter |
1.3 表达载体的构建
根据质粒提取试剂盒提供的方法将测序正确的重组质粒从大肠杆菌DH5α中提取出来,分别转入农杆菌GV3101[15]。于固体LB培养基(50 mg/L利福平、25 mg/L庆大霉素、100 mg/L卡那霉素)上,28 ℃黑暗培养2 d,直至长出清晰可见的单菌落。挑取单菌落进行PCR扩增验证,扩增引物为P-HMGR-1~5与GUSP-seqF。
1.4 表达载体转化烟草将PCR扩增验证正确的农杆菌采用农杆菌介导法[16]转化烟草,转化烟草置于固体MS培养基中25 ℃暗培养2 d,转入再生培养基[1 mg/L 6-BA、0.15 mg/L吲哚乙酸(NAA)、30 mg/L潮霉素(Hyg)、400 mg/L头孢霉素]、25 ℃,16 h光/8 h暗进行筛选,经4周左右再生出烟草幼苗,将幼苗转入生根培养基(0.15 mg/L NAA、15 mg/L Hyg、200 mg/L Cef)待其生根后移入土壤中。经2~3周去除农杆菌影响后采用CTAB法[15]提取抗性株叶片DNA,进行PCR扩增,扩增引物为HybF(R)。鉴定转化烟草。
1.5 HMGR启动子在转化烟草中不同部位的活性表达分别对PCR鉴定阳性的P-HMGR-1-PCX转化烟草上部叶片、下部叶片、根、茎、花、果荚等不同部位进行GUS染色,考察HMGR启动子在烟草中的表达情况。GUS染色液配方:0.2 mol/L磷酸缓冲液(pH 7),15 mL;0.5 mol/L EDTA(pH 8),600 μL;20 mmol/L铁氰化钾,750 μL;20 mmol/L亚铁氰化钾750 μL;20 mmol/L X-gluc 1.5 mL;Triton X-100 30 μL;补充蒸馏水至30 mL。将烟草浸泡于染色液中37 ℃水浴过夜,再经酒精脱色[17]。
1.6 胁迫条件对HMGR启动子的影响挑选经过GUS组化染色鉴定且表达稳定的P-HMGR-1-PCX烟草转化苗,进行继代培养,待其生根后(25 ℃,16 h光/8 h暗),取生长状况和大小相近的植株按以下条件进行处理。(1) 脱水处理:将烟草从培养基中取出,置于干净滤纸上,25 ℃,分别光培养6 h、16 h光/8 h暗中培养,脱水处理后进行GUS染色。(2) 热处理:将烟草置于35 ℃,16 h光/8 h暗中培养,热处理后进行GUS染色。(3) 冷处理:将烟草置于4 ℃,16 h光/8 h暗中培养,冷处理后进行GUS染色[18-20]。
1.7 HMGR启动子核心序列的筛选分别选取含有5个HMGR启动子片段的转化烟草的相同部位叶片同时进行GUS染色[21]。观察染色情况,分析HMGR启动子核心序列所在区域。
2 结果与分析 2.1 HMGR启动子系列缺失片段的获得及重组质粒的构建图 1显示,经PCR扩增后,得到了5个大小不同的HMGR启动子系列缺失片段,分别命名为P-HMGR-1、P-HMGR-2、P-HMGR-3、P-HMGR-4和P-HMGR-5,图中1号引物PCR得出两条亮带,根据HMGR启动子序列小于1 500 bp,切取较小片段与质粒酶切片段PCX-GUS-P连接。各片段连接产物转化大肠杆菌后,菌落PCR结果见图 2。挑取阳性单菌落进行测序验证,测序得到5个片段长度分别为1 357、922、413、249、174 bp,与PCR扩增电泳结果一致,说明重组质粒已成功构建。
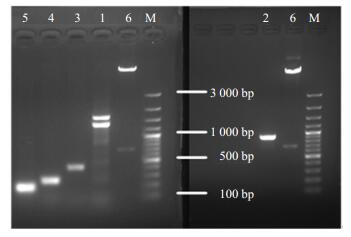
|
1-P-HMGR-1 2-P-HMGR-2 3-P-HMGR-3 4-P-HMGR-4 5-P-HMGR-5 6-PCX-GUS-P M-marker 图 1 HMGR启动子系列缺失片段的PCR扩增结果及PCX-GUS-P的XcmI酶切鉴定 Fig.1 PCR amplification of different HMGR promoter deletion fragments and verification of PCX-GUS-P by XcmI enzyme digestion |
|
1-P-HMGR-1-PCX 2-P-HMGR-2-PCX 3-P-HMGR-3-PCX 4-P-HMGR-4-PCX 5-P-HMGR-5-PCX M-marker 图 2 携带HMGR启动子系列重组质粒的大肠杆菌克隆子PCR检测 Fig.2 PCR detection of E. coli with recombinant coli carrying HMGR promoter deletion fragments |
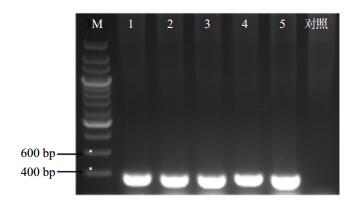
2.2 重组质粒转化农杆菌GV3101的菌落PCR检测
将测序正确的克隆子提取质粒,转化农杆菌GV3101感受态,分别命名为P-HMGR-1-PCXG、P-HMGR-2-PCXG、P-HMGR-3-PCXG、P-HMGR-4-PCXG和P-HMGR-5-PCXG,挑取单菌落进行菌落PCR检测,电泳结果如图 3所示,因PCR所用引物为P-HMGR-1~5与GUSP-seqF,所得电泳结果比各片段原本长度大200 bp左右,与各片段PCR电泳结果一致,表明携带5个片段的重组质粒已分别成功转化到农杆菌GV3101中。

|
1-P-HMGR-1-PCXG 2-P-HMGR-2-PCXG 3-P-HMGR-3-PCXG 4-P-HMGR-4-PCXG 5-P-HMGR-5-PCXG M-marker 图 3 携带HMGR启动子系列片段表达载体的农杆菌克隆子PCR检测 Fig.3 PCR detection of A. tumefaciens transformants with expression vectors carrying HMGR promoter deletion fragments |
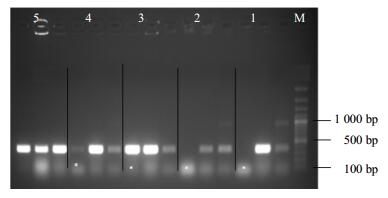
2.3 转基因烟草PCR检测
经生根培养,每个启动子片段分别得到4~6株转基因烟草,各片段烟草分别命名为P-HMGR-1-PCXDG、P-HMGR-2-PCXDG、P-HMGR-3-PCXDG、P-HMGR-4-PCXDG、P-HMGR-5-PCXDG将从抗性株叶片中提取的DNA进行PCR扩增,从图 4可以看出,各片段株系均有一条特异扩增条带而野生型烟草作为对照的泳道没有扩增条带,表明从筛选培养基上筛选出的阳性株系的确为转基因株系。5个启动子片段各获得3~5个阳性株系。
|
1-P-HMGR-1-PCXDG 2-P-HMGR-2-PCXDG 3-P-HMGR-3-PCXDG 4-P-HMGR-4-PCXDG 5-P-HMGR-5-PCXDG M-marker 图 4 转基因烟草PCR检测 Fig.4 PCR detection of transgenic tobacco |
2.4 HMGR启动子在转化烟草中不同部位的活性表达
选取P-HMGR-1-PCXDG片段转烟草稳定表达阳性株3号进行继代培养,图 5显示,P-HMGR-1-PCXDG在转化烟草的根、茎、花、果荚中都观察到蓝色,说明HMGR启动子序列基因已通过农杆菌整合至烟草DNA中,且能在根、茎、叶、花、果荚中稳定表达,并参与烟草整个生长周期的代谢活动。同时,下部叶片比上部叶片更容易染色,这可能与成熟叶片的代谢积累较多及通透性较好有关。此外,在花中的染色主要表现在花药和柱头上。

|
1-上部叶片2-下部叶片4-果荚6-根、茎、叶8-花3、5、7、9-对照 1-leaves near top 2-leaves near root 4-friut pods 6-roots, stems, and leaves 8-flowers 3, 5, 7, 9-controls 图 5 GUS在转基因烟草中不同部位的表达 Fig.5 GUS在转基因烟草中不同部位的表达 |
2.5 胁迫条件对HMGR启动子活性的影响
图 6显示,P-HMGR-1-PCXDG在6 h和24 h脱水条件的染色均明显变浅,且经24 h脱水处理的颜色变浅程度大于经6 h脱水处理的颜色;在高温处理中,染色也变浅,而在低温处理中染色未见明显变化。由此可见,脱水能降低HMGR启动子活性且脱水时间越长对启动子活性影响越大;高温也能使启动子活性降低,但低温处理对启动子活性的影响不明显,说明该启动子对低温处理不敏感,对高温和脱水条件的影响较敏感。

|
1、4、7、10-P-HMGR-1-PCXDG正常组2-P-HMGR-1-PCXDG脱水处理6 h 5-P-HMGR-1-PCXDG脱水处理24 h 8-P-HMGR-1-PCXDG高温处理24 h 11-P-HMGR-1-PCXDG低温处理24 h 3、6、9、12-对照 1, 4, 7, 10-normal group of P-HMGR-1-PCXDG 2-P-HMGR-1-PCXDG dewater treatment for 6 h 5-P-HMGR-1-PCXDG dewater treatment for 24 h 8-P-HMGR-1-PCXDG high temperature treatment for 24 h 11-P-HMGR-1-PCXDG low temperature treatment for 24h 3, 6, 9, 12-controls 图 6 胁迫条件对HMGR启动子活性的影响 Fig.6 Effect of stress on activity of HMGR promoter |
2.6 HMGR启动子核心序列分析
对含有HMGR不同启动子片段的烟草叶片染色结果(图 7)可以看出,P-HMGR-1-PCXDG、P-HMGR-2-PCXDG和P-HMGR-3-PCXDG的烟草叶片呈现蓝色,而P-HMGR-4-PCXDG、P-HMGR-5-PCXDG和对照的烟草叶片中没有观察到蓝色,说明启动子片段AaGPX1、AaGPX2和AaGPX3具有驱动GUS报告基因表达的功能,而AaGPX4和AaGPX5不能驱动GUS报告基因表达。由此推断HMGR启动子的核心序列在P-HMGR-3区域。根据叶片切口的颜色还可以看出,P-HMGR-2-PCXDG与P-HMGR-1-PCXDG颜色深浅相近,P-HMGR-3-PCXDG颜色较P-HMGR-1-PCXDG浅,说明AaGPX2片段的启动子活性与AaGPX1启动子活性相当,而AaGPX3片段具有部分启动子活性,推测AaGPX2片段与AaGPX3片段的非重叠区存在与HMGR启动子活性强弱相关的调控元件,但不是该启动子表达的必需元件。

|
1-P-HMGR-1-PCXDG 2-P-HMGR-2-PCXDG 3-P-HMGR-3-PCXDG 4-P-HMGR-4-PCXDG 5-P-HMGR-5-PCXDG 6-对照 1-P-HMGR-1-PCXDG 2-P-HMGR-2-PCXDG 3-P-HMGR-3-PCXDG 4-P-HMGR-4-PCXDG 5-P-HMGR-5-PCXDG 6-control 图 7 GUS在转基因烟草中的表达 Fig.7 Expression of GUS in transgenic tobacco leaves |
3 讨论
世界上大部分具有提取价值的野生黄花蒿来自我国南方地区,因此,我国青蒿素产业有着重要的国际影响力。除品种差异外,外界环境对青蒿素生物合成的影响也极其显著[22],相关探索也有很多,在花蕾期采收[23]、种植期间喷施水杨酸和脱落酸[24]、控制光照时间[23]等栽培措施都有利于促进青蒿素的生物积累,但其在黄花蒿中的水平仍然较低的事实严重影响了青蒿素的低成本生产。本研究在对HMGR启动子的活性分析中发现该启动子对低温不敏感,可能有较好的抗寒性,这与低温能诱导青蒿素生物合成的研究结果相符[25],还发现该启动子在脱水条件下活性明显降低的现象也与黄花蒿喜潮湿环境的研究结果相近[22],这些活性与有利于青蒿素生物产量积累的外界条件相似。该启动子在光照等更多条件下的表达特性和具体的变化水平及其与青蒿素生物合成的相关性还有待于进一步的探索。
同时,经GUS染色分析,推断HMGR启动子的核心序列在P-HMGR-3区域内,而该启动子还有相关调控元件在P-HMGR-2与AaGPX3片段的非重叠区内,该部分相关调控元件的具体作用还需要进一步的研究证明。HMGR启动子核心序列的分析也有助于后续对该启动子相关调控元件的进一步研究。
青蒿素的生物合成是黄花蒿体内众多代谢活动中的一条分支,在相同条件下,充足的IPP底物将有利于青蒿素的生物合成。因此HMGR启动子的研究可对IPP的生物合成提供合适的外界条件,通过调节关键酶的活性来增加IPP的供给量,有助于促进青蒿素的积累,进而显著提高黄花蒿中青蒿素的量,为青蒿素的工业化生产提供优异原料。
| [1] | 吴毓林. 青蒿素——中药奇葩疟疾克星[J]. 大学化学报 , 2010, 25 (4) :12–15. |
| [2] | 杨桂霞, 郑欣, 孙桂霞, 等. 青蒿素及其衍生物研究进展[J]. 世界最新医学信息文摘 , 2013, 13 (10) :26–28. |
| [3] | 尹纪业, 王和枚, 丁日高. 青蒿素及其衍生物毒理学研究进展[J]. 中国药理学与毒理学杂志 , 2014 (2) :309–314. |
| [4] | 谭涛, 秦宗会, 谭蓉. 青蒿素类药物的药理作用研究进展[J]. 中国药业 , 2009, 18 (3) :63–64. |
| [5] | 曾庆平, 鲍飞. 青蒿素合成生物学及代谢工程研究进展[J]. 科学通报 , 2011, 56 (27) :2289–2297. |
| [6] | 孔建强, 王伟, 程克棣, 等. 青蒿素的合成生物学研究进展[J]. 药学学报 , 2013, 48 (2) :193–205. |
| [7] | Ram M, Khan M A, Jha P, et al. HMG-CoA reductase limits artemisinin biosynthesis and accumulation in Artemisia annua L.plants[J]. Acta Physiol Plant , 2010, 32 (5) :859–866. DOI:10.1007/s11738-010-0470-5 |
| [8] | 刘硕谦, 田娜, 李娟, 等. 青蒿素组合生物合成的研究进展[J]. 中草药 , 2007, 38 (9) :1425–1431. |
| [9] | 刘涤, 胡之壁. 植物类异戊二烯生物合成途径的调节[J]. 植物生理学通讯 , 1998 (1) :1–9. |
| [10] | 刘万宏, 黄玺, 张巧卓. 青蒿素生物合成与基因工程研究进展[J]. 中草药 , 2013, 44 (1) :101–107. |
| [11] | Aquil S, Husaini A M, Abdin M Z, et al. Overexpression of the HMG-CoA reductase gene leads to enhanced artemisinin biosynthesis in transgenic Artemisia annua plants[J]. Planta Med , 2009, 75 (13) :1453–1458. DOI:10.1055/s-0029-1185775 |
| [12] | Nafis T, Akmal M, Ram M, et al. Enhancement of artemisinin content by constitutive expression of the HMG-CoA reductase gene in high-yielding strain of Artemisia annua L[J]. Plant Biotechnol Rep , 2011, 5 (1) :53–60. DOI:10.1007/s11816-010-0156-x |
| [13] | 赵金风, 李杰, 张爽, 等. 杨树木质部特异启动子5'端侧翼序列缺失表达载体构建及转化烟草的研究[J]. 蚕业科学 , 2013 (5) :858–861. |
| [14] | 邓婷婷.不同温度下安吉白茶差异表达基因的分离、鉴定及CsPDS3基因的功能研究[D].长沙:湖南农业大学, 2013. |
| [15] | Wang Y Y, Yang K, Jing F Y, et al. Cloning and characterization of trichome-specific promoter of cpr71av1 gene involved in artemisinin biosynthesis in Artemisia annua L[J]. Molr Biol , 2011, 45 (5) :751–758. DOI:10.1134/S0026893311040145 |
| [16] | 吴扬.保靖黄金茶资源多样性分析及CsICE1基因转化烟草研究[D].长沙:湖南农业大学, 2013. |
| [17] | 周小琼, 丁一琼, 左丽, 等. 大豆硫转运蛋白基因GmSULTR1;2b启动子的克隆及活性分析[J]. 中国农业科学 , 2015, 48 (8) :1650–1659. |
| [18] | 杨瑞仪, 杨雪芹, 冯丽玲, 等. 黄花蒿cyp71av1启动子的分离及表达特性分析[J]. 中草药 , 2011, 42 (4) :765–769. |
| [19] | 杨瑞仪, 杨雪芹, 冯丽玲, 等. 黄花蒿ADS启动子的分离及表达特性分析[J]. 中国中药杂志 , 2011, 36 (15) :2052–2055. |
| [20] | 刘晓敏.玉米低温和干旱诱导型启动子的克隆及功能分析[D].长春:吉林大学, 2011. |
| [21] | 孙清华.盐芥TsVP启动子核心区域的鉴定及其上游调控蛋白的功能分析[D].济南:山东大学, 2011. |
| [22] | 范正涛, 马小军, 张明庆. 青蒿素产量影响因素的研究进展[J]. 中草药 , 2008, 39 (2) :313–316. |
| [23] | 钟凤林, 陈和荣, 陈敏. 青蒿最佳采收时期、采收部位和干燥方式的实验研究[J]. 中国中药杂志 , 1997, 22 (7) :21–22. |
| [24] | 何军.SA与ABA调节青蒿素的生物合成及青蒿副产物的综合利用[D].重庆:西南农业大学, 2004. |
| [25] | 杨瑞仪, 卢元媛, 杨雪芹, 等. 低温诱导黄花蒿中青蒿素的生物合成及其机制研究[J]. 中草药 , 2012, 43 (2) :350–354. |
 2016, Vol. 47
2016, Vol. 47


