黄芪与川芎配伍是经典益气活血方药补阳还五汤(王清任《医林改错》)和许多现代中药复方制剂(如步长脑心通胶囊等)及临床的常用配伍药物,治疗缺血性脑卒中等心脑血管疾病气虚血瘀证具有确切临床疗效。本课题组前期研究了川芎、黄芪有效成分配伍对缺氧脑微血管内皮细胞的影响[1]及黄芪川芎主要有效成分配伍的转运特征,表明川芎与黄芪有效成分配伍具有显著的药理作用,并且有效成分之间存在吸收促进作用[2]。但关于黄芪与川芎有效成分配伍与抗脑缺血性损伤机制的相关性尚需深入研究,各有效成分配伍后在体内的药动学过程也尚未阐明。川芎嗪是川芎中的主要有效成分,自20世纪70年代开始川芎嗪应用于缺血性脑卒中的治疗,至今已有40多年的使用史。川芎嗪用于心脑血管疾病治疗,主要因为其具有抗炎、抗氧化应激、保护血管内皮、抗动脉粥样硬化、抗血小板、抗脑缺血再灌注损伤、神经保护、钙拮抗等作用[3-8];在临床实践中,常用的川芎嗪药物有磷酸川芎嗪片、注射用磷酸川芎嗪、盐酸川芎嗪注射液等。川芎嗪是川芎中生物碱类的代表成分,川芎中还含有苯酞类、萜烯类、有机酸及其酯类及多糖等多种活性成分。黄芪的化学成分主要有黄酮类、皂苷类和多糖等,而黄酮类及皂苷类为其代表性的有效成分。故本研究将黄芪总皂苷、黄芪总黄酮、川芎总生物碱及川芎总有机酸按等质量比配伍,考察4种有效部位配伍对川芎嗪在在脑缺血再灌注大鼠体内的药动学特征。
当脑组织缺血缺氧时,Ca2+超载可激活细胞膜上的磷脂酶和蛋白酶,导致质膜损害、细胞结构和功能的破坏,被破坏的细胞内乳酸脱氢酶(LDH)释放入血,引起血清中LDH的升高。因此,血清中LDH的升高可以用来作为判断细胞损伤的指标[9]。同时,肖丽萍等[10]发现脑缺血面积越大,细胞被破坏越多,血清LDH水平越高,认为LDH是脑缺血脑组织受损时最敏感的酶,监测血清中LDH水平,不仅可以了解脑缺血的范围和轻重程度,而且,可通过监测LDH的变化来判断疾病的治疗效果。故本研究以脑缺血再灌注大鼠为实验动物模型,以给药组与模型组大鼠血浆中LDH活性差值作为效应指标,采用Sheiner等[11-12]提出的基于效应室理论的药动学-药效学(PK-PD)结合模型,综合分析脑缺血再灌注大鼠给予黄芪川芎有效部位配伍药物后,川芎嗪的血药浓度、时间和LDH效应3者之间的关系,计算有关的药动学和药效学参数。通过PK-PD结合模型的建立,评价川芎嗪和大鼠血浆中LDH活性变化效应的相关性,探讨黄芪川芎有效部位配伍抗脑缺血再灌注损伤可能的作用机制,为临床合理用药提供实验依据。
1 材料 1.1 药品与试剂川芎嗪对照品(质量分数>98%,批号110817-200305)、芦丁对照品(质量分数>98%,批号10080-200707),中国食品药品检定研究院;黄芪总黄酮、黄芪总皂苷、川芎总生物碱(含川芎嗪51%)、川芎有机酸(质量分数均在80%以上)均由浙江中医药大学心脑血管病研究所制备;甲醇、乙腈均为色谱纯(Tedia公司);甲酸,无锡市晶科化工有限公司;肝素钠,国药集团化学试剂有限公司;LDH检测试剂盒(批号20141022),南京建成生物工程研究所。
1.2 仪器Agilent1200高效液相色谱仪(手动进样器、VWD检测器);SK5210HP超声清洗器(上海科导超声仪器有限公司);ND100-1氮吹吹扫仪(杭州瑞城仪器有限公司);HH系列数显恒温水浴锅(上海江星仪器有限公司);LDZ5-2低温离心机(北京医用离心机厂);Millipore Simplicity纯水仪(美国Millipore公司);Molecular Devices Spectra MAX Plus 384酶标仪(美国MD公司)。
1.3 实验动物雄性清洁级SD大鼠,体质量(270±10)g,购自上海西普尔-必凯实验动物有限公司,动物许可证号SCXK(沪)2013-0016。实验前进行为期1周的适应性饲养,实验室温度25 ℃左右。实验前禁食12 h,自由饮水。
2 方法 2.1 分组、造模与给药将大鼠随机分为3组,分别为对照组、模型组和给药组,每组6只,模型组和给药组大鼠按照Longa等[13]方法进行大脑中动脉局灶性栓塞(MCAO)手术,制备脑缺血再灌注模型。模型完成后于再灌注同时给药组ig给予黄芪总皂苷、黄芪总黄酮、川芎总生物碱、川芎总有机酸各100 mg/kg混悬液(各提取物以纯净水溶解),对照组和模型组ig等量纯净水。
2.2 血样采集各组分别于给药后0.083、0.25、0.5、0.75、1.0、1.5、2.0、3.0、4.0、6.0 h眼眶取血0.5 mL,置于1.5 mL含肝素钠的EP管中,4 000 r/min离心10 min,取上清即得含药血浆,-80 ℃保存待测。
2.3 大鼠血浆中川芎嗪的测定 2.3.1 血样处理精密量取血浆样品100 μL加入100 μL甲醇和100 μL乙腈于1.5 mL离心管中,用微量加样器加入20 μL内标液。电动涡旋器混匀2 min,12 000 r/min离心10 min,取上清氮气吹干,加入100 μL甲醇复溶,电动涡旋器混匀2 min, 12 000 r/min离心10 min,取上清待测。
2.3.2 对照品及内标溶液的制备精密称取川芎嗪对照品1.20 mg,用甲醇溶解配成1.0 mg/mL的对照品母液。精密称取芦丁2.26 mg,用甲醇溶解配成0.09 mg/mL的内标溶液。精密量取川芎嗪对照品母液适量,用大鼠空白血浆稀释成质量浓度为2.5、5、10、20、50、100 μg/mL的系列对照品溶液;按“2.3.1”项方法进行处理,取20 μL进样。
2.3.3 色谱条件采用Agilent1200高效液相色谱仪,色谱柱为Agilent Extend-C18(150 mm×4.6 mm,5 μm),流动相为甲醇(A)-0.1%甲酸水溶液(B),梯度洗脱:0~5 min,25%A;5~6 min,25%~35%A;6~10 min,35%~60%A;10~14 min,60%A;柱温30 ℃;体积流量1 mL/min;检测波长280 nm。
2.4 大鼠血浆LDH活性的测定严格按照试剂盒说明书进行操作,血浆充分混匀后,室温放置5 min后,各管取200 μL加入到96孔酶标板,450 nm波长,酶标仪测定吸光度(A)值。根据公式计算出LDH的活性。
2.5 PK-PD模型的建立采用非房室模型进行川芎嗪的药动学分析,DAS 3.2.6软件计算药动学参数。最终药效值以相对于模型组指标差值表示,并进行PD模型的拟合。参考文献方法[4-6]建立多种联结模型,以残差图、最小化信息量、参数估计值变异率为标准比较各模型拟合优度。
2.6 统计方法采用配对t检验进行主要药动学参数的统计学处理。采用SPSS 19.0统计软件进行方差分析。
3 结果 3.1 大鼠血浆中川芎嗪的测定方法标准曲线及色谱分离情况以川芎嗪的质量浓度为横坐标(X),川芎嗪和内标色谱峰面积比值为纵坐标(Y),加权最小二乘法进行回归运算,求得直线回归方程为Y=0.002 3 X+0.000 9,R2=0.999 1,川芎嗪在2.5~100 μg/mL内线性良好。HPLC色谱图见图 1。
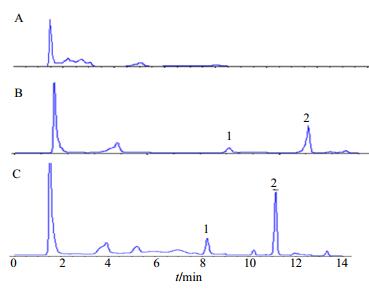
|
1-川芎嗪2-芦丁(内标) 1-ligustrazine 2-lutin (internal standard) 图 1 空白血浆(A)、空白血浆+川芎嗪+内标(B)和含药血浆样品+内标(C)高效液相色谱图 Fig.1 HPLC of blank plasma (A), blank plasma + ligustrazine + internal standard (B), and plasma with drug sample + internal standard (C) |
3.2 药动学结果
以川芎嗪血药浓度均值为纵坐标,采血时间为横坐标绘制药时曲线,见图 2。采用非房室模型进行川芎嗪的药动学分析,DAS 3.2.6软件计算药动学参数,结果见表 1。
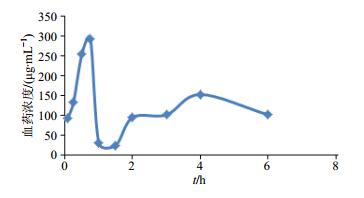
|
图 2 MCAO大鼠血浆中川芎嗪的药时曲线 Fig.2 Concentration-time curve of ligustrazine in plasma of MCAO rats |
|
|
表 1 川芎和黄芪有效部位组合给药后川芎嗪在MCAO大鼠体内的主要药动学参数(x±s, n=6) Table 1 In vivo main PK parameters of ligustrazine in MCAO rats after ig administration of effective parts in compatibility of Chuanxiong Rhizoma and Astragali Radix (x±s, n=6) |
3.3 药效学结果
大鼠脑缺血再灌注损伤后,数据经SPSS 19.0软件处理,最终药效值以相对于模型组指标差值ΔLDH表示,并与药动学模型进行PK-PD模型拟合。
由表 2可以看出,对照组大鼠血浆中LDH活性维持相对稳定,大鼠脑缺血再灌注损伤后,LDH活性随时间延长呈现上升趋势。模型组与对照组相比各时间点均具有显著差异(P<0.01)。给药组各时间点LDH活性相对于模型组均有所降低,其中4.0 h和6.0 h与模型组相比无显著性差异(P>0.05),其余各时间点相对于模型组具有显著性差异(P<0.01)。
|
|
表 2 各组给药后不同时间大鼠中LDH活性(x±s, n=6) Table 2 LDH activity in plasma at different time points after ig administratin of rats in each group (x±s, n=6) |
3.4 PK-PD模型拟合
实验中得到的大鼠血浆中LDH活力的数据,不能直接反映出给药设计对脑缺血再灌注损伤大鼠的纯粹修复值,无法进行药物效应动力学的直接分析,因此本实验对原始数据进行变化处理,采用各时间点LDH活性与模型组的差值为即时的效应值,用ΔLDH来表示。
本实验采用DAS3.2.6软件处理,根据赤池信息量准则(AIC)值越小、残差平方和值越小以及拟合度值越大,则模型拟合越好的判断原则,综合考虑兼顾各个指标以及模型的简单性,最终建立了以效应室联结的Emax[E=Emax·C/(EC50+C)]PK-PD模型,并得到药效动力学模型参数Emax为8 590.473 U/L、EC50为29.462 μg/mL、Keo为0.508 h-1。
根据川芎嗪血药浓度、各组ΔLDH量、时间绘制浓度-时间-效应图,见图 3。由图可知,在给药后ΔLDH变化和血药浓度变化基本呈正比趋势,4~6 h阶段,川芎嗪的血药浓度出现下降而ΔLDH变化保持基本稳定。可以推测这个现象的出现可能是由于有效部位的其他成分如毛蕊异黄酮、阿魏酸等也发挥了一定的作用。川芎嗪达峰时间为0.75 h,ΔLDH达峰时间为1.0 h,效应峰值滞后于血药浓度峰值。给药后每一时间点上的血药浓度值和药物效应值不是严格一一对应关系,这表明药物作用的效应室不在血液室,由于药物需要按一级速率常数从血液室转运到作用部位(如骨骼肌、心肌、脑组织等)需要时间,所以出现了效应明显滞后于血药浓度的现象,血药浓度的改变和药物效应的变化不同步。
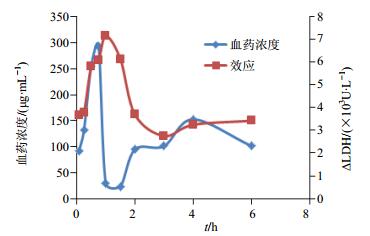
|
图 3 川芎嗪血药浓度-时间-效应图 Fig.3 Blood drug concentration-time-effect diagram of ligustrazine |
4 讨论
本研究选取LDH为指标研究黄芪川芎有效部位配伍的药效学,通过研究LDH在对照、模型及给药组大鼠体内的活性变化,来反映黄芪川芎有效部位配伍抗脑缺血再灌注损伤的作用。结果发现,大鼠手术后血浆中LDH活性显著升高,与对照组相比具有显著差异(P<0.01);给予黄芪川芎有效部位配伍组方后各时间点LDH活性相对于模型组都有不同程度的降低,除4.0、6.0h与模型组相比无显著性差异外(P>0.05),其余各时间点相对于模型组都具有显著性差异(P<0.01)。说明配伍给药能够在给药后4.0 h前对降低血浆中LDH活性作用更为明显,能够发挥更好的疗效,对脑缺血再灌注损伤起到一定的保护作用。
药动学与药效学模型的结合是现代药物研究方法的一个热点,也是评价中药作用的一个重要手段。PK-PD结合模型可定量评价药物作用效能、量效关系和维持时间,已成为评价药物作用特点和合理安排给药方案的重要工具[14]。开展中药PK-PD结合研究,不仅能够为新药创制、质量评价及临床给药方案制订等提供科学数据,还有助于阐明中药的药效物质基础及其作用机制,因而受到中医药研究人员的日益重视,被认为是中药现代化的重要研究领域[15-18]。本研究结果发现ΔLDH效应值滞后于川芎嗪血药浓度,给药后每一时间点上的血药浓度值和药物效应值不是严格一一对应关系,这与众多中药PK-PD模型研究文献报导一致[19-20]。这可能是由于药物逐渐分布进入心肌、血管平滑肌等效应部位,由于相关细胞从组织液或血液中摄取药物的速度较慢,从而导致其浓度变化滞后于血药浓度的变化,进而产生的药理效应也滞后于血药浓度。
本研究以大鼠脑缺血再灌注后给予黄芪川芎有效部位配伍组方后,对川芎嗪进行药动学研究,选取LDH对脑缺血再灌注损伤大鼠进行了药效学分析,成功建立了效应室联结的Emax[E=Emax·C/(EC50+C)]PK-PD模型,并得到药效动力学模型参数Emax、EC50、Keo。可较有效地用于预测黄芪川芎配伍后川芎嗪的血药浓度和效应。但是由于中药复方成分的复杂性和药效作用的多样性,黄芪川芎有效部位配伍中其他活性成分如毛蕊异黄酮和阿魏酸等都有可能对川芎嗪治疗脑缺血在灌注损伤起到一定的协同作用。
综上所述,本研究通过建立宏观作用及其微观作用机制的PK-PD模型,可以定量评价中药作用的效价强度、效能、量效关系范围及其微观机制对宏观效应产生的贡献献率,是中药药理学研究的重要工具,值得进一步推广和深化。
| [1] | 杨珍, 周惠芬, 周鹏, 等. 川芎、黄芪有效成分配伍对缺氧脑微血管内皮细胞的影响[J]. 中草药 , 2015, 46 (9) :1326–1332. |
| [2] | 周惠芬, 何昱, 张宇燕, 等. 黄芪川芎主要有效成分配伍的转运研究[J]. 中华中医药学刊 , 2015, 33 (4) :868–871. |
| [3] | Han J, Wan H T, Yang J H, et al. Effect of ligustrazine on levels of amino acid neurotransmitters in rat striatum after cerebral ischemia-reperfusion injury[J]. J Asian Natl Prod Res , 2014, 16 (11) :1060–1067. DOI:10.1080/10286020.2014.935347 |
| [4] | 吴海明, 卓晓晖. 川芎嗪用于心脑血管的药理作用及临床应用研究进展[J]. 临床医药文献杂志 , 2015, 2 (9) :1683–1686. |
| [5] | 蒋跃绒, 陈可冀. 川芎嗪的心脑血管药理作用及临床应用研究进展[J]. 中国中西医结合杂志 , 2013, 33 (5) :707–710. |
| [6] | 胡长鹏, 唐勤, 邢茂. 川芎嗪抗脑缺血再灌注损伤作用机制的研究进展[J]. 中国中医急症 , 2014, 23 (9) :1680–1682. |
| [7] | 高海军, 白焕焕, 雷廷, 等. 川芎嗪在脑缺血再灌注损伤中的保护作用[J]. 中国老年学杂志 , 2015, 35 (17) :5019–5023. |
| [8] | 焦志勤, 肖飞. 盐酸川芎嗪联合甲钴胺治疗股外侧皮神经炎的疗效观察[J]. 现代药物与临床 , 2015, 30 (4) :429–432. |
| [9] | Fan Y M, Zhang C J, Peng W N, et al. Secretory pathway Ca2+-ATPase isoform 1 knockdown promotes Golgi apparatus stress injury in a mouse model of focal cerebral ischemia-reperfusion:In vivo and in vitro study[J]. Brain Res , 2016 . DOI:10.1016/j.brainres.2016.03.049 |
| [10] | 肖丽萍, 黄益兴. 急性脑梗塞血清乳酸脱氢酶的测定及临床意义[J]. 脑与神经疾病杂志 , 2000, 8 (1) :54. |
| [11] | 张忠亮, 李强, 杜思邈, 等. PK-PD结合模型的研究现状及其应用于中医药领域面临的挑战[J]. 中草药 , 2013, 44 (2) :121–127. |
| [12] | 曹岗, 张云, 丛晓东, 等. PK-PD模型在中药药动学中的应用[J]. 中草药 , 2009, 40 (11) :1830–1834. |
| [13] | Longa E Z, Wsinstein P R, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke , 1989, 20 (1) :84–91. DOI:10.1161/01.STR.20.1.84 |
| [14] | 于宜平, 张艳, 李红, 等. 黄芩苷对角叉菜胶致热大鼠解热作用的PK-PD模型研究[J]. 中草药 , 2014, 45 (4) :527–531. |
| [15] | 袁美燕, 吴虹. PK-PD模型在中药药物代谢动力学中的应用[J]. 安徽中医学院学报 , 2009, 28 (5) :86–88. |
| [16] | Chu K M, Hu O Y, Shieh S M. Cardiovascular effect and simultaneous pharmacokinetic and pharmacodynamic modeling of pimobendan in healthy normal subjects[J]. Drug Metab Dispos , 1999, 27 (6) :701–709. |
| [17] | Sheiner L B, Stanski D R, Vozeh S, et al. Simultaneous modeling of pharmacokinetics and pharmacodynamics:application to d-tubocurarine[J]. Clin Pharmacol Ther , 1979, 25 (3) :358–371. DOI:10.1002/cpt.1979.25.issue-3 |
| [18] | Holford N H, Sheiner L B. Understanding the dose-effect relationship:clinical application of pharmacokinetic-pharmacodynamic models[J]. Clin Pharmacokinet , 1981, 6 (6) :429–453. DOI:10.2165/00003088-198106060-00002 |
| [19] | Liu X Y, Wang B J, Yuan G Y, et al. Comparison of different pharmacodynamic models for pharmacokinetic-pharmacodynamic (PK-PD) modeling of carvedilol[J]. Acta Pharm Sin , 2009, 44 (4) :406–411. |
| [20] | 师少军, 顾世芬, 陈汇, 等. 蝙蝠葛碱在犬体内的药代动力学和药效动力学研究[J]. 中国药理学通报 , 2005, 21 (4) :464–467. |
 2016, Vol. 47
2016, Vol. 47


