2. 上海张江中药现代制剂技术工程研究中心, 上海 201203 ;
3. 中国医学科学院药物研究所, 北京 100050 ;
4. 上海中医药大学附属市中医医院 脑病科, 上海 200071
2. Engineering Research Center of Modern Preparation Technology of Zhangjiang, Shanghai 201203, China ;
3. Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China ;
4. Municipal Hospital of Traditional Chinese Medicine Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200071, China
帕金森病(Parkinson’s disease,PD)是一种循序渐进的神经退化性疾病,目前在60岁以上的人群中,大约有1%的患病率[1],其症状主要表现为静止性震颤、肌强直、运动迟缓、姿势反射障碍等,病理特征是患者黑质致密部位的多巴胺能神经元变性,纹状体内多巴胺神经递质的量减少,黑质纹状体多巴胺神经元功能低下而胆碱能神经元功能相对占优势,从而产生运动障碍[2]。其发病机制可能与遗传、环境、氧化应激、免疫炎症等诸多因素有关[3-7],目前尚未完全清楚,但神经毒素在PD的发病过程中起着重要作用。1-甲基-4-苯基-1, 2, 3, 6-四氢吡啶(MPTP)是一种合成的神经毒素,其脂溶性的特点使其容易通过血脑屏障,MPTP本身毒性不高,但其能被脑星形胶质细胞、5-羟色胺能神经元等细胞的单胺氧化酶-B(MAO-B)氧化生成中间代谢产物MPDP+,并进一步氧化形成高毒性的1-甲基-4-苯基吡啶离子(MPP+)[8],后者被多巴胺能神经元通过末梢高亲和力的多巴胺摄取系统摄入,并在线粒体内聚集,阻断NADH氧化磷酸化系统,干扰ATP合成,进一步导致多巴胺能神经元变性坏死[9]。基于MPP+的这一特点,其主要被选择用来制备PD的动物及细胞模型[10-11]。非人灵长类如猴对MPTP最敏感,但由于经济和伦理道德限制极少使用;小鼠对MPTP毒性的敏感性次之,但引起的生化和细胞改变与人类PD非常相似,故应用普遍。
左旋多巴(L-DOPA)是PD临床常见的一线治疗药物,其作用机制是补充脑内缺乏的多巴胺(DA),但会出现药物剂量依赖性而且产生不自主的异常动作、运动障碍等副作用[12-14]。中医从整体观念、辨证论治角度,利用中药成分的多组分、多靶点来治疗PD,效果确切且药性平和、不良反应小[15-17]。止颤颗粒来源于临床有效方,由钩藤、黄芪、白芍、知母等7味药组成,具有益气养阴、熄风清热的功效,可有效改善PD病人肢体僵硬、震颤等症状[18-22]。随机、双盲、安慰剂对照临床研究表明,在UPDRS量表总分及分项III(运动检查)积分、中医证候总分及主要症状积分的改善等方面,止颤颗粒联合常规化学药治疗组优于常规化学药治疗组[23]。目前围绕PD开展的临床前研究多集中在MAO-B抑制剂、DA受体激动剂、神经营养因子和中药复方[24-26],而中药复方与美多芭(主要成分为L-DOPA)联合用药的药效学研究并不多见。本研究拟采用经典的MPTP诱发的小鼠亚急性PD模型,观察联合应用止颤颗粒和美多芭对PD小鼠行为学、纹状体多巴胺水平、黑质多巴胺神经元数量等的影响,评价止颤颗粒是否具有增强美多芭药效的作用,为中西医结合治疗PD提供实验依据。
1 材料 1.1 实验动物清洁级雄性C57小鼠105只,体质量(24±1)g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-0007。饲养条件:屏障级动物房饲养,许可证号SYXK(京)2009-0004,标准饲养盒内饲养,每盒5只。
1.2 药物与试剂止颤颗粒,由上海张江中药现代制剂技术工程研究中心制备,每克颗粒相当于原生药材3.5 g,其中每克颗粒含知母以芒果苷计,不得低于1.6 mg,每克颗粒含生白芍以芍药苷计,不得低于2.4 mg。美多芭(多巴丝肼片),上海罗氏制药有限公司,批号SH0895。MPTP,Sigma公司;DA和异丙肾上腺素(IP)购自Sigma公司。其余试剂均为分析纯,购自北京化学试剂公司。
1.3 仪器岛津LC-10AT vp Plus高效液相色谱仪(检测器:BASi CC-5e,LC-4C),美国;Nikon eclipse 80i正置显微镜(日本);2K15低温高速离心机(Sigma公司,美国);转棍仪和爬杆棒(中国医学科学院药物研究所)。
2 方法 2.1 模型制备小鼠采用转棍法提前训练3 d,将运动不协调的小鼠剔除。造模小鼠每天ip MPTP(溶于生理盐水)20 mg/kg,每天1次,连续10 d。
2.2 分组及给药105只小鼠,随机分为7组,每组15只。分别为对照组、模型组、止颤颗粒低剂量(3.5 g/kg)+美多芭(以L-DOPA计,50 mg/kg,下同)组、止颤颗粒中剂量(9.0 g/kg)+美多芭(50 mg/kg)组、止颤颗粒高剂量(22 g/kg)+美多芭(50 mg/kg)组、止颤颗粒(22 g/kg)组、美多芭(50 mg/kg)组。止颤颗粒溶于无菌双蒸水中,美多芭片剂悬浮于0.5% CMC-Na中。止颤颗粒、美多芭ig给药后30 min ip MPTP,每天1次,连续10 d。MPTP停止注射后继续给予小鼠止颤颗粒、美多芭,每天1次,连续7 d。对照组ig和ip相同剂量的无菌双蒸水和生理盐水,模型组ig给予相同剂量的无菌双蒸水。
2.3 行为学检测 2.3.1 转棍法转棍仪(中国医学科学院药物研究所研制)为直径3 cm,长为50 cm,用隔板分隔为5段的水平杆,保证动物彼此不受影响。转棍仪转速设为恒速14转/min。将小鼠置于杆上,打开开关,开始计时,记录从开始转棍到小鼠从杆上掉下的时间,记为潜伏期(即第1次掉落的时间),以此表示其运动协调能力。每只小鼠测试3次,每次间隔1 h,取平均值。小鼠分别于实验的第5、9、16天进行转棍测试。
2.3.2 爬杆法用一直径13 mm,高50 cm,顶部有一直径3 cm的木球的光滑木杆(中国医学科学院药物研究所研制),垂直放置,将小鼠头向下放置在杆的顶部球上,让其沿杆自然爬下,观察动物在爬下过程中的行为。小鼠爬下过程中的行为按标准记分,评分标准如下[27]:四肢并用,一步一步协调向下爬行,计5分;一步一步向下爬行但兼有后肢滑行行为,计4分;爬过一半距离后向下滑行,但可抱紧杆,计3分;未爬过一半距离即出现滑行行为,计2分;爬过一半距离后不能抓杆从杆上掉落,计1分;未爬过一半距离即不能抓杆,从杆上掉落,计0分。实验前每只小鼠训练2次。于实验第6、10、17天进行爬杆测试,每只小鼠测试2次,每次间隔1 h,按照上述标准进行评分,取平均值。
2.4 纹状体DA水平检测末次行为学结束后,将小鼠断头取脑,分离纹状体,处理过程均在冰浴条件下进行,遵循低温快速的原则。加入A液(0.6 mol/L高氯酸溶液含浓度为0.375 μg/mL的IP),匀浆,4 ℃,20 000×g离心20 min,吸取一定量上清,加入半体积的B液(柠檬酸钾20 mmol/L,磷酸氢二钾300 mmol/L,EDTA·Na2 2 mmol/L),冰浴30 min,混匀,静置,20 000×g,4 ℃离心20 min,吸取上清,20 000×g,4 ℃离心20 min,吸取上清,4 ℃保存待测。
2.4.1 色谱条件采用岛津高效液相色谱仪和电化学检测器检测。检测器检测灵敏度10 nA,玻碳工作电极,Ag/AgCl参比电极,检测电位0.76 V。流动相为乙酸钠-柠檬酸缓冲液(柠檬酸85 mmol/L、无水乙酸钠100 mmol/L、EDTA∙Na2 0.2 mmol/L、15%甲醇),三蒸水定容至1 L,调节pH为3.68,抽滤后加入适量辛烷磺酸钠(SOS)(先加90 mg,再根据分离情况而定)、正二丁胺(先加15 μL)使峰完全分离。岛津C18色谱柱(250 mm×4.6 mm, 5μm),进样量50 μL,体积流量1.2 mL/min,柱温25 ℃。
2.4.2 对照品溶液的制备称取DA、IP分别溶于0.1 mol/L HClO4中,配制成对照品储备液,取储备液定量混合,用0.1 mol/L HClO4稀释使DA质量浓度为0.125 μg/mL,IP为0.25 μg/mL。
2.5 免疫组化检测黑质多巴胺神经元末次行为学实验后,每组随机取5只小鼠,0.5%戊巴比妥钠ip麻醉后,用4%多聚甲醛(含3%蔗糖,用pH 7.4的PBS配制)灌流,灌流固定后断头取脑。在黑质部位行连续冠状面切片,厚度20 μm。然后在3% H2O2室温孵育10 min,PBST洗5 min×3次。用羊血清原液室温封闭30 min,加入酪氨酸羟化酶(TH)一抗(1:500)置于水平摇床中室温下孵育2 h,4 ℃孵育过夜。PBST洗5 min×3次,加生物素标记的兔抗山羊二抗(1:300),室温孵育2 h,PBST洗5 min×3次。加辣根过氧化物酶(HRP)标记链亲合素三抗(1:300),室温孵育2 h,PBST洗,5 min×3次。用DAB工作液显色2 min,将显色后的脑切片置于0.01 mol/L PBST中。酒精依次脱水后用二甲苯透明2次,每次5 min,中性树脂封片。正置显微镜下观察计数小鼠黑质致密部TH阳性神经元数目,将每只小鼠的脑片取平均值为最后该小鼠TH阳性神经元数目。
2.6 统计学分析应用SPSS 13.0统计软件进行处理,多组数据之间差异比较采用One-way ANOVA及LSD法,组间差异比较用t检验;数据以x±s表示。
3 结果 3.1 对亚急性PD模型小鼠转棍行为的改善作用转棍法结果显示(表 1),在实验的第5、9、16天,模型组小鼠转棍掉落潜伏期明显低于对照组(P<0.01);与模型组比较,止颤颗粒低剂量+美多芭组和止颤颗粒中剂量+美多芭组在第5天可明显提高小鼠转棍潜伏期(P<0.05);在实验第9、16天止颤颗粒低剂量+美多芭、止颤颗粒中剂量+美多芭、止颤颗粒高剂量+美多芭(第16天没有统计学差异)以及单用止颤颗粒均可明显提高小鼠转棍潜伏期(P<0.05、0.01)。单用美多芭对小鼠行为学无明显改善作用。止颤颗粒低剂量+美多芭组的药效优于其他各组。止颤颗粒中剂量+美多芭组、止颤颗粒高剂量+美多芭对转棍行为的改善作用与美多芭组相比有增强趋势,但无显著差异,止颤颗粒低剂量+美多芭组对转棍行为障碍的改善作用明显高于美多芭组。
|
|
表 1 止颤颗粒对MPTP引起的亚急性PD模型小鼠转棍行为的影响(x±s) Table 1 Effect of Zhichan Granule on rotary rod behavior disorder in subacute PD model mice induced by MPTP (x±s) |
3.2 对亚急性PD模型小鼠爬杆行为的改善作用
爬杆法结果显示(表 2),在实验的第6、10、17天,模型组与对照组比较,小鼠爬杆评分明显降低(P<0.01)。与模型组比较,在实验第6天,止颤颗粒低剂量+美多芭组小鼠爬杆评分明显提高(P<0.05),在第10天和第17天,止颤颗粒低剂量+美多芭组、止颤颗粒中剂量+美多芭组、止颤颗粒高剂量+美多芭组和止颤颗粒组均可明显提高小鼠爬杆评分(P<0.01),而美多芭组对小鼠爬杆行为无明显改善作用。
|
|
表 2 止颤颗粒对MPTP引起的亚急性PD模型小鼠爬杆行为的影响(x±s) Table 2 Effect of Zhichan Granule on climbing behavior disorder in subacute PD model mice induced by MPTP (x±s) |
3.3 对亚急性PD模型小鼠纹状体中DA的影响
表 3结果显示,模型组小鼠纹状体DA水平明显低于对照组(P<0.01)。与模型组比较,止颤颗粒低剂量+美多芭组、止颤颗粒中剂量+美多芭组以及美多芭组均可显著提高小鼠纹状体DA水平(P<0.05、0.01)。止颤颗粒组和止颤颗粒高剂量+美多芭组有提高DA水平的趋势,但与模型组比较差异不显著。此外,各剂量止颤颗粒联合用药组小鼠纹状体DA水平均高于美多芭组,且止颤颗粒低剂量+美多芭组效果显著优于美多芭组(P<0.01)。
|
|
表 3 止颤颗粒对MPTP引起的亚急性PD模型小鼠纹状体中DA水平的影响(x±s) Table 3 Effect of Zhichan Granule on level of striatum DA in subacute PD model mice induced by MPTP (x±s) |
3.4 对亚急性PD模型小鼠黑质多巴胺神经元的影响
免疫组化结果(图 1和表 4)显示,模型组小鼠黑质致密部TH阳性神经元数目较正常小鼠数量明显减少(P<0.01)。给药各组均可增加TH阳性神经元数目,且止颤颗粒低剂量+美多芭组TH阳性神经元数量与模型组及美多芭组相比显著增多(P<0.05)。
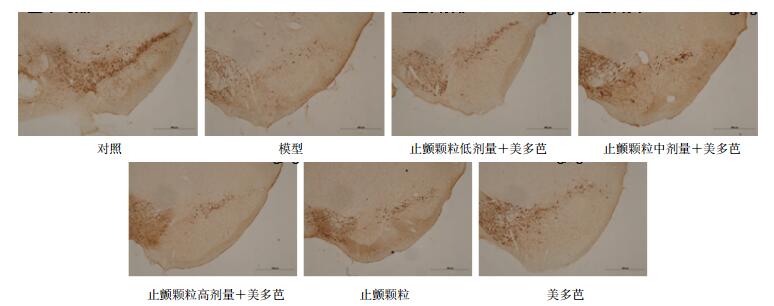
|
图 1 止颤颗粒对MPTP引起的亚急性PD模型小鼠黑质多巴胺神经元的影响 Fig.1 Effect of Zhichan Granule on dopamine neurons of substantia nigra in subacute PD model mice induced by MPTP |
|
|
表 4 止颤颗粒对MPTP引起的亚急性PD模型小鼠黑质TH阳性神经元数目的影响(x±s, n=5) Table 4 Effect of Zhichan Granule on dopamine neurons of substantia nigra in subacute PD model mice induced by MPTP (x±s, n=5) |
4 讨论
PD的主要病理改变是黑质致密部多巴胺能神经元的进行性变性死亡、残存神经元多巴胺合成能力降低,导致纹状体DA神经递质的不足,从而对锥体外系的运动调节功能失调[28]。美多芭是临床上明确的治疗PD的药物,能补充脑中DA,但对受损的多巴胺神经元没有保护作用,所以只能用于改善PD症状。
MPTP模型是最常用的研究PD的模型,MPTP能够引起黑质致密部多巴胺能神经元的变性,线粒体功能障碍和氧化应激反应,最终导致与帕金森病相似的临床和病理学特征,广泛的应用于PD药效评价的研究。因此,本研究采用MPTP诱发的小鼠亚急性PD模型来评价止颤颗粒与美多芭合用是否能增强美多芭的疗效。
本研究分别选取MPTP注射期间,MPTP刚注射后和MPTP注射后数日内,3个不同的毒性阶段观察MPTP对小鼠行为学的改变以及药物干预的影响。结果表明,20 mg/kg MPTP连续多日注射可诱发小鼠出现显著的PD症状,动物的运动协调能力下降从实验初期维持至终点。有研究报道称,小剂量MPTP给药,根据动物品系、年龄的不同,部分会出现明显的自发恢复倾向[29],但在本研究中,并未发现。
在以往研究中,通常采用75 mg/kg的美多芭(以L-DOPA计)作为阳性药物。在临床研究中发现,止颤颗粒与2/3临床剂量的美多芭合用,可达到美多芭全量的效果。因此在本实验中选择50 mg/kg的美多芭作为阳性药物。药物干预的结果显示,随着造模时间的延长,各剂量止颤颗粒+美多芭组以及单用止颤颗粒组动物在转棍及爬杆行为学测试中均表现出优于美多芭组的效果,并且止颤颗粒低剂量+美多芭组在转棍实验第9、16天,止颤颗粒高剂量+美多芭组在爬杆实验的第10天,相比较单用美多芭组,对小鼠的运动协调能力均有显著改善。这与前期临床研究中,联合用药组在中医症候及运动评分中都优于单用美多芭的结果一致[23]。
DA及其代谢产物的减少是PD的主要神经生化改变,其减少的程度与黑质细胞丧失的程度成正比。因此,中脑黑质纹状体DA的量测定是临床诊断的主要指标之一[30]。纹状体内DA的量极高,由其调控大脑运动神经功能,当DA变形死亡达到80%以上,大脑不再具有调节神经系统的正常功能,进而出现PD症状[31]。据此,本研究选择纹状体DA的量测定来评价止颤颗粒联合用药是否优于单独使用美多芭。研究结果显示,造模后,模型组DA量相较对照组显著下降(P<0.01),而低、中剂量止颤颗粒联合用药组以及美多芭组均能显著提升纹状体内DA的量(P<0.05、0.01)。此外,单用止颤颗粒及高剂量止颤颗粒联合用药也能一定程度保护由神经毒性造成的模型动物脑内DA量显著减少。提示,止颤颗粒联合用药对PD模型小鼠中脑纹状体DA的量有保护作用,其效果比单独使用美多芭为优。
另外,PD的发病是因纹状体黑质致密部DA的量下降,而多巴胺的合成途径是酪氨酸在TH的催化作用下生成多巴,继而多巴在多巴胺脱酶的催化作用下形成DA。由此可见TH是DA合成的第一步,也是其合成过程中的限速酶。研究表明,PD病人中TH的量降低,同时动物PD模型的研究也发现,模型动物TH mRNA的表达量降低,TH的失活与PD的产生有着重要的联系[32]。本研究中,各剂量止颤颗粒联合用药组及单用止颤颗粒组TH阳性细胞计数数目均多于美多芭组,其中低剂量止颤颗粒联合用药组TH阳性细胞数目与美多芭组比较有显著增多。表明止颤颗粒联合用药可以保护DA在体内生物合成的关键限速酶,提高纹状体内DA的量,其效果优于单用美多芭。
止颤颗粒来源于临床用方,由钩藤、黄芪、白芍、知母等7味中药组成。有研究指出,中药钩藤提取物异钩藤碱能够诱导多种神经细胞发生自噬,清除积聚于大脑、导致PD症状的异常蛋白,并促进神经细胞中α-突触核蛋白的降解[33]。同样,黄芪甲苷也被报道可显著抑制MPTP诱导的凋亡前体蛋白Bax表达量的升高,增加Bcl-2的表达量,并能抑制其下游凋亡蛋白caspase-3的表达,通过BAX途径抑制细胞凋亡起到神经保护作用[34]。此外,有报道称中药白芍中的主要成分芍药苷可以通过提升PD小鼠模型脑内超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的量,抑制氧化损伤来起到对多巴胺能神经元的保护作用[35]。
综上,本研究发现各剂量止颤颗粒联合美多芭用药,尤其是止颤颗粒低剂量+美多芭组能显著提升PD小鼠中脑纹状体内TH阳性细胞的数目,提高DA的量,并显著改善PD小鼠运动协调性,其作用效果优于单独使用美多芭,其作用机制可能与抑制细胞凋亡、氧化损伤及诱导自噬有关,并有待后续研究进一步验证。
| [1] | Jankovic J, Stacy M. Medical management of levodopa-associated motor complications in patients with Parkinson's disease[J]. CNS Drugs , 2007, 21 (8) :677–692. DOI:10.2165/00023210-200721080-00005 |
| [2] | Burch D, Sheerin F. Parkinson's disease[J]. Lancet , 2005, 365 (9459) :622–627. DOI:10.1016/S0140-6736(05)70807-2 |
| [3] | Wakabayashi K, Takahashi H. Pathology of familial Parkinson's disease[J]. Brain Nerve , 2007, 59 :851–864. |
| [4] | Hirsch EC, Hunot S. Neuroinflammation in Parkinson's disease:a target for neuroprotection?[J]. Lancet Neurol , 2009, 8 (4) :382–397. DOI:10.1016/S1474-4422(09)70062-6 |
| [5] | Chin-Chan M, Navarro-Yepes J, Quintanilla-Vega B. Environmental pollutants as risk factors for neurodegenerative disorders:Alzheimer and Parkinson diseases[J]. Front Cell Neurosci , 2015 . DOI:10.3389/fncel.2015.00124 |
| [6] | Jenner P. Oxidative stress in Parkinson's disease[J]. Ann Neurol , 2003, 53 (Suppl 3) :26–36. |
| [7] | Mosley R L, Benner E J, Kadiu I, et al. Neuroinflammation, Oxidative Stress and the Pathogenesis of Parkinson's Disease[J]. Clin Neurosci Res , 2006, 6 (5) :261–281. DOI:10.1016/j.cnr.2006.09.006 |
| [8] | Przedborski S, Vila M. The 1-2methyl-4-phenyl-1, 2, 3, 62 tetrahy-dropyridine mouse model:a tool to explore the pathogenesis of Parkinson's disease[J]. Ann N Y Acad Sci , 2003, 991 (6) :189–198. |
| [9] | Janetzky B, Hauck S, Youdim MBH, et al. Unaltered aconitase activity, but decreased complex I activity in substantia nigra pars compact of patients with Parkinson's disease[J]. Neurosci Let , 1994, 169 (1/2) :126–128. |
| [10] | Dauer W, Przedborski S. Parkinson's disease:mechanisms and models[J]. Neuron , 2003, 39 (6) :889–909. DOI:10.1016/S0896-6273(03)00568-3 |
| [11] | Miller G W, Cainetdinov RR, Levey AI, et al. Dopamine transporters and neuronal injury[J]. TIPS , 1999, 20 (10) :424–429. |
| [12] | Carta M, Carlsson T, Kirik D, et al. Dopamine released from 5-HT terminals is the cause of L-DOPA-induced dyskinesia in parkinsonian rats[J]. Brain , 2007, 130 (7) :1819–1833. DOI:10.1093/brain/awm082 |
| [13] | Cenci M A. Dopamine dysregulation of movement control in L-DOPA-induced dyskinesia[J]. Trend Neurosci , 2007, 30 (5) :236–243. DOI:10.1016/j.tins.2007.03.005 |
| [14] | Fabbrini G, Brotchie J M, Grandas F, et al. Levodopa-induced dyskinesias[J]. Mov Disord , 2007, 22 (10) :1379–1389. DOI:10.1002/(ISSN)1531-8257 |
| [15] | 王冬梅, 魏风, 莫遗盛, 等. 帕宁方治疗帕金森病的临床研究[J]. 中药药理与临床 , 2011, 27 (6) :96–97. |
| [16] | 曹子成, 李凤莲, 张耀升. 脑康泰胶囊治疗帕金森病62例[J]. 中国临床药理学与治疗 , 2002, 7 (1) :75–76. |
| [17] | 胡雅琼, 罗理勇, 曾亮. 茶叶提取物对帕金森病的防治作用研究进展[J]. 中草药 , 2014, 45 (9) :1342–1348. |
| [18] | 王友联, 苏国志, 张叔杰, 等. 止颤胶囊对帕金森大鼠血清中细胞因子IL-1β和IL-6水平的影响[J]. 药物评价研究 , 2013, 36 (4) :270–273. |
| [19] | 王慧新, 刘毅, 李如奎. 止颤汤联合美多巴片治疗帕金森病30例临床研究[J]. 中医杂志 , 2010, 51 (1) :146–147. |
| [20] | 刘毅, 王慧新, 李如奎. 止颤汤治疗帕金森病的临床疗效观察[J]. 中西医结合心脑血管病杂志 , 2007, 5 (11) :1064–1065. |
| [21] | 刘亚珍, 施雨露, 刘永茂, 等. 止颤胶囊对帕金森模型大鼠脑内单胺氧化酶B的影响[J]. 中草药 , 2010, 41 (6) :963–965. |
| [22] | 王慧新, 刘毅, 李如奎. 止颤汤联合西药治疗帕金森病的临床研究[J]. 中医药导报 , 2010, 16 (3) :17–18. |
| [23] | 陈梦云, 刘毅, 阮克锋, 等. 止颤颗粒联合常规西药治疗肝肾不足、气血两虚型帕金森病的随机、双盲、安慰剂对照临床研究[J]. 上海中医药杂志 , 2014, 48 (10) :27–30. |
| [24] | 杨宇. 普拉克索治疗帕金森病的疗效分析与评价[J]. 临床合理用药杂志 , 2011, 4 (5C) :37–38. |
| [25] | Wolozin B, Wang S W, Li N C, et al. Simvas-tatin is associated with a reduced incidence of dementia and Parkinson's disease[J]. BMC Med , 2007 (5) :20. |
| [26] | 郜利霞, 刘轲. 中医药治疗帕金森病综述[J]. 时珍国医国药 , 2010, 21 (3) :724–725. |
| [27] | 郭德玉, 于向东, 陈彪, 等. MPTP致C57BL/6小鼠帕金森模型的复制及常用的行为学分析方法[J]. 实验动物科学 , 2010, 27 (2) :1–4. |
| [28] | 方伟.多巴胺能神经元轴突变性在MPTP诱导的帕金森病模型中的作用研究[D].西安:第四军医大学, 2015. |
| [29] | Sugama S, Yang L, Cho B P, et al. Age-related microglial activation in MPTP-induced dopaminergic neurodegeneration in C57BL/6 mice[J]. Brain Res , 2003, 964 (2) :288–294. DOI:10.1016/S0006-8993(02)04085-4 |
| [30] | 卢晨.川芎嗪对MPTP诱导大鼠中脑多巴胺神经元损伤所致帕金森病的脑神经保护机制研究[D].西安:第四军医大学, 2015. |
| [31] | Chiasserini D, Paciotti S, Eusebi P, et al. Selective loss of glucocerebrosidase activity in sporadic Parkinson's disease and dementia with Lewy bodies[J]. Mol Neurodegener , 2015 . DOI:10.1186/s13024-015-0010-2 |
| [32] | 陈锡群. 酪氨酸轻化酶与帕金森病[J]. 国外医学:神经病学神经外科学分册 , 2001, 28 (1) :59–62. |
| [33] | Lu J H, Tan J Q, Durairajan S S, et al. Isorhynchophylline, a natural alkaloid, promotes the degradation of alpha-synuclein in neuronal cells via inducing autophagy[J]. Autophagy , 2012, 8 (1) :98–108. DOI:10.4161/auto.8.1.18313 |
| [34] | 张治国.黄芪甲苷对帕金森神经元的保护作用及其机制研究[D].西安:第四军医大学, 2012. |
| [35] | 郑梅竹, 范亚军, 时东方, 等. 白芍提取物对MPTP致帕金森小鼠的保护作用及机制的研究[J]. 湖北农业科学 , 2015, 54 (12) :2960–2963. |
 2016, Vol. 47
2016, Vol. 47


