2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. State Key Laboratory of Pharmaceutical Process New-tech for Chinese Medicine, Lianyungang 222001, China
双鱼颗粒(SG)处方由鱼腥草、金银花、赤芍、艾叶和薄荷5味药组成,为江苏康缘药业股份有限公司研制的中药复方6类新药,具有辛凉解表、清热解毒之功效,用于外感风热型普通感冒,症见发热头痛、全身酸痛、鼻塞、流涕、咳嗽、咳痰、咽喉发痒、口干而渴、咽喉红肿疼痛、舌红、脉数等症[1]。目前,SG质量标准中对挥发性成分桉油精、薄荷脑和甲基正壬酮进行了鉴别,并对绿原酸和芍药苷进行了定量控制,但仅对2个成分进行定量控制,难以保证产品批间一致性。为了更好地控制产品质量,保证临床疗效和产品批间一致性,本实验采用HPLC法同时对SG进行了指纹图谱研究(标出17个共有峰)和7个指标成分的定量测定,所测定的7个指标成分分别为金银花、艾叶中的酚酸类成分和赤芍中的单萜类成分,具有较广泛的药理活性[2-6]。本实验所建立的方法可作为全面控制SG质量的有效方法之一。
1 仪器和试药Agilent 1200高效液相色谱仪,DAD紫外检测器及MWD紫外检测器,美国安捷伦公司;Agilent 1290超高压液相色谱仪,Agilent 6538 Q-TOF/MS质谱检测器,电喷雾(ESI)离子源,美国安捷伦公司;Mettler AE240电子分析天平、Mettler XP-6电子分析天平,瑞士梅特勒公司;Centrifuge 5415D高速离心机,德国Eppendorf公司;Milli-Q Academic纯水机,密理博公司;KQ-250DB型超声波清洗仪,昆山超声仪器有限公司。
10批SG,批号分别为150201、150202、150203、141201、141202、141203、141102、141104、150301、150302,江苏康缘药业股份有限公司生产;绿原酸对照品(批号110753-201314,质量分数以96.6%计)和芍药苷对照品(批号110736-201337,质量分数以94.9%计),均购自中国食品药品检定研究院;新绿原酸对照品(批号MUST-13013001,质量分数以99.37%计)、隐绿原酸对照品(批号MUST-13013002,质量分数以99.07%计)、异绿原酸A对照品(批号MUST-13101101,质量分数以98.82%计)、异绿原酸B对照品(批号MUST-13081402,质量分数以99.05%计)、异绿原酸C对照品(批号MUST-13081401,质量分数以99.84%计),均购自成都曼斯特生物技术有限公司;乙腈和三氟乙酸,均为色谱纯,美国天地公司;水为超纯水,其余试剂均为分析纯。
2 方法与结果 2.1 色谱条件色谱柱为Kromasil C18柱(250 mm×4.6 mm,3.5 μm);流动相为乙腈-0.05%三氟乙酸水溶液,梯度洗脱,线性洗脱程序为0~10 min,5%~10%乙腈;10~15 min,10%~15%乙腈;15~25 min,15%~25%乙腈;25~34 min,25%~34%乙腈;34~45 min,34%~70%乙腈;45~50 min,70%乙腈;体积流量0.8 mL/min;检测波长为230 nm(测定指纹图谱和芍药苷)和327 nm(测定绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C和新绿原酸);柱温30 ℃;进样量10 μL。见图 1。
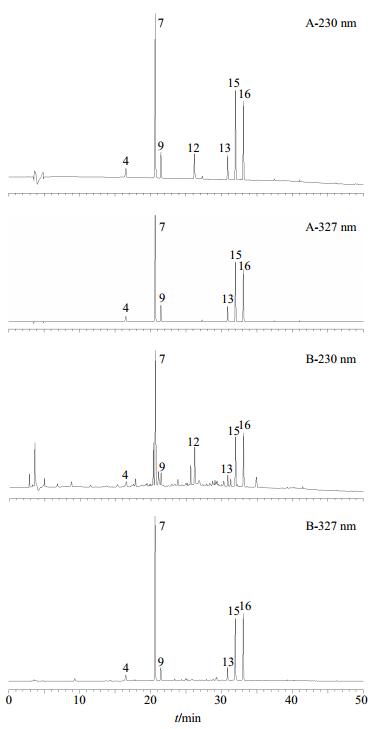
|
4-新绿原酸7-绿原酸9-隐绿原酸12-芍药苷13-异绿原酸B 15-异绿原酸A 16-异绿原酸C 12-paeoniflorin 13-isochlorogenic acid B 15-isochlorogenic acid A 16-isochlorogenic acid C 图 1 混合对照品(A)和SG供试品(B) HPLC图 Fig.1 HPLC of mixed reference substance (A) and SG sample (B) |
进行质谱分析时,流动相中0.05%三氟乙酸水溶液用0.2%甲酸水溶液替代。
2.2 质谱条件ESI离子源,正、负离子模式分别扫描,毛细管电压3 500 V,雾化气压力310.30 kPa(45 psi),干燥气体积流量10 L/min,加热毛细管温度350 ℃,源内裂解电压175 V,质量数扫描范围为m/z 100~1 000。
2.3 溶液制备 2.3.1 混合对照品溶液的制备取新绿原酸、绿原酸、隐绿原酸、芍药苷、异绿原酸B、异绿原酸A、异绿原酸C对照品适量,加70%甲醇制成含新绿原酸18 μg/mL、绿原酸110 μg/mL、隐绿原酸25 μg/mL、芍药苷30 μg/mL、异绿原酸B 16 μg/mL、异绿原酸A 30 μg/mL、异绿原酸C 58 μg/mL的混合对照品溶液,即得。
2.3.2 供试品溶液的制备取本品5袋,混匀,研细,取约0.25 g,置具塞锥形瓶中,精密加入70%甲醇25 mL,超声提取(250 W,40 kHz)30 min,放冷,称质量,用70%甲醇补足减失的质量,摇匀,即得。
2.4 线性范围考察精密称取新绿原酸对照品、绿原酸对照品、隐绿原酸对照品、芍药苷对照品、异绿原酸B对照品、异绿原酸A对照品、异绿原酸C对照品适量,加70%甲醇配制成质量浓度分别为164.8、806.4、189.6、243.2、135.2、241.6、465.6 μg/mL的混合对照品溶液,将其作为母液用70%甲醇逐倍稀释,分别精密吸取10 μL,注入液相色谱仪,测定,以进样质量浓度为横坐标(X),峰面积积分值为纵坐标(Y),绘制回归曲线,得各对照品线性范围、回归方程和相关系数分别为新绿原酸Y=13.61 X+3.048,r=1.000 0,线性范围5.15~164.80 μg/mL;绿原酸Y=22.83 X+42.19,r=0.999 9,线性范围25.2~806.4 μg/mL;隐绿原酸Y=17.72 X+4.590,r=0.999 9,线性范围5.925~189.600 μg/mL;芍药苷Y=15.06 X+18.48,r=0.999 7,线性范围7.6~243.2 μg/mL;异绿原酸B Y=21.45 X-1.348,r=1.000 0,线性范围4.225~135.200 μg/mL;异绿原酸A Y=25.71 X-8.784,r=1.000 0,线性范围7.55~241.60 μg/mL;异绿原酸C Y=23.84 X+53.36,r=0.999 8,线性范围14.55~465.60 μg/mL。
2.5 方法学考察 2.5.1 精密度试验取同一供试品(批号150201)溶液连续进样6针,以峰面积计算各指标成分RSD,分别为新绿原酸0.16%、绿原酸0.06%、隐绿原酸0.15%、芍药苷0.16%、异绿原酸B 0.22%、异绿原酸A 0.17%和异绿原酸C 0.25%。以芍药苷为参照峰,计算共有峰相对保留时间及相对峰面积,结果RSD均小于2.53%。
2.5.2 稳定性试验取同一供试品(批号150201)内容物,研细,取约0.25 g,精密称定,按“2.3.2”项方法制备供试品溶液,精密吸取10 μL,分别于0、2、4、6、8、12 h注入高效液相色谱仪,以峰面积计算各指标成分RSD,分别为新绿原酸0.85%、绿原酸0.21%、隐绿原酸1.01%、芍药苷0.69%、异绿原酸B 0.90%、异绿原酸A 0.41%和异绿原酸C 0.25%。以芍药苷为参照峰,计算共有峰相对保留时间及相对峰面积,结果RSD均小于2.47%。结果表明供试品溶液室温放置12 h稳定。
2.5.3 重复性试验取同一供试品(批号150201)内容物,研细,取约0.25 g,精密称定,按“2.3.2”项方法制备供试品溶液,平行制备6份,测定,计算质量分数。结果新绿原酸、绿原酸、隐绿原酸、芍药苷、异绿原酸B、异绿原酸A和异绿原酸C的平均质量分数分别为2.29、13.18、2.57、3.50、1.69、2.99、6.26 mg/g,RSD分别为1.00%、0.30%、0.73%、0.72%、1.65%、1.02%、0.60%。以芍药苷为参照峰,计算共有峰相对保留时间及相对峰面积,结果RSD均小于2.73%。结果表明本方法重复性良好。
2.5.4 回收率试验取同一供试品(批号150201)内容物,研细,取约0.125 g,精密称定,共称取6份,置具塞锥形瓶中,分别精密加入混合对照品溶液(各指标成分质量浓度分别为新绿原酸286.2 μg/mL、绿原酸1 605.3 μg/mL、隐绿原酸324.1 μg/mL、芍药苷435.4 μg/mL、异绿原酸B 208.5 μg/mL、异绿原酸A 365.6 μg/mL和异绿原酸C 763.8 μg/mL)1 mL,再精密加入70%甲醇24 mL,称定质量,超声提取(250 W,40 kHz)30 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液离心,测定,计算回收率。结果新绿原酸、绿原酸、隐绿原酸、芍药苷、异绿原酸B、异绿原酸A和异绿原酸C的平均回收率分别为97.8%、101.3%、100.2%、101.6%、98.4%、100.0%、101.8%,RSD分别为0.67%、1.23%、0.83%、0.65%、1.26%、0.66%、0.78%。
2.6 指纹图谱的建立与技术参数根据10批SG检测所得图谱,标定17个共有峰,共有峰峰面积占总峰面积90%以上,其中芍药苷(12号峰)在本品指纹图谱中保留时间适中、分离较好、质量分数较稳定、对照品易获得,因此选择芍药苷为本品指纹图谱参照物。
采用国家药典委员会颁布的《中药色谱指纹图谱相似度评价系统2012版》进行分析,经数据匹配,以中位数法建立对照指纹图谱。见图 2。10批所测供试品色谱图与对照指纹图谱相似度分别为0.970、0.969、0.978、0.951、0.957、0.962、0.985、0.980、0.987、0.988。
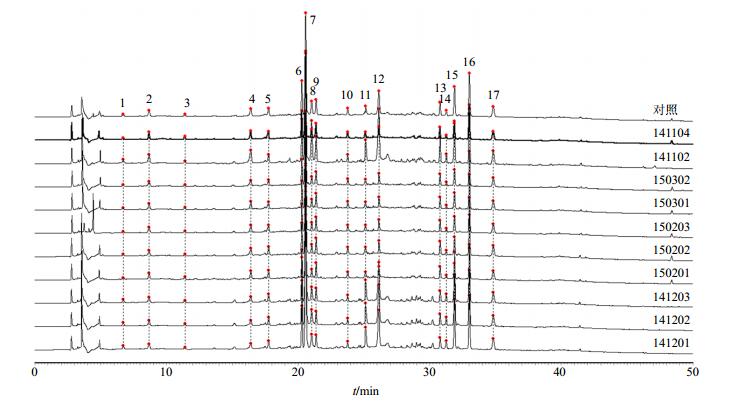
|
图 2 10批SG的HPLC指纹图谱和对照指纹图谱 Fig.2 HPLC fingerprints for 10 batches of SG and control fingerprint |
2.7 药材与制剂的相关性
取SG处方中5味药材分别按SG制剂工艺制备样品,按“2.3.2”项下方法制备供试品溶液,测定,对比各吸收峰的紫外吸收光谱和相对保留时间,得到SG指纹图谱中的17个特征峰在5味药材中的归属,见图 3。结果表明3、4、5、6、7、8、10、11、14、15、16号峰来源于金银花,4、7、9、13、15、16号峰来源于艾叶,2、12、17号峰来源于赤芍,1号峰来源于鱼腥草。结果表明4味药材对本实验所建立的SG指纹图谱有贡献,薄荷中主要化学成分无紫外吸收或响应较低,在该指纹图谱中无体现。
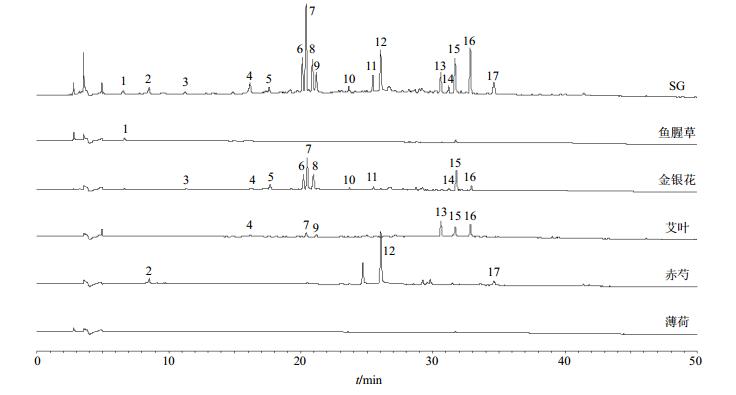
|
图 3 SG指纹图谱中各共有峰归属色谱图 Fig.3 SG fingerprints of each common peak attribution |
2.8 指纹图谱共有峰的鉴定
为进一步阐明SG的化学物质成分,采用UPLC Q-TOF/MS技术对指纹图谱中各共有峰进行指认。通过正、负离子模式扫描,将已知化合物的理论相对分子质量与获取的目标化合物的精确相对分子质量进行比对,设置Analyst QS数据库分析软件质谱测量误差小于±5×10−6,计算出化合物可能的元素组成,同时结合对照品信息、对比相关文献报道进行化学成分指认[7-10],对SG指纹图谱中14个共有峰进行了指认,结果见表 1。共有峰1、14、17对应的化学成分未能查阅到其相关的文献报道,有待于进一步研究。
|
|
表 1 14个共有峰通用名称、分子式和质谱数据 Table 1 Common name, molecular formula, and mass spectral data of 14 common peaks |
2.9 样品定量测定
为更好地控制产品质量,在指纹图谱研究的基础上,对具有广泛药理活性和指纹图谱中峰面积较大的7个主要共有峰进行了定量测定。取10批SG,按“2.3.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样分析,分别计算7个成分质量分数,结果见表 2。从10批样品定量测定结果可知,个别成分如异绿原酸A质量分数差异较大,通过溯源留样的工艺中间体和投料药材中质量分数,不同批次成品中质量分数差异主要来源于药材的质量分数差异,10批SG分别为3批次药材投料所得,3批次药材中各指标成分的质量分数存在一些差异,尤其是异绿原酸A的量最高的一批为最低一批的2.6倍。目前本课题组正在收集药材,对其量差异的原因进行研究。为了控制好成品质量、确保样品批间一致性,需对药材质量进行严格控制。
|
|
表 2 样品中7种成分定量测定结果(n=3) Table 2 Determination of seven components in Shuangyu Granules (n=3) |
3 讨论
采用DAD检测器在190~400 nm对供试品溶液进行扫描,结果230 nm下反映的信息较全面,各色谱峰分离较好,因此选择230 nm作为指纹图谱的检测波长;芍药苷最大吸收波长为230 nm,因此芍药苷定量测定波长选择为230 nm,结合绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C和新绿原酸紫外吸收曲线,这6个成分定量测定波长选择为327 nm。
考虑到本品含有大量有机酸类成分,选用乙腈-酸水系统进行研究。实验比较了乙腈-0.05%三氟乙酸水溶液、乙腈-0.3%甲酸水溶液和乙腈-0.05%磷酸水溶液系统,结果显示乙腈-0.05%三氟乙酸水溶液所得色谱图中各色谱峰峰型较好、分离较佳,因此选用乙腈-0.05%三氟乙酸水溶液作为流动相。
本实验建立了SG指纹图谱,并同时对7个成分进行定量测定,方法简便、稳定、可靠、重复性好,可以控制SG的质量,保证生产的稳定性。
| [1] | 王俨如, 张新庄, 李娜, 等. 基于网络药理学方法探讨双鱼颗粒治疗上呼吸道感染的作用机制[J]. 中国新药杂志 , 2015, 24 (11) :1222–1227. |
| [2] | 宋亚玲, 王红梅, 倪付勇, 等. 金银花中酚酸类成分及其抗炎活性研究[J]. 中草药 , 2015, 46 (4) :490–495. |
| [3] | 王亚丹, 杨建波, 戴忠, 等. 中药金银花的研究进展[J]. 药物分析杂志 , 2014, 34 (11) :1928–1935. |
| [4] | 王永丽, 尉小慧, 刘伟, 等. 不同产地艾叶炮制前后总酚酸的含量比较研究[J]. 时珍国医国药 , 2015, 26 (1) :88–90. |
| [5] | 陆小华, 马骁, 王建, 等. 赤芍的化学成分和药理作用研究进展[J]. 中草药 , 2015, 46 (4) :595–602. |
| [6] | 郑世存, 李晓宇, 欧阳兵, 等. 芍药苷药理作用研究新进展[J]. 中国药物警戒 , 2012, 9 (2) :100–103. |
| [7] | 范玛莉, 邢婕, 李震宇, 等. 基于NMR代谢组学技术的白芍与赤芍化学成分比较研究[J]. 中草药 , 2014, 45 (22) :3230–3237. |
| [8] | Qi L W, Chen C Y, Li P. Structural characterization and identification of iridoid glycosides, saponins, phenolic acids and flavonoids in Flos Lonicerae Japonicae by a fast liquid chromatography method with diode-array detection and time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom , 2009, 23 (19) :3227–3242. DOI:10.1002/rcm.v23:19 |
| [9] | 白雪, 黄惠锋, 吴修红, 等. HPLC-DAD-MS/MS法分析金银花中化学成分[J]. 食品与药品 , 2015, 17 (1) :5–8. |
| [10] | 张丽媛, 李遇伯, 李利新, 等. HPLC-Q-TOF/MS分析金银花的化学成分[J]. 中南药学 , 2012, 10 (3) :204–208. |
 2016, Vol. 47
2016, Vol. 47



