2. 云南省昆虫生物医药研发重点实验室, 云南 大理 671000
2. Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R & D, Dali 671000, China
美洲大蠊提取物(CⅡ-3)是蜚蠊科昆虫美洲大蠊Periplaneta americana L.的虫体鲜品或干品经醇水提取、大孔吸附树脂柱色谱、醇溶剂洗脱精制而成。研究表明,CⅡ-3有显著的抗肿瘤活性,可在肿瘤的起始、增殖及发展阶段产生抑制作用[1-5]。张成桂等[6]通过SDS-PAGE电泳实验对CⅡ-3进行成分分析,结果发现CⅡ-3中含有大量的低相对分子质量(MW)多肽混合物;福林酚法测定CⅡ-3中的蛋白质质量分数在总成分中占62.7%。众所周知,由于胃酸破坏、胃肠道中蛋白水解酶降解,以及药物MW过大、脂溶性差、与消化道生物膜的亲和力差、难以通过消化道的生物膜屏障等原因,使得蛋白多肽类药物口服生物利用度普遍较低[7]。聚乙二醇-聚乳酸羟基乙酸共聚物(PEG-PLGA)是一种可生物降解的天然的高分子材料,低毒,生物相容性良好,医药学领域应用广泛,以其为载体材料制备的纳米粒、微球等给药系统是近年来的研究热点[8-11]。纳米粒是通过细胞旁路或集合淋巴结的微皱褶细胞(Microfold cells,M细胞)吞噬途径吸收入血,其包裹蛋白多肽类药物可以有效避免胃肠道分泌的酸和消化酶的破坏[12-14]。因此,本课题组选用PEG-PLGA为材料,采用复乳/溶媒蒸发法制备CⅡ-3纳米粒[15],对其体外释放行为以及在人工胃液中的体外稳定性进行研究,为今后进一步的细胞学及动物实验提供有价值的实验数据。
1 仪器与材料TU-1901紫外可见分光光度计,北京普析通用仪器有限公司;JY-II超声细胞粉碎机,宁波新芝生物科技股份有限公司;电子天平,梅特勒-托利多(上海)有限公司;R-210旋转蒸发仪,瑞士BUCHI公司;90-2定时恒温磁力搅拌器,江苏金坛市大地自动化仪器厂;3K-15高速冷冻离心机,德国SIGMA公司;HH-s2s数显恒温水浴锅,江苏金坛市大地自动化仪器厂;ZEN3600激光粒度分析仪,英国马尔文仪器有限公司;XK96-A快速混匀器,江苏姜堰市新康仪器厂;DLSB-5/25低温冷却液循环泵,巩义市予华仪器有限责任公司;JEM-100CX透射电镜仪,日本电子公司;THZ-C恒温振荡器,太仓市实验设备厂。
CⅡ-3冻干粉,蛋白多肽质量分数62.7%,大理大学药学与化学学院提供,批号201103251-2;PEG-PLGA[PEG 2000-PLGA(50:50)],MW 38 000,中国科学院成都有机化学研究所;福林酚试剂(Folin phenol),生物级,国药集团化学试剂有限公司,批号73104861;胃蛋白酶,批号64007137,国药集团化学试剂有限公司;谷氨酸,批号140690-201203,中国食品药品检定研究院;胰酶,国药集团化学试剂有限公司,批号64008836;其他试剂均为分析纯;实验中所用水皆为超纯水。
2 方法与结果 2.1 CⅡ-3纳米粒的制备按照本课题组已报道的方法[16-20],将CⅡ-3储备液或超纯水加入到PEG-PLGA的醋酸乙酯溶液中,采用复乳/溶媒蒸发法制备纳米粒。CⅡ-3储备液制得的纳米粒为CⅡ-3纳米粒,超纯水制得的纳米粒为空白纳米粒。
2.2 CⅡ-3纳米粒包封率和载药量的测定包封率和载药量的测定参见文献方法[21],并按下式计算包封率和载药量。
包封率=M2/M1
载药量=CV/m
M1为总投药量,M2为纳米粒中含药量,C为纳米粒重悬液蛋白质质量浓度,V为纳米粒重悬液取样体积,m为3份等体积纳米粒重悬液干质量的均值
测得CⅡ-3纳米粒包封率和载药量分别为(35.43±3.50)%和(1.19±0.09)%。
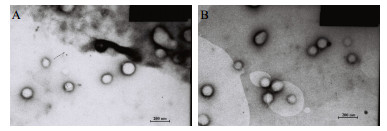
2.3 纳米粒的表征 2.3.1 纳米粒的形态学研究将空白纳米粒、CⅡ-3纳米粒分别用去离子水重悬,取适量滴到铜网上,1.0%磷钨酸染色,待其干燥后形成薄膜,置于透射电子显微镜(TEM)下观察。如图 1所示,制备得到的纳米粒外观圆整,大小均匀,分散性好;测得CⅡ-3纳米粒平均粒径为(104.9±7.4)nm,空白纳米粒平均粒径为(93.7±8.5)nm,表明CⅡ-3纳米粒平均粒径略大于空白纳米粒平均粒径。
|
图 1 空白纳米粒(A)和CⅡ-3纳米粒(B)的TEM图(× 50 000) Fig.1 TEM photographs of water-loaded nanoparticles (A) and CⅡ-3-loaded nanoparticles (B) (× 50 000) |
2.3.2 纳米粒的平均粒径和Zeta电位测定
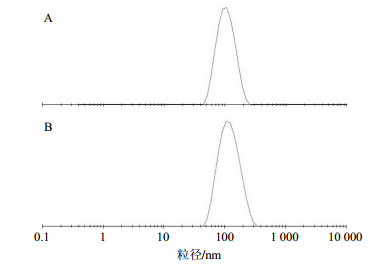
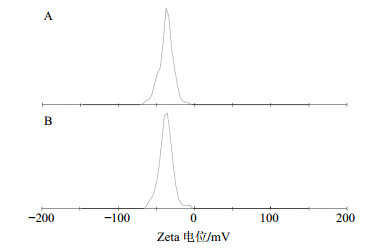
分别制备空白纳米粒和CⅡ-3纳米粒,各3批,将纳米粒用超纯水重悬,ZEN3600激光粒度分析仪测定纳米粒重悬液的平均粒径和Zeta电位。空白纳米粒平均粒径为(97.8±2.0)nm、多分散指数(PDI)为0.284±0.010,Zeta电位为(−38.6±2.8)mV;CⅡ-3纳米粒的平均粒径为(109.9±0.61)nm、PDI为0.119±0.010,Zeta电位为(−37.5±3.5)mV。平均粒径分布图见图 2,Zeta电位分布图见图 3。
|
图 2 空白纳米粒(A)和CⅡ-3纳米粒(B)的粒径分布图 Fig.2 Particle size distribution of water-loaded nanoparticles (A) and CⅡ-3-loaded nanoparticles (B) |
|
图 3 空白纳米粒(A)和CⅡ-3纳米粒(B)的Zeta电位分布图 Fig.3 Zeta potential distribution of water-loaded nanoparticles (A) and CⅡ-3-loaded nanoparticles (B) |
2.4 体外释放分析方法的建立 2.4.1 波长选择
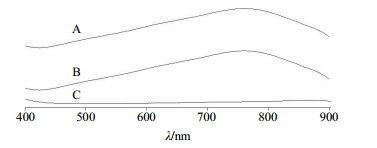
按纳米粒制备方法制备空白纳米粒与CⅡ-3纳米粒,制备好的纳米粒分别用适量超纯水重悬。然后向纳米粒重悬液中加入3倍重悬液体积的二氯甲烷,分散、溶解材料,10 000 r/min离心20 min,小心吸取上清液,最后按Lowry法显色,于400~900 nm波长下扫描。精密称取CⅡ-3冻干粉适量,用蒸馏水配制成2 mg/mL的溶液,同样按Lowry法显色,于400~900 nm波长下扫描。紫外吸收图谱见图 4。CⅡ-3、CⅡ-3纳米粒及空白纳米粒经Lowry法显色后,在400~900 nm内,CⅡ-3、CⅡ-3纳米粒在762 nm处均有最大吸收,且纳米粒材料无干扰,所以选取762 nm为测定波长。
|
图 4 CⅡ-3纳米粒(A)、CⅡ-3 (B)和空白纳米粒(C)的紫外吸收图谱 Fig.4 UV absorption spectrum of CⅡ-3-loaded nano-particles (A), CⅡ-3 (B), and water-loaded nanoparticles (C) |
2.4.2 线性关系考察
精密称取6.45 mg牛血清白蛋白(BSA)于25 mL量瓶中,加入超纯水溶解、定容、摇匀,配制成0.258 mg/mL的标准蛋白溶液。分别精密量取上述质量浓度的BSA溶液0.1、0.2、0.4、0.6、0.8、1.0 mL于10 mL具塞试管中,加水至1.0 mL。精密加入福林酚A溶液5 mL,摇匀,迅速置于35 ℃水浴中5 min,冷却后再向其精密加入福林酚B溶液0.5 mL,边加边摇,置于55 ℃水浴中10 min,再置于冰水浴中10 min即可。以超纯水同法操作为空白对照。照紫外-可见光分光光度法在762 nm波长处测定吸光度(A)值。以A值对BSA溶液质量浓度(C)进行线性回归,得到回归方程为A=2.640 C+0.033,r=0.999 3,结果表明,BSA在0.025~0.258 mg/mL与A值具有良好的线性关系。
2.4.3 精密度试验精密量取质量浓度为0.258 mg/mL的标准BSA储备溶液0.15、0.50、0.90 mL,分别置具塞试管中,分别加水至1.0 mL配成低、中、高3种质量浓度(38.7、129.0、232.2 μg/mL),然后按照“2.4.2”项下方法在762 nm处重复测定3次,统计各质量浓度A值的RSD,即为精密度。结果3个质量浓度对照品溶液A值的RSD分别为0.75%、0.27%、0.47%,表明仪器精密度良好。
2.4.4 重复性试验将制备的同一批CⅡ-3纳米粒用超纯水重悬,按“2.4.1”项下方法对纳米粒进行前处理,然后取6份100 μL重悬液于2 mL离心管中,然后照“2.4.2”下方法于762 nm处测定各个样品的A值。结果表明,6份纳米粒A值的RSD为1.48%,表明该方法的重复性好,结果可靠。
2.4.5 稳定性试验取同一份供试品溶液100 μL,按“2.4.2”项下方法测定,于0、10、20、30、40、50、60 min时在762 nm处测定A值,统计测定数据的RSD。其RSD值为0.95%,表明供试品在1 h内吸收稳定,颜色保持一致。
2.4.6 回收率试验精密称取CⅡ-3冻干粉适量,加空白纳米粒溶液混合,制备低、中、高3种质量浓度的CⅡ-3标准溶液,质量浓度分别为40.5、130.0、235.4 μg/mL,同上述方法处理进样,所得A值与含等量CⅡ-3的标准溶液,不经处理,直接加适量蒸馏水稀释至相同体积所得A值相比,计算提取回收率。结果3个质量浓度样品的平均回收率分别为98.34%、101.15%、101.74%,RSD为0.93%,说明提取完全,符合体外样品测定的要求。
2.5 体外释放实验 2.5.1 CⅡ-3纳米粒在人工胃肠液中的释药特征将1.300 g的CⅡ-3纳米粒用适量超纯水重悬,随即取0.8 mL该重悬液于2 mL离心管,再向其中加入等体积的人工胃液(pH 1.2,浓度为药典规定的2倍)溶散,置37 ℃ 60 r/min恒温振荡器中。分别于0、0.5、1、2 h取出同时间点3份样品,立即于4 ℃、10 000 r/min离心45 min,小心吸弃上清液。沉淀加入150 μL二氯甲烷溶解纳米粒材料,释放CⅡ-3,然后于4 ℃、10 000 r/min离心20 min,取100 μL上清液,采用Lowry法测蛋白方法进行样品测定。2 h后的样品全部于4 ℃、10 000 r/min离心45 min,小心吸弃上清液,再分别向沉淀中加入0.8 mL人工肠液(pH 6.8),超声使纳米粒再分散,继续置于37 ℃、60 r/min恒温振荡器中孵育,分别于4、12、24、36、48、60、72、96、120、192、240 h取出同时间点3份样品,照上述人工胃液样品处理方式进行样品测定。同时测定0时间点CⅡ-3纳米粒中的蛋白质的量(C0),计算各时间点保留在纳米粒中的蛋白质的量(Ct),则累积释放率(Qt)=(C0-Ct)/C0。以Qt对时间t作图,绘制释放曲线。
2.5.2 CⅡ-3纳米粒在pH 7.4 PBS中的释药特征将1 300 mg的CⅡ-3纳米粒加入pH 7.4 PBS中分散均匀,随即取1.5 mL该分散液置2 mL离心管中,置37 ℃、60 r/min恒温振荡器中。分别于0、0.5、1、2、4、12、24、36、48、60、72、96、120、192、240 h取出同时间点3份样品,立即于4 ℃、10 000 r/min离心45 min,小心吸弃上清液。沉淀加入150 μL二氯甲烷溶解纳米粒材料,释放CⅡ-3,然后于4 ℃、10 000 r/min离心20 min,取100 μL上清液,采用Lowry法测蛋白方法进行样品测定。
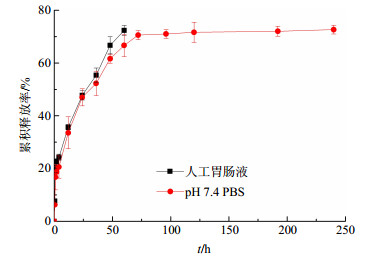
以取样时间为横坐标,Qt为纵坐标绘制体外释放曲线。CⅡ-3纳米粒在人工胃肠液中连续释放60 h以及在pH 7.4 PBS中连续释放10 d(240 h)的测定结果见表 1及图 5。在人工胃肠液中,前2 h CⅡ-3纳米粒在人工胃液中的Qt为(22.63±1.17)%,此后在人工肠液中释放,60 h的Qt为(72.35±1.90)%。CⅡ-3纳米粒在pH 7.4 PBS中连续释放10 d(240 h)的Qt为(72.67±1.65)%。CⅡ-3纳米粒在体外具有良好的缓释作用,释放过程释放分为突释和缓释部分(图 5)。对药物的释放曲线分别用零级释放模型、一级释放模型、Higuchi模型及Weibull分布模型进行拟合,在人工胃肠液中结果以Higuchi模型拟合度最高(R2=0.979 4,表 2),CⅡ-3纳米粒在人工胃肠液中体外释放符合该模型规律;在pH 7.4 PBS中结果以Weibull分布模型拟合度最高(R2=0.959 1,表 2),CⅡ-3纳米粒在pH 7.4 PBS中体外释放符合该模型规律。
|
|
表 1 CⅡ-3纳米粒在人工胃肠液和pH 7.4 PBS中Qt的测定结果(n=3) Table 1 Qt of CⅡ-3-loaded nanoparticles in artificial gastric and intestinal juice and pH 7.4 PBS (n=3) |
|
图 5 CⅡ-3纳米粒在人工胃肠液和pH 7.4 PBS中的体外释放 Fig.5 Accumulative release curves of CⅡ-3-loaded nanoparticles in artificial gastric and intestinal juice and pH 7.4 PBS |
|
|
表 2 CⅡ-3纳米粒在人工胃肠液和pH 7.4 PBS中体外释放的拟合方程 Table 2 Fitting equation of in vitro release of CⅡ-3-loaded nanoparticles in artificial gastrice and intestinal juice and pH 7.4 PBS |
2.6 体外保护作用研究分析方法的建立 2.6.1 波长选择
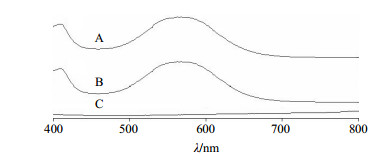
按纳米粒制备方法制备空白纳米粒与CⅡ-3纳米粒,制备好的纳米粒分别用适量超纯水重悬,按照“2.4.1”项下方法对纳米粒进行前处理,最后按茚三酮法显色,于400~800 nm波长下扫描。精密称取CⅡ-3冻干粉适量,用蒸馏水配制成1.5 mg/mL的溶液,同样按茚三酮法显色,于400~800 nm波长下扫描。CⅡ-3、CⅡ-3纳米粒及空白纳米粒经茚三酮法显色后,UV吸收图谱分别为图 6所示,可见在400~800 nm内,CⅡ-3、CⅡ-3纳米粒在566 nm处均有最大吸收,且纳米粒材料无干扰,所以选取566 nm为测定波长。
|
图 6 CⅡ-3纳米粒(A)、CⅡ-3 (B)和空白纳米粒(C)的UV吸收图谱 Fig.6 UV absorption spectrum of CⅡ-3-loaded nano-particles (A), CⅡ-3 (B), and water-loaded nanoparticles (C) |
2.6.2 线性关系考察
精密称取谷氨酸10 mg于100 mL量瓶中,加入超纯水溶解、定容、摇匀,配制成0.1 mg/mL的对照品溶液。分别精密量取上述质量浓度的对照品溶液0.5、1.0、1.5、2.0、3.0、4.0 mL于25 mL量瓶中,再加入0.5 mL 2%的茚三酮醇溶液,在沸水浴中加热15 min,冷却后加纯水定容,放置10 min后,照紫外-可见光分光光度法在566 nm波长处测定吸光度(A)值。以A值对谷氨酸溶液质量浓度(C)进行线性回归得标准曲线。得到回归方程A=42.703 6 C+0.081 5,r=0.999 6。结果表明,谷氨酸在2.0~16.0 μg/mL与A值具有良好的线性关系。
2.6.3 精密度试验精密量取质量浓度为0.1 mg/mL的对照品溶液1.0、2.0、4.0 mL,分别置25 mL量瓶中,加入0.5 mL 2%茚三酮醇溶液,在沸水浴中加热15 min,冷却后加纯水定容,配成低、中、高3种质量浓度(4.0、8.0、16.0 μg/mL),1 d内在566 nm处重复测定3次,统计各质量浓度测定数据的RSD,即为精密度。以A值考察该方法精密度,结果表明3个质量浓度下A值的RSD值分别为0.10%、0.05%、0.10%,表明仪器精密度良好。
2.6.4 重复性试验将制备的同一批CⅡ-3纳米粒用超纯水重悬,照“2.4.1”下方法对纳米粒进行前处理,精密量取6份2 mL样品溶液于25 mL量瓶中,加入0.5 mL 2%的茚三酮醇溶液,在沸水浴中加热15 min,冷却后加纯水定容,于566 nm处测定各个样品的A值。结果表明,6份纳米粒A值的RSD为1.25%,表明该方法的重复性好,结果可靠。
2.6.5 稳定性试验将制备的CⅡ-3纳米粒用超纯水重悬,照“2.4.1”项下方法对纳米粒进行前处理,精密量取样品溶液2 mL于25 mL量瓶中,加入0.5 mL 2%的茚三酮醇溶液,在沸水浴中加热15 min,冷却后加纯水定容,分别于0、0.5、1.0、1.5、2.0、3.0、4.0 h后测定。计算其RSD为0.42%,表明供试品在4 h内吸收稳定,颜色保持一致。
2.7 纳米粒对CⅡ-3保护作用的体外研究分别将适量CⅡ-3、CⅡ-3纳米粒分散于人工胃液(pH 1.2)中,置37 ℃水浴摇床(60 r/min)中孵育,于0、0.5、l、2、3、4 h取样,茚三酮显色法分析人工胃液中氨基酸的量,并与0时间点比较。每个时间点重复3次。由于蛋白多肽在酸和酶的作用下,会降解为氨基酸,本实验以谷氨酸为对照品测定各个时刻样品的总游离氨基酸质量浓度[22]。预试验发现CⅡ-3和CⅡ-3纳米粒放置24 h后氨基酸的量均不再变化,所以将24 h的氨基酸质量浓度作为蛋白质完全降解后的氨基酸质量浓度,则蛋白质降解率=(Ct-C0)/(Ctotal-C0),其中,Ct为各个时刻的氨基酸质量浓度,C0为0 h的氨基酸质量浓度,Ctotal为蛋白质完全降解后的氨基酸质量浓度。如表 3结果所示,CⅡ-3在人工胃液中极易被降解,0.5 h就有约70%被降解。相比之下,CⅡ-3经纳米粒包载后,在人工胃液中的稳定性显著提高。
|
|
表 3 蛋白质在人工胃液中不同时间点的降解率 Table 3 Degradation percentage of protein in different time points in artificial gastric juice |
3 讨论
美洲大蠊的主要抗肿瘤活性成分为蛋白多肽类物质,多肽、蛋白类药物半衰期短,口服生物利用度低,曾有将其制备成乳膏剂的报道[23]。将多肽、蛋白类药物制成纳米粒,利用纳米粒的缓释和控释特性可以保护其免受胃肠道等外部环境的破坏,延缓药物释放,减少给药次数[24-26]。实验中所用PEG-PLGA是采用开环聚合法将聚乙二醇(PEG)与D, L-丙交酯(LA)、乙交酯(GA)反应,纯化后得到PEG-PLGA两嵌段共聚物,然后制备纳米粒。在水相中,大部分的亲水性PEG链段由纳米粒内核向外水相伸展并可在水中摇摆,而疏水性PLGA链段则构成纳米粒内核,这种结构既能减少纳米粒与血液中蛋白的相互作用又能躲避单核巨噬系统(MPS)中巨噬细胞的吞噬,延长纳米载药系统在体内的循环时间,提高蛋白多肽药物的生物利用度[27]。
本实验采用UV法和干重法联合的方式进行载药量和包封率的测定。该方法简便、快速且成本低,只需要用到实验室的一些基本常见仪器[20, 22]。很多文献报道的载药量和包封率的测定都是在纳米粒经过冻干后由纳米粒的载药量除以纳米粒总质量换算得到的。也有文献是通过超滤离心法来测药物的载药量和包封率[28-30]。这些方法不仅成本高而且比较耗时。而且超滤离心过程难免会使蛋白多肽等稳定性低的药物被破坏,测蛋白浓度与测干质量的样品来自同一份样品,而测蛋白浓度的样品不用通过超速离心等步骤,这样保证了样品蛋白浓度数据的可靠性[31]。
本实验采用激光粒度仪和TEM对纳米粒进行了表征,从结果中可以看出,激光粒度仪与TEM测出的粒径结果并不完全相等,前者测得的粒径数值略大于后者。原因主要有2方面:第一,动态光散射对粒径大的微粒响应值较高,因此测出的微粒粒径偏大;第二,动态光散射测试的是稀溶液状态的纳米聚合物流体体积,纳米聚合物处于充分的舒展状态,而透射电镜则可更直观且客观地看到并测得颗粒粒径大小[32-33]。
通过纳米粒体外释放实验模拟其体内过程,有助于制剂内在质量的控制。PEG-PLGA纳米粒为一种骨架结构,包封在纳米粒中的药物主要通过以下4种途径进行释放:(1)直接从纳米粒表面解吸附并溶解释放;(2)通过纳米粒内部的孔洞扩散释放;(3)内部药物向外扩散释放;(4)伴随着纳米粒的降解释放[34]。不同的释药途径主要由PLGA的分子质量、载药量、纳米粒的粒径大小以及制备工艺等参数的不同所决定[35]。
由CⅡ-3纳米粒在人工胃肠液、pH 7.4 PBS中的释放曲线,可以清楚观察到药物从CⅡ-3纳米粒的释放分为初期的突释部分和随后平稳的缓释部分。CⅡ-3纳米粒在人工胃肠液中释放遵循Higuchi方程,药物主要通过骨架中水性孔道扩散释放。相同纳米粒在不同释放介质中的释药特征并不完全相同,在pH 7.4 PBS中,4 h内释放了总包封量的20.57%,前期释药较快,这主要因为部分吸附或沉淀在纳米粒表面的药物迅速溶解和扩散所产生的突释现象。由于PLGA是生物可降解的高分子材料,纳米粒后期释放遵循上述第4种释药机制,24 h内Qt达到46.98%,表明该实验所制得纳米粒能在短时间内达到较高质量浓度,并通过持续释放,使药物不断发挥药效,10 d后CⅡ-3纳米粒的Qt为72.67%,仍有27.33%的药物存在于纳米粒中,未释出部分可能被PLGA材料所吸附。而同一时间CⅡ-3纳米粒在人工胃肠液中释放较快,说明胃肠液中的酶会加速PLGA的降解和代谢[36]。
为了验证将CⅡ-3制备成纳米粒可以有效避免胃肠道分泌的酸和消化酶的破坏,本实验将CⅡ-3和CⅡ-3纳米粒均置于人工胃液中孵育,采用茚三酮显色法检测各个时间点的氨基酸变化量,用氨基酸的变化量来表示蛋白质的降解速度。茚三酮显色法测氨基酸的原理是茚三酮与自由氨基反应,蛋白多肽在人工胃液中降解程度越高,产生的自由氨基越多,所测得的氨基酸释放量越高即蛋白质降解得越多。CⅡ-3纳米粒在1 h后开始有降解,这主要是因为部分吸附在纳米粒表面或从纳米粒中释放的蛋白质在人工胃液的破坏下开始降解成多肽片段或氨基酸。
以PEG-PLGA为材料制备的CⅡ-3纳米粒具有良好的缓释性,并能提高CⅡ-3在人工胃液中的稳定性。PEG-PLGA纳米粒可能是口服CⅡ-3的良好载体。
| [1] | 何正春, 王晓雨, 胡明辉, 等. 美洲大蠊提取物对3株人体呼吸系统肿瘤细胞的细胞毒性研究[J]. 中国现代药物应用 , 2009, 7 (3) :1–2. |
| [2] | 何正春, 胡明辉, 王晓雨, 等. 美洲大蠊提取物对3株人及小鼠白血病细胞的细胞毒性研究[J]. 云南中医中药杂志 , 2009, 30 (5) :56–57. |
| [3] | 何正春, 王晓雨, 杨雷香, 等. 美洲大蠊提取物对3株消化系统肿瘤细胞的细胞毒性研究[J]. 中国药业 , 2009, 18 (9) :11–12. |
| [4] | 蒋永新, 王熙才, 金从国, 等. 康复新体外诱导胃癌BGC-823细胞凋亡的实验研究[J]. 昆明医学院学报 , 2006 (2) :5–9. |
| [5] | 蒋永新, 王熙才, 金从国, 等. 美洲大蠊提取物对小鼠3LL肺癌的抑制作用及其机制探讨[J]. 中国肺癌杂志 , 2006, 9 (6) :488–491. |
| [6] | 张成桂, 何正春, 焦春香, 等. 美洲大蠊抗癌活性成分体外抗氧化性分析[J]. 时珍国医国药 , 2010, 21 (9) :2249–2250. |
| [7] | 毛娟.抗癌药物与蛋白多肽类药物PLGA纳米载药系统的研究[D].天津:天津大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10056-2008183467.htm |
| [8] | 戴东波, 尤佳, 何雯洁, 等. 姜黄素聚乙二醇-聚乳酸嵌段共聚物纳米粒的制备及其质量评价[J]. 中草药 , 2014, 45 (2) :194–199. |
| [9] | Makadia H K, Siegel S J. Poly Lactic-co-glycolic acid (PLGA) as biodegradable controlled drug delivery carrier[J]. Polymers , 2011, 3 (3) :1377–1397. |
| [10] | 刘楠楠, 蒋福升, 俞婷婷, 等. 改良溶剂挥发法制备姜黄素衍生物mPEG5000-PLGA纳米粒的研究[J]. 中草药 , 2013, 44 (16) :2223–2229. |
| [11] | Danhier F, Ansorena E, Silva J M, et al. PLGA-based nanoparticles:An overview of biomedical applications[J]. J Controlled Release , 2012, 161 (2) :505–522. DOI:10.1016/j.jconrel.2012.01.043 |
| [12] | Rieux A, Fievez V, Garinot M, et al. Nanoparticles as potential oral delivery systems of proteins and vaccines:A mechanistic approach[J]. J Controlled Release , 2006, 116 (1) :1–27. DOI:10.1016/j.jconrel.2006.08.013 |
| [13] | Florence A T. Nanoparticle uptake by the oral route:Fulfilling it's potential?[J]. Drug Discov Today , 2005, 1 (2) :75–81. |
| [14] | Carino G P, Jacob J S, Mathiowitz E. Nanosphere based oral insulin delivery[J]. J Controlled Release , 2000, 65 (1/2) :261–269. |
| [15] | 黄丫丫, 刘光明, 李婧炜. 美洲大蠊蛋白多肽纳米粒的制备及处方优化[J]. 中成药 , 2016, 38 (1) :67–72. |
| [16] | Panyam J, Dali M M, Sahoo S K, et al. Polymer degradation and in vitro release of a model protein from Poly (D, L-laetide-co-glycolide) nano and micro particles[J]. J Controlled Release , 2003, 92 (1/2) :173–187. |
| [17] | Pan y, Zhao H, Xu H, et al. Effect of experimental parameters on the encapsulation of insulin-loaded poly (laetide-co-glycolide) nanoparticles prepared by a double emulsion method[J]. J Chin Pharm Sci , 2002, 11 (1) :38–41. |
| [18] | 潘妍, 徐晖, 赵会英, 等. 胰岛素乳酸/羟基乙酸共聚物纳米粒的制备及口服药效学研究[J]. 药学学报 , 2002, 37 (5) :374–377. |
| [19] | 徐丰.阳离子白蛋白结合PLGA纳米粒介导c-Myc基因siRNA治疗C6脑胶质瘤的研究[D].上海:复旦大学, 2009. |
| [20] | 焦春香, 张成桂, 刘光明, 等. 心脉隆注射液中多肽限量检测方法的建立[J]. 时珍国医国药 , 2012, 23 (12) :3137–3139. |
| [21] | 高小玲.凝集素修饰纳米粒经鼻入脑的递药特性研究[D].上海:复旦大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10246-2007168680.htm |
| [22] | 郑爱萍, 张晓燕, 毕芸祺. 载胰岛素的生物黏附性聚乳酸-羟基乙酸纳米粒的制备、表征及活性评价[J]. 中国药学杂志 , 2011, 46 (18) :1421–1426. |
| [23] | 张臻, 傅超美, 胡慧玲, 等. D-最优混料设计优化美洲大蠊乳膏的基质配方研究[J]. 中草药 , 2013, 44 (12) :1574–1578. |
| [24] | 张臻, 宋芹, 胡慧玲, 等. 美洲大蠊提取物的质量标准研究[J]. 中药与临床 , 2013, 4 (5) :159–161. |
| [25] | Kocbek P, Obermajer N, Cegnar M, et al. Targeting cancer cells using PLGA nanoparticles surface modified with monoclonal antibody[J]. J Controlled Release , 2007, 120 (1/2) :18–26. |
| [26] | Son S J, Lee W R, Joung Y K, et al. Optimized stability retention of a monoclonal antibody in the PLGA nanoparticles[J]. Int J Pharm , 2009, 368 (1/2) :178–185. |
| [27] | Galindo-Rodriguez S A, Allemann E, Fessi H, et al. Polymeric nanoparticles for oral delivery of drugs and vaccines:a critical evaluation of in vivo studies[J]. Crit Rev Ther Drug Carrier Syst , 2005, 22 (5) :419–464. DOI:10.1615/CritRevTherDrugCarrierSyst.v22.i5 |
| [28] | 庄英华, 张中文, 韩伟, 等. 超滤离心法测定连翘酯苷脂质体包封率[J]. 中国新药杂志 , 2012, 21 (18) :2209–2216. |
| [29] | 杨春荣, 郑素芹, 单静颖. 离心超滤法测定石杉碱甲固体脂质体纳米粒的包封率[J]. 黑龙江医药科学 , 2009, 32 (5) :75. |
| [30] | 周恺, 姚亮, 戴浩志, 等. 超滤离心法测定银杏内酯B纳米结构脂质载体包封率[J]. 安徽中医药大学学报 , 2015, 34 (2) :78–81. |
| [31] | 杨安树. MePEG-PLGA纳米粒长循环机制及载TNF-拮抗肽性能研究. 武汉:华中科技大学[M]. 2009 . |
| [32] | 陆伟.阳离子白蛋白结合聚乙二醇-聚乳酸纳米粒的脑内递药研究[D].上海:复旦大学, 2005. http://cdmd.cnki.com.cn/article/cdmd-10246-2005121143.htm |
| [33] | 陈帅君.叶酸受体介导的载顺铂磁性纳米pH敏感靶向给药系统研究[D].广州:南方医科大学, 2013. |
| [34] | Azzam T, Eisenberg A. Control of vesicular morphologies through hydrophobic block length[J]. Angew Chem , 2006, 45 (44) :7443–7447. DOI:10.1002/(ISSN)1521-3773 |
| [35] | 封文静, 管庆霞, 张亮, 等. 丁香苦苷PLGA纳米粒的体外释放研究[J]. 哈尔滨商业大学学报:自然科学版 , 2014, 30 (4) :395–401. |
| [36] | Hua Z, Ibrahim A A, Steven H N. An in vitro evaluation of a chitosan-containing multiparticulate system for macromolecule delivery to the colon[J]. Int J Pharm , 2002, 239 (1/2) :197–205. |
 2016, Vol. 47
2016, Vol. 47


