2. 重庆医药高等专科学校, 重庆 401331
2. Chongqing Medical and Pharmaceutical College, Chongqing 401331, China
姜黄素(curcumin,Cur)是传统中药姜黄Curcumae Longae Rhizoma中的主要有效成分,具有抗癌[1-3]、抗炎[4]等广泛的药理作用,但由于其易降解,水溶性极差等不利因素导致其人体生物利用度极低,严重限制了其在临床上的广泛应用,故如何利用新的载药系统提高Cur的生物利用度成了研究者们关注的重点。纳米结构脂质载体是将药物吸附或包裹于脂质膜中制成的新一代纳米粒给药系统,具有可避免药物的降解或泄漏以及良好的靶向性等优点,对于提高难溶性药物生物利用度和作用时间均有较好的表现[5],是目前的研究热点之一。
星点设计-效应面法(central composite design-response surface methodology,CCD-RSM)是国内外常用的实验设计优化方法[6-9],其结果可用集数学和统计学方法于一体的效应面法(RSM)进行优化,利用实验设计并通过实验得到一定数据,采用多元2次方程来拟合因素和效应值之间的函数关系,通过对回归方程的分析来寻求最优处方,解决多变量问题。与正交设计法相比,可以评价指标和因素间的非线性关系,使用方便,条件预测性好,预测实验结果接近实际实验结果,因此本实验拟通过CCD-RSM优化Cur正负离子纳米结构脂质载体(Cur-catanionic nanoparticle lipid carries,Cur-CNLC)处方[10-12],并对其理化性质进行研究,为进一步将Cur-CNLC制成口服制剂或注射制剂提供实验依据。
1 仪器与材料Cur,质量分数98%,陕西森弗生物制药有限责任公司;卵磷脂,生化试剂级,国药集团化学试剂有限公司;葡聚糖凝胶G-50,上海凯友生物技术有限责任公司;单硬脂酸甘油酯、十二烷基硫酸钠、十六烷基三甲基溴化铵,分析纯,成都科龙试剂化工试剂厂;棕榈酸异丙酯,分析纯,嘉兴市精博化学品有限公司;其余试剂均为分析纯。
微孔滤膜,0.45 μm,天津市津腾实验设备有限公司;T-6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;KQ2200B型超声清洗仪,昆山市超声仪器公司;Mettler Toledo AB 204 S电子分析天平,瑞士梅特勒-托利多公司;Design expert 8.0,美国Stat-Ease公司;Nano-ZS90型马尔文粒径测定仪,英国马尔文公司;Hitachi-7500透射电镜,日本日立公司。
2 方法与结果 2.1 Cur-CNLC的制备 2.1.1 影响因素试验纳米结构脂质载体制备的影响因素主要有药物质量、固体脂质质量(单硬脂酸甘油酯)、液体脂质质量(棕榈酸异丙酯)、卵磷脂质量、表面活性剂种类和质量等。通过单因素试验考察发现当药物Cur的质量为10 mg,固体脂质质量在50~150 mg,液体脂质质量在20~80 mg,卵磷脂质量在50~150 mg,表面活性剂为阴阳离子混合表面活性剂(十二烷基硫酸钠和十六烷基三甲基溴化铵)在75~225 μmol且物质的量比为2:1时,形成的纳米粒大小均一、分散均匀。
2.1.2 Cur-CNLC的制备将主药Cur和处方量固体脂质、液体脂质和卵磷脂置于圆底烧瓶中,加入适量乙醇,超声溶解后,旋转蒸发掉有机溶剂,在瓶壁形成浅黄色均匀薄膜。另将处方量混合表面活性剂溶于10 mL纯水中,将其加入圆底烧瓶,超声10 min后得到黄色混悬液,用0.45 μm微孔滤膜滤过,即得Cur-CNLC[13]。
2.2 包封率和载药量的测定精密称取Cur对照品适量,用95%乙醇溶解,制备得质量浓度为100 mg/L的Cur储备液,吸取Cur储备液适量并用95%乙醇稀释适当倍数配制成质量浓度(C)分别为1.5、2.0、2.5、3.0、3.5、4.0、4.5 mg/L的系列对照品溶液,在426 nm处测定吸光度(A)值,结果Cur在1.5~4.5 mg/L与A值呈良好的线性关系,回归方程为A=0.154 3 C-0.000 3,r=0.999 8;精密吸取Cur储备液适量,用95%乙醇稀释制得质量浓度分别为4.2、3.5、2.8 mg/L的对照品溶液,高、中、低3个质量浓度的溶液日内、日间精密度良好,RSD分别为0.31%、0.28%、0.79%和0.74%、0.56%、1.22%;精密量取Cur-CNLC制剂和Cur储备液适量,用95%乙醇稀释制得质量浓度分别为4.18、3.83、3.47 mg/L的溶液,测得平均回收率为98.2%,RSD为1.4%,精密度和回收率均符合方法学要求。
采用葡聚糖凝胶法测定纳米粒的包封率。精密移取Cur-CNLC 1 mL,沿色谱柱内壁缓缓加入凝胶柱中,上样完毕后,用纯水做洗脱剂,收集的洗脱液中,将有乳光的洗脱液合并,取0.5 mL合并的洗脱液至10 mL量瓶中,用无水乙醇破乳并稀释至刻度,在426 nm处测定A值,计算Cur-CNLC中包封的Cur质量;另取Cur-CNLC制剂0.5 mL至50 mL量瓶中,用95%乙醇破乳并稀释至刻度,在426 nm处测定A值,计算Cur-CNLC中Cur总量。根据包封率计算公式:包封率=m包封药量/m总药量,其中m总药量为1 mL制剂中含有的总药量,m总药量=CCur-CNLC×V,V=1 mL,CCur-CNLC指Cur-CNLC制剂中Cur质量浓度,用分光光度法测定,m包封药量为凝胶柱法用1 mL制剂测定包封率时Cur-CNLC中包封药物Cur的量,计算Cur-CNLC中Cur包封率。根据脂质载药量计算公式,测定Cur-CNLC的脂质载药量。

|
在Cur投药量为10 mg时,选择对Cur-CNLC性质影响较显著的4个因素:固体脂质质量(X1)、液体脂质质量(X2)、卵磷脂质量(X3)和混合表面活性剂(X4)作为考察对象,在5个水平上进行优化研究,以包封率(Y1)及脂质载药量(Y2)为评价指标安排试验,因素水平及试验结果见表 1。
|
|
表 1 CCD-RSM优化Cur-CNLC处方的组合和响应值(x±s, n=3) Table 1 Composition and observed responses in CCD-RSM for Cur-CNLC (x±s, n=3) |
2.3.1 二次回归方程的建立
采用实验软件对表 1中数据进行拟合分析,得到的二次多元回归模型为Y1=88.9-12.09 X1+8.23 X2+3.15 X3+2.06 X4-5.89 X1X2+5.66 X1X3+1.36 X1X4+4.90 X2X3-4.42 X2X4-2.16 X3X4-5.29 X12-16.71 X22-32.01 X32-9.18 X42,R2=0.948 5;Y2=5.05-0.84 X1-0.39 X2+0.70 X3+0.86 X4-0.31 X1X2-0.36 X1X3-0.49 X1X4+0.48 X2X3-0.28 X2X4-0.29 X3X4-0.057 X12-0.54X22-0.33 X32-0.34 X42,R2=0.910 7。
2-3-2 方差分析和显著性检验2个拟合方程的R2分别为0.948 5和0.910 7,说明设计模型拟合程度良好,可用此模型对Cur-CNLC的处方进行分析和预测。从表 2回归系数的显著性检验可知:模型Y1中X1、X2、X1X2、X1X3、X12达到极显著(P<0.01),X3、X4、X2X3、X2X4显著(P<0.05),其他项不显著;模型Y2中X1、X3、X4、X1X4达到极显著(P<0.01),X2、X1X2、X1X3、X2X3、X2X4、X3X4、X32、X42显著(P<0.05),其他项不显著。
|
|
表 2 回归系数的显著性检验 Table 2 Significance of coefficients in regression equations |
2.3.3 效应面分析预测与处方优化
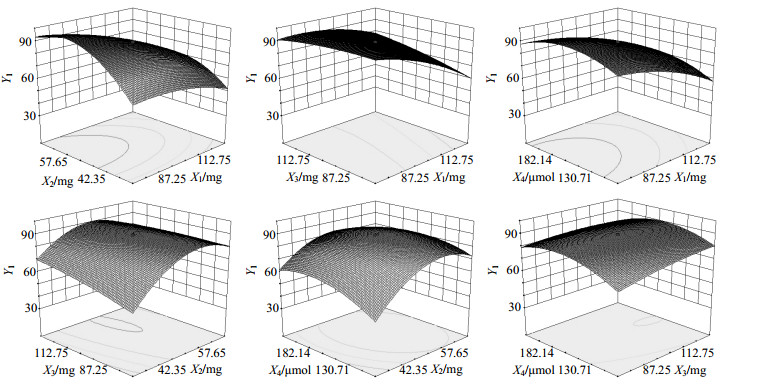
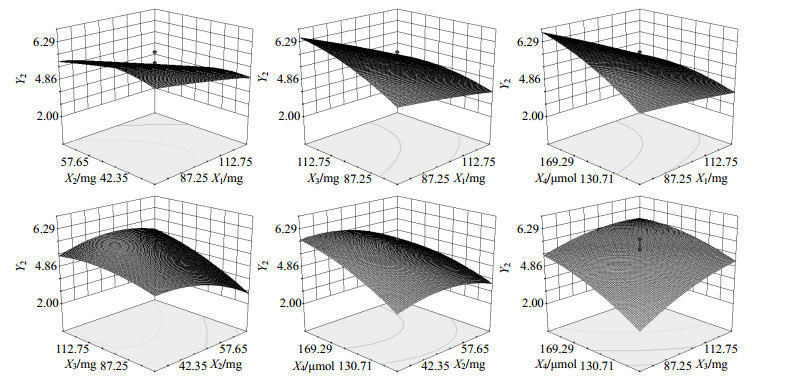
根据拟合所得二项式方程,绘制效应指标包封率与脂质载药量与其中2个自变量的三维效应面图(另外2个自变量设为中心点值),结果分别见图 1和图 2。
|
图 1 各因素对Y1影响的三维效应面图 Fig.1 3D-Response surface plot of effects of each factor on Y1 |
|
图 2 各因素对Y2影响的三维效应面图 Fig.2 3D-Response surface plot of effects of each factor on Y2 |
综合以上三维效应面图的结果,将各个较优区域进行重叠后,发现制备Cur-CNLC的优化处方范围是:固体脂质质量最优范围为70~100 mg;液体脂质质量的最优范围为40~60 mg,乳化剂质量的最优范围为80~150 mg;混合表面活性剂的用量为为110~190μmol。
2.3.4 最优处方验证根据CCD-RSM结果,得到的预测最优处方为X1=70.24 mg,X2=54.07 mg,X3=117.35 mg,X4=168.77μmol。按最优处方制备3批Cur-CNLC,其包封率和载药量见表 3。从表 3可知实验观察值和模型预测值比较接近,偏差的绝对值均小于5%,说明模型的预测性良好,拟合的方程可以描述因素与指标的关系。
|
|
表 3 CCD-RSM优选所得最优处方验证试验结果(n=3) Table 3 Veritication of optimized formulation by CCD-RSM (n=3) |
2.4 Cur-CNLC物理性质考察
取适量最优处方制备的Cur-CNLC,加适量蒸馏水稀释后,滴加在覆盖碳膜的铜网上,以2%磷钨酸钠溶液负染,在透射电镜下观察粒径大小和形态。结果见图 3;Cur-CNLC呈圆球形,分散均匀,未见粘连聚集现象。

|
图 3 Cur-CNLC透射电镜图 Fig.3 Transmission electron microscopy of Cur-CNLC |
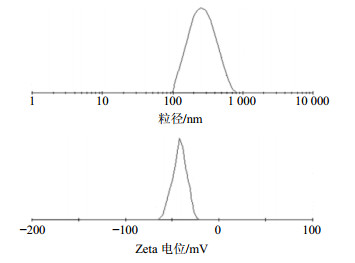
另取适量最优处方制备的Cur-CNLC,蒸馏水稀释后,用激光粒径测定仪测定其粒径和Zeta电位。结果见图 4,Cur-CNLC的粒径范围分布较窄,多分散指数(polydispersity,PDI)为0.272±0.017,平均粒径为(235.9±9.6)nm,其Zeta电位平均值为(−28.40±0.35)mV(n=3)。
|
图 4 Cur-CNLC平均粒径和Zeta电位分布图 Fig.4 Distribution of average particle size and Zeta potential of Cur-CNLC |
3 讨论
本实验所制备的Cur-CNLC经透射电镜观察,其外观呈圆球形,结构类似于Kuo等[10]研究的阿霉素正负离子固体脂质纳米粒和Liang等[11]研究的正负离子囊泡,即在水溶液中结构呈球状胶球[10],由内外2层组成,内层为包裹有液体脂质和药物的纳米粒,外层为按照一定比例排列的混合表面活性剂及乳化剂。最优处方制备的Cur-CNLC在4 ℃保存30 d后外观仍无明显变化,分析原因可能为处方中SDS(十二烷基硫酸钠)可提高姜黄素的稳定性[14],且和阳离子表面活性剂[CTAB(十六烷基三甲基溴化铵)]合用时能在较低浓度范围内显著地降低溶液表面张力[12],从而提高了Cur-CNLC的稳定性。本实验采用葡聚糖凝胶柱法测定Cur-CNLC的包封率,以纯水为洗脱剂即可有效地将Cur-CNLC与游离药物分离,分析其原因主要是由于葡聚糖凝胶本身具有分子筛的作用,Cur被包封于纳米结构脂质载体后由于其分子结构较大,在葡聚糖凝胶柱中保留时间短,先被洗脱,游离药物则由于其分子结构较小,在葡聚糖凝胶柱中保留时间长,后被洗脱,故以纯水为洗脱剂时葡聚糖凝胶柱法即能准确地测定Cur-CNLC的包封率。
从三维效应面图的结果可以发现,Cur-CNLC的包封率和载药量随固体脂质质量的增加,同时在一定范围内随液体脂质和表面活性剂的增加而增加,分析原因可能为固体脂质的增加可形成更大的晶体结构,即可包封容纳更多的药物,而液体脂质在一定范围内增加时,形成的液体小空间可承载更多的药物,但超过一定范围后由于不能被固体脂质包裹而不再能提高包封率和载药量;乳化剂和表面活性剂则主要通过降低表面张力,促进纳米粒分离,减少粒子聚集,起到提高制剂的稳定性的作用,但超过一定范围时,混合表面活性剂可能在水溶液中形成胶束,不能均匀吸附于纳米球,从而影响包封率和载药量。
本实验主要采用CCD-RSM考察了纳米结构脂质载体的最优制备处方,按照筛选得到的最优处方制备的Cur-CNLC,经透射电镜和激光粒径测定仪的观察,发现Cur-CNLC外观呈圆球形,粒径范围分布较窄,分散均匀,且经验证该优化处方包封率和载药量的预测值与实验值吻合良好且符合设计要求,说明本实验方法有效、可行,为下一步研究Cur-CNLC体内外释放奠定了良好基础。
| [1] | Jutooru I, Chadalapaka G, Lei P, et al. Inhibition of NFkappaB and pancreatic cancer cell and tumor growth by curcumin is dependent on specificity protein down-regulation[J]. J Biol Chem , 2010, 285 (33) :25332–25344. |
| [2] | Hosseinzadehdehkordi M, Adelinik A, Tashakor A. Dual effect of curcumin targets reactive oxygen species, adenosine triphosphate contents and intermediate steps of mitochondria-mediated apoptosis in lung cancer cell lines[J]. Eur J Pharmacol , 2015, 769 :203–210. |
| [3] | Chen Q, Gao Q, Chen K, et al. Curcumin suppresses migration and invasion of human endometrial carcinoma cells[J]. Oncol Lett , 2015, 10 (3) :1297–1302. |
| [4] | Sun Y P, Gu J F, Tan X B, et al. Curcumin inhibits advanced glycation end product-induced oxidative stress and inflammatory responses in endothelial cell damage via trapping methylglyoxal[J]. Mol Med Rep , 2016, 13 (2) :1475–1486. |
| [5] | Duan Y, Wang J, Yang X, et al. Curcumin-loaded mixed micelles:preparation, optimization, physicochemical properties and cytotoxicity in vitro[J]. Drug Deliv , 2015, 22 (1) :50–57. |
| [6] | 李颖, 曾茂贵, 郑笈, 等. 星点设计-效应面法优化鱼腥草挥发油-β-环糊精包合物的制备工艺[J]. 中草药 , 2014, 45 (13) :1855–1862. |
| [7] | 严春临, 张季, 刘敏, 等. 星点设计效应面法优化吴茱萸次碱固体脂质纳米粒处方[J]. 中草药 , 2015, 46 (9) :1307–1313. |
| [8] | Razack S A, Duraiarasan S. Response surface methodology assisted biodiesel production from waste cooking oil using encapsulated mixed enzyme[J]. Waste Manag , 2016, 47 (Pt A) :98–104. |
| [9] | Ge S, Lin Y, Lu H, et al. Percutaneous delivery of econazole using microemulsion as vehicle:formulation, evaluation and vesicle-skin interaction[J]. Int J Pharm , 2014, 465 (1/2) :120–131. |
| [10] | Kuo Y C, Liang C T. Catanionic solid lipid nanoparticles carrying doxorubicin for inhibiting the growth of U87MG cells[J]. Colloids Surf B Biointerfaces , 2011, 85 (2) :131–137. |
| [11] | Liang C H, Yeh L H, Liao P W, et al. Characterization and in vitro biocompatibility of catanionic assemblies formed with oppositely charged dicetyl amphiphiles[J]. Colloids Surf B Biointerfaces , 2015, 126 :10–17. |
| [12] | Fauser H, Uhlig M, Miller R, et al. Surface adsorption of oppositely charged SDS:C (12) TAB mixtures and the relation to foam film formation and stability[J]. J Phys Chem B , 2015, 119 (40) :12877–12886. |
| [13] | 张生杰, 焦文温, 张瑜, 等. 异穿心莲内酯固体脂质纳米粒的制备及体外释放研究[J]. 中草药 , 2012, 43 (12) :2390–2395. |
| [14] | 韩刚, 霍文, 李秋影, 等. 姜黄素的稳定性研究[J]. 中成药 , 2007, 29 (2) :291–293. |
 2016, Vol. 47
2016, Vol. 47


