2. 江苏省中药资源产业化过程协同创新中心, 江苏 南京 210023
2. Jiangsu Collaborative Innovation Center of Chinese Medicinal Resources Industrialization, Nanjing 210023, China
纳滤是膜分离技术中的一种,截留相对分子质量在100~1 000,具有分离过程可常温操作、无热效应、能耗低、不产生二次污染等优点[1]。Donnan效应是将荷电基团的膜置于含盐溶剂中时,溶液中的反离子(所带电荷与膜内固定电荷相反的离子)在膜内质量浓度大于其在主体溶液中的质量浓度,而同名离子在膜内的质量浓度则低于其在主体溶液中的质量浓度[2-3]。纳滤膜表面荷负电,通过Donnan效应实现目的性分离,多用于蛋白富集、离子去除,目前在中药产业中的应用尚处于初步阶段,尤其是中药成分的纳滤浓缩研究较少。
苦参碱是豆科植物苦参Sophora flavescens Ait.的干燥根,具有清热燥湿、杀虫、利尿等功效,在临床应用广泛[4],如复方苦参注射液、当归苦参丸等。其中苦参碱是其指标性成分,经研究发现,在药材提取浓缩过程中需长时间加热,加热温度≥80 ℃,或长时间受热苦参碱发生降解转化[5],因此在相关制剂生产中多通过低温减压、避光等方式降低其分解。
本实验结合纳滤分离的技术优势,在单因素考察的基础上,以纳滤截留相对分子质量、指标成分质量浓度及pH值为影响因子[6-7],应用Box-Behnken中心组合设计建立数学模型[8],以苦参碱截留率作为响应值,利用响应面分析软件分析,优选苦参提取液纳滤浓缩工艺参数,同时加入乙醇改变苦参碱与纳滤膜之间的Donnan效应,提升苦参碱截留效率,建立纳滤浓缩方法,从而为含有热敏性成分的中药进行纳滤浓缩提供数据基础。
1 仪器与材料TNZ-1型纳滤分离设备,南京拓鉒医药科技有限公司;Agilent 1100高效液相色谱仪,VWD检测器,Agilent色谱工作站,美国安捷伦公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;KH-250B型超声波清洗器,昆山禾创超声仪器有限公司;PB-10型pH计,德国Sartorius公司。
纳滤膜,聚酰胺复合膜,截留相对分子质量150、475、800,南京拓鉒医药科技有限公司;苦参药材购自安徽亳州,批号20150628,经南京中医药大学陈建伟教授鉴定为豆科植物苦参Sophora flavescens Ait.的干燥根,符合《中国药典》2015年版一部相关项下要求;苦参碱对照品,批号110753-200413,质量分数≥98%,购自中国食品药品检定研究院;乙腈为色谱纯,乙醇为分析纯,水为纯化水,其他试剂均为分析纯。
2 方法与结果 2.1 溶液的制备 2.1.1 苦参提取液称取苦参药材10 kg,分别加入8、6倍纯化水提取2次,每次1 h,0.45 μm微孔滤膜滤过,合并滤液,得苦参提取液,其中苦参碱质量浓度为0.509 mg/mL,总生物碱质量浓度为1.501 mg/mL。
2.1.2 苦参碱对照品溶液精密称取苦参碱对照品36.40 mg,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得3.64 mg/mL苦参碱对照品溶液。
2.1.3 溴麝香草酚蓝溶液称取溴麝香草酚蓝0.025 g溶于pH值为7.0的磷酸盐缓冲液200 mL中,配成质量浓度0.2 mmol/L的酸性染料。
2.2 纳滤操作按照试验设计要求,采用高效液相色谱仪检测苦参提取液中苦参碱质量浓度,进而采用纯化水稀释药液调节质量浓度达到实验需求。调节溶液pH值、选择纳滤膜,组装纳滤系统,将药液置于纳滤系统中进行循环平衡,待苦参碱在纳滤膜中的吸附-解吸附达到平衡时,取样苦参平衡液,进而将溶液进行纳滤,待纳滤完成后,取样纳滤液。
2.3 指标检测及截留率计算 2.3.1 苦参碱测定(1)色谱条件[9]:色谱柱为Agilent NH2柱(150 mm×4.6 mm,5 μm);流动相为乙腈-无水乙醇-3%磷酸溶液(80:10:10);检测波长220 nm;体积流量1 mL/min;进样量10 μL;柱温25 ℃。
(2)线性关系考察:精密吸取苦参碱对照品溶液0.10、0.20、0.50、1.00、2.00 mL分别置于10 mL量瓶中,甲醇定容至刻度,进样检测,以峰面积为纵坐标(Y),对照品溶液质量浓度为横坐标(X),得线性回归方程Y=6.77 X+112.11,r=0.999 2,苦参碱在36.4~728.0 μg/mL线性关系良好。
(3)样品测定:取苦参平衡液、纳滤液按“2.3.1(1)”项下的色谱条件,进样量10 μL,测定峰面积,将测得的峰面积代入回归方程计算待测溶液中苦参碱的质量浓度。
2.3.2 总生物碱测定(1)线性关系考察:用移液管准确量取苦参碱对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL置于干燥的具塞三角瓶中,各加蒸馏水至10 mL,分取5 mL,分别加入pH值7.0磷酸盐缓冲液5 mL,再依次精密加入0.025%溴麝香草酚蓝溶液2.0 mL,氯仿10.0 mL,振摇1 min,转移至50 mL分液漏斗放置分层,静置1 h,分取氯仿层,在417 nm波长处测定吸光度(A)值,以A值为纵坐标,质量浓度(C)为横坐标,得线性回归方程A=0.001 9 C+0.068 9,r=0.999 0,苦参碱在36.4~364.0 μg/mL线性关系良好。
(2)总生物碱定量测定:苦参平衡液、纳滤液采用纯化水稀释一定倍数,进而分别精密量取5.0 mL置分液漏斗中,依次加入pH值7.0磷酸盐缓冲溶液5 mL、0.025%溴麝香草酚蓝溶液2.0 mL,氯仿10.0 mL,振摇1 min,静置1 h,分取氯仿层。置于紫外可见分光光度计中,在检测波长417 nm处测定A值。将测得的A值代入回归方程计算待测溶液中总生物碱的量。
2.3.3 截留率计算分别精密吸取平衡液、纳滤液,采用HPLC法测定样品中苦参碱峰面积或按分光光度法检测总生物碱质量浓度,按下式计算苦参碱或总生物碱的截留率。
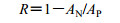
|
R为成分的截留率,AN为纳滤液中苦参碱的峰面积或纳滤液中总生物碱质量浓度,AP为平衡液中苦参碱的峰面积或平衡液中总生物碱质量浓度
2.4 单因素考察取苦参提取液适量(约4 L),选择药液平衡体积、温度、压力对苦参提取液的纳滤浓缩效果进行单因素考察。
2.4.1 药液平衡体积对苦参碱和总生物碱截留率的影响固定生药质量浓度40.0 mg/mL(其中苦参碱质量浓度0.240 μg/mL,总生物碱质量浓度0.710 μg/mL),温度20 ℃,压力1.0 MPa,纳滤膜截留相对分子质量475,pH值8.0,考察药液平衡体积1、2、4、8、16、32 L对苦参碱和总生物碱截留率的影响。结果苦参碱在系列平衡体积下截留率分别为81.78%、73.05%、74.29%、74.52%、75.02%、75.21%,由结果可知药液平衡体积对苦参碱截留率的影响呈现出先下降后上升再趋于稳定的规律,当平衡体积达到16 L时,苦参碱的截留率逐步稳定。同时,总生物碱截留率分别为81.01%、78.61%、79.46%、79.88%、79.46%、79.74%,截留率变化规律与苦参碱相似,为了保障分离效果的稳定性,选择平衡体积16 L为纳滤平衡体积。
2.4.2 温度对苦参碱和总生物碱截留率的影响固定生药质量浓度40.0 mg/mL(其中苦参碱质量浓度0.240 μg/mL,总生物碱质量浓度0.710 μg/mL),压力1.0 MPa,纳滤膜截留相对分子质量475,药液平衡体积32 L,pH值8.0,考察温度5、20、40 ℃对苦参碱和总生物碱截留率的影响。结果苦参碱截留率分别为79.40%、75.02%、71.65%,总生物碱截留率分别为82.06%、79.46%、79.32%。由结果可知,在固定截留相对分子质量纳滤膜条件下,随着操作温度的升高,苦参碱和总生物碱截留率均呈下降趋势,且总生物碱的截留率高于苦参碱。在实验操作过程中,提高操作温度可以提升膜通量从而提高分离效率,但是结合常温操作易实现,且温度对截留率影响并不明显,故选择20 ℃(常温)为纳滤操作温度。
2.4.3 操作压力对苦参碱和总生物碱截留率的影响固定生药质量浓度40.0 mg/mL(其中苦参碱质量浓度0.240 μg/mL,总生物碱质量浓度0.710 μg/mL),温度20 ℃,纳滤膜截留相对分子质量475,药液平衡体积32 L,pH值8.0,考察操作压力0.5、1.0、1.5 MPa对苦参碱和总生物碱截留率的影响。结果苦参碱截留率分别为74.95%、76.43%、77.04%,总生物碱截留率分别为79.37%、79.70%、80.47%。由结果可知,纳滤操作压力对苦参提取液中的生物碱类成分的截留率影响较小,但是升高纳滤压力可以增加膜通量,提升浓缩效率,因此选择1.5 MPa为纳滤操作压力。
2.5 响应面试验设计与结果在明确药液平衡体积、温度、操作压力因素影响的基础上,利用Design-Expert 8.06软件为辅助手段设计响应面试验。根据中心组合设计原理,以纳滤膜截留相对分子质量(A)、药液质量浓度(B)、溶液pH值(C)作为变量,以−1、0、1代表变量水平,设计3因素3水平实验方案,具体因素水平见表 1,试验结果见表 2。
|
|
表 1 纳滤浓缩因素与水平 Table 1 Factors and levels of nanofiltration concentration |
|
|
表 2 响应面分析试验结果 Table 2 Results of response surface methodology experiment |
2.5.1 模型方程建立与显著性检验
(1)苦参碱:根据Box-Benhnken中心组合设计原理,综合单因素试验考察结果,为保障试验结果的准确性和稳定性,选定温度20 ℃,操作压力1.5 MPa,平衡体积16 L为纳滤浓缩条件。利用Design-Expert 8.06软件对试验结果进行回归拟合,得到苦参碱截留率对截留相对分子质量、质量浓度、pH值3个因素的二次多项回归模型:苦参碱截留率Y=75.91-37.21 A+1.98 B-10.83 C-0.10 AB+2.28 AC+1.29 BC-23.11 A2-1.08 B2-2.57 C2。
对该模型进行方差分析,结果见表 3。回归F值为271.20,在所考察的试验范围内,3个因素对苦参碱截留率影响的排序为A>C>B。多元相关系数R2=0.997 1,预测R2=0.969 1,调整R2=0.993 5,说明模型对试验实际情况拟合较好;P<0.000 1说明该模型高度显著,可用来进行响应值的预测,试验设计方案正确。
|
|
表 3 苦参碱和总生物碱的响应曲面二次回归模型的方差分析 Table 3 Analysis on variance to response surface quadratic model of matrine and total alkaloids |
(2)总生物碱:利用Design-Expert 8.06软件对试验结果进行回归拟合,得到总生物碱截留率对截留相对分子质量、质量浓度、pH值3个因素的2次多项回归模型:总生物碱截留率Y=80.54-35.43 A-0.16 B-7.743 C-3.29 AB-2.91 AC-2.32 BC-20.13 A2-0.82 B2-0.31 C2。
对该模型进行方差分析,结果见表 3。回归F值为325.43,在所考察的试验范围内,3个因素对苦参碱截留率影响的排序为A>C>B。多元相关系数R2=0.997 6,预测R2=0.967 9,调整R2=0.994 6,说明模型对试验实际情况拟合较好;P<0.000 1说明该模型高度显著,可用来进行响应值的预测,试验设计方案正确。
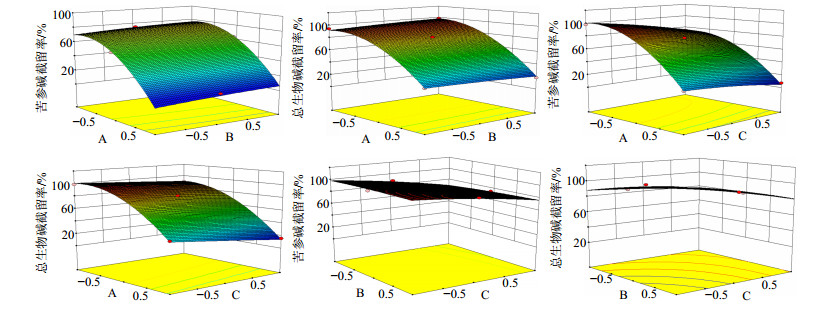
2.5.2 响应曲面分析及条件优化多元回归方程式所做的响应曲面图,见图 1。可以看出,所考察因素对苦参中苦参碱和总生物碱的截留率均有不同程度的影响,其中纳滤膜的截留相对分子质量的影响显著,随着截留相对分子质量减小,苦参碱截留率随之增大,表现出曲面斜率大,说明纳滤分离中孔径截留占有主导地位;pH值影响也相对显著,随着溶液环境由碱到酸,生物碱逐步离子化成盐,根据纳滤膜分离的电荷效应[10-11],以离子形式存在的生物碱与荷负电的纳滤膜之间的Donnan效应要强于游离态,从而引起成分截留率升高。
|
图 1 截留相对分子质量(A)、质量浓度(B)和pH值(C)对截留率交互影响的三维曲面图 Fig.1 3D kyrtograph of effects of MWCO (A), concentration (B), and pH value (C) on retention rate |
药液质量浓度影响较小,曲面表现平缓,随着苦参碱质量浓度升高,成分扩散系数增加,从而出现轻微的截留率下降的现象,而苦参总生物碱影响较小。苦参碱的截留率数据中A、B、C 3因素之间交互作用不显著,它们对截留率的影响并不会随着另一因素的改变而发生明显变化,而总生物碱的截留率数据中AB、AC之间存在较显著的交互作用,在二者的共同作用下调节总生物碱的截留率。
采用Design-Expert 8.06软件的响应优化功能对试验结果进行优化,以根据提高截留率和膜分离效率为目的,得到苦参提取液的最佳浓缩工艺为截留相对分子质量150,药液中苦参碱质量浓度204.3 μg/mL,总生物碱质量浓度603.1 μg/mL,pH值6.19,理论计算苦参碱的截留率为85.01%,总生物碱截留率91.40%。
2.6 乙醇溶液调节Donnan效应苦参中生物碱成盐比例越高,越影响其在溶液中的稳定性,因此在响应曲面法优化苦参碱纳滤浓缩参数的基础上,设定pH值在6~7,加入乙醇改变溶液环境调节纳滤膜的Donnan效应,使得苦参提取液中乙醇体积分数分别为5%、10%、15%、20%,考察苦参生物碱截留率与乙醇体积分数的相关性。
2.7 乙醇体积分数对苦参碱截留率的影响在截留相对分子质量150,苦参碱质量浓度204.3 μg/mL,pH值6.19的纳滤浓缩条件下,不同体积分数(0、5%、10%、15%、20%)乙醇时的苦参碱截留率分别为84.57%、89.31%、95.63%、97.20%、97.53%。改变溶液中乙醇体积分数对苦参碱截留率具有明显影响,且呈现一定的正相关。当乙醇体积分数增加至10%时,相较于水溶液中苦参碱截留率升高11.06%,截留率大于95%。
由于有机溶剂对膜材质有一定的破坏性,因此选择10%乙醇溶液作为溶剂,同时以截留相对分子质量150,苦参碱质量浓度204.3 μg/mL,总生物碱质量浓度603.1 μg/mL,pH值6.19作为相应纳滤参数进行验证试验,结果3批验证试验中苦参碱截留率分别为95.45%、92.30%、95.49%,均值为94.41%,RSD为1.94%;总生物碱截留率分别为97.90%、96.45%、98.53%,均值为97.63%,RSD为1.09%;说明通过响应曲面法筛选浓缩参数,进而调节成分与纳滤膜间的Donnan效应可以调节其分离行为,该模型适用于苦参提取液的纳滤浓缩条件优化。
3 讨论苦参碱在酸性条件下解离,借助荷负电纳滤膜的Donnan效应和空间效应实现目的性截留,但是随着酸性增强,苦参碱稳定性逐步下降。溶液中加入乙醇等有机溶剂,将直接改变荷电膜表面与溶质之间由Donnan效应而形成的界面层组成。根据“2.7”项结果推测,复合聚酰胺膜为有机材质,从膜表面的界面层到溶液内部,乙醇体积分数呈现出从高到低过渡,而解离态生物碱根据溶解-扩散理论呈现出相反趋势,与水溶液相比膜表面质量浓度偏低,呈现出“增强”Donnan效应的趋势,导致生物碱透膜性能下降[12-13]。同时纳滤膜在含乙醇的水溶液中发生溶胀,膜孔半径缩小,因此在增强Donnan效应和膜孔截留的复合效应下,在接近中性条件下的溶液环境中,实现苦参碱高截留率纳滤浓缩。
在进行纳滤浓缩验证时,苦参提取液在0.3 m2、截留相对分子质量150的纳滤膜中通量在2.1~2.9 L/h,4 L提取液浓缩至400 mL耗时1.5 h,总生物碱保留率大于97%;相同条件下采用常压浓缩,电磁炉加热温度200 ℃,浓缩至400 mL耗时3 h,总生物碱保留率为83.63%;旋转蒸发仪在80 ℃、−0.1 MPa条件下进行减压浓缩,相同原液体积浓缩至400 mL耗时8 h,总生物碱保留率为93.41%,常温纳滤浓缩效率及有效成分保留率均高于常压和减压加热浓缩,具有一定技术优势,但是纳滤分离时对原液的澄明度要求较高,需要进行微滤预处理,才能有效提升分离效率、降低膜污染。
基于Donnan效应和相应曲面法,优选出苦参提取液的浓缩工艺截留相对分子质量150,苦参碱质量浓度204.3 μg/mL,总生物碱质量浓度603.1 μg/mL,pH值6.19,乙醇体积分数10%,此条件下苦参碱的截留率为94.41%,总生物碱截留率为97.63%。回归分析和验证试验结果表明,模型可目的性选择纳滤浓缩参数。苦参碱作为中药热敏性成分中的一类,通过采用无热效应的纳滤分离技术进行浓缩,可以有效地提升中药制药水平。
| [1] | 李存玉, 钱祥, 杨泽秋, 等. 基于纳滤技术的消癌平注射液中的钾离子去除工艺优化[J]. 中成药 , 2015, 37 (2) :294–297. |
| [2] | Shiran R, David H, Hilla S, et al. Simple modeling of Donnan separation processes[J]. J Membrane Sci , 2015, 476 :348–355. DOI:10.1016/j.memsci.2014.12.001 |
| [3] | Jacek W, Agnieszka R, Tomasz W. Removal of troublesome anions from water by means of Donnan dialysis[J]. Desalination , 2005, 182 (1/3) :339–346. |
| [4] | 苗抗立, 张建中, 董颖, 等. 苦参的化学成分及药理的研究进展[J]. 天然产物研究与开发 , 2001, 13 (2) :69–73. |
| [5] | 邹姝姝.苦参碱的分离纯化及其初步药效学实验研究[D].重庆:重庆大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10611-2007182112.htm |
| [6] | Yaroshchuk A, Bruening M L, Bernal E E L. Solution-Diffusion-Electro-Migration model and its uses for analysis of nanofiltration, pressure-retarded osmosis and forward osmosis in multi-ionic solutions[J]. J Membrane Sci , 2013, 447 :463–467. DOI:10.1016/j.memsci.2013.07.047 |
| [7] | Yan F, Chen H, Lü Y. Improving the water permeability and antifouling property of thin-film composite polyamide nanofiltration membrane by modifying the active layer with triethanolamine[J]. J Membrane Sci , 2016, 513 :108–116. DOI:10.1016/j.memsci.2016.04.049 |
| [8] | 郝吉福, 房信胜, 王建筑, 等. 应用Box-Behnken实验设计优化水飞蓟素固体脂质纳米粒处方研究[J]. 中草药 , 2011, 42 (11) :2221–2225. |
| [9] | 中国药典[S].一部.2015. |
| [10] | Zhao Y Y, Yuan Q P. Effect of concentration, molecular charge and solvents on solute rejection with solvent-resistance nanofiltration membrane in non-aqueous system[J]. Membrane Sci Technol , 2006, 26 (5) :31–36. |
| [11] | Andriy E Y. Non-steric mechanisms of nanofiltration:superposition of Donnan and dielectric exclusion[J]. Sep Purif Technol , 2001, 22 (1/3) :143–158. |
| [12] | Fang J, Deng B L. Rejection and modeling of arsenate by nanofiltration:Contributions of convection, diffusion and electromigration to arsenic transport[J]. Membrane Sci Technol , 2014, 453 :42–51. DOI:10.1016/j.memsci.2013.10.056 |
| [13] | 邱实, 吴礼光, 张林, 等. 纳滤分离机理[J]. 水处理技术 , 2009, 35 (1) :15–19. |
 2016, Vol. 47
2016, Vol. 47


