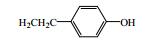
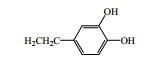
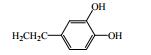
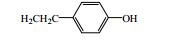
秦皮为常用中药,始载于《神农本草经》,列为中品,《中国药典》2015年版规定秦皮为木犀科植物苦枥白蜡树Fraxinus rhynchophylla Hance、白蜡树Fraxinus chinensis Roxb.、尖叶白蜡树Fraxinus szaboana Lingelsh.、宿柱白蜡树Fraxinus stylosa Lingelsh.的干燥枝皮或干皮,是临床常用中药。其主要功效为清热燥湿、平喘止咳、明目,临床上用于治疗肠炎、白带过多、慢性支气管炎、细菌性痢疾、目赤肿痛、迎风流泪、牛皮癣等[1]。本文对近年来有关秦皮的化学成分和药理作用研究进展进行了总结,以期为秦皮的深入研究和利用提供参考。
1 秦皮化学成分目前,秦皮中香豆素类、裂环烯醚萜类及苯乙醇苷类是秦皮的特征性化学成分,木脂素类、黄酮类、酚酸类、三萜类及甾体类化学成分在不同基原秦皮中的分布则较为局限。
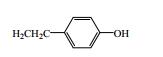
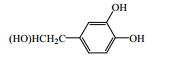
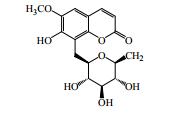
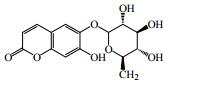
1.1 香豆素类成分香豆素类化合物是秦皮的主要活性成分,其中秦皮甲素(1)、秦皮乙素(2)、秦皮素(4)是秦皮药材质量控制的指标性成分[2-4]。秦皮是工业香豆素提取的一个重要来源,秦皮香豆素的分离、提取方法与工艺也在不断改进与优化。目前已分离鉴定出的秦皮香豆素类化合物共有21种,见图 1和表 1。

|
图 1 秦皮香豆素类成分化学结构 Fig.1 Chemical structures of coumarins in Fraxini Cortex |
|
|
表 1 秦皮中香豆素类成分 Table 1 Coumarins in Fraxini Cortex |
1.2 木脂素类成分
木脂素是一类由苯丙素氧化聚合而成的天然产物,通常是指其二聚物。秦皮中发现的木脂素类可以分为双四氢呋喃类木脂素(图 2、表 2)、苯并呋喃类木脂素[8, 14, 18-19](33、34、37)、四氢呋喃类[14]木脂素(36)、二芳基丁烷类木脂素[9, 16](38)及其他木脂素类(35)[8, 20]。
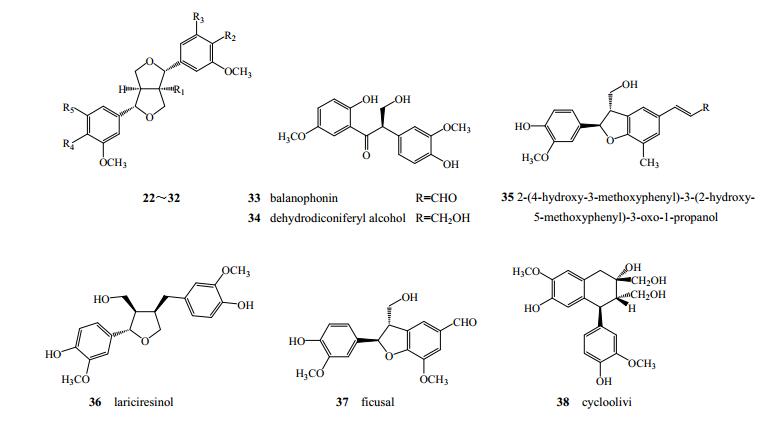
|
图 2 秦皮中木脂素类成分化学结构 Fig.2 Chemical structures of lignans in Fraxini Cortex |
|
|
表 2 秦皮中双四氢呋喃类木脂素类成分 Table 2 Double tetrahydrofuran lignans in Fraxini Cortex |
1.3 裂环烯醚萜类成分
秦皮中裂环烯醚萜类成分大多数以裂环烯醚萜苷类形式存在(39~50)[21-24],少数以裂环烯醚萜的形式存在(51)[25],见图 3和表 3。
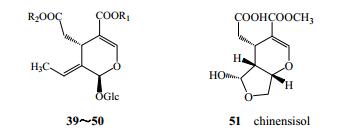
|
图 3 裂环烯醚萜类成分化学结构 Fig.3 Chemical structures of secoiridoids in Fraxini Cortex |
|
|
表 3 秦皮中裂环烯醚萜苷类成分 Table 3 Secoiridoids in Fraxini Cortex |
1.4 苯乙醇苷类成分
翁远超等[22]从秦皮中分离得到苯乙醇苷类成分木通苯乙醇苷A(52)、木通苯乙醇苷B(53)、车前草苷A(54)、车前草苷B(55)[12, 26-27]。Xiao等[11]从苦枥白蜡树中分离得到osmanthuside H(56),见图 4。
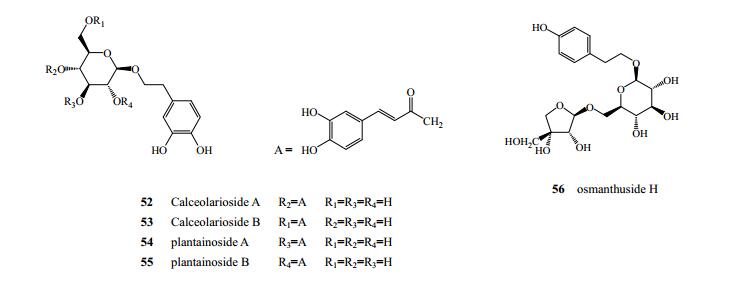
|
图 4 秦皮中苯乙醇苷类成分化学结构 Fig.4 Chemical structures of phenylethanoids in Fraxini Cortex |
1.5 黄酮类成分
翁远超等[22]首次从秦皮中分离得到大黄素(57);Xiao等[11]首次从苦枥白蜡树中分离得到柚皮素(58);Kostova等[9]发现白蜡树中含有黄酮类化合物芹菜素(59)、cosmosiin(60),见图 5。
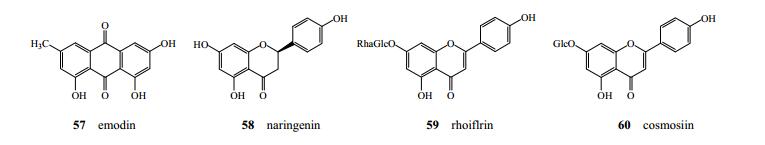
|
图 5 秦皮中黄酮类成分化学结构 Fig.5 Chemical structures of flavonoids in Fraxini Cortex |
1.6 酚酸类成分
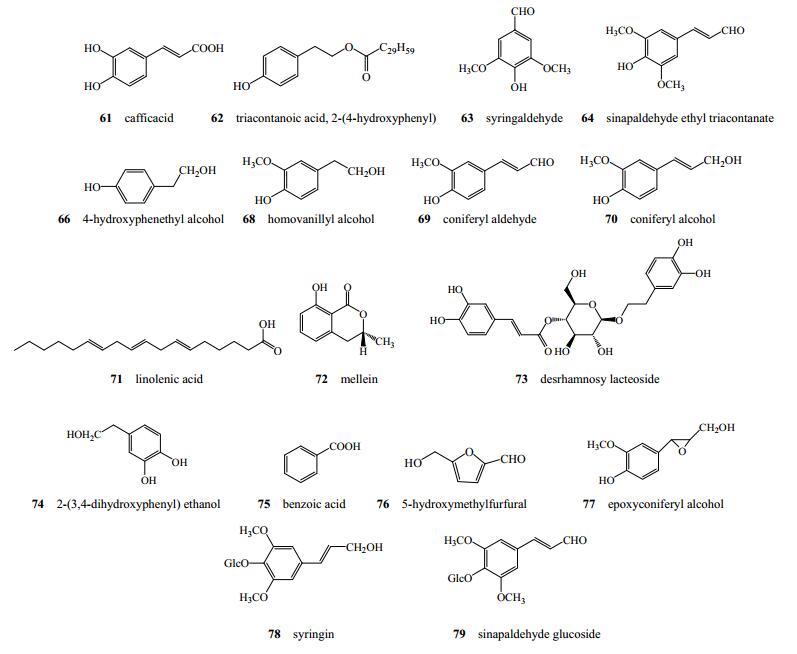
魏秀丽等[28]从秦皮中分离鉴定得到7个酚酸类化合物咖啡酸(61)、对羟基苯乙醇三十烷酸酯(62)、丁香醛(63)、芥子醛(64)、三十烷酸(65)、对羟基苯乙醇(66)、三十三烷酸(67);王立军[10]从秦皮中分离得到4-羟基-3-甲氧基苯乙醇(68)、松柏醛(69)、松柏醇(70)、亚油酸(71);Zhang等[12]从白蜡树中分离得到(−)-蜂蜜曲菌素(72)[29]、desrhamnosy lacteoside[30](73)、2-(3, 4-dihydroxyphenyl) ethanol[31](74);翁远超等[22]从秦皮中分离出苯甲酸(75)、5-羟甲基糠醛(76);Kostova等[32]首次从白蜡树中分离得到新化合物epoxyconiferyl alcohol(77);Kostova等[9]发现白蜡树中含有紫丁香苷(78);魏秀丽等[28]从秦皮中分离鉴定出苯丙醇苷类成分芥子醛葡萄糖苷(79),见图 6。
|
图 6 秦皮中酚酸类成分化学结构 Fig.6 Chemical structures of phenolic acids in Fraxini Cortex |
1.7 三萜类及甾体类成分
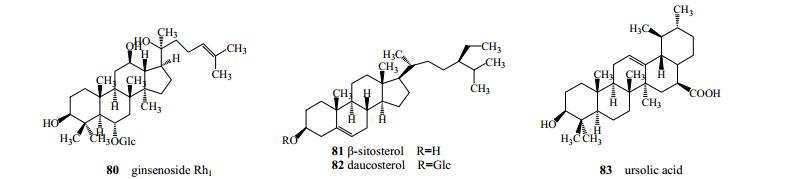
翁远超等[22]从秦皮中分离鉴定得到四环三萜类成分人参皂苷Rh1(80),魏秀丽等[28]从秦皮中分离得到甾体类成分β-谷甾醇(81)、胡萝卜苷(82)及五环三萜类成分熊果酸(83),见图 7。
|
图 7 秦皮中三萜类及甾体类成分化学结构 Fig.7 Chemical structures of triterpenoids and steroids in Fraxini Cortex |
1.8 其他成分
李冲等[33]首次从尖叶白蜡树中获得微量成分N-苯基-2-萘胺及2, 6-二甲氧基对苯醌。崔伟等[34]采用气相色谱-质谱(GC-MS)联用技术对挥发油成分进行分析,分析鉴定出65种化学成分。
2 药理活性 2.1 抗菌活性香豆素类成分为秦皮抑制病原微生物的主要活性成分。杨天鸣等[35]体内实验结果显示秦皮水煎液可降低由伤寒杆菌所致的小鼠急性腹腔感染的死亡率。刘丽梅等[36]通过体外抑菌实验发现4种不同基原的秦皮提取物对大肠杆菌、金黄色葡萄球菌、绿脓杆菌等9种细菌均具有显著的抑制、杀灭作用,它们抑菌作用强度依次是宿柱白腊树>苦枥白腊树>尖叶白腊树>白腊树。刘丽梅等[36]还发现5种香豆素单体对大肠杆菌、金黄色葡萄球菌、绿脓杆菌等9种细菌均具有显著的抑制、杀灭作用,抑菌作用强度依次是秦皮素>秦皮乙素>秦皮甲素>秦皮苷>6, 7-二甲氧基-8-羟基香豆素。Duncan等[37]研究了秦皮香豆素类化合物单体对动物内脏细菌的抑制作用,结果表明秦皮甲素等香豆素均能显著抑制动物内脏器官中的大肠杆菌O157的生长。Wang等[38]研究了秦皮素抗金黄色葡萄球菌的作用机制,结果表明秦皮素可通过增加菌体细胞膜通透性、抑制菌体DNA、RNA的合成及抑制拓扑异构酶I、拓扑异构酶II的活性来发挥抑菌作用。刘爽等[39]研究报道利用TTC法测得秦皮素对大肠埃希菌ATCC25922的最低抑菌质量浓度(MIC)为40 μg/mL,显示出秦皮素可较好地抑制大肠埃希菌的生长,其作用机制可能是通过改变细胞膜的通透性、抑制菌体可溶性蛋白的合成及消除菌体质粒来发挥抑菌作用,但不影响细胞膜的完整性。Imen等[40]采用微量肉汤法测定了秦皮甲素对金黄色葡萄球菌及4种耐药性大肠杆菌变体的MIC(分别为2.5、1.25、2.5、2.5、1.25 mg/mL),表明秦皮甲素具有良好的抑菌活性。Watanabe等[41]研究表明秦皮乙素对小鼠实验性大肠杆菌病O111︰B4也具有较好的防治作用。
近年来,有研究运用微量稀释法和微量棋盘法进行秦皮苯乙醇苷类化合物(52~55)及裂环烯醚萜苷类化合物(40、43)体外单独及联合抑菌活性实验,单独抑菌实验显示它们对耐甲氧西林金黄色葡萄球菌具有显著抑制作用,联合抑菌实验发现它们可以减少β-内酰胺类抗生素的用量,增强抑菌作用[25]。
2.2 抗炎活性杨庆等[42]通过实验观察了4种基原秦皮提取物对脂多糖(LPS)刺激小鼠单核-巨噬细胞株RAW264.7后细胞分泌炎症因子的影响,结果表明它们均具有显著的抗炎作用,4种基原秦皮提取物以尖叶白蜡树活性最强。曹世霞等[43]研究表明秦皮总香豆素对大鼠急性痛风性关节炎具有良好的治疗作用,其作用机制与抑制大鼠血清白细胞介素-1β(IL-1β)、肿瘤坏死因子α(TNF-α)的产生有关。
杨庆等[42]研究发现秦皮中5种香豆素均具有显著的抗炎作用,其中以秦皮乙素抗炎活性最强,而秦皮甲素、秦皮素抗炎活性存在量效关系。Zhang等[44]研究发现秦皮甲素能够通过调节TLR/NF-κB通路来改善由LPS介导的急性肺炎。Watanabe等[41]以兔软骨细胞为对象,研究了秦皮乙素对蛋白多糖新陈代谢的抑制作用,结果表明秦皮乙素可用于治疗骨关节炎和风湿性关节炎造成的软骨损伤。段慧琴等[45]采用体外培养的肠黏膜微血管内皮细胞,研究了秦皮乙素的抗炎机制,结果显示秦皮乙素可以通过2种途径来发挥其抗炎机制:①降低NO的分泌,从而调节血管收缩,增加血流量,促进毒素排出,减轻炎症中组织器官的损伤;②抑制可溶性细胞间黏附分子(sICAM-1)的分泌,减轻白细胞与内皮细胞的黏附反应,控制白细胞穿出血管壁,减少炎症组织中白细胞数,从而减轻炎症反应,通过调控微血管功能实现其抗炎作用。Choi等[46]观察了秦皮乙素对实验性骨关节炎关节液中NO、前列腺素E2(PGE2)和软骨中基质金属蛋白酶-1(MMP-1)水平的影响,结果显示秦皮乙素能明显降低关节炎关节软骨中的MMP-1及关节液中的NO、PGE2水平,减缓骨关节炎的发生。王志强等[47]通过秦皮乙素预处理大鼠来研究其对急性心肌缺血再灌注损伤(MIRI)的保护作用,结果显示秦皮乙素通过抑制炎症反应发挥对缺血再灌注心肌的保护作用。Wang等[48]和Kang等[49]研究表明秦皮甲素能够改善链脲佐菌素所诱导的糖尿病小鼠的血脂异常、炎症反应、肾损伤反应,其作用机制可能与抑制肾皮质糖基化终产物(AGEs)的形成有关。
2.3 抗氧化活性自由基(ROS)可与生物体内的许多物质,如脂肪酸、蛋白质、DNA等作用,夺取它们的氢原子,造成相关细胞结构与功能的破坏及细胞功能丧失、基因突变、甚至死亡。Li等[50]运用DPPH法测定了秦皮水提取液对自由基的半数清除质量浓度(SC50)为0.15 mg/mL,显示出良好的抗氧化活性,且能够逆转6-羟基多巴胺诱导的细胞内氧化自由基水平升高。Wu等[51]采用DPPH和TEAC法对秦皮粗提物与不同提取部位抗氧化活性进行了比较,发现秦皮氯仿提取部位活性最高,其抗氧化活性与总酚的量呈正相关,同时也比较了不同香豆素单体之间抗氧化活性,发现秦皮乙素抗氧化活性最高,并且秦皮乙素能够抑制由Fe2+/抗坏血酸盐引起的过氧化作用。赵二劳等[52]利用清除DPPH•和•OH法评价秦皮水提物、醇提物及酶水提取物的抗氧化活性,发现秦皮不同溶剂提取均具有显著的抗氧化活性,以酶水提取物的抗氧化活性最强。其抗氧化活性与秦皮提取物中总酚量呈正相关。
梁敏[53]采用DPPH分析法比较了秦皮乙醇提取物、秦皮甲素、秦皮乙素的抗氧化活性(秦皮乙素>秦皮乙醇提取物>秦皮甲素),秦皮乙素对DPPH•自由基的清除能力远远强于广泛使用的合成抗氧化剂2, 6-二叔丁基对甲酚(BHN),而且它们对自由基的清除能力与浓度和时间相关,浓度越大,抗氧化物加入时间越长,对自由基的清除能力就越强。
2.4 抗肿瘤活性陈晓蕾等[54]研究了秦皮不同浓度醇提取物的体外抗乳腺癌细胞活性研究,发现秦皮95%和70%乙醇提取物在50~400 μg/mL质量浓度内均能显著抑制人乳腺癌细胞的增殖。
王晶[55]探讨了秦皮甲素抗肺癌移植瘤作用机制,认为秦皮甲素可降低瘤细胞线粒体膜电位,上调促凋亡蛋白(Bax2)表达,下调抗凋亡蛋白(Bcl-2)表达,使肿瘤细胞滞于S期,并通过线粒体途径诱导其凋亡。Chu等[56]研究了秦皮乙素的抗肿瘤机制,认为秦皮乙素可通过增加细胞色素C的细胞溶质迁移以及激活半胱氨酸蛋白水解酶原(CPP32)从而诱导人类白血病细胞的凋亡。Pack等[57]进一步研究了秦皮乙素诱导细胞凋亡的机制,通过分析细胞凋亡小体、DNA碎片以及G1期的细胞积累等得出JNK和ERK(丝裂原活化蛋白激酶MAPK的2种亚型)是调节秦皮乙素诱导细胞凋亡的主要通路。Takao等[58]研究了秦皮甲素对1, 2-二甲肼(DMH)诱导的雄性Fischer 344小鼠结肠癌的作用,表明秦皮甲素对DMH诱导的DNA氧化破坏和小鼠结肠癌有抑制作用。Wang等[59]利用免疫印迹分析研究了秦皮乙素对白血病细胞HL-60 G1期调控因子的影响,结果表明秦皮乙素通过G1期细胞周期阻滞来抑制白血病细胞HL60的增殖。秦皮乙素在体外显示出对人白血病细胞、人胃癌细胞、肝癌细胞等几种肿瘤细胞株生长的抑制作用。Park等[60]研究表明,秦皮乙素与HA14-1(Bcl-2蛋白抑制剂)合用时,能够有效抑制人白血病U937细胞中的肿瘤活性。贾绍华等[61]通过MTT法考察了秦皮乙素对胃癌SGC-7901细胞的体外抑瘤作用,随着给药浓度的增加,SGC-7901细胞的生长率也随之降低,且有明显的凋亡形态学特征。张舜尧[62]研究显示,秦皮乙素在体外可以通过促进凋亡受体途径相关蛋白Fas、FasL、FADD的表达,并形成聚合体促进caspase-3、caspase-8(含半胱氨酸的天冬氨酸特异水解酶-3、8)的表达,从而诱导SGC-7901细胞凋亡。秦皮乙素还可以增强紫杉醇对ERK通路介导的HepG2人肝癌细胞的凋亡作用,抑制人肝癌细胞株SMMC-7721的增殖,诱导肝癌细胞凋亡。
2.5 利尿与抗高尿酸血症活性有资料显示,秦皮总香豆素具有显著的利尿与促尿酸排泄作用,利尿的作用机制在于秦皮甲素可兴奋交感神经系统,而且对肾脏也有直接作用,并且抑制了对尿酸的重吸收[63]。曹瑞竹等[64]利用氧嗪酸钾诱导小鼠高尿酸血症模型,观察了秦皮总香豆素对小鼠血尿酸水平、肝脏黄嘌呤氧化酶、腺苷脱氨酶、鸟苷脱氨酶的影响,发现秦皮总香豆素能够通过抑制肝脏黄嘌呤氧化酶活性降低小鼠血清尿酸水平。
秦皮甲素既能够利尿以促进尿酸的排泄,又能够抑制黄嘌呤氧化酶活性来抑制尿酸的生成,秦皮乙素也具有抑制黄嘌呤氧化酶活性的作用[59, 65]。Li等[66]研究表明,秦皮甲素、秦皮乙素、秦皮素及秦皮苷能显著降低由氧嗪酸钾(250 mg/kg)所诱导的高血尿酸小鼠血清尿酸水平,其作用机制是秦皮甲素、秦皮乙素可上调肾脏尿酸有机阴离子转运体(OAT1)基因的表达量,秦皮素能够抑制肾脏尿酸转运体(URAT1)基因的表达量,秦皮苷调控肾脏尿酸转运体GLUT9、URAT1基因的表达量,秦皮乙素、秦皮素、秦皮苷可以调控肠道尿酸转运体ABCG2基因的表达量,来达到降低血清尿酸水平的目的。
2.6 其他作用 2.6.1 抗病毒活性Galabov等[67]将秦皮中分离得到一些香豆素类化合物进行抗脊髓灰质炎病毒、新城疫病毒、流感病毒3种病毒活性测定,结果显示秦皮乙素具有较好的抗新城疫病毒活性。Kostova等[9]报道了给予28 mmol/mL的秦皮乙素能够抗鸡新城疫病毒。
2.6.2 抗过敏作用Yamagami等[68]发现秦皮中的秦皮甲素、秦皮乙素能够抑制大鼠由角叉菜胶、葡聚糖和酵母等引起的水肿。Tubaro等[69]在另一项研究中也发现秦皮乙素能够降低大鼠由巴豆油引起的水肿和粒细胞渗入。
2.6.3 保肝活性尹明浩等[70]采用水飞蓟宾作为阳性药,比较分析各组动物丙氨酸氨基转移酶(ALT)、超氧化物歧化酶(SOD)和丙二醛(MDA)水平,发现秦皮提取物对CCl4所致小鼠急性肝损伤具有保护作用。
预防给药6 mg/kg秦皮乙素可保护扑热息痛和CCl4引起的大鼠肝损伤[71]。秦皮乙素也能够降低叔丁基过氧化氢t-BHP诱导的肝脏病变的发生率,包括肝细胞肿胀、白细胞浸润和坏死的发生率[72]。Chen等[73]研究发现秦皮素对CCl4诱导的大鼠肝纤维化也具有保护作用。
2.6.4 保护中枢神经系统活性秦皮甲素、秦皮乙素、秦皮素对中枢神经系统有一定的保护作用。胡隐恒等[74]通过给小鼠ip或po秦皮素和秦皮素苷,发现对小鼠有安定作用,研究表明秦皮素和秦皮素苷对中枢神经系统均有抑制作用。Wie等[75]研究表明3~30 μmol/L秦皮乙素作为脂氧合酶抑制剂可显著降低由BAPTA/AM(一种细胞内的钙离子螯合剂)对小鼠引起的神经毒性。
3 结语与展望秦皮中含有丰富的生物活性成分,其传统的功效经过现代药理学的科学评价正逐渐被证实和挖掘。秦皮具有丰富的药理活性,如抗菌、抗炎、抗氧化、抗高尿酸血症等作用,与其含有多种化学成分如香豆素类、裂环烯醚萜类、苯乙醇苷类等密切相关。在过去的几十年里,虽然关于秦皮的化学成分及药理活性已有较多文献报道,然而由于临床试验设计的局限性,它对人体健康有益的原因还不明确,如秦皮抗高尿酸血症机制值得进一步研究。
关于秦皮中的化合物及活性成分的研究多停留在香豆素类等较为局限的几个化合物上,如秦皮甲素、秦皮乙素、秦皮素、秦皮苷等,且对其发挥药效的作用机制还不够深入。未来需要解决的问题主要是明确秦皮各粗提物的化学成分组成,挖掘具有确切生物活性的药效物质。此外,目前的研究多集中在秦皮传统主治功效方面,对于其相关的副作用或毒性研究还有待开展。随着秦皮越来越多治疗效果的科学证据被发现,秦皮应用于临床的前景将更加广阔。
| [1] | 曲海洋, 贾绍华, 赵明春.中药秦皮的药理活性研究进展[A]//第10届全国药用植物及植物药学术研讨会论文集[C].昆明:中国植物学会药用植物及植物药专业委员会, 2011. |
| [2] | Yang L, Liu Y, Zu Y G, et al. Optimize the process of ionic liquid-based ultrasonic-assisted extraction of aesculin and aesculetin from Cortex Fraxini by response surface methodology[J]. Chem Eng J , 2011, 175 (1) :539–547. |
| [3] | 中国药典[S].一部. 2015. |
| [4] | Yang M, Chen J L, Shi X F, et al. Rapid determination of aesculin, aesculetin and fraxetin in Cortex Fraxini extract solutions based on ultraviolet spectroscopy[J]. J Chem , 2011, 8 (S1) :S225–S236. |
| [5] | Liu R, Sun Q H, Sun A L, et al. Isolation and purification of coumarin compounds from Cortex Fraxinus by high-speed counter-current chromatography[J]. J Chromatogr A , 2005, 1072 (2) :195–199. DOI:10.1016/j.chroma.2005.03.023 |
| [6] | Fu S, Zhang J, Li T, et al. Multi-responses extraction optimization based on response surface methodology combined with polarity switching HPLC-MS/MS for the simultaneous quantitation[J]. J Pharm Biomed Anal , 2014, 91 (25) :210–221. |
| [7] | 郭希圣, 章育中. 中药秦皮的化学研究[J]. 药学学报 , 1983, 18 (6) :434–439. |
| [8] | 王立军.秦皮和荔枝核中的活性成分研究[D].杭州:浙江大学, 2012. |
| [9] | Kostova I, Iossifova T. Chemical components of Fraxinus species[J]. Fitoterapia , 2007, 78 (2) :85–106. DOI:10.1016/j.fitote.2006.08.002 |
| [10] | Si C L, Liu Z, Su Y F, et al. Coumarins and secoiridoid glucosides from bark of Fraxinus rhynchophylla Hance[J]. Holzforschung , 2008, 62 (5) :553–555. |
| [11] | Xiao K, Song Q H, Zhang S W, et al. Water-soluble constituents of the root barks of Fraxinus rhynchophylla(Chinese drug Qinpi)[J]. J Asian Nat Prod Res , 2008, 10 (1/2) :205–210. |
| [12] | Zhang D M, Wang L L, Li J, et al. Two new coumarins from Fraxinus chinensis Rexb[J]. J Integr Plant Biol , 2007, 49 (2) :218–221. DOI:10.1111/jipb.2007.49.issue-2 |
| [13] | Gu J Q, Wang Y S, Montenegro G, et al. Antitubercular constituents of Valeriana laxiflora[J]. Planta Med , 2004, 70 (6) :509–514. DOI:10.1055/s-2004-827149 |
| [14] | Fiorentino A, Dellagreca M, Abrosca B, et al. Lignans, neolignans and sesquilignans from Cestrum parqui L'Her[J]. Biochem Syst Ecol , 2007, 35 (6) :392–396. DOI:10.1016/j.bse.2006.12.009 |
| [15] | Tsukamoto H, Hisada S, Nishide S. Lignans from bark of Fraxinus mandshurica var. japonica and F. japonica[J]. Chem Pharm Bull , 1984, 32 (11) :4482–4489. DOI:10.1248/cpb.32.4482 |
| [16] | 张冬梅, 胡立宏, 叶文才, 等. 白蜡树的化学成分研究[J]. 中国天然药物 , 2003, 1 (2) :18–20. |
| [17] | Wu Z B, Liu Y, Tian S S, et al. Chemical constituents of the stem bark of Fraxinus rhynchophylla[J]. Chem Nat Compd , 2014, 49 (6) :1162–1163. DOI:10.1007/s10600-014-0850-y |
| [18] | Zhu Y, Lü Z P, Xue C B, et al. New triterpenoid saponins and neolignans from Morina kokonorica[J]. Helv Chim Acta , 2009, 92 (3) :536–545. DOI:10.1002/hlca.v92:3 |
| [19] | Li Y C, Kuo Y H. Four New Compounds, ficusal, ficusesquilignan A, B, and ficusolide diacetate from the heartwood of ficus microcarpa[J]. Chem Pharm Bull , 2000, 48 (12) :1862–1865. DOI:10.1248/cpb.48.1862 |
| [20] | Aziz M, Rahman A, Moon S S. Isoetin 5'-methyl ether, A cytotoxic flavone from Trichosanthes kirilowii Bull[J]. Bull Korean Chem Soc , 2007, 28 (8) :1261–1264. DOI:10.5012/bkcs.2007.28.8.1261 |
| [21] | Ahn J H, Shin E J, Liu Q, et al. Secoiridoids from the stem barks of Fraxinus rhynchophylla with pancreatic lipase inhibitory activity[J]. Nat Prod Res , 2013, 27 (12) :1132–1135. DOI:10.1080/14786419.2012.711328 |
| [22] | 翁远超, 刘静雯, 崔璨, 等. 秦皮中化学成分的分离鉴定及其体外抑菌活性[J]. 中国药物化学杂志 , 2014, 24 (1) :40–47. |
| [23] | Shen Y C, Lin S L, Chein C C. Jaspolyside, A secoiridoid glucoside from Jasminum polyanthum[J]. Phytochemistry , 1996, 42 (6) :1629–1631. DOI:10.1016/0031-9422(96)00161-6 |
| [24] | Zhou L, Kang J, Fan L, et al. Simultaneous analysis of coumarins and secoiridoids in Cortex Fraxini by high-performance liquid chromatography-diode array detection-electrospray ionizati tandem mass spectrometry[J]. J Pharm Biomed Anal , 2008, 47 (1) :39–46. DOI:10.1016/j.jpba.2007.12.009 |
| [25] | Wang L J, Sun F, Zhang X Y, et al. A secoiridoid with quinone reductase inducing activity from Cortex fraxini[J]. Fitoterapia , 2010, 81 (7) :834–837. DOI:10.1016/j.fitote.2010.05.003 |
| [26] | Liu D L, Zhang Y, Xu S X, et al. Phenylethanoid glycosides from Forsythia suspensa Vahl[J]. J Chin Pharm Sci , 1998, 7 (2) :103–105. |
| [27] | Chen Y Y, Chen W J, Li D P, et al. Preparative isolation and purification of five phenylethanoid glycosides from Chirita eburnea[J]. Chem Nat Compd , 2011, 47 (4) :615–618. DOI:10.1007/s10600-011-0009-z |
| [28] | 魏秀丽, 杨春华, 梁敬钰. 中药秦皮的化学成分[J]. 中国天然药物 , 2005, 3 (4) :228–230. |
| [29] | Mori K, Gupta A K. Chiral synthesis of(R)-(-)-mellein and(3R, 4aS)-(+)-ramulosin[J]. Tetrahedron , 1985, 41 (22) :5295–5299. DOI:10.1016/S0040-4020(01)96780-8 |
| [30] | Matsumoto M, Koga S, Shoyama Y, et al. I Nishioka phenolic glycoside composition of leaves and callus cultures of digitalis purpuerea[J]. Phytochemistry , 2003, 18 (1) :49–50. |
| [31] | Kobayashi H, Karasawa H, Miyase T, et al. Studies on the constituents of cistanchis herba. IV. Isolation and structures of two new phenylpropanoid glycosides, cistanosides C and D[J]. Chem Pharm Bull , 1984, 32 (10) :3880–3885. DOI:10.1248/cpb.32.3880 |
| [32] | Kostova I, Dinchev D, Mikhova B, et al. Epoxyconiferyl alcohol from Fraxinus oxycarpa bark[J]. Phytochemistry , 1995, 38 (3) :801–802. DOI:10.1016/0031-9422(94)00656-E |
| [33] | 李冲, 徐茂润, 谢晶曦, 等. 尖叶白蜡树化学成分的研究[J]. 中草药 , 1990, 21 (8) :2–4. |
| [34] | 崔伟, 徐淑楠, 刘建华, 等. 秦皮挥发油成分的GC-MS分析[J]. 中国药房 , 2014, 25 (35) :3310–3312. |
| [35] | 杨天鸣, 葛欣, 王晓妮. 秦皮抗菌作用研究[J]. 西北国防医学杂志 , 2003, 24 (5) :387–388. |
| [36] | 刘丽梅, 王瑞海, 陈琳, 等. 不同基原秦皮、香豆素单体抗菌作用对比研究[J]. 中国中医药信息杂志 , 2009, 16 (5) :39–42. |
| [37] | Duncan S H, Flint H J, Stewart C S. Inhibitory activity of gut bacteria against Escherichia coli O157 mediated by dietary plant metabolites[J]. Fems Microbiol Lett , 1998, 164 (2) :283–288. DOI:10.1111/fml.1998.164.issue-2 |
| [38] | Wang H T, Zhou D, Xie K, et al. Antibacterial mechanism of fraxetin against Staphylococcus aureus[J]. Mol Med Rep , 2014, 10 (5) :2341–2345. |
| [39] | 刘爽, 谢鲲鹏, 邹丹, 等. 秦皮素对大肠埃希菌作用机制的初步研究[J]. 中国微生态学杂志 , 2014, 26 (10) :1123–1126. |
| [40] | Imen M B, Nadia M, Fadwa C, et al. Oligomerization of esculin improves its antibacterial activity and modulates antibiotic resistance[J]. J Antibiot , 2014, 68 (3) :148–152. |
| [41] | Watanabe K, Ito A T, Saito T, et al. Esculetin suppresses proteoglycan metabolism by inhibiting the production of matrix metalloproteinases in rabbit chondrocytes[J]. Eur J Pharmacol , 1999, 370 (3) :297–305. DOI:10.1016/S0014-2999(99)00143-0 |
| [42] | 杨庆, 翁小刚, 聂淑琴, 等. 不同基原秦皮、香豆素单体以及不同指纹区样品对内毒素刺激单核-巨噬细胞株分泌炎症因子的影响[J]. 中国实验方剂学杂志 , 2010, 16 (13) :127–131. |
| [43] | 曹世霞, 祝捷, 张三印, 等. 秦皮总香豆素对急性痛风性关节炎大鼠模型IL-1β、IL-8、TNF-α的影响[J]. 四川中医 , 2011, 29 (3) :68–70. |
| [44] | Zhang T, Wang S. Esculin inhibits the inflammation of LPS-induced acute lung injury in mice via regulation of TLR/NF-κB pathways[J]. Inflammation , 2015, 38 (4) :1529–1536. DOI:10.1007/s10753-015-0127-z |
| [45] | 段慧琴, 张永东, 范开, 等. 七叶亭抗炎机理研究[J]. 中国兽医杂志 , 2007, 43 (9) :45–46. |
| [46] | Choi J H, Kim D Y, Yoon J H, et al. Effects of SKI 306X, a new herbal agent, on proteoglycan degradation in cartilage explant culture and collagenase-induced rabbit osteoarthritis model[J]. Osteoarthritis Cartilage , 2002, 10 (6) :471–478. DOI:10.1053/joca.2002.0526 |
| [47] | 王志强, 夏勇. 七叶亭预处理对大鼠急性心肌缺血再灌注损伤的保护作用[J]. 成都医学院学报 , 2011, 6 (1) :49–51. |
| [48] | Wang Y H, Liu Y H, He G R, et al. Esculin improves dyslipidemia, inflammation and renal damage in streptozotocin-induced diabetic rats[J]. BMC Complement Altern Med , 2015, 15 (1) :141–152. DOI:10.1186/s12906-015-0657-9 |
| [49] | Kang K S, Lee W J, Jung Y J, et al. Protective effect of esculin on streptozotocin-induced diabetic renal damage in mice[J]. J Agric Food Chem , 2014, 62 (9) :2069–2076. DOI:10.1021/jf403840c |
| [50] | Li J J, Zhou S Y, Zhang H, et al. Cortex Fraxini(Qingpi) protects rat pheochromocytoma cells against 6-hydroxydopamine-induced apoptosis[J]. Parkinsons Dis , 2015, 2015 :532849. |
| [51] | Wu C R, Huang M Y, Lin Y T, et al. Antioxidant properties of Cortex Fraxini and its simple coumarins[J]. Food Chem , 2007, 104 (4) :1464–1471. DOI:10.1016/j.foodchem.2007.02.023 |
| [52] | 赵二劳, 姚宇霞, 史淑美, 等. 秦皮不同溶剂提取物总酚含量及抗氧化活性[J]. 中国食品添加剂 , 2012 (3) :116–119. |
| [53] | 梁敏. 秦皮抗氧化成分的分离及其活性研究[J]. 食品工业科技 , 2006, 27 (3) :64–66. |
| [54] | 陈晓蕾, 汤立建, 李庆林. 淫羊藿、秦皮醇提取物体外抗乳腺癌细胞增殖的研究[J]. 中国药房 , 2007, 18 (15) :1124–1127. |
| [55] | 王晶. 秦皮甲素对肺癌小鼠抑瘤作用的研究[J]. 中成药 , 2014, 36 (2) :249–252. |
| [56] | Chu C Y, Tsai Y Y, Wang C J, et al. Induction of apoptosis by esculetin in human leukemia cells[J]. Eur J Pharmacol , 2001, 416 (1/2) :25–32. |
| [57] | Park C, Jin C Y, Kim G Y, et al. Induction of apoptosis by esculetin in human leukemia U937 cells through activation of JNK and ERK[J]. Toxicol Appl Pharmacol , 2008, 227 (2) :219–228. DOI:10.1016/j.taap.2007.10.003 |
| [58] | Takao K, Shoichi T, Fumiyo T. Inhibitory effect of natural coumarin compounds, esculetin and esculin, on oxidative DNA damage and formation of aberrant crypt foci and tumors induced by 1, 2-dimethylhydrazine in rat colons[J]. Biol Pharm Bull , 2007, 30 (11) :2052–2057. DOI:10.1248/bpb.30.2052 |
| [59] | Wang C J, Hsieh Y J, Chu C Y, et al. Inhibition of cell cycle progression in human leukemia HL-60 cells by esculetin[J]. Cancer Lett , 2002, 183 (2) :163–168. DOI:10.1016/S0304-3835(02)00031-9 |
| [60] | Park C, Jin C Y, Kwon H J, et al. Induction of apoptosis by esculetin in human leukemia U937 cells:roles of Bcl-2 and extracellular-regulated kinase signaling[J]. Toxicol In Vitro , 2010, 24 (2) :486–494. DOI:10.1016/j.tiv.2009.09.017 |
| [61] | 贾绍华, 刘冰洁, 张道勇, 等. 秦皮乙素诱导人胃癌SGC-7901细胞凋亡机制的研究[J]. 黑龙江医药 , 2012, 25 (3) :365–368. |
| [62] | 张舜尧.秦皮乙素诱导SGC-7901肿瘤细胞凋亡的实验研究[D].哈尔滨:哈尔滨商业大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10240-1012251956.htm |
| [63] | 王红权, 詹杰, 王小波, 等. 中药有效成分治疗高尿酸血症基础研究进展[J]. 中国药理学与毒理学杂志 , 2015, 29 (3) :471–476. |
| [64] | 曹瑞竹, 张三印, 代勇, 等. 秦皮总香豆素降低小鼠急性高尿酸血症血尿酸水平及机理研究[J]. 辽宁中医杂志 , 2010, 37 (2) :362–363. |
| [65] | Liu Z, Gu H, Yang L. An approach of ionic liquids/lithium salts based microwave irradiation pretreatment followed by ultrasound-microwave synergistic extraction for two coumarins preparation from Cortex fraxini[J]. J Chromatogr A , 2015, 1417 :8–20. DOI:10.1016/j.chroma.2015.09.037 |
| [66] | Li J M, Zhang X, Wang X. Protective effects of cortex fraxini coumarines against oxonate-induced hyperuricemia and renal dysfunction in mice[J]. Eur J Pharmacol , 2011, 666 (1/3) :196–204. |
| [67] | Galabov A S, Iosifova T, Vassileva E, et al. Antiviral activity of some hydroxycoumarin derivativese[J]. Z Naturforsch C , 1996, 51 (7/8) :558–562. |
| [68] | Yamagami I, Suzuki Y, Ito K. Pharmacological studies on the components of Fraxinus japonica Blume[J]. Nihon Yakurigaku Zasshi , 1968, 64 (6) :714–729. DOI:10.1254/fpj.64.714 |
| [69] | Tubaro A, Del N P, Ragazzi E, et al. Anti-inflammatory and peripheral analgesic activity of esculetin in vivo[J]. Pharmacol Res Commun , 1988, 20 (Suppl 5) :83–85. |
| [70] | 尹明浩, 吕惠子, 姜丽君, 等. 秦皮提取物对小鼠急性肝损伤保护作用的实验研究[J]. 时珍国医国药 , 2007, 18 (3) :590–591. |
| [71] | Gilani A H, Janbaz K H, Shah B H. Esculetin prevents liver damage induced by paracetamol and CCl4[J]. Pharmacol Res , 1998, 37 (1) :31–35. DOI:10.1006/phrs.1997.0262 |
| [72] | Lin W L, Wang C J, Tsai Y Y, et al. Inhibitory effect of esculetin on oxidative damage induced by t-butyl hydroperoxide in rat liver[J]. Arc Toxicol , 2000, 74 (8) :467–472. DOI:10.1007/s002040000148 |
| [73] | Chen X W, Ying X Z, Zhang W W, et al. The hepatoprotective effect of fraxetin on carbon tetrachloride induced hepatic fibrosis by antioxidative activities in rats[J]. Int Immunopharmacol , 2013, 17 (3) :543–547. DOI:10.1016/j.intimp.2013.08.006 |
| [74] | 胡隐恒, 汪曼影. 秦皮中所含的秦皮素和秦皮素甙的主要药理作用[J]. 新医药学杂志 , 1975 (8) :41–42. |
| [75] | Wie M B, Koh J Y, Won M H, et al. An intracellular calciumchelator, induces delayednecrosisby lipoxygenase mediatedfree radicals in mouse corticalcultures[J]. Prog Neuropsychopharmacol Biol Psychiatry , 2001, 25 (8) :1641–1659. DOI:10.1016/S0278-5846(01)00202-0 |
 2016, Vol. 47
2016, Vol. 47