丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bunge的干燥根及根茎。作为我国传统大宗中药材之一,丹参具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效,临床用于治疗月经不调、经闭痛经、胸腹刺痛、热痹疼痛、疮疡肿痛、心烦不眠、肝脾肿大、心绞痛等症[1]。丹参酚酸(salvianolic acids)为丹参中含量丰富的水溶性多聚酚酸类物质,是丹参活血化瘀主要功效成分,目前已分离得到至少20种单体化合物[2],包括丹参素(danshensu)、咖啡酸(caffeic acid)、迷迭香酸(rosmarinic acid)、原儿茶酸(protocatechuic acid),丹酚酸A、B、C、D、E(salvianolic acid A、B、C、D、E)等,具有抗血小板聚集、抗血栓、改善微循环、促进组织恢复、抗脂质过氧化和清除自由基等多种生理活性,尤其以抗氧化作用更为突出[3-6]。由于丹参酚酸类成分的重要药用价值和经济价值,提高丹参中丹酚酸类成分积累显得尤为重要。因此通过代谢工程或合成生物学提高丹酚酸类成分的产量具有重要意义和实用价值。本文对丹参酚酸类化合物的生物合成途径及其关键酶、调控机制及生物转化利用等方面进行探讨,以期为丹参酚酸类物质资源的高效合成与综合开发利用提供科学依据。
1 酚酸类物质的生物合成途径丹参中酚酸类成分具有多聚酚酸的特殊结构,而大多数多聚酚酸类化合物均为咖啡酸的衍生物,丹参素化学名为β-3, 4-二羟基苯乳酸,被认为是各种丹参酚酸类化合物的基本化学结构。迷迭香酸从结构上看是咖啡酸与丹参素的二聚物,丹酚酸B为迷迭香酸二聚体,由3分子丹参素和1分子咖啡酸缩合而成,丹酚酸A由1分子丹参素与2分子咖啡酸缩合而成,因此理论上认为迷迭香酸可能为其他更为复杂丹酚酸类化合物的代谢前体[7-9]。
近年来人们对于迷迭香酸及丹酚酸类物质生物合成途径的研究多从相关酶基因入手,考察关键酶基因表达量或酶活性的变化与目标产物累积量之间的关系,从而利用基因组学提供的信息和产物,对参与生物合成途径的多个基因或蛋白质进行全面分析与研究。例如,通过以紫草和彩叶草的悬浮培养细胞为研究对象,对迷迭香酸生物合成途径及相关酶进行了较全面的阐述,认为迷迭香酸的次生代谢包括苯丙氨酸(phenylpropanoid)和酪氨酸(tyrosine-derived)2条相互平行的支路途径[10]。苯丙氨酸在苯丙氨酸解氨酶(PAL)作用下生成肉桂酸,肉桂酸在肉桂酸-4-羟化酶(C4H)和4-香豆素CoA连接酶(4CL)的催化下生成苯丙氨酸支路途径的产物4-香豆酰CoA。另一支路,酪氨酸在酪氨酸氨基转移酶(TAT)和对羟基苯丙酮酸还原酶(HPPR)作用下经过4-羟基苯丙酮酸生成4-羟基苯乳酸。4-羟基苯乳酸与4-香豆酰CoA在迷迭香酸合成酶(RAS)作用下首先生成2-氧-(4-香豆酰)-3-(4-羟基苯)-乳酸(迷迭香酸生物合成途径中一个重要的中间产物),最后由细胞色素P450蛋白CYP98A14催化生成迷迭香酸。此外,酪氨酸支路中的4-羟基苯丙酮酸在对羟基苯丙酮酸双氧化酶(HPPD)作用下还可生成2, 5-二羟基苯乙酸(尿黑酸),它是生成生育酚(维生素E)和质体醌的前体物质。2012年,邸鹏[11]利用同位素标记动态监测的方法对迷迭香酸生源途径进行了重新评估,推测4-香豆酸先被转化为咖啡酸,咖啡酸被催化生成咖啡酰辅酶A(CoA)与4-羟基苯乳酸经过RAS催化生成2-氧-(3, 4-香豆酰)-3-(4-羟基苯)-乳酸,之后又经CYP98A14催化生成迷迭香酸,可能为其主要合成途径。丹酚酸类化合物合成下游途径中迷迭香酸在漆酶作用下氧化成自由基,通过互变异构重排和分子内亲核反应形成中间产物,再经过丹酚酸E进一步催化生成丹酚酸B,或自发直接形成丹酚酸B(图 1)[12],为后续丹参中酚酸类成分生物合成途径的研究提供了一定的理论基础。
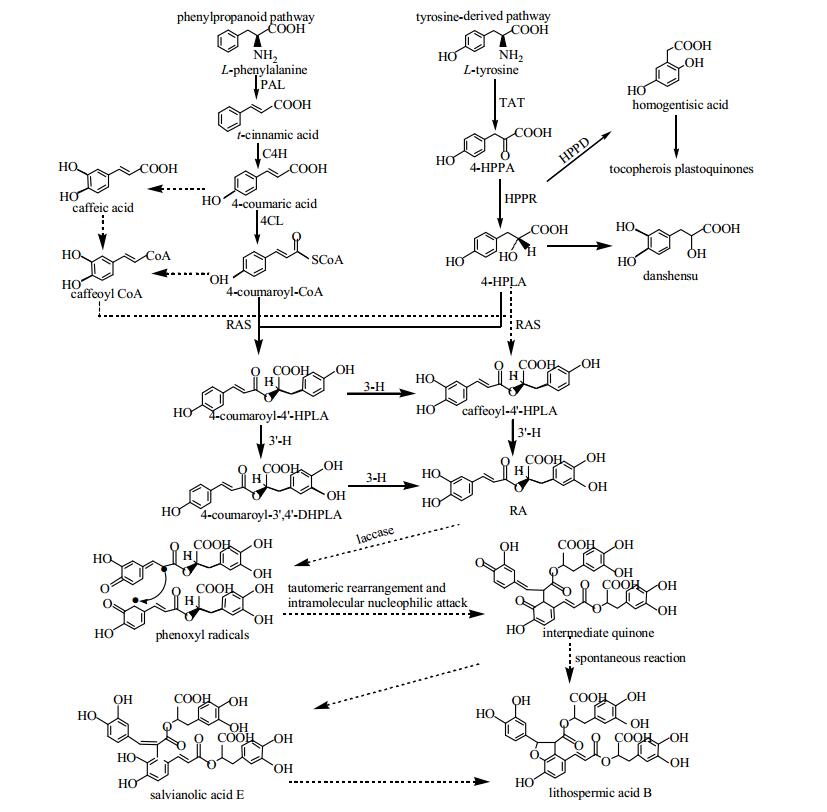
|
4-HPPA: 4-羟基苯丙酮酸;4-HPLA: 4-羟基苯乳酸;4-coumaroyl-4′-HPLA: 2-O-(4-香豆酰)-3-(4-羟基苯)-乳酸;4-coumaroyl-3′, 4′-DHPLA: 2-O-(4-香豆酰)-3-(3′, 4′-二羟基苯)-乳酸;caffeoyl-4′-HPLA: 2-氧-(4′-咖啡酰)-3-(3, 4-二羟基苯)-乳酸;3-H, 3′-H:羟桂皮烯醛基-羟苯乳酸基3-和3′-羟化酶;RA:迷迭香酸;实线表示已知的生源途径,虚线表示可能的生源途径 4-HPPA: 4-hydroxyphenyl pyruvic acid; 4-HPLA: 4-hydroxyphenyllactic acid; 4-coumaroyl-4′-HPLA: 4-coumaroyl-4′-hydroxyphenyllactic acid; 4-coumaroyl-3′, 4′-DHPLA: 4-coumaroyl-3′, 4′-dihydroxyphenyllactic acid; caffeoyl-4′-HPLA: caffeoyl-4′-hydroxyphenyllactic acid; 3-H, 3′-H: hydroxycinnamoyl-hydroxyphenyllactate 3-and 3′-hydroxylases; RA: rosmarinic acid; The verified biosynthesis process is represented with solid line and the proposed biosynthetic process is represented with dotted line 图 1 丹参中迷迭香酸生物合成途径及从迷迭香酸到丹酚酸B的可能途径 Fig.1 New biosynthesis pathway of rosmarinic acid in roots and rhizomes of S. miltiorrhiza and proposed biosynthesis process from rosmarinic acid to salvianolic acid B |
2 迷迭香酸生物合成途径关键酶基因 2.1 苯丙氨酸解氨酶基因
苯丙氨酸解氨酶(phenylalanine aimnonia-lyase,PAL,EC:4.3.1.5)是苯丙烷类代谢途径的第1个酶,也是连接初生代谢和次生代谢的关键酶,在植物代谢中起着重要作用。PAL催化L-苯丙氨酸生成反式肉桂酸,反式肉桂酸进一步在苯丙烷类代谢途径其他酶的作用下生成黄酮类、木质素、花青素等物质[13]。鉴于PAL酶在植物次生代谢过程中的重要作用,迄今其功能已被广泛研究,证实该酶参与花青素积累、木质化、黄酮类物质合成以及病虫害防御等多种生理过程[14-15]。Song等[16]通过RNA干扰引起PAL基因在丹参中的异常表达发现,PAL酶活性降低,总酚酸量下降了20%~70%,且植株表型发生变化,表明PAL基因在迷迭香酸合成途径中的重要性。PAL基因的普遍特点是由多基因家族组成,在植物中的表达具有组织特异性,且同一物种PAL基因的不同家族成员的表达也不同。对丹参中的PAL1、PAL2、PAL3基因(SmPAL1、SmPAL2、SmPAL3)进行全长cDNA克隆、序列分析和基因表达分析发现,SmPAL1和SmPAL3具有较高的相似度,SmPAL1和SmPAL3在所有组织器官中均有表达,而SmPAL2仅在花和茎中发挥作用,说明了SmPALs相关代谢网络的复杂性[17],关于PAL基因在丹参生长发育和次生物质代谢中的功能关联尚有待深入研究。
2.2 肉桂酸-4-羟化酶基因肉桂酸-4-羟化酶(cinnamate 4-hydroxylase,C4H,EC:1.14.13.11)是目前在植物中研究最多的P450单加氧酶,2008年首次从丹参中克隆得到[18],C4H催化反式肉桂酸对位羟基化,调控4-肉桂酸转化为4-香豆酸,与下游产物如木质素、黄酮类等许多代谢物的合成有关。Xiao等[19]研究发现在丹参毛状根中过量表达C4H基因激活了迷迭香酸合成中的2条平行支路途径,促进苯丙氨酸支路中肉桂酸和4-香豆酸合成,以及酪氨酸途径中酪氨酸和4-羟基苯丙酮酸的积累,并且能够显著提高终产物中总酚酸的量。利用实时荧光定量PCR对丹参中C4H表达进行分析,结果显示该基因在根、茎、叶、花等多种器官中均有表达,在根中的表达量最高。
2.34 -香豆素CoA连接酶基因4-香豆素CoA连接酶(4-couniamte coenzyme A ligase,4CL,EC:6.2.1.12)催化4-香豆酸生成4-香豆素CoA,是苯丙氨酸途径中最后一个关键酶,为该途径下游产物如木质素、黄酮类等物质的合成提供活化底物。4CL基因多以基因家族的形式存在,每个家族成员以不同反应底物或相似催化功能参与苯丙氨酸途径终产物的合成[20]。目前丹参中已鉴定得到7类4CL基因(Sm4CL),它们分别作用于不同的亚细胞结构[21],已知序列信息的4-香豆酰CoA连接酶基因有2条,分别为Sm4CL1和Sm4CL2,其中Sm4CL2与4-香豆酸具有较强的亲和性,前体参与木质素、黄酮类、总酚酸类物质包括迷迭香酸的生物合成,而对于Sm4CL1则更偏向于咖啡酸和阿魏酸[22],表明Sm4CL2在迷迭香酸合成途径中发挥着更关键作用,具有深入研究价值,可通过调控Sm4CL1或Sm4CL2的表达及酶活性从而使目标产物得到积累。
2.4 酪氨酸氨基转移酶基因酪氨酸氨基转移酶(tyrosine aminotransferase,TAT,EC:2.6.1.5)是酪氨酸代谢途径的第1个酶,也被公认为是该途径的限速酶之一,催化酪氨酸转变成4-羟基苯丙酮酸。目前已从多种植物中克隆得到TAT基因,如丹参、彩叶草、苜蓿和拟南芥,荧光定量PCR分析表明TAT在茎中的表达明显高于根和叶。受内源性植物激素信号分子及外界刺激,如甲基茉莉酸(methyl jasmonic acid,MeJA)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)和紫外照射(ultraviolet-B radiation,UV-B)处理可分别在一定程度上调TAT转录水平的表达[23]。研究发现酵母提取物(YE)和Ag+同时处理丹参毛状根,在迷迭香酸和总酚酸量被诱导增加之前观察到TAT酶活性显著升高,而PAL酶活性迅速下降,结果表明,诱导子对丹参毛状根中迷迭香酸和酚酸的生物合成的诱导与TAT酶活性相关而不是PAL酶[24]。关于迷迭香酸合成是由苯丙氨酸和酪氨酸这2条平行途径共同参与完成,或是酪氨酸途径为主,苯丙氨酸途径为辅合成迷迭香酸还有待进一步阐明。
2.5 对羟基苯丙酮酸双氧化酶基因对羟基苯丙酮酸双氧化酶(4-hydroxyphenyl-pyruvate dioxygenase,HPPD,EC:1.13.11.27)是一种广泛存在于各种有机体中的铁-酪氨酸蛋白,催化对羟基苯丙酮酸转化为尿黑酸,从而合成质体醌和生育酚。丹参HPPD基因(SmHPPD)cDNA序列全长1 736 bp,包含一个长度为939 bp,编码481个氨基酸残基的开放阅读框(ORF),荧光定量PCR分析表明SmHPPD在丹参根、茎、叶中均有表达,以根中表达量最高[25]。SmHPPD为迷迭香酸合成旁路竞争途径中的关键酶基因,通过抑制该基因的表达,丹参中迷迭香酸及丹酚酸B的量均得到显著提高[19]。
2.6 对羟基苯丙酮酸还原酶基因对羟基苯丙酮酸还原酶(hydroxyphenylpyravate reductase,HPPR,EC:1.1.1.237)是迷迭香酸生物合成途径第1个特异性关键酶,催化对羟基苯丙酮酸生成对羟基苯乳酸。丹参HPPR基因(SmHPPR)cDNA序列全长1 066 bp,包含1个长度为939 bp,编码313个氨基酸残基的ORF。基因组DNA揭示含有2个外显子和1个内含子。各种诱导刺激考察显示MeJA、SA、ABA和赤霉素(gibberellic acid,GA3)能上调SmHPPR表达水平,UV-B和过氧化氢(H2O2)处理则能下调其表达。在丹参毛状根中,过量表达HPPR及共表达TAT-HPPR均能同时显著提高迷迭香酸和丹酚酸B的量[19]。
2.7 迷迭香酸合成酶基因迷迭香酸合成酶(rosmarinatesynthase,RAS,EC:2.3.1.140)由1个内含子和2个外显子组成,cDNA全长1 489 bp,包含1个1 284 bp的ORF,编码428个氨基酸属于BAHD酰基转移酶家族,以4-香豆酰CoA和4-羟苯基乳酸为底物,催化4-香豆酰CoA与4-羟基苯乳酸共同催化生成2-氧-(4-香豆酰)-3-(4-羟基苯)-乳酸,这是迷迭香酸生物合成的关键步骤。宋婕[26]检测了光照处理和MeJA处理后迷迭香酸合成相关酶基因的表达变化以及对应条件下迷迭香酸产物的量。结果证实,光照和MeJA都可以诱导迷迭香酸生物合成酶基因的表达,并且提高迷迭香酸及其衍生的丹酚酸B的积累量。通过构建RNAi载体抑制丹参RAS基因(SmRAS)表达,引起迷迭香酸和LAB合成积累减少,这些均表明SmRAS在丹参迷迭香酸合成途径中发挥关键作用[11]。SmRAS基因在丹参的根、茎、叶中均有表达,根中的表达量最高。RAS基因属于迷迭香酸合成下游途径关键酶基因,迄今在丹参中尚未见迷迭香酸合成酶相关代谢调控研究,因此深入研究该基因在丹参迷迭香酸合成过程中的调控机制对于开发丹参中酚酸类物质具有重要科学价值。
2.8 细胞色素P450(CYP450)酶基因CYP98A14(coumaroyl 3′-monooxygenase,CYP98A14,EC:1.14.13.36)是一类家族非常庞大的CYP450酶,在迷迭香酸合成过程中将SmRAS催化4-香豆酰CoA与4-羟基苯乳酸生成的2-氧-(4-香豆酰)-3-(4-羟基苯)-乳酸在3位和3′位添加羟基从而生成迷迭香酸。丹参CYP98A14(SmCYP98A14)在根、茎、叶中均有表达,在根中表达量最高,MeJA诱导后其转录水平可被上调,但其调控模式不同于SmRAS。通过对SmCYP98A14以anti-sense方式抑制,丹参毛状根中迷迭香酸和丹酚酸B的量显著降低,从转录水平揭示了SmCYP98A14在酚酸类生物合成中的作用[11]。同时,Wang等[21]研究提出参与丹参酚酸类合成下游途径CYPP450酶基因为SmCYP98A98,而非SmCYP98A14。
除RAS、CYP98A14外,PAL、C4H、4CL、TAT基因均已从丹参中克隆得到,这些基因的表达及调控与丹参素、迷迭香酸及其随后的丹酚酸B等一系列复杂酚酸类化合物积累密切相关,但其具体的作用机制及调控模式尚需系统深入研究,且仅迷迭香酸上游生源途径已得到部分阐明,下游其他酚酸类成分如丹酚酸B等的生源途径尚未清楚,因此需要深入细致地对迷迭香酸下游酚酸类生源合成途径进行研究。
3 丹参酚酸类物质合成的调控研究丹参酚酸类成分作为具有重要经济和药用价值的活性成分,其合成途径已基本明了,如何提高丹参细胞内酚酸类化合物的量成为国内外研究的热点和难点。随着分子生物学、转录组学与代谢组学的不断发展,利用现代生物技术和分子生物学手段,有可能实现对丹参中酚酸类成分的生物合成调控,主要的调控机制体现在关键酶、调节基因或转录因子等方面。
3.1 诱导子诱导子(elicitor)从植物病理学角度是指在抗病生理过程中诱发植物产生植保素(phytoalexin)和引起植物过敏反应(hypersensivereaction,HR)的因子;从细胞培养角度是指能促进植物细胞产生目的产物的因子。根据其来源可分为生物诱导子(bioticelicitor,包括病原菌与植物细胞成分)和非生物诱导子(abiotieelieitor,如紫外线、高温、低温、乙烯、pH、重金属盐类和高浓度盐等),其中重金属盐较为常用[27-28],利用诱导子来提高次生代谢产物的量,是目前在药用植物细胞培养中常用的方法和有效途径。
3.1.1 生物诱导子Xiao等[29]克隆并且研究了与迷迭香酸合成有关的HPPD,用酵母提取物诱导丹参毛状根,丹参毛状根中RA和总酚酸量增加,而HPPD的表达量降低,结果表明酵母诱导迷迭香酸的积累与HPPD无关。明乾良[30]研究了丹参内生真菌D16菌丝及其诱导子溶液对丹参毛状根生长及次生代谢的影响。研究发现D16诱导子溶液能够显著促进丹参毛状根生长,但在一定程度上抑制丹酚酸类成分的生物合成。张顺仓等[31]研究了真菌诱导子对丹参毛状根有效成分积累的影响,真菌处理后第1天总酚酸的量是对照的1.2倍,随着诱导时间的延长,真菌诱导子表现出了对总酚酸积累的抑制作用。迷迭香酸在真菌诱导后的第1天和第2天积累量有了一定程度的提高,分别是对照的1.2和1.5倍,但从第5天开始积累受到抑制,丹酚酸B的积累则一直处于受抑制状态。
3.1.2 非生物诱导子丹参毛状根或细胞培养物中酚酸类化合物已经被报道可由诸多诱导子如Ag+[32]、SA[33]和MeJA[34]等诱导积累。Zhang等[35]将MeJA作为丹参毛状根中合成酚酸类化合物的诱导剂,发现RA合成途径中的2条平行支路上的关键酶表现出不同反应,相比于苯丙氨酸支路上的关键酶(PAL、C4H、4CL),酪氨酸途径中的TAT和HPPR表现出更为显著的基因表达和酶活性水平,同时伴随目标次生代谢产物的积累,由此推论酪氨酸途径关键酶与丹参中RA和SAB的合成联系更紧密。Dong等[33]用SA诱导丹参细胞培养物,对酶活力及酚酸类物质的量进行检测。结果表明,PAL、TAT酶活性相应增强的同时,酚酸类物质积累增多。Hao等[36]用80 μmol/L的ABA处理白花丹参毛状根,使处理组中丹酚酸B和丹酚酸A的量分别达到了对照组的2.0倍和3.3倍。李东等[37]研究热胁迫下丹参迷迭香酸代谢途径关键酶基因的表达,构建迷迭香酸合成途径中7个关键酶基因PAL、C4H、4CL、TAT、HPPD、HPPR和RAS热胁迫0~48 h的代谢途径,其中,PAL、C4H和RAS受热胁迫影响表达量下降;TAT、4CL和HPPD表达量呈先上升后下降趋势;HPPR表达量前期变化不大,后期呈下降趋势,结果表明热胁迫对迷迭香酸合成途径关键酶基因表达有极显著影响。
3.2 基因调控 3.2.1 转录因子转录因子(transcription factors)也称反式作用因子,是能够与真核基因启动子区域中顺式作用元件发生特异性相互作用的DNA结合蛋白,通过它们之间以及与其他相关蛋白之间的相互作用,激活或抑制转录,在植物整个代谢途径中起关键作用[38]。MYB类转录因子是植物转录因子中最大的家族之一,广泛参与植物的发育和代谢调控,其中,R2R3-MYB亚家族主要参与苯丙烷类代谢途径的调节[39],Zhang等[40]发现将拟南芥的一个R2R3-MYB转录因子基因PAP1转入丹参,可显著提高丹酚酸B的量。刘芬[41]将拟南芥MYB90家族转录因子PAP2在丹参中过表达,分析此转录因子基因在丹参植株中的表达模式,PAP2基因在叶和根的部位均有表达,且表达水平有较大的差别,在叶中表达最高,其次为根,茎中无表达,同时转基因株系中丹参素、迷迭香酸以及丹酚酸B的量均有所提高,而咖啡酸量的变化不明显,结果表明,PAP2转录因子通过激活苯丙烷代谢途径中PAL、C4H、4CL-1和酪氨酸代谢途径中TAT基因的表达,促进了酚酸类物质的合成积累,通过探究转录因子的功能,能实现对代谢产物的间接控制。SmMYC是一个丹参bHLH类转录因子,王浩如等[42]利用拟南芥miRNA319前体为模板骨架,构建旨在对SmMYC进行特异性沉默的artifical miRNA(amiRNA)植物表达载体将其导入丹参中,所得转化阳性株系中参与酚酸类代谢途径中相关酶基因的表达也表现为相应程度的下调,伴随总酚酸量的降低。
3.2.2 RNA干扰技术(RNA interference,RNAi)RNAi技术作为一种下调特定基因表达的技术,可应用于特异性下调植物代谢过程中的某些关键基因,从而调控植物次生代谢物的积累。Song等[16]利用RNAi沉默抑制了丹参中PAL基因的表达,使基因转化株系中总酚量降低20%~70%,PAL酶活性降低的同时,迷迭香酸生源途径上其他关键酶基因C4H、4CL2和TAT的表达上调,说明迷迭香酸途径相关酶基因的表达可以相互影响。邸鹏[11]研究发现通过抑制SmRAS及SmCYP98A14表达,能够明显降低丹参毛状根中迷迭香酸和丹酚酸B的量,同时抑制这2个基因的表达均导致酚酸类合成途径上其他基因表达明显下调。
4 丹参酚酸类物质生物转化初步研究生物合成为生物体内进行的同化反应的总称,生物转化(biotransformation)也称生物催化(biocatalysis),是指以真菌、细菌、植物悬浮细胞或组织以及动物细胞或组织为生物体系或酶体系,对外源性化合物进行结构修饰,从而得到新活性化合物的生理生化反应[43]。其具有专一性强、反应条件温和、催化效率高以及环境污染小等特点,往往可用于催化有机合成中难以完成的化学反应。关于丹参酚酸类物质生物转化的研究已取得初步进展,通过将丹参水提取液用于培养球形红细菌菌体,发现丹参水提取液能诱导球形红细菌合成新的可能参与丹参生物转化的蛋白质(包括酶),如酯酶(EST)同工酶、细胞氧化色素氧化酶(COD)同工酶、超氧化物歧化酶(SOD)与过氧化物酶(POD)同工酶等[44]。丹酚酸B为丹参酚酸类物质中量最高的活性成分,有研究通过采用微生物发酵技术,在150株真菌中筛选出一株真菌可将丹酚酸B高效转化为一般化学合成方式很难得到的原紫草酸[45],成为寻找药源的新方式。生物转化反应选择性强、低能耗、绿色环保,可克服化学合成的缺点,对于丹参中酚酸类化合物及其他类成分新药源的发现具有重要意义,但其对外界环境敏感、培养耗资巨大且转化机制复杂性给生物转化的发展带来巨大困难。
5 结语与讨论利用基因工程、细胞工程等现代生物技术手段构建“基因表达-代谢物积累”或“酶活性-代谢物积累”相关谱,可对丹参酚酸类成分的生物合成进行调控,但由于其代谢网络的复杂性,其作用机制及调控模式尚需深入探讨。将分子生物学、转录组学和代谢组学相结合,构建从基因到代谢的网络,发掘目标代谢物相关基因簇及表达机制,有助于进一步确定与迷迭香酸及其他丹酚酸类物质的合成、转运、调节、修饰有关的新基因及调控机制。同时,丹参酚酸类化合物的生源途径仅上游迷迭香酸的合成得到部分阐明,参与合成相关的基因中除SmRAS及SmCYP98A14外均已克隆得到,但迷迭香酸下游其他酚酸类成分如丹酚酸B等的生源途径尚未阐明。因此,寻找丹参酚酸类物质的转化途径,找到参与其转化的关键酶,深入研究丹参生物转化机制,将有助于推动丹参酚酸类物质资源在生产和新药研制开发中的应用。
对于丹参酚酸类化合物的调控研究主要集中在丹参毛状根或丹参细胞培养。研究表明,丹参地上茎叶及花序中含有丰富的丹酚酸类资源性化学成分,且生长旺盛期总酚酸类成分的量明显高于地下根及根茎[46]。利用植物组织化学定位和定性定量分析技术相结合的手段研究丹参中酚酸类化合物在植株不同组织中的确切定位和差异性,明确自然生长状态下丹参中酚酸类化合物的形成时期及其在整个生长过程中的组织转运,从而在关键期对丹参中酚酸类物质的合成进行调控,这对于进一步高效生产和利用丹参酚酸类物质资源具有重要科学意义与应用前景。
| [1] | 中国药典[S].一部. 2015. |
| [2] | Ma X H, Ma Y, Tang J F, et al. The biosynthetic pathways of tanshinones and phenolic acids in Salvia miltiorrhiza[J]. Molecues , 2015, 20 (9) :16235–16254. DOI:10.3390/molecules200916235 |
| [3] | Ma L J, Zhang X Z, Guo H, et al. Determination of four water-soluble compounds in Salvia miltiorrhiza Bunge by highperformance liquid chromatography with a coulometric electrode array system[J]. J Chromatogr B Analyt Technol Biomed Life Sci , 2006, 833 (2) :260–263. DOI:10.1016/j.jchromb.2006.01.021 |
| [4] | Ho J H, Hong C Y. Salvianolic acids:small compounds with multiple mechanisms for cardiovascular protection[J]. J Biomed Sci , 2011, 18 (1) :30–34. DOI:10.1186/1423-0127-18-30 |
| [5] | 王冰瑶, 吴晓燕, 樊官伟. 丹参素保护心血管系统的药理作用机制研究进展[J]. 中草药 , 2014, 45 (17) :2571–2575. |
| [6] | Cao W, Guo X W, Zheng H Z, et al. Current progress of research on pharmacologic actions of salvianolic acid B[J]. Chin J Integr Med , 2012, 18 (4) :316–320. DOI:10.1007/s11655-012-1052-8 |
| [7] | 赵淑娟, 章国瑛, 刘涤, 等. 丹参水溶性酚酸类化合物药理及生物合成途径研究进展[J]. 中草药 , 2004, 35 (3) :341–344. |
| [8] | Petersena M, Simmonds M S. Rosmarinic acid[J]. Phytochemistry , 2003, 62 (2) :121–125. DOI:10.1016/S0031-9422(02)00513-7 |
| [9] | 肖莹. 丹参酚酸类成分生源合成的调控研究[J]. 上海:第二军医大学 , 2009 . |
| [10] | 韩立敏. 丹参酚酸类成分生物合成途径研究进展[J]. 安徽农业科学 , 2014, 42 (20) :6562–6564. |
| [11] | 邸鹏.丹参酚酸类成分生源途径的探索及相关基因的克隆与功能研究[D].上海:第二军医大学, 2012. |
| [12] | Di P, Zhang L, Chen J F, et al. 13C tracer reveals phenolic acids biosynthesis in hairy root cultures of Salvia miltiorrhiza[J]. ACS Chem Biol , 2013, 8 (7) :1537–1548. DOI:10.1021/cb3006962 |
| [13] | Yun Y H, Koo J S, Kim S H, et al. Cloning and expression analysis of phenylalanine ammonia-lyase gene in the mycelium and fruit body of the edible mushroom flammulina velutipes[J]. Mycrobiology , 2015, 43 (3) :327–332. |
| [14] | MacDonald M J, D'Cunha G B. A modern view of phenylalanine ammonia lyase[J]. Biochem Cell Biol , 2007, 85 (3) :273–282. DOI:10.1139/O07-018 |
| [15] | Shadle G L, Wesley S V, Korth K L, et al. Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J]. Phytochemistry , 2003, 64 (1) :153–161. DOI:10.1016/S0031-9422(03)00151-1 |
| [16] | Song J, Wang Z Z. RNAi-mediated suppression of the phenylalanine ammonia-lyase gene in Salvia miltiorrhiza causes abnormal phenotypes and a reduction in rosmarinic acid biosynthesis[J]. J Plant Res , 2011, 124 (1) :183–192. DOI:10.1007/s10265-010-0350-5 |
| [17] | Hou X M, Shao F J, Ma Y M. The phenylalanine ammonia-lyase gene family in Salvia miltiorrhiza:genome-wide characterization, molecular cloning and expression analysis[J]. Mol Biol Rep , 2013, 40 (7) :4301–4310. DOI:10.1007/s11033-013-2517-3 |
| [18] | Huang B B, Duan Y B, Yi B, et al. Characterization and expression profiling of cinnamate 4-hydroxylase gene from Salvia miltiorrhiza in rosmarinic acid biosynthesis pathway[J]. Russ J Plant Physiol , 2008, 55 (3) :390–399. DOI:10.1134/S1021443708030163 |
| [19] | Xiao Y, Zhang L, Gao S H, et al. The c4h, tat, hppr and hppd genes prompted engineering of rosmarinic acid biosynthetic pathway in Salvia miltiorrhiza hairy root cultures[J]. PLoS One , 2011, 6 (12) :1–10. |
| [20] | Hamberger B, Hahlbrock K. The 4-coumarate:CoA ligase gene family in Arabidopsis thaliana comprises one rare, sinapate-activating and three commonly occurring isoenzymes[J]. Proc Natl Acad Sci USA , 2004, 101 (7) :2209–2214. DOI:10.1073/pnas.0307307101 |
| [21] | Wang B, Sun W, Li Q S, et al. Genome-wide identification of phenolic acid biosynthetic genes in Salvia miltiorrhiza[J]. Planta , 2015, 241 (3) :711–725. DOI:10.1007/s00425-014-2212-1 |
| [22] | Zhao S J, Hu Z B, Liu D, et al. Two divergent members of 4-coumarate:Coenzyme A ligase from Salvia miltiorrhiza bunge:cDNA cloning and functional study[J]. J Integr Plant Biol , 2006, 48 (11) :1355–1364. DOI:10.1111/jipb.2006.48.issue-11 |
| [23] | Huang B B, Yi B, Duan Y B, et al. Characterization and expression profiling of tyrosine aminotransferase gene from Salvia miltiorrhiza(Dan-shen) in rosmarinic acid biosynthesis pathway[J]. Mol Biol Rep , 2008, 35 (4) :601–612. DOI:10.1007/s11033-007-9130-2 |
| [24] | Yan Q, Shi M, Ng J, et al. Elicitor-induced rosmarinic acid accumulation and secondary metabolism enzyme activities in Salvia miltiorrhiza hairy roots[J]. Plant Sci , 2006, 170 (4) :853–858. DOI:10.1016/j.plantsci.2005.12.004 |
| [25] | Ma P D, Liu J Y, Zhang C L, et al. Regulation of water-soluble phenolic acid biosynthesis in Salvia miltiorrhiza Bunge[J]. Appl Biochem Biotechnol , 2013, 170 (6) :1253–1262. DOI:10.1007/s12010-013-0265-4 |
| [26] | 宋婕.丹参苯丙氨酸解氨酶基因(SmPAL1)的克隆及功能初探[D].西安:陕西师范大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10718-2007199207.htm |
| [27] | 宋婕.丹参苯丙氨酸解氨酶基因(SmPAL1)的克隆及功能初探[D].西安:陕西师范大学, 2007. http://cdmd.cnki.com.cn/article/cdmd-10718-2007199207.htm |
| [28] | Zhao J L, Zhou L G, Wu J Y. Effects of biotic and abiotic elicitors on cell growth and tanshinone accumulation in Salvia miltiorrhiza cell cultures[J]. Appl Microbiol Biotechnol , 2010, 87 (1) :137–144. DOI:10.1007/s00253-010-2443-4 |
| [29] | Xiao Y, Di P, Chen J F, et al. Characterization and expression profiling of 4-hydroxyphenyl-pyruvate dioxygenase gene(Smhppd) from Salvia miltiorrhiza hairy root cultures[J]. Mol Biol Rep , 2009, 36 (7) :2019–2029. DOI:10.1007/s11033-008-9413-2 |
| [30] | 明乾良.内生真菌对丹参毛状根生长和次生代谢的影响及其分子机制[D].上海:第二军医大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-90030-1015518325.htm |
| [31] | 张顺仓, 刘岩, 沈双, 等. 诱导子对丹参毛状根酚酸类和丹参酮类成分积累的影响[J]. 中国中药杂志 , 2011, 36 (10) :1269–1273. |
| [32] | Xiao Y, Gao S H, Di P, et al. Lithospermic acid B is more responsive to silver ions(Ag+) than rosmarinic acid in Salvia miltiorrhiza hairy root cultures[J]. Biosci Rep , 2009, 30 (1) :33–40. DOI:10.1042/BSR20080124 |
| [33] | Dong J, Wan G W, Liang Z S. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell cultures[J]. J Biotechnol , 2010, 148 (2/3) :99–104. |
| [34] | Xiao Y, Gao S H, Di P, et al. Methyl jasmonate dramatically enhances the accumulation of phenolic acids in Salvia miltiorrhiza hairy root cultures[J]. Physiol Plant , 2009, 137 (1) :1–9. DOI:10.1111/ppl.2009.137.issue-1 |
| [35] | Zhang S C, Yan Y, Wang B Q, et al. Selective responses of enzymes in the two parallel pathways of rosmarinic acid biosynthetic pathway to elicitors in Salvia miltiorrhiza hairy root cultures[J]. J Biosci Bioeng , 2014, 117 (5) :645–651. DOI:10.1016/j.jbiosc.2013.10.013 |
| [36] | Hao G P, Ji H W, Li Y L, et al. Exogenous ABA and polyamines enhanced salvianolic acids contents in hairy root cultures of Salvia miltiorrhiza Bge. f. alba[J]. Plant Omics:J Plant Mol Biol Omics , 2012, 5 (5) :446–452. |
| [37] | 李东, 吴先军, 陈新. 热胁迫下丹参迷迭香酸代谢途径关键酶基因的表达研究[J]. 核农学报 , 2012, 26 (1) :60–67. |
| [38] | Li C, Li D, Shao F, et al. Molecular cloning and expression analysis of WRKY transcription factor genes in Salvia miltiorrhiza[J]. BMC Genomics , 2015, 16 (1) :200–220. DOI:10.1186/s12864-015-1411-x |
| [39] | Li C, Lu S. Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks in Salvia miltiorrhiza[J]. BMC Genomics , 2014, 15 :277–288. DOI:10.1186/1471-2164-15-277 |
| [40] | Zhang Y A, Yan Y P, Wang Z Z. The arabidopsis PAP1 transcription factor plays an important role in the enrichment of phenolic acids in Salvia miltiorrhiza[J]. J Agric Food Chem , 2010, 58 (23) :12168–12175. DOI:10.1021/jf103203e |
| [41] | 刘芬.转录因子PAP2对丹参酚酸类产物合成的影响[D].西安:陕西师范大学, 2011. http://cdmd.cnki.com.cn/article/cdmd-10718-1011143330.htm |
| [42] | 王浩如, 王健, 王仕英, 等. 丹参转录因子基因SmMYC amiRNA表达载体的构建及其对丹参的转化[J]. 植物生理学报 , 2013, 49 (12) :1339–1346. |
| [43] | 牛红军, 李邦东, 李军, 等. 光合细菌生物转化技术在中药研究中的应用进展[J]. 中草药 , 2014, 45 (13) :1966–1970. |
| [44] | 张守元, 薛强强, 许宁宁, 等. 丹参提取液对球形红细菌菌体蛋白及几种酶的影响[J]. 应用与环境生物学报 , 2012, 18 (4) :623–629. |
| [45] | 赵丹, 张怡轩, 王金辉, 等. 丹参酚酸B的微生物转化[J]. 中国现代中药 , 2007, 9 (12) :17–19. |
| [46] | 沙秀秀, 宿树兰, 沈飞, 等. 不同生长期丹参茎叶及花序中丹酚酸类化学成分的分布与积累动态分析评价[J]. 中草药 , 2015, 46 (22) :3414–3419. |
 2016, Vol. 47
2016, Vol. 47


