2. 吉林省延边农业科学院, 吉林 龙井 133400
2. Yanbian Academy of Agricultural Sciences, Longjing 133400, China
金线莲Anoectochilus roxburghii (Wall.) Lindl.,兰科(Orchidaceae)开唇兰属Anoectochilus Bl.多年生草本植物,是十分珍稀的中草药,素有“神草”“乌人参”等美称[1]。全身药用,味平,性甘,具有清热凉血、除湿解毒、益寿延年等功用,可治疗肺热咳嗽、风湿骨痛、糖尿病、膀胱炎等[2]。富含多糖、黄酮类、微量元素、氨基酸、酚类、三萜类等多种物质[3-4]。近年来,随着对金线莲研究的不断深入,其功能也被越来越多的人们了解,市场需求量逐年增加,但金线莲自然条件下很难大量繁殖,而人工栽培自然危害较严重,管理不方便[5]。通过植物组织培养进行金线莲大量繁殖是目前最快最有效的办法。目前,金线莲组培方面的研究主要集中在试管苗培养的培养条件筛选[6-8],但是,通过金线莲组培的方式直接从培养物中获得有效物质的研究并不多见。因此,本实验研究了影响金线莲丛生芽的生物量和有效物质积累的几种因素,并探明了在反应器内通过大量培养丛生芽生产有效物质的可行性,旨在为丛生芽作为新材料来源提供参考。
1 材料样品经笔者鉴定为金线莲Anoectochilus roxburghii (Wall.) Lindl.,将其切成单芽备用。
JA21002电子天平(上海精天电子仪器有限公司);YHW1103远红外快速干燥箱(天津市华北实验仪器有限公司);LG16-B离心机(北京雷波尔离心机有限公司);UV1102紫外分光光度计(上海天美科学仪器有限公司)。所用试剂购于天津市科密欧化学试剂有限公司。
2 方法 2.1 外植体长度对金线莲丛生芽增殖的影响根据袁晓玲等[9]和杨清林等[10]的实验结果作为参考,将丛生芽长度设定为1 mm和5 mm作为外植体,接种于MS+BA 1.0 mg/L+NAA 0.5 mg/L+KT 0.2 mg/L+蔗糖30 g/L+琼脂7 g/L的培养皿中,pH调节为5.8。每个培养皿(Φ×h=9.5 cm×1.5 cm)接入9个外植体。温度为(25±2)℃,相对湿度为70%,暗培养。45 d后调查金线莲丛生芽的鲜物质质量、干物质质量及增殖数。
2.2 BA质量浓度对金线莲丛生芽生物量和有效物质积累的影响将丛生芽切成5 mm接种于含不同BA质量浓度(1.0、1.5、2.0、2.5、3.0 mg/L)的MS培养基中。培养基的其他成分为NAA 0.5 mg/L,KT 0.2 mg/L,蔗糖30 g/L和琼脂7 g/L,pH调节为5.8,每个培养皿接入9个外植体。温度为(25±2)℃,相对湿度为70%条件下,暗培养。45 d后调查金线莲丛生芽的鲜物质质量、干物质质量以及测定多糖、黄酮、总酚的质量分数。
2.3 光条件对金线莲丛生芽生物量和有效物质积累的影响根据以上实验结果,将5 mm的外植体接种于BA质量浓度为2.0 mg/L的MS培养基中,培养基的其他成分为NAA 0.5 mg/L,KT 0.2 mg/L,蔗糖30 g/L和琼脂7 g/L,pH调节为5.8。每个培养皿接入9个外植体。温度为(25±2)℃,相对湿度为70%,分别在光照(光照强度为1 600 lx,光照时间为16 h)和暗条件下培养。45 d后调查金线莲丛生芽的鲜物质质量、干物质质量以及测定多糖、黄酮、总酚的质量分数。
2.4 金线莲丛生芽反应器培养选用3 L气升式生物反应器,加入2 L培养基(MS+BA 2.0 mg/L+NAA 0.5 mg/L+KT 0.2 mg/L+蔗糖30 g/L,pH调节为5.8)。反应器中接入丛生芽5 g/L后进行完全浸模式培养。在培养温度为(25±2)℃,光照条件下(光照强度为1 600 lx,光照时间为16 h)培养30 d。以筛选出最好条件的固体培养为对照。比较反应器培养与固体培养的金线莲丛生芽的鲜物质质量、干物质质量以及多糖、黄酮、酚类物质的质量分数。
2.5 样品测定 2.5.1 生物量的测定取出丛生芽,用自来水冲洗2~3次后,用滤纸吸干表面水分,称鲜物质质量。最后放入40 ℃的干燥箱中烘干,48 h后称干物质质量。
2.5.2 多糖质量分数的测定采用苯酚-浓硫酸法[11]。精密称取干燥后的葡萄糖25 mg,加蒸馏水溶解定容至25 mL,精密吸取0.1、0.25、0.5、0.75、1.0、1.25、1.5 mL置于量瓶中,加蒸馏水定容至10 mL。分别吸取1 mL上述对照品溶液及1 mL蒸馏水于试管中,加入5%苯酚溶液1.5 mL,摇匀后加入5 mL浓硫酸,静置20 min,以蒸馏水作为空白对照。在490 nm处测定吸光度值,绘制标准曲线。
精确称取丛生芽干燥粉末10 g,用90%乙醇溶液浸泡2次,每次6 h,放于通风橱中将滤渣挥干后,加入100 mL蒸馏水,分3次于45 ℃条件下超声提取30 min,将滤液合并浓缩至10 mL。用Sevage试剂除蛋白,离心15 min后,取上清溶液加入95%乙醇溶液,静置12 h抽滤,依次用无水乙醇、丙酮和乙醚洗涤滤渣,反复冲洗3次后,待滤液挥发散尽,在温度为40 ℃条件下烘干,即为金线莲多糖。称取10 mg,溶解定容至100 mL量瓶中,即为0.1 mg/mL金线莲多糖溶液,并计算出换算因素(f)。

|
W为总多糖质量,C为多糖溶液中葡萄糖的浓度,D为多糖的稀释因素
精确称取各处理的丛生芽干燥粉末0.1 g,用90%乙醇浸泡2次,每次6 h,于通风橱中将滤渣挥干,加蒸馏水20 mL,在45 ℃条件下超声处理30 min,滤过,收集滤液,重复3次后合并滤液,定容至100 mL量瓶中,即得供试样品溶液。以苯酚-浓硫酸法在490 nm处测定葡萄糖的吸光度值,计算丛生芽中多糖的质量分数。

|
C为样品溶液中葡萄糖的质量浓度,D为样品溶液的稀释因素,W为样品的质量
2.5.3 黄酮质量分数的测定采用硝酸铝比色法[12]。精密称取120 ℃干燥至恒定质量的芦丁对照品10 mg,用70%乙醇溶解定容至250 mL,摇匀,即得0.04 mg/mL芦丁对照品溶液。精密吸取芦丁对照品溶液0.1、0.2、0.4、0.6、0.8、1.0 mL置于试管中,加70%乙醇至2 mL,再分别加入5%亚硝酸钠溶液0.3 mL,10%硝酸铝溶液0.3 mL,4%氢氧化钠溶液2.0 mL,间隔6 min,摇匀,70%乙醇作为空白对照。在510 nm处测定吸光度值,绘制标准曲线。
精确称取各处理的丛生芽干燥粉末0.1 g,加70%乙醇,60 ℃下处理3 h,离心15 min,取上清液定容至25 mL,即得供试样品溶液。取2 mL样品溶液加入试管中,分别加入5%亚硝酸钠溶液0.3 mL,10%硝酸铝溶液0.3 mL,4%氢氧化钠溶液2.0 mL,每加一溶液间隔6 min,摇匀,以70%乙醇作为空白对照。在510 nm处测定吸光度值,计算丛生芽中黄酮质量分数。
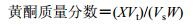
|
X为样品溶液中黄酮质量浓度,Vt为样品提取液总体积,Vs为提取体积,W为样品质量
2.5.4 总酚质量分数的测定采用福林酚比色法[13]。精确称取没食子酸25 mg置于250 mL量瓶中,定容后摇匀,即得溶液中没食子酸质量浓度为0.1 mg/mL。取没食子酸标准液0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL于试管中,加蒸馏水至1 mL,加入0.1 mL 2 mol/L的福林-酚试剂,放置6 min,再加入2%碳酸钠溶液0.5 mL,暗处放置1 h后,在760 nm处测定吸光度值,绘制标准曲线。
精确称取各处理的丛生芽干燥粉末0.1 g,加入80%甲醇15 mL,80 ℃下处理2 h,冷却后,离心15 min,抽取上清液,用80%甲醇定容至25 mL。取1 mL样品溶液加入试管中,加入0.1 mL 2 mol/L福林-酚试剂,放置6 min,再加入2%碳酸钠溶液0.5 mL,以蒸馏水做空白对照。暗处放置1 h后,在760 nm处测定吸光度值,计算丛生芽中总酚质量分数。

|
C为样品溶液中总酚质量浓度,V为样品提取液总体积,D为稀释倍数,M为样品的质量
2.6 数据整理及软件分析利用SPSS 11.5程序中的方差分析对实验数据进行分析,采用邓肯氏新复极差法进行比较,显著水平为0.05,固体培养每个处理重复10次,反应器培养每个处理重复3次。
3 结果与分析 3.1 外植体长度对金线莲丛生芽增殖的影响将1 mm和5 mm的丛生芽接种到增殖培养基中培养45 d,发现不同长度外植体得到丛生芽增殖效果有很大差异。外植体长度为5 mm时,丛生芽增殖效果好,丛生芽增殖数为(5.0±0.6)个,而1 mm时仅为(2.0±0.2)个。外植体长度5 mm的鲜物质质量和干物质质量分别为(640.0±35.4)、(76.1±2.5)mg,1 mm时的鲜物质质量和干物质质量分别为(141.0±5.6)、(15.1±0.9)mg。因此,在进行金线莲组培丛生芽增殖培养时,将外植体切成5 mm大小为好。
3.2 BA质量浓度对金线莲丛生芽生物量和有效物质积累的影响金线莲丛生芽的生物量与BA质量浓度密切相关,在BA质量浓度为1.0~2.0 mg/L时,随BA质量浓度升高,丛生芽鲜物质质量和干物质质量不断增加,当BA质量浓度为2.5 mg/L时,出现最大值,分别为1 496.9、159.9 mg,之后继续增加质量浓度反而减少。金线莲丛生芽的有效物质的积累也呈这一趋势,多糖、黄酮、总酚的最高质量分数和生产量出现在BA质量浓度为2.0 mg/L时(表 1)。说明BA能够影响生物量和有效成分的合成,配合光照,可以获得更多的生物量和有效物质。因此,本实验选择BA质量浓度为2.0 mg/L作为最佳质量浓度。
|
|
表 1 BA质量浓度对金线莲丛生芽生物量和有效物质积累的影响(n=10) Table 1 Effect of BA concentration on multiple shoot biomass and effective material accumulation of A.roxburghii (n=10) |
3.3 光条件对金线莲丛生芽生物量和有效物质积累的影响
为明确光条件对金线莲丛生芽生物量和有效物质积累的影响,确定BA质量浓度为2.0 mg/L后分别对明和暗培养条件下丛生芽生物量和有效物质积累情况进行了比较。结果发现明培养条件下,丛生芽生物量和多糖积累量显著高于暗培养,多糖质量分数和生产量分别达到477.8 mg/g和1 441.9 mg/L。光照条件对黄酮和总酚的质量分数无显著的影响,但2种物质的生产量明条件明显高于暗条件,明培养的丛生芽中黄酮和总酚生产量分别达到12.9、19.0 mg/L(表 2)。
|
|
表 2 光条件对金线莲丛生芽生物量和有效物质积累的影响(n=10) Table 2 Effect of light condition on rhizome biomass and effective material accumulation of A. roxburghii (n=10) |
3.4 反应器培养对金线莲丛生芽生物量与有效物质积累的影响
反应器培养可获得大量丛生芽。在3 L反应器(含2 L培养液)中接入5 g/L的反应器培养的丛生芽培养30 d,并与固体培养45 d的丛生芽进行比较发现,反应器培养鲜物质量和干物质量分别为24.4 g/L和3.1 g/L,固体培养鲜物质量和干物质量分别为(10.0±0.2)g/L、(1 030.0±118.0)mg/L。因此,反应器培养更适于丛生芽增殖生长。且适宜的接种量可使丛生芽的生物量大大提高,进一步筛选接种量,有利于在短时间内大量繁殖金线莲丛生芽。比较固体培养和反应器培养的丛生芽中多糖、黄酮和总酚质量分数和生产量,如图 1所示,反应器培养的多糖多糖质量分数和生产量均高于固体培养,反应器培养更利于多糖的积累;反应器培养黄铜质量分数和生产量均明显高于固体培养,总酚的结果与黄酮相一致,反应器培养能获得更多的总酚质量分数(5.8 mg/g)和生产量。说明反应器培养比固体培养能获得更多的有效物质,筛选适宜的接种量可以积累更多的多糖、黄酮、酚类物质。

|
图 1 金线莲反应器培养与固体培养的丛生芽中有效物质积累的比较 Fig.1 Comparison on effective material accumulation of A. roxburghii multiple shoot in bioreactor culture with in solid culture |
4 讨论
对于兰科植物,当外植体长度过短时,其增殖生长的能力降低,且生长势较弱;当长度过长时,继续进行组织生长,生长缓慢。本实验中取丛生芽长度为5 mm时,外植体健壮,长势良好,增殖速度快。这与袁晓玲等[9]和高丽等[14]的实验结果相似。光是植物生长发育的重要因子。利用光能把无机物转变成有机物,供给植物自身需求[15]。低弱光照条件下,影响金线莲光合作用和产物合成,严重减少植株生长量和干物质积累,同时,光照条件对有效物质产量也有影响,李琰等[16]研究发现,光照条件对杜仲愈伤组织生长和次生代谢产物有显著影响,这与本试验结果相一致,相同BA质量浓度下,明培养得到的生物量和有效物质产量高于暗培养。
在植物组织培养过程中,植物生长激素对植物生长起到促进作用,同时,激素配比不同,浓度高低会影响植物生长和有效物质的积累。Seeni等[17]提出,在兰花的组织培养中,BA对外植体增殖和诱导起着重要的作用。于荣敏等[18]的实验表明,MS培养基中适当的BA,NAA质量浓度对何首乌毛状根的生长和蒽醌化合物的积累有促进作用,本试验适于金线莲增殖和分化的BA最佳质量浓度为2.0 mg/L,添加一定质量浓度的BA(2.0 mg/L)有利于有效物质的合成和积累。
研究表明,通过生物反应器培养不定根[20]和球茎[20]等植物器官已成功地实现了大量繁殖和生产次生代谢产物,例如,利用生物反应器培养铁皮石斛原球茎的生物量和有效物质的量明显高于其他培养方式[21],这与本实验结果相一致。吴荣哲[22]研究出了利用生物反应器进行金线莲种苗大量扩繁的最佳条件。但利用生物反应器通过金线莲的大量培养生产有效物质的研究尚未发现。由于本实验只是初步研究,在反应器内培养金线莲丛生芽的各影响因素还未进行筛选,今后有必要进一步研究和探讨。
| [1] | 张君诚, 张超, 陈强, 等. 金线莲产业化现状及发展对策[J]. 福建林业科技 , 2014, 41 (4) :220–224. |
| [2] | 《全国中草药汇编》编写组. 全国中草药汇编[M]. 北京: 人民卫生出版社, 1996 . |
| [3] | 王晋成. 金线莲化学成分研究进展[J]. 东南园艺 , 2014 (6) :68–74. |
| [4] | Du X M, Nobuto I, Norihiro F, et al. Pharmacologically active compounds in the Anoectochilus and Goodyera species[J]. J Nat Med , 2008, 62 (2) :132–148. DOI:10.1007/s11418-007-0169-0 |
| [5] | 朱小鹏. 台湾金线莲的栽培技术[J]. 林业勘察设计 , 2006 (2) :209–211. |
| [6] | 沈睿, 李婉怡, 张莉莉, 等. 金线莲快繁技术体系的优化[J]. 安徽农业科学 , 2015, 43 (6) :68–69. |
| [7] | Zhang A L, Wang H Z, Shao Q S, et al. Large scale in vitro propagation of Anoectochilus roxburghii for commercial application:Pharmaceutically important and ornamental plant[J]. Ind Crops Prod , 2015, 70 :158–162. DOI:10.1016/j.indcrop.2015.03.032 |
| [8] | 王小敏, 黄肇宇, 莫昭展, 等. 金线莲丛生芽的增殖和壮苗生根[J]. 玉林师范学院学报 , 2014, 35 (5) :54–58. |
| [9] | 袁晓玲, 王建栋, 王思雨, 等. 金线莲组培快繁体系优化及多糖含量测定[J]. 浙江农业科学 , 2015, 56 (7) :983–985. |
| [10] | 杨清林, 管天冰, 戴传云. 台湾金线莲丛生芽的诱导与增殖研究[J]. 安徽农业科学 , 2012, 40 (17) :9209–9210. |
| [11] | Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method of determination of sugars and related substances[J]. Anal Chem , 1956, 28 (3) :350–356. DOI:10.1021/ac60111a017 |
| [12] | Chang C C, Yang M H, Wen H M, et al. Estimation of total flavonoids content in propolis by two complementary colorimetric methods[J]. J Food Drug Anal , 2002, 10 (3) :178–182. |
| [13] | Folin O, Ciocalteu V. On tyrosine and tryptophane determination in proteins[J]. J Biol Chem , 1927, 73 (2) :627–650. |
| [14] | 高丽, 李洪林, 杨波. 基本培养基与生长调节剂组合对素心建兰丛生芽增殖和芽分化的影响[J]. 亚热带植物科学 , 2007, 36 (4) :13–15. |
| [15] | 魏翠华, 谢宇, 秦建彬, 等. 光照强度对金线莲生长及产量的影响[J]. 北方园艺 , 2015 (12) :139–141. |
| [16] | 李琰, 王冬梅, 江在民, 等. 培养基及培养条件对杜仲愈伤组织生长及次生代谢产物含量的影响[J]. 西北植物学报 , 2004, 24 (10) :1912–1916. |
| [17] | Seeni S, Latha P G. Foliar regeneration of the endangered Red Vanda, Renanthera imschootiana Rolfe(Orchidaceae)[J]. Plant Cell Tissue Org Cult , 1992, 29 (3) :167–172. DOI:10.1007/BF00034349 |
| [18] | 于荣敏, 马娜, 严春艳. 外源激素对何首乌毛状根生长及蒽醌类成分生物合成的影响[J]. 生物工程学报 , 2006 (4) :619–623. |
| [19] | Gao R, Wu S Q, Piao X C, et al. Micropropagation of Cymbidium sinense using continuous and temporary airlift bioreactor systems[J]. Acta Physiol Plant , 2014, 9 (36) :117–124. |
| [20] | Wu S Q, Yu X K, Lian M L, et al. Several factors affecting hypericin production of Hypericum perforatum during adventitious root culture in airlift bioreactors[J]. Acta Physiol Plant , 2014, 36 (4) :975–981. DOI:10.1007/s11738-013-1476-6 |
| [21] | 魏楠楠, 姚睿, 李阳, 等. 几种因素对反应器铁皮石斛原球茎生长及有效物质的影响[J]. 北方园艺 , 2014 (14) :156–159. |
| [22] | 吴荣哲. 生物反应器在金线莲扩繁中的应用研究[J]. 安徽农业科学 , 2010, 38 (36) :20571–20573. |
 2016, Vol. 47
2016, Vol. 47


