长春花Catharanthus roseus L.属于夹竹桃科(Apocynaceae)草本植物,含有丰富的抗癌萜类吲哚生物碱(terpenoid indole alkaloids,TIAs)[1-2]。长春碱、长春新碱和阿吗碱均属于长春花中的TIAs。研究表明,长春碱对绒毛上皮细胞癌的治疗效果明显,长春新碱对恶性淋巴肿瘤有作用,阿吗碱可作为高效的降压药[3-4]。1-脱氧-D-木酮糖-5-磷酸(DXP)途径和莽草酸途径是长春花TIAs生物合成的上游途径。异胡豆苷(strictosidine)是合成长春碱、长春新碱及其他生物碱的共同前体,而阿吗碱也是由异胡豆苷转变过来,只是其合成部位在液泡[5-6]。在长春花生物碱合成途径中异胡豆苷的合成由多步反应所形成。丙酮酸(pyruvic acid)和3-磷酸甘油醛(glyceraldehyde 3-phosphate,G3P)通过1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy- D-xylulose5-phosphate synthase,DXS)催化生成1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose 5-phosphate,DXP)[7]。法尼基焦磷酸(farnesyl diphosphate,FPP)和异戊烯基焦磷酸(isopentenyl pyrophate,IPP)在香叶基香叶基焦磷酸合成酶(geranylgeranyl diphosphate synthase,GGPPS)作用下缩合成香叶基香叶基焦磷酸(geranylgeranyl diphosphate,GGPP)。细胞色素P450和依赖NADPH的细胞色素P450还原酶(cytochrome P450-reductase,CPR)组成的香叶醇10-脱氢酶(geraniol 10-hydroxylase,G10H)能将香叶基焦磷酸羟基化形成10-羟基香叶醇(10-hydroxy-geraniol)[8]。在莽草酸途径中,chorismate通过邻氨基苯甲酸合成酶(anthranilate synthase alpha subunit,ASα)催化形成邻氨基苯甲酸[9]。莽草酸途径中的色氨酸通过色氨酸脱羧酶(tryptophan decarboxylase,TDC)脱羧产生色胺(trypamine)。色胺和裂环马钱子苷(secologanin)通过异胡豆苷合成酶(strictosidine synthase,STR)作用形成异胡豆苷(strictosidine)。去乙酰文多灵(desacetoxyvindoline)转变成脱乙酰文多灵(deacetylvindoline)是通过去乙酰文多灵-4-脱羧酶(desacetoxyvindoline-4-hydroxylase,D4H)的作用完成。而脱乙酰文多灵则是经脱乙酰文多灵-4-O-乙酰转移酶(4-O-deacetylvindoline 4-O-acetyltransferase,DAT)催化形成文多灵。
长春花次生代谢产物TIAs在治疗癌症、过敏和抗高血压中有应用。但是天然药物的合成受植物生长和产量的控制,无法满足人们的需求[10]。其次,TIAs化学结构复杂,化学合成有较大困难且成本太高[11]。目前,利用体外刺激和生长调节因子提高长春花生物碱次生代谢产物的研究较多[12-13]。如土壤条件、光照、外源钾、β-环糊精和甲基茉莉酸等对长春花生物碱产量的影响[14-17]。代谢工程和代谢调控技术能够为长春花TIAs量积累提供新的途径。近年来,长春花生物碱合成途径中关键限速酶基因的不断发现也为代谢工程在长春花中的研究提供了保障[18]。TIAs的生物合成与裂环马钱子苷的合成有一定关系,g10h基因的过量表达可以提高裂环马钱子苷量[19]。长春花细胞中合成TIAs的能力也与G10H活性有关[20]。因此,G10H在TIAs的合成中起到关键调控的作用。Gong等[21]成功将g10h基因导入长春花毛状根,与非转基因长春花普通根相比,转g10h基因长春花毛状根的TIAs量显著增加,说明该基因是长春花生物碱合成关键基因之一。但研究表明G10H活性受到TIAs生物合成中代谢产物和终产物的抑制。诱导基因表达的转录调控因子能够降低抑制作用,从而提高长春花中生物碱量。转录因子脂肪酸衍生物反映长春花AP2结构域蛋白(ORCA3)在吲哚前体的合成中有重要作用,在TIA生物合成途径中,ORCA3与多种酶合成基因的调节有关[22]。研究发现单转orca3基因能够提高长春花中dxs、asα、tdc、str和d4h基因的表达,但对g10h、sgd和dat没有影响,并且没有提高生物碱量[23]。本实验首次将orca3和g10h基因共转长春花毛状根,通过RT-qPCR研究TIAs生物合成中相关基因转录差异,利用HPLC研究共转orca3/g10h基因后长春花毛状根TIAs量的差异。
1 材料与方法 1.1 材料长春花种子购自BD-Vereniging公司(荷兰)。pCAMBIA1304载体由CAMBIA公司提供,长春花毛状根无性系则由复旦-交大-诺丁汉植物生物技术研发中心馈赠。对照品长春碱、长春新碱和阿吗碱均购自Sigma公司(质量分数为99.9%)。胶回收(小量)试剂盒,pGEM-T easy vector(Promega公司,美国),限制性内切酶(Biolab公司),T4 DNA连接酶(Takara公司,中国),质粒提取(小量)试剂盒,Ex-Taq DNA聚合酶(Takara公司,中国)。
1.2 方法 1.2.1 植物表达载体pCAMBIA1304+-orca3-g10h表达载体的构建以长春花cDNA为模板,利用带BglII和BstEII酶切位点的引物fg10h:5’-GGAGATCTATGGATTACCTTACCATAATATTA-AC-3’,rg10h:5’-TCGGTGACCTTAAA GGGTGCTTGGTACAG-3’克隆g10h基因。带XbaI和SacI酶切位点的引物forca3:5’-GCTCTAGAATGTCCGA-AGAAATCATTTCCGTCTC-3’,rorca3:5’-GGGAG-CTCTTAATATCGTCTCTTCTTCCTTCCTCC-3’扩增orca3基因序列(划线部分为酶切位点)。将2基因扩增片段分别与pGEM T-easy载体连接,获得pGEM T-g10h和pGEM T-orca3克隆载体。以EcoRI和HindIII分别对pCAMBIA1304和pBI121进行双酶切。并对pCAMBIA1304酶切后大片段和pBI121酶切后小片段进行连接,构建新的表达载体pCAMBIA1304+。利用XbaI/SacI对重组载体pCAMBIA1304+和pGEMT-orca3进行双酶切并利用T4 DNA连接酶连接,以达到orca3基因替换pCAMBIA1304+中gus基因的目的。以pCAMBIA1304+-orca3为基础,利用BglII/BstEII对表达载体pCAMBIA1304+-orca3和pGEMT-g10h载体进行双酶切,连接形成pCAMBIA1304+-orca3-g10h重组载体(g10h基因替换pCAMBIA1304+载体上的gfp+gus融合基因)。
1.2.2 发根农杆菌C58C1介导pCAMBIA1304++orca3+g10h转化长春花及阳性克隆检测利用冻融法转化发根农杆菌C58C1感受态细胞,将活化菌液涂布于含抗生素的YEB固体培养基上(50 mg/L Kan和40 mg/L Rif),28 ℃培养1~2 d至菌落大小适中,挑菌落于相同抗性液体培养基中,28 ℃恒温培养至一定质量浓度,对转化的C58C1进行目的基因和pRiA4质粒中的rolB和rolC基因、潮霉素抗性基因hpt基因PCR检测,验证pCAMBIA1304++orca3+g10h重组载体是否导入发根农杆菌(rolB、rolC、hpt、g10h、orca3基因PCR验证引物见表 1)。挑选含重组载体阳性克隆的C58C1发根农杆菌于同抗生素LB培养基,28 ℃,200 r/min过夜培养。离心10 min,弃上清,用含乙酰丁香酮终浓度为100 μmol/L的1/2 MS液体培养基重悬,稀释至原体积的5~20倍,相同培养条件培养至A600值为0.5左右。将长春花无菌苗叶片和外植体剪成适当大小于预培养基中25 ℃暗培养2 d。将导入重组载体的C58C1发根农杆菌菌液与长春花叶片及茎段外植体充分接触,灭菌吸水纸吸干表面菌体,在共培养基(1/2 MS+AS 100 μmol/L)上黑暗培养2 d。随后,将其转移至脱菌培养基(1/2 MS+250 mg/L Cef)中25 ℃光照培养(16 h/8 h)至外植体边缘长出毛状根。剪毛状根于上述培养基中暗培养2周。取毛状根于1/2 MS+250 mg/L Cef培养基中进行脱菌处理(5次继代培养)。最后将毛状根转入1/2 MS培养基中暗培养20 d作为后续分子鉴定、基因表达和定量测定的实验材料。分别提取毛状根DNA,检测各组DNA中rolB、rolC、hpt基因及目的基因orca3,g10h,以此确定是否导入成功。本实验以1/2 MS培养基浸泡的未转基因叶片和茎段外植体为阴性对照,以C58C1+pCAMBIA1304++orca3+g10h工程菌为阳性对照。
|
|
表 1 长春花毛状根PCR检测引物 Table 1 Primers for PCR analysis on hairy roots of C.roseus |
1.2.3 转基因长春花毛状根TIAs生物合成相关基因转录差异
利用Trizol法分别提取各组毛状根总RNA,利用反转录试剂盒(Takara公司,中国)将RNA反转录成cDNA。以非转基因毛状根cDNA为模板,扩增orca3、10个TIAs生物合成相关基因及18S rRNA基因(作为内参基因)(表 2),目的条带回收后测定浓度,并进行梯度稀释。对各组标准稀释液进行RT-qPCR检测,得到各组Ct值,分别将12组浓度和Ct值建立标准曲线。SYBR Premix Ex TaqTM Ⅱ(Takara公司,中国)为荧光染料。PCR反应体系:2×SYBR Green Master Mix 10 μL,F-primer 0.2 μL,R-primer 0.2 μL,ddH2O 4.6 μL,模板5 μL,共计20 μL。反应程序:94 ℃预变性15 min,50轮扩增循环(94 ℃、15 s,55/58 ℃、30 s,72 ℃、30 s,80 ℃、20 s),72 ℃延伸10 min,分别设3组重复。将各组Ct值带入各标准工作曲线,获得各基因初始浓度。各组基因初始浓度与其内参基因初始浓度比值为校正浓度。该校正浓度与非转基因毛状根相应基因校正浓度的比值即为相对转录水平。
|
|
表 2 长春花毛状RT-qPCR检测所用的引物 Table 2 Primers used in RT-qPCR analysis on hairy roots of C. roseus |
1.2.4 长春花毛状根TIAs提取
选择经PCR鉴定为转基因成功长春花毛状根,将其切成5 cm根段于1/2 MS液体培养基25 ℃暗培养30 d。将毛状根表面擦净,称鲜质量,60 ℃烘2 d,记录干质量。研磨后加入95%乙醇(1:5),50 ℃超声破碎30 min,冷却至室温。12 000 r/min,10 min离心吸上清(重复离心),2次上清为长春花毛状根TIAs提取物。
1.2.5 转基因长春花毛状根TIAs量的测定精确称取10.0 mg长春碱、5.0 mg长春新碱和10.0 mg阿吗碱对照品,分别充分溶解于1 mL甲醇中。3组对照品各进行梯度稀释。将各对照品及对照品稀释液进HPLC检测。建立长春碱、长春新碱和阿吗碱标准曲线。各组TIAs提取物分别进行HPLC检测,根据积峰面积和标准曲线得到各组提取物TIAs量。本实验色谱条件[23]:C18反相硅胶柱(Symmetry ShieldTM C18,250 mm×4.6 mm,5μm,Waters公司),乙腈-磷酸缓冲液(25:75)为流动相,220 nm监测波长,体积流量1.0 mL/min。
2 结果与分析 2.1 植物表达载体pCAMBIA1304+-orca3-g10h的构建用含BglⅡ/BstEⅡ和XbaI/SacI酶切位点的引物分别扩增长春花g10h、orca3基因。并利用相同的限制性内切酶分别对pGEM T-g10h和pGEM T-orca3进行双酶切。回收小片段(g10h基因片段为1 499 bp,orca3基因片段为628 bp,图 1),并与重组载体pCAMBIA1304+连接进行植物双元表达载体的构建。
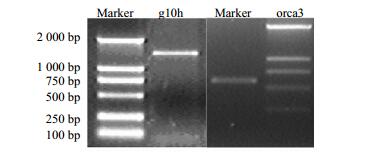
|
图 1 长春花g10h和orca3基因编码区克隆 Fig.1 Gene coding region cloning of g10h and orca3 gene from C. roseus |
2.2 发根农杆菌介导pCAMBIA1304++orca3+g10h转化长春花PCR检测
通过发根农杆菌C58C1介导将pCAMBIA1304++orca3+g10h表达载体导入长春花外植体。转化成功的长春花毛状根含有Ri质粒T-DNA上的rolB和rolC基因和pCAMBIA1304+上hpt基因。因此,通过设计rolB、rolC、hpt基因以及目的基因orca3、g10h引物对各组长春花毛状根进行PCR检测,获得成功导入重组载体的长春花毛状根进行下一步实验。PCR检测结果如图 2和图 3所示(rolB基因为423 bp、rolC基因为622 bp、hpt基因为812 bp)。
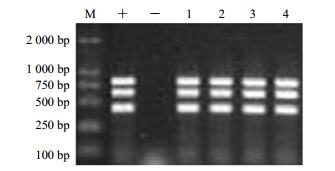
|
M-Marker “+”-阳性对照(C58C1+pCAMBIA1304++orca3+g10h工程菌)“−”-阴性对照(非转基因长春花普通根)1~4为转基因系OG28、OG29、OG30、OG32 M-Marker "+"-represents positive control (correspondant engineered bacteria included vector C58C1 + pCAMBIA1304+ + orca3 + g10h) "−"-represents negative control which was not genetically transformed in C. roseus, 1—4 reprent different transgenic hairy root lines of C. roseus, OG28, OG29, OG30, OG32 图 2 检测C58C1+pCAMBIA1304++orca3+g10h转化长春花毛状根rolB、rolC和hpt基因 Fig.2 Detection of rolB, rolC, and hpt genes in hairy roots of C. roseus induced by C58C1 + pCAMBIA1304+ + orca3 + g10h |
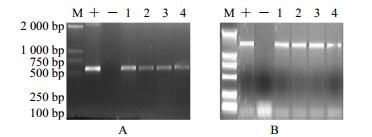
|
A-orca3基因PCR检测B-g10h基因PCR检测M-Marker“+”-阳性对照(C58C1+pCAMBIA1304++orca3+g10h工程菌)“−”-阴性对照(非转基因长春花普通根)1~4-转基因系OG28、OG29、OG30、OG32 A-detection of PCR for orca3 gene B-detection of PCR for g10h gene. M-Marker "+" represents positive control (correspondant engineered bacteria included vector C58C1+pCAMBIA1304++orca3+g10h) "−"-represents negative control which was not genetically transformed in C. roseus 1—4 represent different transgenic hairy root lines of C. roseus, OG28, OG29, OG30, OG32 图 3 长春花转基因毛状根中目的基因orca3 (A)、g10h (B) PCR检测 Fig.3 PCR detection of transgenic hairy root lines of C. roseus for presence of transgenic genes orca3 (A) and g10h (B) |
2.3 共转orca3/g10h长春花毛状根TIAs生物合成相关基因转录差异
利用RT-qPCR研究共转orca3/g10h长春花毛状根中与TIAs生物合成相关基因g10h、asα、dxs、ggpps、str、tdc、cpr、sgd、dat、d4h和转录调控因子orca3基因的转录差异。结果表明(图 4),共转orca3/g10h基因长春花毛状根中与长春花初级代谢有关的基因asα和ggpps基因的转录水平较非转基因高,但相差不大。而与长春花次级代谢相关基因g10h、str、tdc、cpr、sgd和dat的转录差异研究中发现,转基因长春花毛状根中这些基因的转录水平较非转基因有较大的提高。其中,转基因毛状根dat的转录水平较对照组差异最大,是对照组转录水平的22倍。
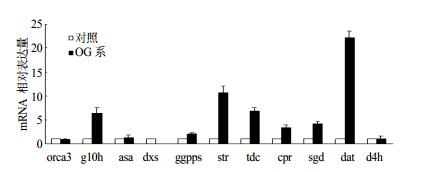
|
图 4 共转orca3/g10h基因长春花毛状根TIAs生物合成相关基因转录差异 Fig.4 Transcriptional differences of genes related to TIAs biosynthesis for covalent orca3/g10h double-gene transgenic hairy root lines (OG lines) and non-transformed roots of C. roseus |
2.4 HPLC检测共转orca3/g10h基因长春花毛状根TIAs量
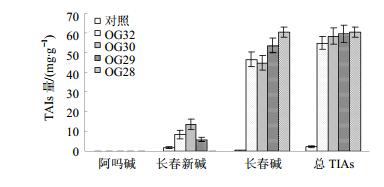
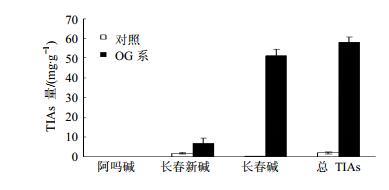
根据长春碱、长春新碱和阿吗碱对照品稀释液质量浓度(X)与其峰面积(Y),建立各组对照品的线性回归方程:Y长春碱=586 912.3 X-1 287.4,r=0.999 93;Y长春新碱=308 665.5 X-1 526.5,r=0.999 94;Y阿吗碱=136 029.4 X-1 553.2,r=0.999 96。将各组待测提取液经HPLC检测,据峰面积与线性回归方程得出转基因毛状根与非转基因普通根长春碱、长春新碱以及阿吗碱量。并对转基因长春花毛状根和非转基因长春花普通根TIAs平均量和TIAs量进行分析。结果表明(图 5和6),相较于非转基因普通根TIAs量,共转orca3/g10h基因的长春花毛状根TIAs量显著提高。其中,长春碱量变化最明显,转基因长春花毛状根中长春碱量为51.30 mg/g,是非转基因普通根的197.3倍。其次是长春新碱的平均量,转基因毛状根为6.93 mg/g,是非转基因普通根的3.8倍。而转基因长春花毛状根和非转普通根中阿吗碱量少且变化不大。总TIAs量为58.23 mg/g,是非转基因普通根的27.5倍。在所有转基因长春花毛状根无性系中,OG28总TIAs量最高,为60.33 mg/g。
|
图 5 共转orca3/g10h基因长春花毛状根TIAs的量 Fig.5 Content of TIAs in covalent orca3/g10h transgenic hairy roots (OG lines) of C. roseus |
|
图 6 共转orca3/g10h基因长春花毛状根TIAs平均量 Fig.6 Average content of TIAs in covalent orca3/g10h double-gene transgenic hairy roots of C. roseus |
3 讨论
长春花中因含较高药用价值的生物碱而受到人们的青睐。但长春花生物碱量并不能满足人们的需求,使得价格相对较高。代谢工程为长春花TIAs的生物合成提供了新思路。本研究首次成功将orca3/g10h基因导入长春花毛状根。通过RT-qPCR研究了转orca3/g10h基因长春花毛状根中TIAs生物合成途径中相关基因的转录差异。研究表明,通过转基因长春花毛状根中相关基因asα、ggpps、g10h、str、tdc、cpr、sgd和dat的转录水平均较非转基因长春花普通根高。Gong等[21]研究表明单转g10h基因长春花毛状根TIAs生物合成途径中ggpps、g10h、str、tdc、sgd和dat的转录水平明显较非转基因长春花普通根高。Van等[24]通过单转orca3基因发现长春花生物碱合成中dxs、asα、tdc、str和d4h基因的转录水平提高,对g10h、sgd和dat的转录无影响。双转orca3/g10h基因长春花毛状根TIAs生物合成中g10h、str、tdc、cpr、sgd和dat基因均比单转orca3和单转g10h的转录水平高。
利用HPLC研究双转orca3/g10h基因长春花毛状根中TIAs量。研究表明共转orca3/g10h基因长春花毛状根TIAs量较非转长春花普通根显著增加。并比龚一富[23]的单转g10h和单转orca3基因的长春花毛状根中TIAs量要高。双转orca3/g10h基因长春花毛状根的TIAs量与基因转录差异有一定联系。ORCA3是长春花中重要的转录调控因子,在代谢过程中,不管是代谢产物或是代谢终产物均会对TIAs生物合成产生反馈抑制作用。只有通过转录调控因子才能够使反应朝着TIAs积累的方向移动。而g10h基因是TIAs中重要的限速酶基因。根据van der Fits等[24]的研究发现orca3并不会提高g10h的转录水平,因此TIAs的量也没有提高。本研究通过双转orca3/g10h基因于长春花毛状根中,实现了TIAs生物合成途径中相关基因的显著表达,TIAs量也有较明显的提高。这可能有2个原因引起的。一方面orca3基因打破了TIAs生物合成中的反馈抑制,对通路进行了全局调控;另一方面,更能够体现g10h基因是长春花生物碱合成途径中的关键限制酶,通过转入g10h基因,整条长春花生物碱合成途径由此打通,从而使TIAs的量不断升高。本研究结果表明共转orca3/g10h基因能够有效提高长春花毛状根中TIAs量。
| [1] | O'Connor S E, Maresh J J. Chemistry and biology of monoterpene indole alkaloid biosynthesis[J]. Natl Prod Rep , 2006, 23 (42) :532–547. |
| [2] | 向蓓蓓, 朱晔荣, 王文娟, 等. 盐胁迫对长春花愈伤组织生长及阿玛碱积累的影响[J]. 中草药 , 2011, 42 (1) :167–170. |
| [3] | 卢懿, 候世详, 陈彤. 长春花抗癌成分长春新碱研究的进展[J]. 中国中药杂志 , 2003, 28 (11) :1006–1009. |
| [4] | 龚一富, 王何瑜, 卢鹏, 等. 长春花毛状根再生植株的获得及抗癌生物碱的产生[J]. 中草药 , 2012, 43 (4) :788–794. |
| [5] | De Carolis E, De Luca V. Purification, characterization, and kinetic analysis of a 2-oxoglutarate-dependent deoxygenate involved in vindoline biosynthesis from Catharanthus roseus[J]. J Biol Chem , 1993, 268 (8) :5504–5551. |
| [6] | Blom T J M, Sierra M I, Van Vliet T B, et al. Uptake and accumulation of ajmalicine into isolated vacules of cultures cells of Catharanthus roseus(L.) G. Don and its conversion into serpentine[J]. Planta , 1991, 183 (3) :170–177. |
| [7] | Sprenger G A, Schörken U, Wiegert T, et al. Identification of a thiamin-dependent synthase in Escherichia coli required for the formation of the1-deoxy-D-xylulose 5-phosphate precursor to isoprenoids, thiamin, andpyridoxol[J]. Proc Natl Acad Sci , 1997, 94 (24) :12857–12862. DOI:10.1073/pnas.94.24.12857 |
| [8] | Meijer A H, De Wall A, Verpoorte R, et al. Purification of the cytochrome P-450 enzyme geraniol-10-hydroxylase from cell cultures of Catharanthus roseus[J]. J Chromatogr , 1993, 653 (2) :237–249. |
| [9] | Poulsen C, Bongaerts R J, Verpoorte R. Purification and characterization of anthranilate synthase from Catharanthus roseus[J]. Eur J Biochem , 1993, 212 (2) :431–440. DOI:10.1111/ejb.1993.212.issue-2 |
| [10] | Meijer A H, Verpoorte R, Hoge J H C. Regulation of enzymes and genes involved in terpenoid indole alkaloid biosynthesis in Catharanthus roseus[J]. J Plant Res , 1993, 3 :145–164. |
| [11] | 卢衍, 常凯, 郑月, 等. 长春花萜类吲哚生物碱的分子生物学与代谢工程研究[J]. 安徽农业科学 , 2012, 40 (16) :8793–8796. |
| [12] | Hedhili S, Courdavault V, Giglioli G H N, et al. Regulation of The terpene moiety biosynthesis of Catharanthus roseus terpene indole alkaloids[J]. Phytochem Rev , 2007, 6 (2/3) :341–351. |
| [13] | 章津, 赵淑娟, 胡之璧. 长春花吲哚萜类生物碱代谢途径研究进展[J]. 药物生物技术 , 2012, 19 (3) :278–282. |
| [14] | 何际婵, 董志超, 王建荣, 等. 土壤条件对长春花生物碱含量的影响[J]. 中华中医药学刊 , 2012, 30 (11) :2412–2413. |
| [15] | 郭晓瑞, 陈琪, 段喜华. 外源钾水平对长春花生长和生物碱积累的影响[J]. 植物研究 , 2013, 33 (6) :718–722. |
| [16] | 佟璐, 张宝友, 唐中华, 等. 弱光胁迫对大田长春花生物量分配及次生代谢的影响[J]. 植物研究 , 2011, 31 (2) :227–230. |
| [17] | Zhou P, Yang J, Zhu J, et al. Effect of β-cyclodextrin and methyl jasmonate on the production of vindoline, catharanthine, and ajmalicine in Catharanthus roseus cambial meristematic cell cultures[J]. Appl Microbiol Biotechnol , 2015, 99 (17) :7035–7045. DOI:10.1007/s00253-015-6651-9 |
| [18] | 赵恒伟, 葛锋, 孙颖, 等. 植物萜类物质生物合成的相关转录因子及其应用前景[J]. 中草药 , 2012, 43 (12) :2512–2519. |
| [19] | Whitmer S, Canel C, Hallard D, et al. Influence of precursor availability on alkaloid accumulation by transgenic cell line of Catharanthus roseus[J]. Plant Physiol , 1998, 116 (2) :853–857. DOI:10.1104/pp.116.2.853 |
| [20] | Collu G, Garcia A A, van der Heijden R, et al. Activity of the cytochrome P450 enzyme geraniol 10-hydroxylase and alkaloid production in plant cell cultures[J]. Plant Sci , 2002, 162 (1) :165–172. DOI:10.1016/S0168-9452(01)00554-4 |
| [21] | Gong Y F, Liao Z H, Pi Y, et al. Engineering terpenoid indole alkaloids biosynthetic pathway in Catharanthus roseus hairy root cultures by overexpressing the geraniol 10-hydroxylase gene[J]. J Shanghai Jiao Tong Univ , 2005, 10 (S1) :8–13. |
| [22] | Peebles C A M, Hughes E H, Shanks J V, et al. Transcriptional response of the terpenoid indole alkaloid pathway to the overexpression of ORCA3 along with jasmonic acid elicitation of Catharanthus roseus hairy roots over time[J]. Metab Eng , 2009, 11 (2) :76–86. DOI:10.1016/j.ymben.2008.09.002 |
| [23] | 龚一富.长春花萜类吲哚生物碱代谢工程[D].上海:上海交通大学, 2005. http://www.oalib.com/references/16960717 |
| [24] | van der Fits L, Memelink J. ORCA3, a jasmonate-responsive transcriptional regulator of plant primary and secondary metabolism[J]. Science , 2000, 289 :295–297. DOI:10.1126/science.289.5477.295 |
 2016, Vol. 47
2016, Vol. 47


