丹参为唇形科鼠尾草属植物丹参Salvia miltrorrhiza Bge.的干燥根及根茎,主要产于山东、陕西、河南等地,其主要用于脑卒中、冠心病等心脑血管疾病的治疗[1]。丹参有效成分有2类,以丹酚酸B为代表的丹参总酚酸类成分以及以丹参酮ⅡA为代表的丹参酮类成分[2-3]。现代研究表明,2类成分均是丹参活血化瘀、通脉疏络、安神宁心功效的物质基础,尤其是在丹参活血化瘀效应方面2类成分均发挥了重要作用[4]。因此,丹参在临床上已经被开发为50多种制剂。然而,由于2类成分化学性质的差异,大部分丹参制剂仅仅用了其中一个有效部位,而只有很少的制剂同时用了丹参的水溶性和脂溶性有效部位[5]。此外,丹参酮类成分很难溶于水,但是丹参的临床用法以水煎剂为主,造成了丹参酮类成分的利用率低和丹参药材浪费严重等问题[6]。这2类主要有效部位在丹参中是否具有协同作用,以及其协同程度如何却不得而知。
本实验在课题组前期研究基础上,选择丹参提取物(DT)、丹参总酚酸提取物(DF)、丹参总酮提取物(DST)、丹参总酚酸合用丹参总酮提取物(DF+DST)为研究对象,观察丹参不同部位配伍不同剂量对急性血瘀模型大鼠的血液流变学、凝血功能及血小板聚集的影响。采用主成分分析(PCA)联合多指标综合指数法对丹参不同部位配伍总的活血化瘀效应进行综合比较分析,以期通过动物体内实验,探讨丹参总酚酸和丹参总酮合用在活血化瘀功效方面是否会产生协同增效作用,为更好地利用丹参资源提供依据。对丹参有效部位的合理利用决策提供科学依据。
1 材料 1.1 动物SPF级健康SD大鼠,体质量230~250 g,雌性,购于上海杰思捷实验动物有限公司,合格证号为SCKY(沪)2013-0002。大鼠购入后检疫与驯化1周,使其适应环境并剔除体质差异较大的动物,实验期间动物自由进食、饮水,昼夜节律正常。
1.2 药品与试剂复方丹参滴丸(天士力制药集团股份有限公司,批号141227);阿司匹林肠溶片(拜耳医药保健有限公司,批号BJ24257);盐酸肾上腺素注射液(上海禾丰制药有限公司,批号150609);一次性使用人体静脉血样采集容器(3.2%枸橼酸钠抗凝,江苏康洁医疗器械有限公司,批号20151105);水合氯醛(国药集团试剂有限公司,批号20151021)。对照品丹参素(批号110875-201309)、丹酚酸A(批号110438-201406)、丹酚酸B(批号110562-201404),购自中国食品药品检定研究院;对照品原儿茶醛(批号150623)、迷迭香酸(批号141012)、紫草酸(批号140609)、隐丹参酮(批号131104),二氢丹参酮Ⅰ(批号150114)、丹参酮Ⅰ(批号140812)、丹参酮ⅡA(批号131226),购自成都克洛玛生物科技有限公司,以上对照品质量分数均大于98%。活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、血浆纤维蛋白原(FIB)试剂盒,均购自北京世帝科学仪器公司。
1.3 仪器LG-R-80-B电脑血液黏度测试仪、LG-PABER-1型血小板聚集凝血因子分析仪(北京世帝科学仪器公司);Anke LXJ-ⅡB离心机、Anke TDL-40B离心机(上海安亭科学仪器厂);BT125D电子分析天平(Sartorius,德国)。
1.4 药材丹参(产地陕西商洛,批号150625)药材、DST(浸膏得率0.018 g/g,批号150718)均购自西安连辰进出口有限公司,经南京中医药大学中药鉴定学教研室副教授严辉鉴定,符合《中国药典》2015年版项下标准。
2 方法 2.1 丹参有效部位的制备称取丹参药材4 kg,均分成2份,每份2 kg。2份药材分别用8倍量水、50%乙醇热回流提取1.5 h,自然冷却后,倾出药液,再分别加入6倍量水、50%乙醇进行2次热回流提取各1 h,分别合并3次滤液,得到相应的丹参总酚酸的粗提取液和丹参提取液。将丹参总酚酸的粗提液于60 ℃减压浓缩至相对密度为1.18~1.22的清膏,放冷,加乙醇使含醇量为70%,静置12 h,取上清液,减压回收乙醇,干燥,即得丹参总酚酸提取液[7]。分别将总酚酸提取液和丹参提取液于60 ℃减压浓缩至稠浸膏,将稠浸膏干燥至粉末,得到丹参总酚酸提取物(DF)和丹参提取物(DT)的粉末状样品。其中,DT、DF的得率(浸膏/生药)依次为0.42、0.26 g/g。
2.2.1 色谱条件色谱柱为Thermo Scientific Hypersil GOLD(100 mm×3 mm,1.9 μm);流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱:0~1 min,8% B;1~3 min,8%~16% B;3~4 min,16%~19% B;4~9 min,19% B;9~10 min,19%~22% B;10~12.5 min,22%~25% B;12.5~16.5 min,25%~70% B;16.5~18 min,70%~80% B;18~20 min,80% B;体积流量为0.4 mL/min;检测波长为280 nm;柱温为35 ℃;进样量为5 μL。
2.2.2 混合对照品溶液的制备精密称取各对照品适量,加90%甲醇制成含丹参素40.18 μg/mL、原儿茶醛23.16 μg/mL、迷迭香酸46.54 μg/mL、紫草酸33.28 μg/mL、丹酚酸B 324.82 μg/mL、丹酚酸A 52.28 μg/mL、二氢丹参酮Ⅰ 20.66 μg/mL、隐丹参酮24.21 μg/mL、丹参酮Ⅰ 38.53 μg/mL、丹参酮ⅡA 48.75 μg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备分别取DT、DF、DST的细粉约1 g,精密称定,置100 mL量瓶中,用90%甲醇稀释至刻度,超声5 min后,充分摇匀,即得。经0.22 μm微孔滤膜滤过,取续滤液备用。
2.2.4 样品分析DT、DF、DST的UPLC图谱见图 1。由图 1可知,DT同时含有丹酚酸和丹参酮类成分;DF仅含有丹酚酸类成分;DST仅含有丹参酮类成分。DT中丹参素、原儿茶醛、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A、二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的质量分数依次为1.02、0.023、2.23、3.48、56.08、1.49、0.39、1.22、0.26、1.69 mg/g;DF中丹参素、原儿茶醛、迷迭香酸、紫草酸、丹酚酸B和丹酚酸A的质量分数依次为0.96、0.012、2.57、3.02、43.86、1.28 mg/g;DST中二氢丹参酮Ⅰ、隐丹参酮、丹参酮Ⅰ和丹参酮ⅡA的质量分数依次为0.46、1.62、0.19、1.37 mg/g。
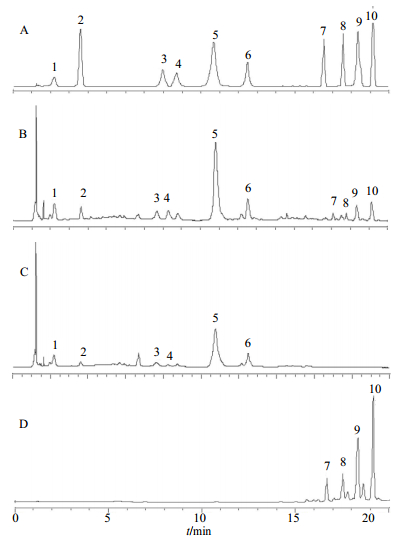
|
1-丹参素2-原儿茶醛3-迷迭香酸4-紫草酸5-丹酚酸B 6-丹酚酸A 7-二氢丹参酮Ⅰ 8-隐丹参酮9-丹参酮Ⅰ 10-丹参酮ⅡA 1-danshensu 2-protocatechualdehyde 3-rosmarinic acid 4-lithospermic acid 5-salvianolic acid B 6-salvianolic acid A 7-1, 2-dihydro-tanshinquinone 8-cryptotanshinone 9-tanshinones Ⅰ 10-tanshinones ⅡA 图 1 混合对照品(A)、DT (B)、DF (C)和DST (D)的UPLC色谱图 Fig.1 UPLC of reference substances (A), DT (B), DF (C), and DST (D) |
2.3 丹参有效部位活血化瘀作用研究 2.3.1 动物分组及给药
大鼠适应性喂养1周后,按体质量将128只大鼠随机分为16组,每组8只,分别为对照组、模型组、阳性对照复方丹参滴丸(DSDW)组,阳性对照阿司匹林(ASPL)组和丹参不同有效部位不同剂量给药组(分别为DT、DF、DST、DF+DST组,各设低、中、高3个剂量)。阳性药组大鼠分别ig给予复方丹参滴丸和阿司匹林,每次剂量为0.10 g/kg;对照组、模型组大鼠ig给予等体积生理盐水;丹参不同有效部位低、中、高剂量分别按照丹参临床用量(丹参的人临床常用量为15 g)1、2、5倍量设定,即分别为生药量1.35、2.70、6.75 g/kg。丹参不同有效部位提取物皆用0.5%羧甲基纤维素钠混悬,其中,DF和DST的配伍比例为两者的得膏率之比,DF和DST提取物的得膏率的比值为14.01。丹参不同有效部位的低、中、高剂量分别为0.57、1.14、1.71 g/kg(提取物剂量)。所有给药组大鼠统一ig给药每次10 mL/kg,每日早晚各1次,共7次,于第5次给药后除对照组外,其余各组大鼠均按照相应的造模方法复制急性血瘀模型,于第7次给药后30 min腹主动脉取血,测定血液流变学和凝血功能相关指标。
2.3.2 急性血瘀大鼠模型的制备除对照组外,其余各组大鼠sc盐酸肾上腺素注射液0.8 mg/kg,共2次,间隔时间为4 h。第1次sc给予盐酸肾上腺素后2 h,将大鼠置于0~2 ℃的冰水中游泳4 min,造成大鼠急性血瘀模型。第2次sc盐酸肾上腺素后大鼠禁食不禁水饲养,12 h后腹主动脉采血测血液流变学和凝血功能相关指标[10]。
2.3.3 血液流变学和凝血功能指标检测各组大鼠均于末次给药30 min后,在10%水合氯醛麻醉下,腹主动脉插管取血,吸取1 mL全血置于压积管中静置1 h读数记录血沉(ESR),然后3 000 r/min离心30 min,读数记录红细胞压积(HCT)。使用LG-R-80 B电脑血液黏度测定仪测定全血黏度(WBV),测好WBV的全血,800 r/min离心10 min吸取富血小板血浆(PRP),采用LG-PABER-1型血小板聚集凝血因子分析仪测定血小板聚集率(ADP)。然后3 000 r/min离心10 min吸取贫血小板血浆(PPP),使用LG-R-80 B电脑血液黏度测定仪测定血浆黏度(PV),LG-PABER-1型血小板聚集凝血因子分析仪测定凝血功能相关指标(APTT、PT、TT、FIB),血浆TT、PT、APTT和FIB的测定按照相应试剂盒说明书进行。
2.4 数据统计分析实验数据采用SPSS 16.0软件中的Descriptives进行统计,实验结果采用x±s表示;与模型组比较采用ANOVA中的Dunnett法进行组间两两比较。
2.5 效应整合依据多指标综合指数法,对WBV、PV、ESR、FIB、HCT、TT、PT、APTT、ADP多个指标进行单一化处理,计算各给药组的总活血效应值。首先对各指标数据进行标化,当模型组的相应指标数值(value,V)与对照组相比升高时,V标化=(V模型-V给药)/V模型;当模型组的相应指标V与对照组相比降低时,V标化=(V给药-V模型)/V模型。标化指标的权重首先依据这些指标在临床中的重要性,查阅5年来急性血瘀相关文献150余篇,其中126篇检测了WBV,123篇检测了PV,118篇检测了HCT,108篇检测了FIB,61篇检测了APTT,59篇检测了PT,48篇检测了ADP,44篇检测了TT。结合同行专家对各指标在活血化瘀效应整体评价中的相对程度打分,最后再结合直观的变量重要性投影值(variable importance in the projection,VIP)处理结果综合给出各指标的权重系数,总活血效应值即为各指标标化值乘以权重的加和值[11-13]。各个指标VIP值的计算是将各组大鼠的所有指标导入MassLynx v4.1(Waters公司)软件的EZ info中,采用PCA中的Pareto进行规格化处理得到各组活血化瘀效应的得分图。然后采用软件中的偏最小二乘(PLS)法分析得到各个指标的VIP值,依据VIP值的大小判断各个指标对分类的重要程度,一般VIP>1的指标认为其对分类的贡献比较大[14]。最终本研究取权重系数分别为WBV、PV和HCT取权重系数为3,FIB取权重系数为2,APTT、PT、TT、ADP、ESR取权重系数为1。综合PCA法的得分图和多指标综合指数法中的总活血化瘀效应值综合评价丹参不同有效部位的活血化瘀功效。
3 结果 3.1 丹参不同有效部位对急性血瘀大鼠血液黏度的影响与对照组比较,模型组大鼠的WBV和PV均显著升高,差异显著(P<0.01)。与模型组比较,各给药组的WBV和PV均有一定程度的降低。对于WBV,丹参不同有效部位的低剂量组中,除了DT、DST组在切变率为5 s-1和30 s-1时的WBV没有显著性差异,以及DST、DF+DST组在切变率为1 s-1黏度时没有显著性差异外,其他各低剂量组均有性显著差异(P<0.01);丹参不同有效部位的中、高剂量组中,除了DST中剂量组在切变率为5 s-1时的WBV没有显著性差异外,其他部位的中、高剂量组的WBV差异均显著(P<0.01)。对于PV,除了DT、DST低剂量组外,其他给药组差异均有统计学差异(P<0.01)。结果见表 1。
|
|
表 1 丹参不同有效部位对急性血瘀大鼠WBV和PV的影响(x±s, n=8) Table 1 Effect of different effective parts of S. miltiorrhiza on whole blood viscosity and plasma viscosity of acute blood stasis rats (x±s, n=8) |
3.2 丹参不同有效部位对急性血瘀大鼠ESR和HCT的影响
与对照组比较,模型组大鼠ESR、HCT均显著升高,差异显著(P<0.01)。与模型组比较,各给药组大鼠的ESR和HCT均有一定程度的降低。对于ESR,除了DT、DF、DF+DST的低剂量组外,其他各给药组的ESR均明显降低(P<0.05、0.01)。对于HCT,DST低剂量组的HCT明显降低(P<0.01);DST、DF+DST中剂量组的HCT明显降低(P<0.01);各给药高剂量组的HCT均明显降低(P<0.05、0.01)。结果见表 2。
|
|
表 2 丹参不同有效部位对急性血瘀大鼠ESR、HCT和凝血功能相关指标的影响(x±s, n=8) Table 2 Effect of different effective parts of S. miltiorrhiza on ESR, HCT, coagulation, and platelet aggregation index changes of acute blood stasis rats (x±s, n=8) |
3.3 丹参不同有效部位对急性血瘀大鼠凝血功能的影响
与对照组比较,模型组的凝血4项(TT、PT、APTT、FIB)和血小板聚集率(ADP)均有显著性差异(P<0.01),其中TT、PT、APTT均明显降低,FIB和ADP量显著升高。与模型组比较,各丹参不同有效部位低剂量组TT较模型组均无明显变化;DST、DF+DST低剂量组的PT和APTT较模型组均显著升高(P<0.01);FIB的量仅在DF+DST低剂量组明显降低(P<0.01);DF、DF+DST低剂量组的ADP较模型组明显降低(P<0.05、0.01)。在各丹参不同有效部位中剂量组中,PT和APTT均显著升高,FIB的量明显降低(P<0.01);另外,DF、DF+DST中剂量组的TT与模型组差异显著(P<0.05);除了DT中剂量组外,其他各丹参不同有效部位中剂量组的ADP较模型组均显著下降(P<0.01)。丹参不同有效部位高剂量组的凝血4项和ADP均有显著性差异(P<0.05、0.01)。结果见表 2。
3.4 基于PCA法的丹参不同有效部位配比的活血化瘀效应评价将所有指标的源数据导入MassLynx v4.1(Waters公司)软件的EZ info中进行PCA,通过降维建立包含第1个主成分(t[1])与第2个主成分(t[2])二维空间的PCA分类模型(图 2)。第1个主成分轴是原始数据矩阵方差最大方向,第2个主成分轴式方差次大方向,降维时最大限度保留有用信息,寻找能够使不同种类样品得到最大分离的方向。从图 2中可以看出,对照组中心大约是(4.5,-2.5),模型组中心大约是(-5.5,-1.0),DSDW组中心大约是(1.5,-1.5),ASPL组中心大约是(2.0,-1.8),DT、DF、DST、DF+DST低剂量组中心依次大约是(-4.5,-0.25)、(-3.5,-0.75)、(-3.6,-0.5)、(-2.5,0.5);DT、DF、DST、DF+DST中剂量中心依次大约是(-1.0,0.25)、(0.5,0.2)、(-0.25,1.0)、(1.0,2.0);DT、DF、DST、DF+DST高剂量组中心依次大约是(1.2,0.2)、(2.5,0.3)、(3.3,1.5)、(4.0,0.8)。丹参不同有效部位高剂量组的中心离对照组最近,说明高剂量组的活血化瘀效应较好,其中,DT高剂量组的中心离对照组最近,表示该组对急性血瘀大鼠的改善作用最好;丹参不同有效部位的中剂量组介于对照组和模型组的中心,表明它们对急性血瘀大鼠的改善作用弱于高剂量组;丹参不同有效部位低剂量组的中心离模型组最近,表示它们对急性血瘀大鼠的改善作用较弱。整体而言,在实验的剂量范围内,丹参不同有效部位随着剂量的增加,其活血化瘀疗效也相应的增强,呈现一定的量效关系。
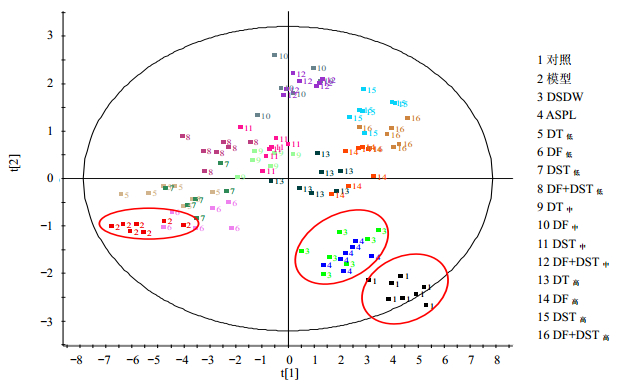
|
图 2 丹参不同有效部位对血瘀指标的PCA图 Fig.2 PCA score plot of blood-stasis indexes after administration of compatibility of effective parts of Salvia miltiorrhiza |
3.5 基于多指标综合指数法的丹参不同部位配伍的活血化瘀效应整合
首先将各组大鼠所有指标的源数据导入MassLynx v4.1(Waters公司)软件的EZ info中,采用PLS法分析得到各个指标的VIP值(图 3),VIP值越大,说明在本实验中该指标对分类的贡献越大[11]。如图 3显示,PT、WBV(1 s-1)、HCT、ADP、FIB、TT、WBV(200 s-1)、WBV(5 s-1)和PV的VIP值均大于1,APTT、ESR和WBV(30 s-1)的VIP值较小。采用本课题组前期的多指标综合指数法对各指标进行归一化处理,得到各组的总活血化瘀效应值(表 3),进而得到丹参不同有效部位的总活血效应值,大小顺序依次为DF+DST高>DST高>DF高>DT高>DF+DST中>DF中>DST中>DT中>DF+DST低>DF低>DST低>DT低,说明DF+DST高给药组的总活血效应值最好。这些研究表明,丹参不同有效部位在相同剂量下,DF+DST给药组的总活血效应皆优于其他组,而DT给药组的总活血效应最差;相同的丹参提取物在实验剂量范围内,随着剂量的增加,各组的活血作用均有所加强,呈现一定的量效关系。这体现了丹参总酚酸与丹参总酮配伍后有协同增强活血效应的功效,并呈相应的量效关系。
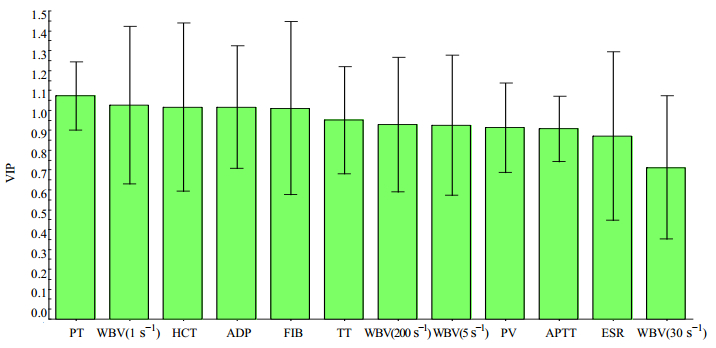
|
图 3 血瘀指标的VIP图 Fig.3 VIP plot of blood-stasis indexes |
|
|
表 3 丹参不同有效部位对血瘀大鼠的总活血化瘀效应值 Table 3 Total effect of diffenent effective parts of S. miltiorchiza on activating blood circulation and dissipating stasis |
3.6 结合PCA法和多指标综合指数法综合评价丹参不同有效部位活血效应
综合PCA法和多指标综合指数法中的总活血化瘀效应结果可知,DF+DST高剂量组的总活血化瘀效应最好,2种分析方法所得结果相一致。这可能与两者合用,共同增加丹参总酚酸的抗氧化和丹参总酮的抗血小板聚集而产生协同增效作用有关。
4 讨论根据中医的论述,血瘀证主要由七情中的“忧怒”和六淫中的“寒邪”为病因导致血液的流动性和黏度变化而引发的,故血瘀模型与“忧怒”和“寒邪”等病因紧密相连。通过给大鼠sc大量的肾上腺素模拟暴怒时机体状态,以冰水浸泡模拟寒邪侵入,两者综合以建立寒凝气滞血瘀模型,并以复方丹参滴丸和阿司匹林作为活血药物的阳性对照,对模型进行了有效性验证。为了综合反映丹参不同有效部位的活血化瘀药效,本实验选择了血液流变学(WBV和PV)、凝血功能(TT、PT、APTT和FIB)、HCT、ESR、与ADP多个效应指标来综合评价其药效。然而由于药物对各指标的反应灵敏度往往不一致,需要将各指标统一计量单位,进行标化,形成整合效应以对药物的终末药效有一个整体的、直观的认识。
多指标综合指数法是将多个不同类别、不同性质、不同计量单位的指标标准化,最后转化成一个无量纲的相对评价值,能反映事物相对水平和整体变动的一种综合评价方法[15]。PCA是把多指标转化为少数几个综合指标(即主成分),其中每个主成分都能够反映原始变量的大部分信息,且所含信息互不重复。这种方法在引进多方面变量的同时将复杂因素归结为几个主成分,使问题简单化,同时得到的结果更加科学有效的数据信息,有助于保证客观地反映样本间的现实关系[12, 16]。对于权重系数的选择,本实验将专家评分法结合相关效应指标在文献中出现的频次来综合确定,在一定程度上弥补了专家评分法的不足,使权重系数的确定趋于科学、合理。此外,由于PLS可以有效解决中药物质效应具有高维变量和变量之间关系复杂的问题,本实验采用了PLS-DA中的VIP对血液流变学和凝血功能指标进行了评分,从而全面地验证上述权重系数的科学性与合理性[17-18]。
通过结合多指标综合指数法和PCA对急性血瘀大鼠的血液流变学和凝血功能指标进行整合。结果显示,复方丹参滴丸与对照组的PCA聚类图最为接近,预示三七与丹参配伍更有利于模型趋向正常。有研究表明,丹参抗凝血成分的物质基础主要是丹参酚酸类成分,而三七皂苷类成分是三七抗血小板聚集作用的物质基础[19]。丹参与三七配伍给药后,三七皂苷类成分能够使丹酚酸类成分保持更高的血药浓度;同时丹参中的丹参酮类成分也可提高三七皂苷的膜渗透性和脂溶性,增强口服吸收率[20]。复方丹参滴丸具有较好的活血化瘀药效可能与两者配伍后在抗血小板聚集、抗心肌缺血和血管内皮细胞的保护作用等方面产生协同增效的作用有关[21-22]。
此外,丹参不同有效部位皆能改善血瘀大鼠的血液流变学和凝血功能异常,其中,DF+DST高剂量组对血瘀大鼠的总活血化瘀效应最好。剂量相同的情况下,DF+DST的活血化瘀作用优于DT、DF、DST或有优于两者单用的趋势,这可能与两者配伍使用,同时发挥了丹参总酚酸抗氧化能力强与丹参总酮的抗血小板聚集作用显著的药效相关,其有效部位配伍使用的潜在机制有待进一步研究。给药相同的情况下,在实验的剂量范围内,随着实验剂量的增加,各给药组的活血化瘀疗效明显增强,呈现一定的量效关系。本研究采用多指标综合指数法和PCA用于丹参有效部位配伍后活血化瘀效应相互作用研究,为丹参有效部位在临床上的合理运用提供了理论支撑,为丹参相关新药的开发利用提供了基础,也为中药有效部位配伍相互作用研究提供思路与方法。
| [1] | Su C Y, Ming Q L, Rahman K, et al. Salvia miltiorrhiza:Traditional medicinal uses, chemistry, and pharmacology[J]. Chin J Nat Med , 2015, 13 (3) :163–182. |
| [2] | 陈磊, 陆茵, 郑仕中, 等. 丹参药理活性成分的整合效应[J]. 中草药 , 2009, 40 (3) :476–479. |
| [3] | 朱海林, 张大伟, 孙隆儒, 等. 白花丹参总酚酸提取物对大鼠血栓闭塞性脉管炎的影响[J]. 中草药 , 2012, 43 (8) :1565–1569. |
| [4] | 王冰瑶, 吴晓燕, 樊官伟. 丹参素保护心血管系统的药理作用机制研究进展[J]. 中草药 , 2014, 45 (17) :2571–2575. |
| [5] | 陈峰, 李泽友, 刘明生. 丹参制剂的研究进展[J]. 中国药房 , 2006, 17 (21) :1675–1677. |
| [6] | Pang H Q, Wu L, Tang Y P, et al. Chemical analysis of the herbal medicine Salviae miltiorrhizae Radix et Rhizoma(Danshen)[J]. Molecules , 2016 . DOI:10.3390/molecules21010051 |
| [7] | 中国药典[S].一部. 2015. |
| [8] | 赵洪芝, 王静, 姜民, 等. 丹参总酚酸提取物UPLC指纹图谱及成分定性研究[J]. 药物分析杂志 , 2012, 32 (4) :620–622. |
| [9] | 李耿, 孟繁蕴, 杨洪军, 等. UPLC法同时测定丹参中11种成分的含量[J]. 中国药房 , 2014, 25 (19) :1766–1768. |
| [10] | 李伟霞, 黄美艳, 唐于平, 等. 大鼠急性血瘀模型造模方法的研究与评价[J]. 中国药理学通报 , 2011, 27 (12) :1761–1765. |
| [11] | 李伟霞, 唐于平, 郭建民, 等. 比较评价当归川芎配伍对急性血瘀大鼠血液流变学及凝血功能的影响[J]. 中国中西医结合杂志 , 2012, 32 (6) :806–811. |
| [12] | 李淑娇, 李伟霞, 唐于平, 等. 基于主成分分析和多指标综合指数法的当归-红花不同配比活血化瘀作用比较[J]. 药学学报 , 2014, 49 (9) :1304–1309. |
| [13] | 李伟霞, 唐于平, 尚尔鑫, 等. 基于人工神经网络的当归-川芎药对整体功效与化学物质关联性分析[J]. 中国中药杂志 , 2012, 33 (19) :2935–2942. |
| [14] | 李伟霞, 黄美艳, 唐于平, 等. 基于代谢组学研究佛手散对血虚小鼠的养血补血作用机制[J]. 药学学报 , 2013, 48 (8) :1301–1306. |
| [15] | 马瑞娟, 苗明三. 一种中药药效的多指标评价新方法-综合权重法[J]. 中药新药与临床药理 , 2011, 22 (5) :569–572. |
| [16] | 杜焰, 冯怡, 徐德生, 等. 基于主成分分析的中药粉体流动性表征研究[J]. 中成药 , 2012, 34 (7) :1258–1263. |
| [17] | 徐培平, 张奉学, 符林春, 等. 基于均匀设计-偏最小二乘回归建模的中药复方配伍规律研究方法[J]. 中草药 , 2011, 42 (4) :819–824. |
| [18] | 蒋海强, 聂磊, 周洪雷, 等. 基于偏最小二乘回归分析的钩藤总碱和莱菔子总碱组分配伍优化研究[J]. 中草药 , 2013, 44 (18) :2351–2536. |
| [19] | 郑琴, 彭常春, 沈美兰, 等. 丹参和三七的配伍研究概况[J]. 中国实验方剂学杂志 , 2009, 15 (2) :83–86. |
| [20] | 牧磊, 陈钢, 张晓. 丹参三七有效组分及其复方的药代动力学研究进展[J]. 中成药 , 2011, 33 (7) :1209–1213. |
| [21] | 商洪才, 张伯礼, 高秀梅, 等. 丹参三七药对不同配比药效学比较研究[J]. 辽宁中医杂志 , 2002, 29 (5) :297–299. |
| [22] | 龚婉, 肖扬, 张萌, 等. 丹参总酚酸及三七总皂苷配伍对缺氧复氧损伤心肌细胞的保护作用研究[J]. 中国中药杂志 , 2013, 38 (7) :1046–1051. |
 2016, Vol. 47
2016, Vol. 47


