2. 山西中医学院中药学院, 山西 太原 030024 ;
3. 中国药科大学 中药评价与转化重点实验室, 江苏 南京 210039
2. College of Chinese Materia Medica, Shanxi University of Traditional Chinese Medicine, Taiyuan 030024, China ;
3. Jiangsu Provincial Key Laboratory for TCM Evaluation and Translation, China Pharmaceutical University, Nanjing 210039, China
酸枣叶Ziziphi Spinosae Folium是鼠李科(Rhamnaceae)植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Huex H.F.Chou的干燥叶子。我国民间广泛将其加工成茶叶,具有利尿、促进胆酸合成、消炎等多种保健功能,且用酸枣叶泡水代茶饮有一定镇静作用[1-2]。酸枣叶中含有丰富的黄酮类和三萜酸类等药用成分[3-4]。酸枣在山西省属于分布广泛并具有明显资源储量优势的野生植物。本课题组前期收集和测定了8个不同地区5~10月间酸枣叶中总黄酮和芦丁的量,其质量分数分别高达8%和3%左右[5-6]。黄酮类化合物具有抗氧化、抗衰老、抗肿瘤等广泛的生物活性,尤其是此类化合物具有较多的酚羟基基团,在抗氧化方面表现出显著的作用。
目前,国内对酸枣叶的研究多集中在酸枣叶茶的加工技术研究方面。对酸枣叶的化学成分及药理研究的文献报道较少。尽管酸枣叶中黄酮类成分结构类型已有报道,但是如何快速简便地阐明酸枣叶中抗氧化活性成分是深入开发酸枣叶的前提。余伯阳教授课题组率先在国内开展了“谱效整合指纹图谱”的研究,建立了高效液相色谱-化学发光(HPLC-CL)在线检测清除超氧阴离子和过氧化氢等技术,并已应用于山楂叶、丹参、银杏叶和茶叶等抗氧化活性研究[7-8]。本研究利用UHPLC-Q Exactive轨道肼高分辨质谱分析技术鉴定酸枣叶中主要的化学成分,同时采用HPLC-CL联用技术,从清除H2O2和超氧负离子2个角度评价酸枣叶的抗氧化活性,并鉴定其清除H2O2和超氧负离子的主要活性成分,为阐明酸枣叶抗氧化物质基础及作用机制提供科学依据,为将酸枣叶黄酮开发成为新型天然抗氧化剂奠定实验基础。
1 仪器与试药 1.1 仪器Thermo fisher U3000超高效液相色谱仪,配置在线脱气机、四元梯度泵、柱温箱、自动进样器(美国Thermo公司),Thermo Scientific Q Exactive质谱仪,(美国Thermo公司);Shimadzu 2010C系列HPLC(日本岛津公司),包括二元泵,柱温箱,自动进样器,SPD-M20A紫外检测器,数据工作站为LC/MSD Trap Software 4.2 and Data Analysis 2.2。BPCL-1-T-GC微弱发光测量仪,BPCL App1.7.2数据处理工作站(中国科学院北京生物物理研究所),BT-200恒流泵(沪西分析仪器厂,上海);KQ-300E型超声波清洗仪(昆山市超声仪器有限公司);十万分之一天平(梅特勒-托利多仪器有限公司)。
1.2 试药酸枣叶样品实地采集于山西省太谷县(S1)、灵石市(S2)、平定县(S3)、五台县(S4)、晋中市榆次区(S5)、闻喜县(S6)、长治县(S7)、盂县(S8)8个不同产地,经山西中医学院中药鉴定教研室裴香萍副教授鉴定为鼠李科植物酸枣Ziziphus jujuba Mill.var.spinosa(Bunge)Huex H.F.Chou的干燥叶子。对照品芦丁(批号为100080-200707)购自中国食品药品检定研究院。
乙腈为色谱纯(美国Tedia公司),水为娃哈哈纯净水;H2O2、冰醋酸、盐酸、无水碳酸钠、碳酸氢钠(南京化学试剂有限公司);3-氨基邻苯二甲酰肼(鲁米诺,Sigma公司);焦性没食子酸(邻苯三酚)(阿拉丁公司)。其余试剂均为分析纯。
2 方法与结果 2.1 对照品溶液制备取芦丁对照品适量,精密称定,加入甲醇制备成质量浓度为1.030 mg/mL对照品储备液。
2.2 供试品溶液制备称取酸枣叶粉末(过40目筛)约0.5 g,精密称定,置于150 mL具塞锥形瓶中,精密加入70%甲醇溶液50 mL,称定质量,超声提取0.5 h,放至室温,补充质量,滤过,离心(13 000 r/min,10 min),上清液过0.45 μm的有机滤膜备用。
2.3 HPLC-CL分析条件采用Agela Venusil MP C18色谱柱(250 mm×4.6 mm,5 μm),以0.1%磷酸水(A)-乙腈(B)为流动相,梯度洗脱(0~5 min,10% B;5~15 min,10%~20% B;15~25 min,20% B;25~35 min,20%~30% B;35~45 min,30%~45% B;45~60 min,45%~65% B);体积流量1.0 mL/min;检测波长300 nm;柱温30 ℃;H2O2进样量2 μL,超氧负离子进样量10 μL。柱后H2O2和超氧负离子分别通过双通道恒流泵以1.2 mL/min输送检测体积流量。
2.4 UHPLC-Q Exactive轨道肼高分辨质谱分析条件 2.4.1 色谱条件Agilent Poroshell 120色谱柱(100 mm×3.0 mm,2.7 μm);流动相为0.1%冰醋酸水溶液(A)-乙腈(B)。梯度洗脱,0~1 min,10% B;1~5 min,10%~20% B;5~11 min,20% B;11~13 min;20%~30% B;13~17 min,30%~45% B,17~23 min,45%~65% B。检测波长254 nm;体积流量0.3 mL/min;柱温30 ℃,进样量1 μL。
2.4.2 质谱条件ESI源;扫描方式:ESI+,ESI−;DAD检测器扫描范围为190~400 nm,检测波长为276 nm,喷雾电压:3.5 kV,鞘气体积流量为35个流量单位,辅助体积流量为10个流量单位,毛细管温度350 ℃,透镜电压55 kPa,扫描范围100~1 500 m/z,质量分辨率70 000。
2.5 化学发光溶液的制备 2.5.1 碳酸缓冲液的制备0.1 mol/L碳酸钠水溶液和0.1 mol/L碳酸氢钠水溶液按一定比例(6∶4)混合,测定pH值为10.0。将0.1 mol/L碳酸钠水溶液和0.1 mol/L碳酸氢钠水溶液按一定比例(9∶1)混合,测定pH值为11.0,分别加入EDTA,使其浓度为6.3 mmol/L。
2.5.2 鲁米诺储备液的制备精密称定一定量的鲁米诺,加0.1 mol/L碳酸钠溶液溶解并稀释,制成浓度为0.018 mol/L的溶液,避光,4 ℃保存,3 d后使用。
2.5.3 邻苯三酚储备液的制备精密称定邻苯三酚试剂0.063 g,用0.1 mmol/L的盐酸溶液溶解并稀释至50 mL,临用前配制。
2.5.4 清除H2O2溶液的制备精密量取鲁米诺储备液用碳酸缓冲液(pH 10.0)稀释至浓度为9.0 μmol/L。H2O2溶液:精密量取30% H2O2溶液用水稀释至浓度为0.88 μmol/L。
2.5.5 清除超氧负离子溶液的制备精密量取鲁米诺储备液用碳酸缓冲液(pH 11.0)稀释至浓度为5.5 μmol/L。精密量取邻苯三酚储备液用水稀释浓度为15 μmol/L溶液。
2.6 不同产地酸枣叶HPLC-UV指纹图谱的建立 2.6.1 精密度试验以S1酸枣叶样品为考察对象,精密称定,按样品溶液制备方法制备,进样10 μL,连续进样6次,计算各主要色谱峰的相对保留时间RSD值均小于0.40%和其相对峰面积的RSD值均小于2.71%。
2.6.2 稳定性试验以S1酸枣叶样品为考察对象,精密称定,按样品溶液制备方法制备,分别于0、2、4、8、12、16、24 h检测酸枣叶指纹图谱,计算各主要色谱峰的相对保留时间RSD值均小于2.07%,其相对峰面积的RSD值均小于2.87%。
2.6.3 重复性试验取同一批次S1酸枣叶样品粉末6份,精密称定,分别按样品溶液制备方法制备,进样10 μL,计算各主要色谱峰的相对保留时间RSD值均小于1.75%,其相对峰面积的RSD值均小于2.87%。
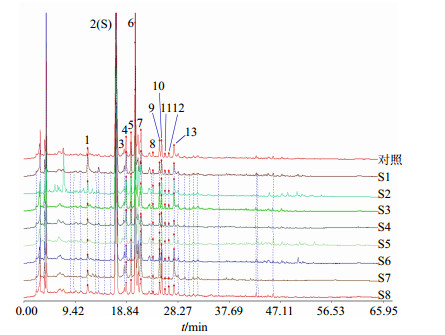
2.6.4 共有峰标定根据8批不同产地的酸枣叶HPLC-UV指纹图谱,共标定了13个共有峰,结果见图 1。
|
图 1 不同产地酸枣叶HPLC-UV指纹图谱 Fig.1 HPLC-UV Fingerprints for Ziziphi Spinosae Folium from different areas in Shanxi |
2.6.5 相似度计算
采用《中国药典》委员会出版的中药色谱指纹图谱相似度评价软件(2004A)进行计算。设置S1号图谱为参照图谱,采用多点校正法和中位数法生成对照指纹图谱,其结果见图 1和表 1。结果表明山西省内不同产地酸枣叶相似度均大于0.9,酸枣叶中化学成分受地理环境的影响较小。
|
|
表 1 不同产地酸枣叶指纹图谱相似度 Table 1 Similarity of HPLC fingerprints for Ziziphi Spinosae Folium from different collections |
2.7 酸枣叶中主要化学成分的鉴定
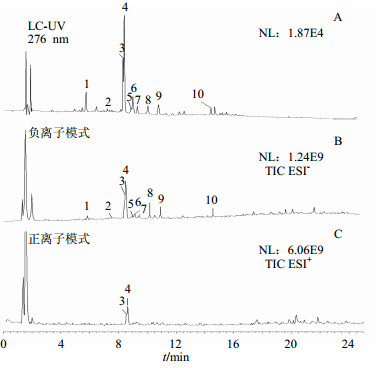
采用Q Exactive轨道肼高分辨质谱共鉴定了酸枣叶中10个黄酮类成分(图 2)。其中4号峰芦丁为已知化合物(4),其余9个化合物根据各自质谱裂解特征,保留时间及紫外光谱图,并结合文献数据[9-11]进行推断。首先分析已知对照品芦丁的裂解规律。在正离子模式下,芦丁产生m/z 611的分子离子峰,二级质谱碎片离子m/z 465由m/z 611脱掉一分子鼠李糖(146)产生,继而脱掉一分子葡萄糖(162),产生碎片m/z 303。化合物3与4产生相同的分子离子峰,参考文献推测其为quercetin-3-O-robinobioside[12]。
|
1~10-化合物1~10 1—10-compound1—10 图 2 酸枣叶提取物UHPLC-Q Exactive轨道肼高分辨质谱图 Fig.2 UHPLC-Q Exactive Orbitrap-HRMS chromatograms of extract for Ziziphi Spinosae Folium |
在正离子模式下,化合物2产生m/z 743的分子离子峰,其脱掉1分子木糖(132)产生碎片m/z 611,继续分别脱去1分子鼠李糖和葡萄糖,产生m/z 465、303碎片离子。在负离子模式下,化合物5和6均产生m/z 463的分子离子峰和m/z 301的碎片峰,分别为5脱掉1分子半乳糖(162)和6脱掉一分子葡萄糖(162)所得。在负离子模式下,化合物7和8均产生m/z 593的分子离子峰,分别脱掉芸香糖和新橙皮糖产生碎片峰m/z 285。在负离子模式下,化合物9产生m/z 579的分子离子峰,碎片峰m/z 301由母离子脱掉1分子鼠李糖(146)和1分子阿拉伯糖(132)产生。在负离子模式下,化合物10产生m/z 755的分子离子峰,首先脱掉1分子对香豆酰基(146),产生碎片峰m/z 609,继续脱掉1分子鼠李糖和葡萄糖,产生碎片峰m/z 301。化合物推测结果见表 2。由以上鉴定结果可知,化合物7和8是以山柰酚为苷元的黄酮糖苷,化合物2、3、4、5、6、9、10是以槲皮素为母核的黄酮苷类化合物。在负离子模式下,2个以山柰酚为苷元的化合物,脱掉糖后发生相同的苷元m/z 284,继而产生碎片m/z 256 [M-H-CO]−、227 [M-H-2CO]−、151 [M-H-C4H4O4-H2O][13]。以槲皮素为苷元的化合物,在正离子模式下,由苷元m/z 303产生碎片m/z 285 [M+H-H2O]+、257 [M+H-H2O-CO]+、229 [M+H-H2O-2CO]+、209 [M+H-3CO-H2O][14],结果见表 2。
|
|
表 2 UHPLC-Q Exactive轨道肼高分辨质谱鉴定酸枣叶中的化学成分 Table 2 Characterization of chemical constituents in Ziziphi Spinosae Folium by UHPLC-Q Exactive Orbitrap-HRMS |
2.8 HPLC-CL在线检测不同产地酸枣叶清除H2O2和超氧负离子自由基活性
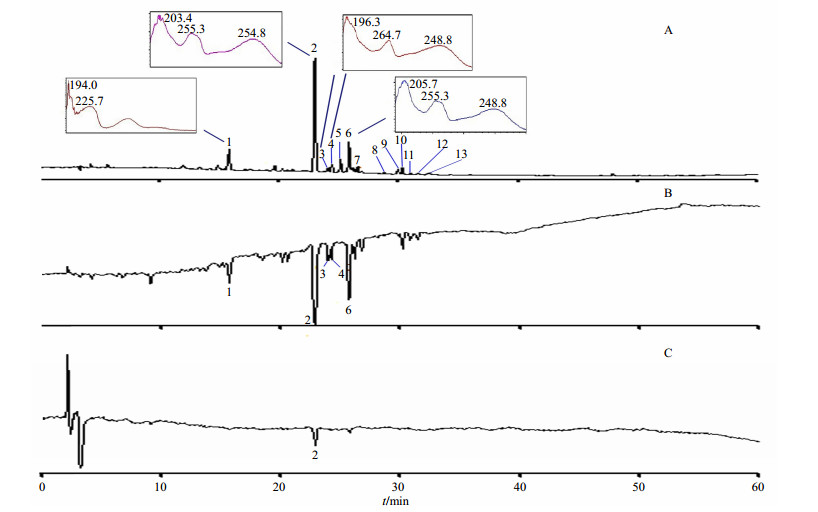
由上述实验结果可知酸枣叶中含有大量的以槲皮素和山柰酚为苷元的黄酮苷类化合物。这些化合物含有较多的酚羟基,具有较强的抗氧化作用。采用HPLC-CL在线检测方法,经过综合标示后,可以获得酸枣叶样品中各成分对应的化学指纹峰和抗氧化活性指纹峰,见图 3。
|
A-紫外图谱(300 nm,2号峰为芦丁对照品)、B-清除H2O2图谱、C-清除超氧负离子自由基图谱 A-UV chromatogram detected at 300 nm Peak 2 is lutin reference substance; B-chromatogram of scavenging H2O2; C-chromatogram of scavenging overtake oxygen negative ion 图 3 榆次酸枣叶紫外图谱(A)及其清除H2O2 (B)和超氧负离子(C)自由基化学发光图谱 Fig.3 UV Chromatograms (A) and chemiluminescence map for scavenging H2O2(B) and overtake oxygen negative ion (C) of Ziziphi Spinosae Folium from Yuci |
酸枣叶HPLC指纹图谱中1、2、3、4、5、6、9、10号峰信号较强。在清除H2O2自由基方面,1、2、3、4、6号峰显示较强的活性,且清除H2O2的检测信号强度明显高于超氧负离子自由基。这可能是因为H2O2和超氧负离子氧化鲁米诺能力不同,而且2种方法的测定过程不同,清除H2O2是直接测定溶解在水中的H2O2,而超氧负离子是在检测过程中由反应产生的[8]。
为追踪HPLC-CL中具有抗氧化活性的1、2、3、4、6号峰,通过与UHPLC的紫外光谱图进行对应比较,确定HPLC色谱图中1号峰为化合物eriodictyol-7-O-rutinoside(1)、2号峰为化合物quercetin-3-O-robinobioside(3)和quercetin-3-O-rutinoside(4)的重叠峰,3号峰为化合物quercetin-3-O-β-D-galactoside(5),4号峰为化合物quercetin-3-O-β-D-glucoside(6),6号峰为化合物quercetin-3-O-β-L-arabinosyl-(1→2)-α-L-rhamnoside(9)。
3 讨论为了将酸枣叶中的黄酮类化合物提取完全,分别考察了超声和回流提取法,结果表明,超声提取简单,快速,提取效率高。另外,考察了100%、70%、50%甲醇对提取效率的影响,结果表明,70%甲醇提取酸枣叶色谱峰较多,信息量大。
HPLC-CL联用,要求检测条件与分析试剂的兼容性。因此分别考察乙腈-甲酸、乙腈-冰醋酸、乙腈-磷酸洗脱系统,结果表明,乙腈-磷酸系统具有较稳定的化学发光强度。此外,磷酸的浓度对化学发光有明显的影响。为了获得稳定的化学发光强度,经考察确定为0.1%磷酸-乙腈洗脱系统。由于质谱分析要求使用挥发性酸试剂,因此在UHPLC-Q Exactive轨道肼高分辨质谱检测中使用了乙腈-冰醋酸洗脱系统。
本研究整合UHPLC-Q Exactive轨道肼高分辨质谱分析技术与HPLC-CL在线联用技术,对酸枣叶主要化学成分进行在线快速检测。在HPLC-CL色谱峰和抗氧化指纹峰中,1、2、3、4、6号峰的抗氧化活性较强,这些化合物分别对应表 2中化合物1、3、4、5、6和9,其共同特点是均具有邻二酚羟基结构,提示具有邻二酚羟基的黄酮糖苷类成分是酸枣叶中主要抗氧化活性成分。此研究为酸枣叶的质量控制、药效学研究奠定了基础,对于筛选高效、天然抗氧化药物和食品抗氧化剂具有一定的指导意义。
| [1] | 王身艳, 刘清飞, 秦明珠. 酸枣仁、叶、肉、根的研究进展[J]. 中成药 , 2000, 22 (11) :794. |
| [2] | 李凤英. 酸枣叶营养保健茶的研制[J]. 园艺学进展 , 1998, 2 :291–294. |
| [3] | 车勇, 郑冰清, 腾勇荣, 等. 酸枣叶化学成分的研究[J]. 中成药 , 2012, 34 (4) :686–688. |
| [4] | Guo S, Duan J A, Tang Y P, et al. Simultaneous qualitative and quantitative analysis of triterpenic acids, saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDA-MS/ELSD[J]. J Pharm Biomed Anal , 2011, 56 :264–270. DOI:10.1016/j.jpba.2011.05.025 |
| [5] | 裴香萍, 杜晨晖, 闫艳, 等. HPLC-UV测定不同产地及不同采收期酸枣叶中芦丁的含量[J]. 中国实验方剂学杂志 , 2011, 17 (21) :94–96. |
| [6] | 白莉, 杜晨晖, 闫艳, 等. 不同产地野生酸枣叶总黄酮的含量测定[J]. 山西中医学院学报 , 2012, 13 (4) :32–34. |
| [7] | 丁晓萍.基于抗氧化活性的生物活性和化学相关指纹的构建及其在中药质量评价研究中的应用[D].南京:中国药科大学, 2009. |
| [8] | 张雷, 丁晓萍, 戚进, 等. HPLC-DPPH在线联用技术评价茶的抗氧化活性[J]. 中国药科大学学报 , 2012, 43 (3) :236–240. |
| [9] | Zhang R T, Chen J H, Shi Q. Quality control method for commercially available wild Jujube leaf tea based on HPLC characteristic fingerprint analysis of flavonoid compounds[J]. J Sep Sci , 2014, 37 :45–52. DOI:10.1002/jssc.201300841 |
| [10] | 张倩倩, 崔庆玲, 刘晓秋, 等. HPLC法同时测定酸枣叶中芦丁等4种黄酮苷的含量[J]. 沈阳药科大学学报 , 2014, 31 (1) :26–31. |
| [11] | 徐晶晶.基于抗氧化谱效关系分析的薄荷药材质量控制和评价方法研究[D].北京:北京中医药大学, 2014. |
| [12] | Guo R Z, Liu X G, Gao W, et al. A strategy for screening antioxidants in Ginkgo biloba extract by comprehensive two-dimensional ultra high performance liquid chromatography[J]. J Chromatogr A , 2015 :10. |
| [13] | 梁艳, 于世锋, 陈卫军, 等. 山柰酚的电喷雾质谱裂解途径[J]. 应用化学 , 2009, 26 (10) :1250–1252. |
| [14] | 李宇航, 戴海学, 汪明明, 等. 槲皮素的电喷雾离子阱质谱分析[J]. 质谱学报 , 2009, 30 (6) :374–378. |
 2016, Vol. 47
2016, Vol. 47

