2. 武警后勤学院 武警部队特需药物研发中心, 天津 300162 ;
3. 天津中新药业集团股份有限公司第六中药厂, 天津 300401
2. Military Special Drug R & D Center, Logistics College of Chinese People's Armed Police Forces, Tianjin 300309, China ;
3. No.6 Traditional Chinese Medicine Factory, Tianjin Zhongxin Pharmaceutical Group Co., Ltd., Tianjin 300401, China
舒脑欣滴丸由川芎和当归两味中药组成,具有理气活血、化瘀止痛的功效。自2005年以来被用于治疗多种心脑血管疾病(批准文号Z20050041)[1-3]。文献报道,舒脑欣滴丸主要单体成分藁本内酯可提高小鼠认知功能,减少神经毒性;洋川芎内酯I可以保护神经细胞[4-6]。目前舒脑欣滴丸抗老年痴呆的作用研究多集中在临床疗效观察方面,舒脑欣滴丸可以改善血管性痴呆患者的记忆障碍及其他认知功能障碍[7],尚无关于舒脑欣滴丸抗阿尔茨海默病(AD)实验方面的研究,更无相关机制的研究。本研究采用D-半乳糖造成AD早期模型大鼠,观察舒脑欣滴丸对模型大鼠的神经保护行为,并初步探讨其作用机制。
1 材料 1.1 药物与试剂舒脑欣滴丸(天津中新药业股份有限公司第六中药厂,批号671002,规格每丸42 mg);脑复康(吡拉西坦片,批号H43020666,湖南迪诺制药有限公司);超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒(南京建成生物科技有限公司);胶质纤维酸性蛋白(GFAP)抗体和Caspase-3抗体(武汉博士德生物工程有限公司)。D-半乳糖(上海阿拉丁生化科技股份有限公司)。
1.2 实验动物Wistar大鼠,雌雄各半,体质量为(200±20)g,由军事医学科学院实验动物中心提供;许可证号SCXK-2007-004,实验用大鼠于25 ℃条件下适应性饲养1周以后进行实验。
1.3 实验仪器水迷宫实验系统(天津中医药大学提供);TopScanLite-TopView行为学分析系统(NoldusInformation Technology,Leesburg,VA,美国);Molecular Device Flexstation 3酶标仪,美国Molecular Devices(MD)公司。
2 方法 2.1 分组、造模及给药将40只健康Wistar大鼠随机分成5组:对照组,模型组,舒脑欣滴丸高、低剂量(800、400 mg/kg,将舒脑欣滴丸研碎,称取粉末,用5% CMC-Na溶解至一定质量浓度)组,阳性对照脑复康(430 mg/kg)组,每组8只大鼠。除对照组外,其余各组大鼠均ip D-半乳糖100 mg/(kg·d)[7],对照组ip等量生理盐水,连续注射60 d。造模同时,对照组、模型组ig给予5% CMC-Na,各给药组ig相应剂量药物,每天1次,连续给药60 d。
2.2 样本采集于末次给药后以5%戊巴比妥钠(0.6 g/kg)ip麻醉大鼠,股主动脉取血,处死动物。取4 mL全血,3 000 r/min低温离心机离心30 min,分离血清,−20 ℃冻存,以备测定血清SOD和MDA水平。取脑,于中性福尔马林中保存用于病理观察。
2.3 观察指标及测定方法 2.3.1 行为学测定(水迷宫实验)Morris水迷宫由一个不锈钢喷塑圆柱形水池和自动录像记录系统两部分组成。水池直径为100 cm,高38 cm。池壁上标记有4个等距离点,按顺时针方向将水池分为4个象限,任选一个象限,于其中央放置平台(平台与池壁及圆心距离相等)。平台黑色,直径6 cm,高15 cm,泳池内盛水,水温保持在(25±1)℃,自动录像记录系统包括摄像头和录像系统(计算机、记录软件),摄像头装于水池上方约3 m处,并与录像系统相连接,自动录入并记录大鼠逃避潜伏期和穿越平台次数。大鼠于给药60 d后开始进行Morris水迷宫检测,先训练1周,每天上、下午各2遍,第7天给药60 min后开始检测,运用空间探索实验来检测动物对平台空间位置的准确记忆,即记忆保持能力。水迷宫第7天,撤除平台后,从原实台象限的对角象限(第3象限)作为入水点将动物面向池壁放入水中。记录动物在90 s内在实台象限的穿台次数,用于检测动物对平台空间位置的准确记忆,即记忆保持能力。数据采集和处理均由该装置的图像自动监视和处理系统完成[8-9]。
2.3.2 血清SOD和MDA的检测血清SOD和MDA的检测均严格按照试剂盒说明进行。
2.3.3 大脑GFAP和Caspase-3表达的检测采用免疫组织化学技术观察大鼠大脑皮层GFAP和海马CA1区Caspase-3的表达。
2.3.4采用尼氏染色和HE染色观察各组大鼠海马CA1区的组织形态学变化。
2.4 统计学处理利用SPSS 20.0统计分析处理软件进行统计学分析,实验数据以x±s表示,采用双侧t检验进行比较。
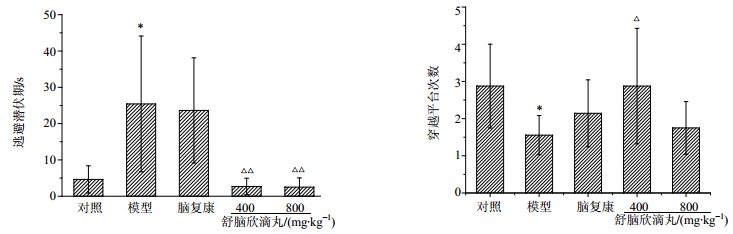
3 结果 3.1 对行为学的影响空间探索实验中的逃避潜伏期和穿越平台次数结果见图 1。脑复康组、舒脑欣滴丸低和高剂量组大鼠的逃避潜伏期均较模型组缩短,且舒脑欣滴丸低、高剂量组差异显著(P<0.01)。脑复康组、舒脑欣滴丸低和高剂量组穿过平台的次数均大于模型组,且舒脑欣滴丸低剂量组差异显著(P<0.05)。表明舒脑欣滴丸可减少D-半乳糖造模大鼠神经损伤,提高其学习记忆能力。
|
与对照组比较:P<0.05;与模型组比较:△P<0.05 △△P<0.01 与对照组比较:P < 0.05;与模型组比较:△P < 0.05 △△P < 0.01 图 1 舒脑欣滴丸对AD模型大鼠Morris水迷宫实验行为学的影响(x±s, n=8) Fig.1 Effect of SDP on behavior of AD model rats in Morris water maze experiment (x±s, n=8) |
3.2 对氧化应激指标的影响
各组大鼠血清中SOD活性和MDA水平结果见表 1,舒脑欣滴丸低、高剂量组大鼠血清中SOD活性显著高于模型组,MDA水平显著低于模型组(P<0.05、0.01),提示舒脑欣滴丸可能通过抗氧化应激作用,抵抗D-半乳糖引起的衰老损伤。
|
|
表 1 舒脑欣滴丸对AD模型大鼠血清中SOD活性和MDA水平的影响(x±s, n=8) Table 1 Effect of SDP on SOD activity and MDA level in serum of AD model rats (x±s, n=8) |
3.3 对脑海马组织Caspase-3和GFAP表达的影响
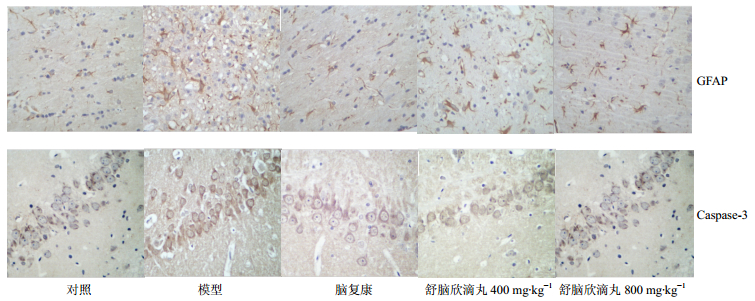
免疫组织化学染色结果见图 2。GFAP的阳性表达颗粒主要出现在神经胶质细胞突起处,呈棕黄色深染颗粒。GFAP染色结果显示,在对照组大鼠大脑皮质内GFAP阳性染色较淡;模型组的神经胶质细胞突起处,可见大量深染的棕黄色颗粒,为GFAP阳性染色细胞,阳性细胞数量明显高于对照组。与模型组相比,脑复康组及不同剂量舒脑欣滴丸组的细胞染色相对较淡,阳性细胞数量明显低于模型组。Caspase-3染色结果显示,对照组的阳性细胞数量与模型组存在有显著差异;模型组大鼠海马神经元阳性细胞数比对照组显著增加。脑复康组和不同剂量舒脑欣滴丸组可见海马阳性反应细胞着色浅。
|
图 2 舒脑欣滴丸对AD大鼠大脑皮质GFAP表达和海马CA1区Caspase-3表达的影响 Fig.2 Effects of SDP on expression of GFAP in cortex and Caspase-3 in hippocampal CA1 region in AD rats |
3.4 对脑海马组织形态学的影响
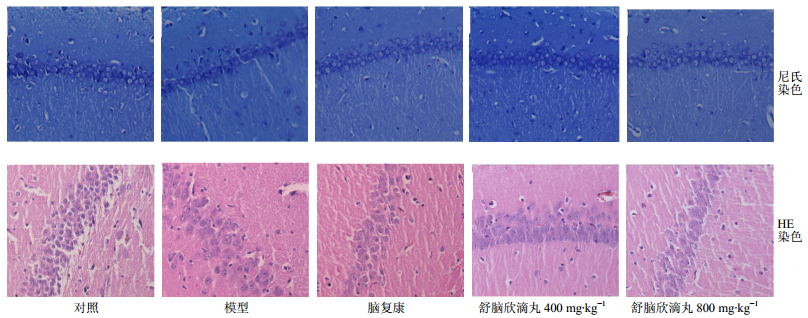
各组大鼠脑海马区形态变化见图 3,正常大鼠海马CA1区结构正常,神经毯排列紧密且整齐,层次清楚,有4~6层细胞,细胞核呈圆形,核仁清晰。模型组大鼠海马CA1区病变严重,神经元排列散乱疏松,锥体细胞带不完整,细胞数量明显减少,核固缩明显,舒脑欣滴丸给药组大鼠海马CAl区病变较模型组明显改善,结构清晰,细胞排列较整齐,细胞核固缩不明显,其病变较模型组明显减轻,与阳性药脑复康组相似,几乎与对照没有差异,显示舒脑欣滴丸可明显改善模型大鼠脑组织的病理变化。
|
图 3 舒脑欣滴丸对AD大鼠海马CA1区组织形态的影响 Fig.3 Effects of SDP on morphology in hippocampal CA1 region in AD rats |
4 讨论
舒脑欣滴丸可减少D-半乳糖造模大鼠的逃避潜伏期,增加穿越平台的次数,提高其认知水平,可以改善D-半乳糖造模大鼠大脑海马区形态异常,其可能通过抗氧化应激、降低炎症反应和神经元凋亡而起到神经保护作用。本课题组前期研究发现阿魏酸、洋川芎内酯I/H、洋川芎内酯A、藁本内酯为舒脑欣滴丸的主要成分[2],且阿魏酸、洋川芎内酯I和藁本内酯具有神经保护作用[4-6],故舒脑欣滴丸的神经保护作用可能是其中多成分相互作用的结果。
D-半乳糖为还原糖,其在体内的异常代谢可导致机体衰老。实验动物注射D-半乳糖后可致突触传递中的认知缺陷和紊乱,D-半乳糖造模大鼠常作为突触紊乱和记忆破坏的模型用于实验研究[8]。长期注射D-半乳糖可以促进衰老,形成轻微的神经损伤和记忆缺陷,造成AD的早期症状,因此D-半乳糖常诱导AD早期模型进行研究[10]。氧化应激在衰老过程中起重要作用,D-半乳糖注射可以增加活性氧(ROS)的生成,降低抗氧化酶的活性,SOD和MDA是氧化应激的重要指标[11]。本实验中,舒脑欣滴丸给药组可以显著降低模型组大鼠血清中MDA水平,提高SOD活性,表明舒脑欣滴丸提高D-半乳糖造模大鼠的认知水平,改善脑海马CA1区病变的作用,可能是通过抗氧化应激来实现的。
星形胶质细胞是中枢神经系统内数量最多的一种胶质细胞,中枢神经系统内的神经元及其突触之间几乎都被星形胶质细胞填充,对神经元起营养和支持作用。GFAP是星形胶质细胞的骨架蛋白,充满于星形胶质细胞的胞体和突起内,被公认为星形胶质细胞的特征性标记,GFAP增加是脑损伤的早期特征性标志[12]。本研究探讨了舒脑欣滴丸对GFAP表达的影响。结果表明,舒脑欣滴丸能明显抑制AD大鼠海马区GFAP蛋白的表达增加,即舒脑欣滴丸抑制GFAP蛋白的表达,间接改善了突触的连接及功能,最终提高了AD大鼠的认知能力。
为了进一步探讨舒脑欣滴丸治疗D-半乳糖所致AD大鼠的可能机制,本研究采用免疫组织化学的手段评价了凋亡主要介质Caspase-3的表达。Caspase-3是凋亡的主要执行者,它能够激活ROS,进而导致神经功能障碍[13]。本研究结果显示,舒脑欣滴丸能够逆转D-半乳糖所致的Caspase-3阳性表达的增高。这些结果表明舒脑欣滴丸能够调节凋亡相关蛋白的表达,从而改善了D-半乳糖引起的神经退化。
本研究结果证明了舒脑欣滴丸对D-半乳糖引起神经损伤的保护作用,为舒脑欣滴丸抗AD的临床研究提供了理论依据。但本实验在机制研究方面还存在不足,仅从氧化应激和神经炎症的角度探讨其神经保护机制,神经保护机制还可能与胆碱能系统的异常有关,具体还需进一步研究。
| [1] | 周鸿, 黄含含, 张静泽, 等. 川芎-当归药对研究进展[J]. 中成药 , 2015, 37 (1) :184–188. |
| [2] | Huo L, Zhang J, Qu Z, et al. Vasorelaxant effects of Shunaoxin pill are mediated by NO/cGMP pathway, HO/CO pathway and calcium channel blockade in isolated rat thoracic aorta[J]. J Ethnopharmacol , 2015, 173 :352–360. DOI:10.1016/j.jep.2015.07.048 |
| [3] | 丰博, 王金磊, 庄朋伟, 等. 舒脑欣滴丸与华法林钠抗凝血相互作用研究[J]. 中草药 , 2015, 46 (16) :2445–2448. |
| [4] | Bunel V, Antoine M H, Nortier J, et al. Nephroprotective effects of ferulic acid, Z-ligustilide and E-ligustilide isolated from Angelica sinensis against cisplatin toxicity in vitro[J]. Toxicol In Vitro , 2015, 29 (3) :458–467. DOI:10.1016/j.tiv.2014.12.017 |
| [5] | Li J J, Zhu Q, Lu Y P, et al. Ligustilide prevents cognitive impairment and attenuates neurotoxicity in D-galactose induced aging mice brain[J]. Brain Res , 2015, 1595 :19–28. DOI:10.1016/j.brainres.2014.10.012 |
| [6] | He C Y, Wang S, Feng Y, et al. Pharmacokinetics, tissue distribution and metabolism of senkyunolide I, a major bioactive component in Ligusticum chuanxiong Hort.(Umbelliferae)[J]. J Ethnopharmacol , 2012, 142 (3) :706–713. DOI:10.1016/j.jep.2012.05.047 |
| [7] | 张梅兰, 金素敏, 李英, 等. 舒脑欣滴丸治疗血管性老年痴呆疗效观察[J]. 河北医药 , 2012, 34 (15) :2375–2376. |
| [8] | Zhan P Y, Peng C X, Zhang L H. Berberine rescues D-galactose-induced synaptic/memory impairment by regulating the levels of Arc[J]. Pharmacol Biochem Behav , 2014, 117 :47–51. DOI:10.1016/j.pbb.2013.12.006 |
| [9] | 卢丹丹, 宿艳敏, 张江华, 等.Morris水迷宫实验中三种小鼠学习能力的对比研究[A]//中国药理学会第十一次全国学术会议专刊[C].济南:中国药理学会, 2011. |
| [10] | Li F, Gong Q H, Wu Q, et al. Icariin isolated from Epimedium brevicornum Maxim attenuates learning and memory deficits induced by D-galactose in rats[J]. Pharmacol Biochem Behav , 2010, 96 (3) :301–305. DOI:10.1016/j.pbb.2010.05.021 |
| [11] | Yang W N, Han H, Hu X D, et al. The effects of perindopril on cognitive impairment induced by D-galactose and aluminum trichloride via inhibition of acetylcholinesterase activity and oxidative stress[J]. Pharmacol Biochem Behav , 2013, 114 . |
| [12] | Fink D M, Palermo M G, Bores G M, et al. Imino 1, 2, 3, 4-tetrahydrocyclopent indole carbamates as dual inhibitors of aeetylcholinesterase and monoamine oxidase[J]. Bioorg Med Chem Lett , 1996, 6 (6) :625–630. DOI:10.1016/0960-894X(96)00072-8 |
| [13] | Zhong S Z, Ge Q H, Li Q, et al. Peoniflorin attenuates Abeta (1-42)-mediated neurotoxicity by regulating calcium homeostasis and ameliorating oxidative stress in hippocampus of rats[J]. J Neurol Sci , 2009, 280 (1/2) :71–78. |
 2016, Vol. 47
2016, Vol. 47


